黃曲霉毒素污染控制的研究進展
沈青山,周 威,莫海珍,胡梁斌*
(河南科技學院食品學院,河南 新鄉 453003)
黃曲霉毒素污染控制的研究進展
沈青山,周 威,莫海珍,胡梁斌*
(河南科技學院食品學院,河南 新鄉 453003)
黃曲霉可以引起糧油作物的霉變,其產生的毒素能夠污染糧食及其制品,對人類和動物的健康造成極其嚴重的危害。本文概述了黃曲霉毒素在產生、運輸和調控階段的分子生物學過程,重點對黃曲霉毒素污染控制方法,如:遺傳育種法、物理降解法及化學降解法等進行綜述,并對植物源殺菌劑控制前期毒素污染,以及干預吸收控制后期毒素污染的前景進行展望。
黃曲霉毒素;污染;控制方法
黃曲霉(Aspergillus flavus,AF)屬于曲霉屬,是一種腐生真菌,常見于發霉的糧食和其他富含有機物的霉變物體表面。菌落可在馬鈴薯葡萄糖瓊脂(potato dextrose agar,PDA)培養基和沙氏瓊脂培養基等營養表面上生長。菌體由許多復雜的分枝菌絲構成,孢子繁殖,適宜生長溫度為25~42 ℃,最佳生長溫度為37 ℃。最初黃曲霉被認為是無性繁殖只產生無性繁殖的孢子、分生孢子以及過冬的子實體和菌核。然而,最近研究表明黃曲霉也會處于有性狀態,被歸屬于石座菌屬[1]。黃曲霉的形態特征比較復雜,因此根據黃曲霉在30 ℃條件下察氏瓊脂培養基(含質量分數為3%的NaNO3)中產生菌核的大小可以大致將其分為L型菌株和S型菌株,其中菌核直徑大于400 μm為L型菌株,小于400 μm為S型菌株。L型菌株和S型菌株都可以產生黃曲霉毒素B1和黃曲霉毒素B2,而S型菌株只能產生黃曲霉毒素G1和黃曲霉毒素G2[2-3]。黃曲霉是釀造工業中的一種常見菌種,可與米曲霉一起用于醬油的生產。然而,生活中黃曲霉導致的食品污染給我們帶來了很大危害。黃曲霉可使糧油作物發生霉變,其產生的次級代謝產物黃曲霉毒素(aflatoxin,AFT)同樣能造成糧食污染。黃曲霉是一種機會致病菌,可以感染人和動物,使其患曲霉病甚至導致死亡。黃曲霉毒素對人和動物具有致癌性。在美國,每年由真菌毒素污染而造成的經濟損失超過數十億,其中由黃曲霉毒素導致的污染占絕大部分[4]。
黃曲霉毒素主要是由黃曲霉和寄生曲霉產生的次級代謝產物,Kurtzman等[5]發現紅綬曲霉(Aspergillus nomius)等其他一些真菌也能產生黃曲霉毒素。黃曲霉毒素是一類化學結構類似的二呋喃環和香豆素的衍生物,呋喃環與毒素的致病性相關,而香豆素主要影響其致癌性[6]。這些毒素中黃曲霉毒素B1(aflatoxin B1,AFB1)是該類毒素中毒性最強的物質,其毒性是氰化物的10 倍,砒霜的68 倍[7],AFB1是目前發現毒性和致癌性最強的化學物質之一,已被世界衛生組織認定為1A級危險物。
黃曲霉和黃曲霉毒素雖然很早就已經被發現且被廣泛地研究,但對黃曲霉及其毒素污染的根除依然沒有找到快速有效的方法。目前來講,黃曲霉和黃曲霉毒素污染的控制和清除仍然是世界級難題。本文主要對國內外黃曲霉和黃曲霉毒素的研究狀況,以及當前對黃曲霉素污染的控制方法進行綜述,并對今后黃曲霉毒素污染控制的發展進行展望,為該領域的研究提供一定的參考依據。
1 黃曲霉及黃曲霉毒素危害
1.1 黃曲霉的危害
黃曲霉作為一種常見的絲狀真菌,通常會侵染花生、玉米、大米等并使其發生霉變[8-9],對于含脂肪量較高的油料作物,黃曲霉及黃曲霉毒素的侵染更為嚴重。目前雖然我國對飼料原料的監管十分嚴格,但是仍有非正規的養殖場收購發生輕微霉變的玉米等作物經簡單處理后制成動物飼料,這種飼料被牲畜食用后對其健康造成潛在的危害,導致病害畜產品的產生,最終將這種潛在危害轉嫁給人。黃曲霉對于糧食作物的污染首先是影響到糧油作物的使用和經濟價值。其次,黃曲霉產生的黃曲霉毒素引起毒素污染,對人和動物的危害更為嚴重。黃曲霉本身就是一種病原菌會導致人和動物患上曲霉病,其致病性僅次于煙曲霉,報道指出南美患曲霉病的兒童中有68%是由黃曲霉引起的[10-12]。在肺移植、骨髓移植的過程中通常會導致相關病癥的出現[13-14],當人體呼吸到黃曲霉的孢子或是食用被黃曲霉污染的糧食時會引起過敏性疾病的發生[15],另外還有報道稱黃曲霉會導致人類患上角膜炎[16],也會引起兔子、家畜類動物感染曲霉病[17]。
1.2 黃曲霉毒素的危害
1960年英國10 萬只火雞和鴨子在幾個月內突然死亡,其原因是這些家禽食用了南美地區被真菌毒素污染的花生粕[18],經證實該毒素就是黃曲霉產生的黃曲霉毒素。從此,人們揭開了對黃曲霉和黃曲霉毒素的研究序幕。目前,已經分離鑒定出的黃曲霉毒素已有20余種,包括B族黃曲霉毒素(AFB1、AFB2和AFB2a)、G族黃曲霉毒素(AFG1、AFG2和AFG2a)、M族黃曲霉毒素(AFM1和AFM2)以及毒醇等。在365 nm紫外光照射下AFB1和AFB2可以發出藍光,AFG1和AFG2可以發出綠光。M族黃曲霉毒素常見于牛奶中,其中AFM1是AFB1在體內經過羥化而衍生成的代謝產物。這些毒素尤其是AFB1對人和動物都有很強的致病性,其致病能力與結構式有很大關系(圖1)。研究表明AFB1和AFG1中的呋喃環不飽和鍵是否發生環氧化,決定了這2 種毒素的致癌能力[19],其中環氧化形式的AFB1是通過體內細胞色素P450單氧酶體統代謝形成[20],而未被氧化的AFB2和AFG2的致病性與之相比就小了很多。環氧化物可以與細胞脫氧核糖核酸(deoxyribonucleic acid,DNA)結合形成毒素-DNA加合物,這種加合物可以在尿液中檢測到[21-22],可隨尿液排出體外。環氧化的AFB1會導致DNA的堿基序列發生突變,這種現象常見于患肝癌病人的癌細胞中[23]。黃曲霉毒素對人體的靶器官主要是肝臟,肝臟細胞的癌變是引起肝癌病變和死亡的主要原因[24]。調查顯示中國每年大約有700 000人患肝癌的病例產生,超過300 000 人因患肝癌死亡[21]。近20 a的流行病學研究發現,肝細胞的癌變率與黃曲霉毒素的攝入有關。研究表明AFB1對嚙齒動物、靈長類動物以及魚類等多種動物都有很強的致癌能力[25]。黃曲霉毒素還可以抑制動物的生長,有報道指出嬰兒的成長也會受到黃曲霉毒素的影響,但這種作用機制目前還不清楚[26-27]。
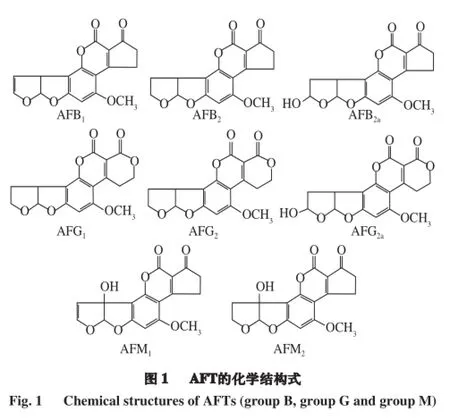
1.3 黃曲霉毒素的合成及運輸
隨著人們對黃曲霉及黃曲霉毒素的深入研究,黃曲霉毒素的合成途徑、合成過程中相關基因的調控、相關酶的參與都已基本清楚。目前普遍認為AFB1的合成過程為:乙酸鹽(acetate)→聚酮化合物(poyketide)→諾素羅瑞尼克酸(norsolorinic acid,NOR)→奧佛蘭提素(averantin,AVN)→hydroxyaverantin(HAVN)→oxoaverantin(OAVN)→奧佛尼紅素(averufin,AVF)→雜色半縮醛乙酸(versiconal hemiacetal acetate,VHA)→versiconal(VAL)→雜色曲霉素B(versicolorin B,VERB)→雜色曲霉素A(versicolorin A,VERA)→柄曲霉素(sterigmatocystin,ST)→O-甲基柄曲霉素(O-methylsterigmatocystin,OMST)→AFB1。在AFB1合成中或合成后,相繼衍化出AFB2、AFG1、AFG2、AFM1和AFM2
[28-31]。黃曲霉毒素的合成過程中會受到如光線、溫度、pH值、氮源、碳源和重金屬等環境條件因素的影響(表1)[32]。貯藏的溫度以及通風條件也會影響黃曲霉的產毒,在低溫、通風、干燥、堿性環境可以有效地抑制黃曲霉毒素的產生[33]。不同的碳源[34]、氮源[35]、培養溫度[36-37]以及培養生長的pH值[38-39]對于黃曲霉毒素的產生都有影響。Price等[40]研究了溫度、pH值、氮源、碳源等4 種因素對黃曲霉毒素通過特定基因轉錄的影響,發現溫度對其影響最大,其次是pH值、氮源、碳源。營養條件、生長條件以及不利的環境脅迫作用等外界條件都會導致黃曲霉毒素的合成受阻,但其根本原因是這些條件影響了黃曲霉相關產毒基因的表達從而引起毒素的產生發生了變化。

黃曲霉毒素作為一種重要的次級代謝產物,在細胞內如何轉運到細胞外一直未得到解決。2009年,Chanda等[41]提出了黃曲霉亞細胞區域化、毒素基因表達、碳源途徑等調控黃曲霉毒素合成運輸的模型。2010年Chanda等[42]又提出了囊泡化合成釋放激素的理論模型,揭示了囊泡和大液泡在黃曲霉毒素合成、轉運、輸出等過程中起到的重要作用。研究表明在AFB1合成過程中至少最后兩步的酶反應是在囊泡中完成,囊泡數量增加與AFB1的累積或者輸出成正相關。當囊泡與液泡融合后,AFB1合成代謝明顯減少,可能是液泡中存在某些酶類破壞了催化AFB1合成的酶類。阻斷囊泡與液泡的融合,則可以提高AFB1的合成或輸出速率。這一發現或許為抑制AFB1的合成提供了新的思路。
1.4 合成黃曲霉毒素的基因調控
目前來講合成黃曲霉毒素的基因調控過程是一個極其復雜的網絡,并非由某一個或是某些基因來調控的。黃曲霉全基因組序列的公開為黃曲霉毒素調控途徑的研究提供了大量的參考數據[43]。研究表明近30 個合成黃曲霉毒素的調控基因,控制了超過20 種酶類的合成,這些酶不同程度地參與了乙酸鹽到黃曲霉毒素的合成過程[44],其中基因aflA和aflB可以控制脂肪酸合成酶、aflC控制聚酮合酶、兩個相鄰的基因aflR和aflS對合成黃曲霉毒素的調控起重要作用,aflR編碼的一個鋅指結構的DNA結合蛋白,能夠激活黃曲霉毒素合成通路上的基因表達,該蛋白是其他大部分毒素合成時所必需的[45-46]。aflR與相鄰的毒素調控基因aflS的間區非常短,但是各自的啟動子卻不同[47]。研究表明,aflS的轉錄依賴于aflR[46,48],aflS蛋白能與aflR蛋白結合從而調節產毒基因的表達,進而改變黃曲霉毒素的合成途徑[32]。與aflR相比,aflS的許多功能還有待進一步的研究。其他相關基因aflD、aflM、aflP等都在不同程度地調控毒素的合成,其中aflD的高表達量起到減弱毒素合成的作用[49,32]。
2 黃曲霉及黃曲霉毒素的污染控制
除黃曲霉外像寄生曲霉(Aspergillus parasiticus)[50]、紅綬曲霉(Aspergillus nomius)[5]、Aspergillus pseudoamarii[51]、Aspergillus bombycis[52]等霉菌都能夠產生黃曲霉毒素。該類霉菌與黃曲霉一樣都屬于真菌,它們可以在糧油作物的生長、收獲、運輸、貯藏以及加工等各個環節引起作物的霉變,并對其相關制品造成不可避免的經濟損失,所產生的黃曲霉毒素對人類和動物的健康危害更為嚴重。對該類霉菌的污染控制常常通過控制其生長條件的方法達到。如降低溫度和水分含量等。本文主要是從黃曲霉及黃曲霉毒素污染的前、后兩個時期進行控制的角度進行論述,前期主要針對黃曲霉或黃曲霉毒素的污染控制,后期主要針對黃曲霉毒素的污染控制,從而起到清除或降低毒素的效果,整個控制流程見圖2。

2.1 黃曲霉及毒素污染的前期控制
2.1.1 遺傳育種
從源頭上培育抗黃曲霉品種是黃曲霉污染前期能夠得到有效控制的良好途徑。該方法可以從兩個方面入手:1)利用基因工程改造產毒菌株的基因。并非所用菌株都能產生黃曲霉毒素,因此,可以通過消除產毒菌株中調控毒素關鍵基因,從而使其失去產毒性[53]。然而,自然消除關鍵的產毒基因卻很難實現。2)改造糧食作物使之具有抗黃曲霉的特性。自20世紀60年代以來,國際上開始了花生黃曲霉抗性育種的研究,且已取得顯著成效[54]。美國農業部農業研究局與尼日利亞國際熱帶農業研究所合作研制了抗黃曲霉的玉米品種,該品種玉米在實驗室和田間獲得良好的抗菌效果[55]。我國福建農林大學油料所,在1997年也研究出了抗黃曲霉的花生品種,并在2009年通過國家農作物品種審定委員會的審定[56]。長遠來看,選育抗黃曲霉作物品種應該是防治黃曲霉污染的有效途徑,但選育抗病品種周期長,對黃曲霉有免疫或高抗的花生、玉米等作物的遺傳資源比較缺乏,另外抗黃曲霉和抗黃曲霉毒素是兩個完全不同的多基因控制的性狀,因此對于這兩種性狀的整合是一個很大挑戰。
2.1.2 生物競爭
在黃曲霉及毒素污染的前期,可以采用微生物之間的拮抗作用和生存競爭來控制黃曲霉毒素的污染。該方法在美國通過無毒優勢菌株在田間防治黃曲霉毒素的實驗中已得到認證[57]。在我國,有研究也證實枯草芽孢桿菌、乳酸菌、醋酸菌能夠顯著地降解黃曲霉毒素[58]。萎縮芽孢桿菌、以及從不同物料中分離出的枯草芽孢桿菌對黃曲霉的生長都有抑制作用[59-60]。另外還可以利用黃曲霉本身進行生物競爭。如利用不產毒菌株與產毒黃曲霉菌株之間的生存競爭進行污染控制。將不產毒菌株大量接種到田地從而生長為強勢菌株來淘汰產毒菌株,從而達到污染控制的目的。然而,將拮抗菌株或是不產毒黃曲霉菌株直接應用于食品行業的事例還沒有報道,并且活體無毒菌株對生態平衡是否會造成負面影響有待于進一步的評估。
2.1.3 抑菌劑
研究報道,一些植物源的化合物在不污染糧食作物的前提下可以有效地抑制黃曲霉的生長并且對毒素的產生也有不同程度的抑制作用。目前報道的抑制劑主要有生物堿、抗生素、雙黃酮、阻斷劑香豆素類、黃酮類、氧肟酸、氧類脂、多烯不飽和脂肪酸、萜類化合物、某些精油等。肉桂醛和改良后的納米化肉桂醛可以進入黃曲霉真菌細胞內,刺激細胞產生大量的活性氧破壞細胞膜,引起細胞膜的損傷從而對黃曲霉菌絲的生長和黃曲霉毒素的產生抑制作用[61]。多糖等抗腫瘤活性成分物質,尤其是海帶多糖,通過與細胞膜上受體蛋白的結合對黃曲霉菌絲的生長和毒素的產生具有顯著地抑制作用[62-63]。另有研究指出茶葉水提物對黃曲霉的菌絲生長雖然沒有明顯的抑制作用,但是可以顯著地抑制黃曲霉毒素的產生[64],如茶多酚、兒茶素、槲皮素[65]。Reverberi等[66]發現寄生曲霉細胞內的氧化還原穩態對黃曲霉毒素的合成發揮著重要的作用,而多酚類物質所具有抗氧化活性打破了這種氧化還原穩態從而影響毒素的產生。這一類植物源抑菌劑最大的優勢在于不會對被污染物造成二次污染和藥物的殘留,但是該類抑菌劑大量的提取以及工業化生產可能會有一定的困難。因此,對于植物源抑菌劑的研究可能會成為對黃曲霉及黃曲霉毒素污染控制的一個熱點。
2.2 黃曲霉毒素污染的后期控制
2.2.1 物理降解法
物理降解法是常用的控制毒素污染的方法。通常使用的物理方法有輻照法和吸附法。輻照法因其方便、快速、無污染的特點而被廣泛應用于食品行業。研究發現一定的照射劑量可以有效去除花生油中2 mg/kg的AFB1,且不會引起花生油品質的改變[67]。在研究γ射線對黃曲霉孢子輻照效應中,發現輻射不僅能殺滅霉菌孢子,也能抑制霉菌毒素產生[68]。在吸附法中,目前常見的黃曲霉毒素吸附劑主要是鋁硅酸鹽類和酵母細胞壁提取物類吸附劑,還有活性炭、活菌制劑、交聯聚乙烯吡咯烷酮(crosslinking polyvingypyrrolidone,PVPP)、復合吸附劑等其他類型吸附劑。李娟娟等[69]研究了酵母培養物、水合鋁硅酸鹽、復合吸附劑等對黃曲霉毒素B1吸附效果,發現水合鋁硅酸鹽的吸附能力最強,能夠降低毒素對肉仔雞的危害。夏鵬等[70]發現在精料補充料中添加真菌毒素吸附劑對奶牛乳中AFM1具有一定吸附和降低其含量的作用,且對乳成分和其他相關指標無顯著影響。
2.2.2 化學降解法
常見的化學去除黃曲霉毒素的方法有氫氧化鈉降解法和氨熏法。在氫氧化鈉強堿條件下黃曲霉毒素的結構通常會被破壞,生成水鄰位香豆素鈉鹽[71]。氨熏法氨處理法主要是利用氨氣與AFB1結合后發生脫羥作用,從而使AFB1的內環發生裂解,達到去毒素降解的效果,經過7.05%氨氣熏蒸96 h的玉米中AFB1的降解率為92%[72]。煙熏法在降解黃曲霉毒素的同時,不會破壞被處理物質的營養價值,并且該方法處理簡單、成本較低,適于大規模應用。
2.2.3 其他降解法
除了上述物理化學方法之外,針對控制黃曲霉及黃曲霉毒素的污染,還有使用強氧化劑、農藥和酶解等其他降解法。通過二氧化氯、強酸性氧化離子水、次氯酸鈉等氧化劑也能完成黃曲霉毒素的脫毒[73]。高毒農藥等也可以殺死黃曲霉真菌,消除黃曲霉和毒素的污染。但這兩種污染控制方法會對環境和原料造成不同程度的污染或引入了二次污染。采用微生物產生的酶及其制劑來進行黃曲霉毒素控制,具備效率高、特異性強、條件相對溫和、對原料和環境沒有污染的優勢,也不會破壞產品品質,可以成為今后研究的方向。
3 結 語
對于前期黃曲霉及黃曲霉毒素污染的控制,植物源殺菌劑的研制有可能成為今后的研究重點。目前的藥物處理大多對黃曲霉的生長具有有效的抑制作用,如生物堿類、抗生素類、酚類物質以及一些植物精油等[60-63],但是這些藥物大都是抑菌而不是殺菌,一旦處理時間過久,藥物的這種抑制作用就會消失,并且有些藥物在食品的應用中還有一定的局限性,例如造成二次污染等。因此,從植物源的抑菌劑層面上升至殺菌劑的層面將有效地控制黃曲霉及其毒素的污染。植物源殺菌劑應該存在以下幾個優點:1)高效快速殺死黃曲霉,阻止黃曲霉的繼續生長繁殖,可以減小前期糧食的污染程度;2)能夠殺死黃曲霉的孢子,從根本上杜絕黃曲霉的再繁殖再污染;3)可有效抑制黃曲霉毒素的產生,從而降低對人和牲畜健康的危害;4)這種殺菌劑通常具有低毒揮發性或是無毒,不會對產品造成二次污染的特點;5)植物源殺菌劑可能含有特殊的香味物質,為產品增加特有的香味等。因此,植物源殺菌劑可能成為今后研究的重點,用于黃曲霉及黃曲霉毒素污染的控制。
對于后期黃曲霉毒素污染的控制,干預劑可能成為研究的重點,干預劑主要用來干預后期毒素在人和動物體內的吸收。水合硅酸鋁作為抗凝劑經常用于動物飼料,在腸道中可以有效吸收黃曲霉毒素[74]。小鼠和人體實驗中,通過血液和尿液的檢測可以發現黃曲霉毒素顯著減少,并且短期內水合硅酸鋁對小鼠和人體沒有產生不良后果[74-76]。還有研究表明,一些益生菌可以吸附黃曲霉毒素形成菌體-毒素復合物從而降低對毒素的吸收,有助于將毒素排出體外,因此益生菌與黃曲霉毒素的結合作用可以對肝癌起到一定的預防作用[77]。葉綠酸是葉綠素的衍生物,在動物體內具有抗癌作用[78],并且葉綠酸與AFB1結合成復合物可以也可以減少黃曲霉毒素在腸道中的轉運吸收。有研究發現葉綠素也可以有效地幫助小鼠抵抗黃曲霉毒素誘導的癌癥[79-80]。因此,經常食用含有葉綠素的食物或是補品對于預防肝癌的發生具有一定的作用。另外一些中藥中的黃酮、多酚類活性物質可作用于酶代謝系統,從而影響黃曲霉毒素的代謝,起到解毒作用[81]。環境中徹底消除黃曲霉毒素的污染幾乎是不可能的,因此干預黃曲霉毒素在人體內的吸收代謝具有重要意義。
[1] HORN B W, MOORE G G, CARBONE I. Sexual reproduction in Aspergillus flavus[J]. Mycologia, 2009, 101(3): 423-429. DOI:10.3852/09-011.
[2] COTTY P J. Virulence and cultural characteristics of two Aspergillus flavus strains pathogenic on cotton[J]. Phytopathology, 1989, 79(7):808-814. DOI:10.1094/Phyto-79-808.
[3] HORN B W. Ecology and population biology of aflatoxigenic fungi in soil[J]. Toxin Reviews, 2003, 22(2/3): 351-379. DOI:10.1081/TXR-120024098.
[4] RICHARD J L, PAYNE G A, DESJARDINS A E, et al. Mycotoxins:risks in plant, animal and human systems[J]. CAST Task Force Report,2003, 139: 101-103.
[5] KURTZMAN C P, HORN B W, HESSELTINE C W. Aspergillus nomius, a new aflatoxin-producing species related to Aspergillus flavus and Aspergillus tamarii[J]. Antonie van Leeuwenhoek, 1987, 53(3):147-158. DOI:10.1007/BF00393843.
[6] ASAO T, BUCHI G, ABDEL-KADER M M, et al. Aflatoxins B and G[J]. Journal of the American Chemical Society, 1963, 85(11): 1706-1707. DOI:10.1021/ja00894a050.
[7] 居乃虎. 黃曲霉毒素[M]. 北京: 中國輕工業出版社, 1980: 58-326.
[8] FARFAN I D B, de la FUENTE G N, MURRAY S C, et al. Genome wide association study for drought, aflatoxin resistance, and important agronomic traits of maize hybrids in the sub-tropics[J]. PLoS ONE,2015, 10(2): e0117737. DOI:10.1371/journal.pone.0117737.
[9] LAI X W, ZHANG H, LIU R C, et al. Potential for aflatoxin B1and B2production by Aspergillus flavus strains isolated from rice samples[J]. Saudi Journal of Biological Sciences, 2015, 22(2): 176-180. DOI:10.1016/j.sjbs.2014.09.013.
[10] KRISHNAN S, MANAVATHU E K, CHANDRASEKAR P H. Aspergillus flavus: an emerging non-fumigatus Aspergillus species of significance[J]. Mycoses, 2009, 52(3): 206-222. DOI:10.1111/j.1439-0507.2008.01642.x.
[11] HETHERINGTON S V, HENWICK S, PARHAM D M, et al. Monoclonal antibodies against a 97-kilodalton antigen from Aspergillus flavus[J]. Clinical and Diagnostic Laboratory Immunology,1994, 1(1): 63-67.
[12] STEINBACH W J. Pediatric aspergillosis: disease and treatment differences in children[J]. The Pediatric Infectious Disease Journal,2005, 24(4): 358-364. DOI:10.1097/01.inf.0000157218.37603.84.
[13] REQUENA F, SAUME E Y, LEóN A. Micotoxinas: enemigas silenciosas de la salud[J]. Ceniap Hoy, 2005, 9: 32.
[14] DIBA K, MAKHDOOMI K, MIRHENDI H. Molecular characterization of Aspergillus infections in an Iranian educational hospital using RAPD-PCR method[J]. Iranian Journal of Basic Medical Sciences, 2014, 17(9): 646-650.
[15] DIXON D M, WALSH T J. Human pathogenesis[J]. Biotechnology,1992, 23: 249-267.
[16] TILAK R, SINGH A, MAURYA O P S, et al. Mycotic keratitis in India: a five-year retrospective study[J]. The Journal of Infection in Developing Countries, 2010, 4(3): 171-174. DOI:10.3855/jidc.309.
[17] HEDAYATI M T, PASQUALOTTO A C, WARN P A, et al. Aspergillus flavus: human pathogen, allergen and mycotoxin producer[J]. Microbiology, 2007, 153(6): 1677-1692. DOI:10.1099/ mic.0.2007/007641-0.
[18] BLOUNT W P. Turkey “X” disease[J]. Turkeys, 1961, 9(2): 52-55.
[19] GROOPMAN J D, KENSLER T W. Role of metabolism and viruses in aflatoxin-induced liver cancer[J]. Toxicology and Applied Pharmacology,2005, 206(2): 131-137. DOI:10.1016/j.taap.2004.09.020.
[20] GALLAGHER E P, WIENKERS L C, STAPLETON P L, et al. Role of human microsomal and human complementary DNA-expressed cytochromes P4501A2 and P4503A4 in the bioactivation of aflatoxin B1[J]. Cancer Research, 1994, 54(1): 101-108.
[21] KENSLER T W, ROEBUCK B D, WOGAN G N, et al. Aflatoxin:a 50-year odyssey of mechanistic and translational toxicology[J]. Toxicological Sciences, 2011, 120(Suppl 1): 28-48. DOI:10.1093/ toxsci/kfq283.
[22] BENNETT R A, ESSIGMANN J M, WOGAN G N. Excretion of an aflatoxin-guanine adduct in the urine of aflatoxin B1-treated rats[J]. Cancer Research, 1981, 41(2): 650-654.
[23] BRESSAC B, PUISIEUX A, KEW M, et al. p53 mutation in hepatocellular carcinoma after aflatoxin exposure[J]. The Lancet,1991, 338: 1356-1359. DOI:10.1016/0140-6736(91)92236-U.
[24] FERLAY J, SHIN H R, BRAY F, et al. Estimates of worldwide burden of cancer in 2008: GLOBOCAN 2008[J]. International Journal of Cancer, 2010, 127(12): 2893-2917. DOI:10.1002/ijc.25516.
[25] BUSBY W F, WOGAN G N. Aflatoxins[J]. Chemical Carcinogens,1984, 2: 945-1136.
[26] GONG Y, HOUNSA A, EGAL S, et al. Postweaning exposure to aflatoxin results in impaired child growth: a longitudinal study in Benin, West Africa[J]. Environmental Health Perspectives, 2004,112(13): 1334-1338. DOI:10.1289/ehp.6954.
[27] TURNER P C, COLLINSON A C, CHEUNG Y B, et al. Aflatoxin exposure in utero causes growth faltering in Gambian infants[J]. International Journal of Epidemiology, 2007, 36(5): 1119-1125. DOI:10.1093/ije/dym122.
[28] MINTO R E, TOWNSEND C A. Enzymology and molecular biology of aflatoxin biosynthesis[J]. Chemical Reviews, 1997, 97(7): 2537-2556. DOI:10.1021/cr960032y.
[29] HUNTER I S. Microbial secondary metabolites: biosyntheses, genetics and regulation[M]. Berlin, German: Spring Press, 2002: 141-166. DOI:10.1007/s11427-013-4501-5.
[30] YABE K, NAKAJIMA H. Enzyme reactions and genes in aflatoxin biosynthesis[J]. Applied Microbiology and Biotechnology, 2004,64(6): 745-755. DOI:10.1007/s00253-004-1566-x.
[31] YU J, BHATNAGAR D, EHRLICH K C. Aflatoxin biosynthesis[J]. Revista Iberoamericana de Micología, 2002, 19(4): 191-200.
[32] GEORGIANNA D R, PAYNE G A. Genetic regulation of aflatoxin biosynthesis: from gene to genome[J]. Fungal Genetics and Biology,2009, 46(2): 113-125. DOI:10.1016/j.fgb.2008.10.011.
[33] 羅自生, 秦雨, 徐艷群, 等. 黃曲霉毒素的生物合成、代謝和毒性研究進展[J]. 食品科學, 2015, 36(3): 250-257. DOI:10.7506/spkx1002-6630-201503048.
[34] BUCHANAN R L, STAHL H G. Ability of various carbon sources to induce and support aflatoxin synthesis by Aspergillus parasiticus[J]. Journal of Food Safety, 1984, 6(4): 271-279. DOI:10.1111/j.1745-4565.1984.tb00488.x.
[35] KACHHOLZ T, DEMAIN A L. Nitrate repression of averufin and aflatoxin biosynthesis[J]. Journal of Natural Products, 1983, 46(4):499-506. DOI:10.1021/np50028a013.
[36] DIENER U L, DAVIS N D. Limiting temperature and relative humidity for growth and production of aflatoxin and free fatty acids by Aspergillus flavus in sterile peanuts[J]. Journal of Oil & Fat Industries,1967, 44(4): 259-263. DOI:10.1007/BF02639271.
[37] SCHINDLER A F, PALMER J G, EISENBERG W V. Aflatoxin production by Aspergillus flavus as related to various temperatures[J]. Applied and Environmental Microbiology, 1967, 15(5): 1006-1009.
[38] COTTY P J, COTTY P J. Aflatoxin and sclerotial production by Aspergillus flavus: influence of pH[J]. Phytopathology, 1988, 78(9):1250-1253. DOI:10.1094/phyto-78-1250.
[39] KELLER N P, NESBITT C, SARR B, et al. pH regulation of sterigmatocystin and aflatoxin biosynthesis in Aspergillus spp.[J]. Phytopathology, 1997, 87(6): 643-648. DOI:10.1094/ PHYTO.1997.87.6.643.
[40] PRICE M S, CONNERS S B, TACHDJIAN S, et al. Aflatoxin conducive and non-conducive growth conditions reveal new gene associations with aflatoxin production[J]. Fungal Genetics and Biology, 2005, 42(6): 506-518. DOI:10.1016/j.fgb.2005.03.009.
[41] CHANDA A, ROZE L V, KANG S, et al. A key role for vesicles in fungal secondary metabolism[J]. Proceedings of the National Academy of Sciences, 2009, 106(46): 19533-19538. DOI:10.1073/ pnas.0907416106.
[42] CHANDA A, ROZE L V, LINZ J E. A possible role for exocytosis in aflatoxin export in Aspergillus parasiticus[J]. Eukaryotic Cell, 2010,9(11): 1724-1727. DOI:10.1128/EC.00118-10.
[43] YU J, PAYNE G A, NIERMAN W C, et al. Aspergillus flavus genomics as a tool for studying the mechanism of aflatoxin formation[J]. Food Additives and Contaminants, 2008, 25(9): 1152-1157. DOI:10.1080/02652030802213375.
[44] CLEVELAND T E, YU J, FEDOROVA N, et al. Potential of Aspergillus flavus genomics for applications in biotechnology[J]. Trends in Biotechnology, 2009, 27(3): 151-157. DOI:10.1016/ j.tibtech.2008.11.008.
[45] CHANG P K, YU J, BHATNAGAR D, et al. Repressor-AFLR interaction modulates aflatoxin biosynthesis in Aspergillus parasiticus[J]. Mycopathologia, 1999, 147(2): 105-112. DOI:10.1023/ A:1007157309168.
[46] PRICE M S, YU J, NIERMAN W C, et al. The aflatoxin pathway regulator AFLR induces gene transcription inside and outside of the aflatoxin biosynthetic cluster[J]. FEMS Microbiology Letters, 2006,255(2): 275-279. DOI:10.1111/j.1574-6968.2005.00084.x.
[47] EHRLICH K C, CARY J W, MONTALBANO B G. Characterization of the promoter for the gene encoding the aflatoxin biosynthetic pathway regulatory protein AFLR[J]. Biochimica et Biophysica Acta(BBA)-Gene Structure and Expression, 1999, 1444(3): 412-417. DOI:10.1016/S0167-4781(99)00022-6.
[48] DU W, OBRIAN G R, PAYNE G A. Function and regulation of aflJ in the accumulation of aflatoxin early pathway intermediate in Aspergillus flavus[J]. Food Additives and Contaminants, 2007, 24(10):1043-1050. DOI:10.1080/02652030701513826.
[49] MEYERS D M, OBRIAN G, DU W L, et al. Characterization of aflJ, a gene required for conversion of pathway intermediates to aflatoxin[J]. Applied and Environmental Microbiology, 1998, 64(10): 3713-3717.
[50] YU J, CHANG P K, CARY J W, et al. Comparative mapping of aflatoxin pathway gene clusters in Aspergillus parasiticus and Aspergillus flavus[J]. Applied and Environmental Microbiology, 1995, 61(6): 2365-2371.
[51] ITO Y, PETERSON S W, WICKLOW D T, et al. Aspergillus pseudotamarii, a new aflatoxin producing species in Aspergillus section Flavi[J]. Mycological Research, 2001, 105(2): 233-239. DOI:10.1017/S0953756200003385.
[52] PETERSON S W, ITO Y, HORN B W, et al. Aspergillus bombycis, a new aflatoxigenic species and genetic variation in its sibling species,A. nomius[J]. Mycologia, 2001, 93(4): 689-703. DOI:10.2307/3761823.
[53] KUSUMOTO K I, NOGATA Y, OHTA H. Directed deletions in the aflatoxin biosynthesis gene homolog cluster of Aspergillus oryzae[J]. Current Genetics, 2000, 37(2): 104-111. DOI:10.1007/ s002940050016.
[54] 田立榮, 廖伯壽, 李玉榮, 等. 花生抗黃曲霉遺傳改良研究進展[J].河北農業科學, 2010, 14(9): 80-83.
[55] MENKIR A, BROWN R L, BANDYOPADHYAY R, et al. Registration of six tropical maize germplasm lines with resistance to aflatoxin contamination[J]. Journal of Plant Registrations, 2008, 2(3):246-250. DOI:10.3198/jpr2008.01.0028crg.
[56] 王再興, 官德義, 石新國, 等. 抗黃曲霉花生良種 “閩花 6號”[J]. 福建農業科技, 2010 (3): 23-24. DOI:10.13651/j.cnki. fjnykj.2010.03.017.
[57] DORNER J W, COLE R J, CONNICK W J, et al. Evaluation of biological control formulations to reduce aflatoxin contamination in peanuts[J]. Biological Control, 2003, 26(3): 318-324. DOI:10.1016/ S1049-9644(02)00139-1.
[58] 朱新貴, 林捷. 幾種食品微生物降解黃曲霉毒素作用的研究[J].食品科學, 2001, 22(10): 65-68.
[59] 劉丁, 秦文. 萎縮芽孢桿菌處理提高花生黃曲霉抗性的作用機制[J].食品科學, 2013, 34(23): 266-270. DOI:10.7506/spkx1002-6630-201323054.
[60] 郭艷萍, 盛海圓, 陳曉琳, 等. 抑黃曲霉乳酸菌的篩選及菌種鑒定[J].中國微生態學雜志, 2010(7): 583-586. DOI:10.13381/j.cnki. cjm.2010.07.002.
[61] LI H B, SHEN Q S, ZHOU W, et al. Nanocapsular dispersion of cinnamaldehyde for enhanced inhibitory activity against aflatoxin production by Aspergillus flavus[J]. Molecules, 2015, 20(4): 6022-6032. DOI:10.3390/molecules20046022.
[62] 李紅波, 胡梁斌, 王淼焱, 等. 幾種多糖對黃曲霉菌生長及產毒的抑制作用[J]. 江西農業學報, 2011(5): 82-84.
[63] HU L B, LI H B, SUN J L, et al. Effect of laminarin on Aspergillus flavus growth and aflatoxin production[J]. Advanced Materials Research, 2012, 343: 1168-1171. DOI:10.4028/www.scientific.net/ AMR.343-344.1168.
[64] 吳清華. 茶葉中抑制黃曲霉毒素產生的組分及相關特性研究[D]. 楊凌: 西北農林科技大學, 2013: 28-37.
[65] ZHOU W, HU L B, ZHAO Y, et al. Inhibition of fungal aflatoxin B1biosynthesis by diverse botanically-derived polyphenols[J]. Tropical Journal of Pharmaceutical Research, 2015, 14(4): 605-609. DOI:10.4314/tjpr.v14i4.7.
[66] REVERBERI M, ZJALIC S, RICELLI A, et al. Oxidant/antioxidant balance in Aspergillus parasiticus affects aflatoxin biosynthesis[J]. Mycotoxin Research, 2006, 22(1): 39-47. DOI:10.1007/BF02954556.
[67] 劉睿杰, 金青哲, 陳波, 等. 紫外照射去除黃曲霉毒素工藝對花生油品質的影響[J]. 中國油脂, 2011, 36(6): 17-20.
[68] 鐘凱, 高翔, 計融.60Co γ 射線對生理鹽水和玉米中黃曲霉孢子的輻照效應研究[J]. 衛生研究, 2011, 40(3): 352-354.
[69] 李娟娟, 蘇曉鷗. 不同吸附劑對黃曲霉毒素B1吸附效果的研究[J].中國畜牧獸醫, 2009, 36(8): 5-10.
[70] 夏鵬, 連紅, 王根林. 飼喂霉菌毒素吸附劑對牛奶中黃曲霉毒素M1殘留量的影響[J]. 中國飼料, 2011(7): 23-24. DOI:10.15906/j.cnki. cn11-2975/s.2011.07.010.
[71] 王波, 楊琳, 張宇昊, 等. 黃曲霉毒素去毒方法研究進展[J]. 中國油脂,2011, 36(2): 60-63.
[72] 陳志娟, 劉陽, 邢福國, 等. 氨氣熏蒸降解玉米中黃曲霉毒素B1的條件優化[J]. 食品科學, 2010, 31(8): 33-37.
[73] 許菲菲, 劉亞麗, 田富饒. 黃曲霉毒素檢測方法研究[J]. 化學分析計量, 2010, 19(5): 93-94.
[74] PHILLIPS T D, LEMKE S L, GRANT P G. Characterization of clay-based enterosorbents for the prevention of aflatoxicosis[J]. Advances in Experimental Medicine & Biology, 2002, 504: 157-171. DOI:10.1007/978-1-4615-0629-4_16.
[75] AFRIYIE-GYAWU E, MACKIE J, DASH B, et al. Chronic toxicological evaluation of dietary NovaSil clay in Sprague-Dawley rats[J]. Food Additives and Contaminants, 2005, 22(3): 259-269. DOI:10.1080/02652030500110758.
[76] WANG J S, LUO H, BILLAM M, et al. Short-term safety evaluation of processed calcium montmorillonite clay (NovaSil) in humans[J]. Food Additives and Contaminants, 2005, 22(3): 270-279. DOI:10.1080/02652030500111129.
[77] van RENSBURG C J, van RENSBURG C E J, van RYSSEN J B J,et al. In vitro and in vivo assessment of humic acid as an aflatoxin binder in broiler chickens[J]. Poultry Science, 2006, 85(9): 1576-1583. DOI:10.1093/ps/85.9.1576.
[78] BREINHOLT V, HENDRICKS J, PEREIRA C, et al. Dietary chlorophyllin is a potent inhibitor of aflatoxin B1hepatocarcinogenesis in rainbow trout[J]. Cancer Research, 1995, 55(1): 57-62.
[79] VERSANTVOORT C H M, OOMEN A G, van de KAMP E, et al. Applicability of an in vitro digestion model in assessing the bioaccessibility of mycotoxins from food[J]. Food and Chemical Toxicology, 2005, 43(1): 31-40. DOI:10.1016/j.fct.2004.08.007.
[80] SIMONICH M T, EGNER P A, ROEBUCK B D, et al. Natural chlorophyll inhibits aflatoxin B1-induced multi-organ carcinogenesis in the rat[J]. Carcinogenesis, 2007, 28(6): 1294-1302. DOI:10.1093/ carcin/bgm027.
[81] 王清蘭, 陶艷艷, 劉成海. 黃曲霉毒素體內吸收與代謝的干預措施研究進展[J]. 腫瘤, 2007, 27(5): 415-418.
Recent Advances in the Control of Aflatoxin Contamination
SHEN Qingshan, ZHOU Wei, MO Haizhen, HU Liangbin*(Department of Food Science, Henan Institute of Science and Technology, Xinxiang 453003, China)
Aspergillus flavus can contaminate crops and food products, and produce aflatoxins which cause extremely serious damage to human and animal health. In this study, the molecular mechanisms involving aflatoxins biosynthesis, regulation and transport are reviewed. The existing strategies used to control aflatoxin contamination, such as genetic engineering and breeding, and physical and chemical decomposition are summarized. Additionally, the development and application of botanical fungicides and biological interventions are also highlighted and discussed.
aflatoxins; contamination; control strategy
10.7506/spkx1002-6630-201609044
TS201.6
A
1002-6630(2016)09-0237-07
沈青山, 周威, 莫海珍, 等. 黃曲霉毒素污染控制的研究進展[J]. 食品科學, 2016, 37(9): 237-243. DOI:10.7506/spkx1002-6630-201609044. http://www.spkx.net.cn
SHEN Qingshan, ZHOU Wei, MO Haizhen, et al. Recent advances in the control of aflatoxin contamination[J]. Food Science,2016, 37(9): 237-243. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201609044. http://www.spkx.net.cn
2015-06-18
國家自然科學基金青年科學基金項目(31101231);河南省高等學校青年骨干教師資助計劃項目(2013GGJS-134);教育部“新世紀優秀人才支持計劃”項目(NCET-12-0694)
沈青山(1989—),男,碩士研究生,研究方向為黃曲霉毒素代謝與污染控制。E-mail:sqs973@hotmail.com
*通信作者:胡梁斌(1979—),男,副教授,博士,研究方向為食源性病原物控制。E-mail:hulb973@163.com

