滇池春夏季浮游動物群落結構特征及與環境因子的關系
王 華,劉麗萍,李婭萍
(昆明市環境監測中心,云南 昆明 650228 )
?
滇池春夏季浮游動物群落結構特征及與環境因子的關系
王 華,劉麗萍,李婭萍
(昆明市環境監測中心,云南 昆明 650228 )
2013年3月和7月對滇池浮游動物群落結構及棲息環境進行調查,研究了滇池中浮游動物群落結構及與環境因子的關系。10個采樣點共鑒定出浮游動物31種,輪蟲類14種,占45.2%;枝角類9種,占29.0%;原生動物5種,占16.1%;橈足類3種,占9.7%。春季密度為1130ind/L,優勢種為螺形龜甲輪蟲(Keratellacochlearis);夏季密度為1932ind/L,優勢種為鐘蟲(Vorticella)和英勇劍水蚤(Cyclopsstrennus)。Pearson相關性分析結果顯示,春季輪蟲類密度與水溫顯著正相關,與CODMn顯著負相關,夏季與水溫、pH、DO顯著正相關,與氮磷營養鹽、電導率顯著負相關;春季枝角類密度與TP顯著負相關,夏季與氮磷營養鹽、電導率顯著正相關,與pH、DO、Chla顯著負相關;橈足類密度與CODMn顯著負相關,春季還與水溫、DO、Chla、透明度、電導率呈顯著正相關,原生動物與環境因子無顯著相關性。浮游動物物種與環境因子的典范對應分析(CCA)結果表明:溶解氧、氮磷營養鹽、葉綠素a、電導率是影響滇池浮游動物群落結構及分布的主要環境因子,其中春季的主要環境影響因子還有透明度、CODMn,夏季水溫和pH也是主要影響因子。
浮游動物;群落結構;環境因子;相關性分析;滇池
滇池屬長江流域金沙江水系,位于昆明市城區西南面,屬斷陷構造湖泊。海拔1887.5m,平均水深5.12m,湖水面積306km2,庫容12.9×108m3,是云貴高原上湖面最大的淡水湖泊[1]。近年來,滇池水質污染嚴重,水體富營養化加劇,水生態系統不容樂觀,已成為國家重點治理的三大湖泊之一。
浮游動物是水域生態系統中的生物組成部分,作為生態系統中重要次級生產力,在物質轉化、能量流動、信息傳遞等生態過程中起著至關重要的作用,對維持整個水域生態系統的平衡至關重要[2,3]。浮游動物對環境變化極敏感[4,5],種類組成與物種多樣性的變化直接影響水域生態系統的結構與功能,同時種類組成和現存量的變化能及時準確地反映水域生態環境質量的優劣[6-9]。對滇池中的浮游動物群落進行系統調查,分析其生物組成的特點,揭示影響浮游植物群落分布的主要環境變量,可對滇池水體的富營養化狀態和污染情況進行較為客觀的評價,為滇池富營養化治理及生態問題的診斷提供科學數據支撐,對減低富營養化水平和生態修復均有重要意義。
目前,對滇池浮游動物的群落結構研究主要集中在年、季節動態變化上,對驅動群落結構變化的內在因子的研究則相對較少。本文于2013年3月(春季)、7月(夏季)分析和測定了滇池浮游動物的密度、種類數及相關水環境因子指標,并通過SPSS、CCA分析,研究探討滇池浮游動物密度、分布、群落結構特征、影響浮游動物群落結構及分布的主要驅動因子以及與環境因子的響應關系,以期為滇池富營養化治理與生態研究提供基礎數據和生物學依據。
1 材料和方法
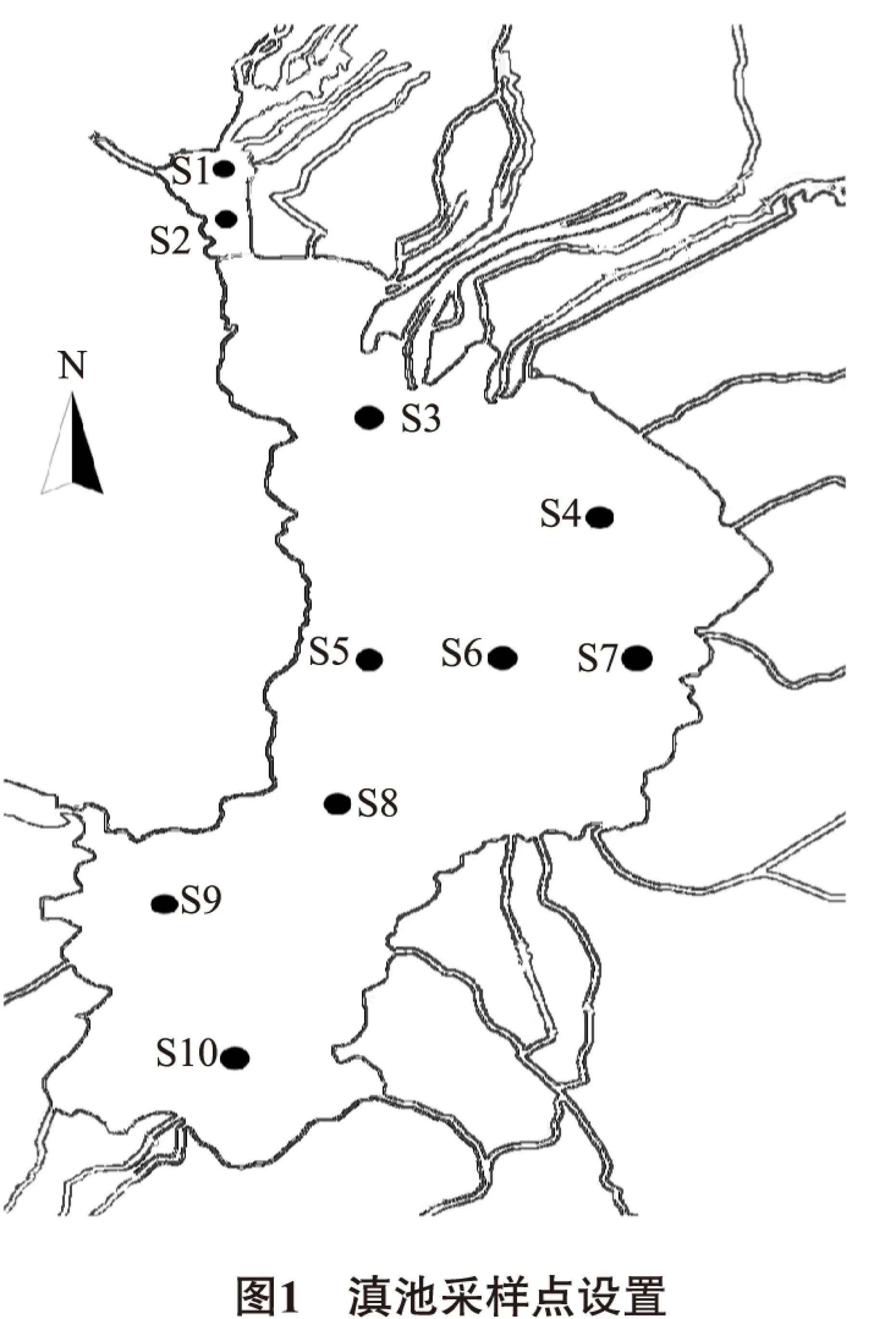
1.1 調查區域及采樣點位設置
本次調查依據地表水湖泊監測布設原則[10],布設具代表性的10個點位(圖1)進行監測。2014年3月(春季)、7月(夏季)各采樣監測1次,通過GPS定位,2次采樣位置保持一致。
1.2 樣品采集、處理、鑒定方法
采樣方法按《淡水浮游生物研究方法》進行[11]。于水體表層0.5m處采集樣品,用25號浮游生物網(孔徑64μm)拖取樣品加入5%甲醛試劑固定,帶回實驗室使用生物顯微鏡進行種類鑒定和數量統計。原生動物、枝角類根據《微型生物監測新技術》[12]鑒定;輪蟲根據《中國淡水輪蟲志》[13]鑒定;橈足類根據《中國動物志》(淡水橈足類)[14]鑒定。
1.3 環境因子測定方法
環境因子的采樣與浮游動物同步進行,樣品采集后冷凍保存,水溫(t) 現場測定(GB13195-1991),pH(GB6920-1986)、溶解氧(GB7489-1987)、高錳酸鹽指數(GB11892-1989)、總磷(GB11893-1989)、 氨氮(HJ535-2009)、總氮(HJ636-2012)、葉綠素a(Chla)采用分光光度法測定,透明度采用塞氏盤法測定,電導率采用電導率儀法測定[15]。
1.4 數據處理分析
采用SPSS17.0對浮游動物與環境因子進行Pearson相關性分析,采用Canoco 4.5分析軟件和Canodraw 4.5作圖軟件對浮游動物群落與環境因子進行典范對應分析。
2 結果與討論
2.1 浮游動物種類組成、結構
2013年滇池浮游動物共檢出31種(表1),其中輪蟲類14種,占45.2%;枝角9種,占29.0%;原生動物5種,占16.1%;橈足類3種,占9.7%。春季檢出18種,輪蟲8種,枝角類5種,橈足類3種,原生動物2種,優勢種為螺形龜甲輪蟲,占24.0%。夏季檢出28種,輪蟲12種,枝角類9種,原生動物5種,橈足類3種,優勢種為鐘蟲和英勇劍水蚤,分別占13.4%、13.1%。
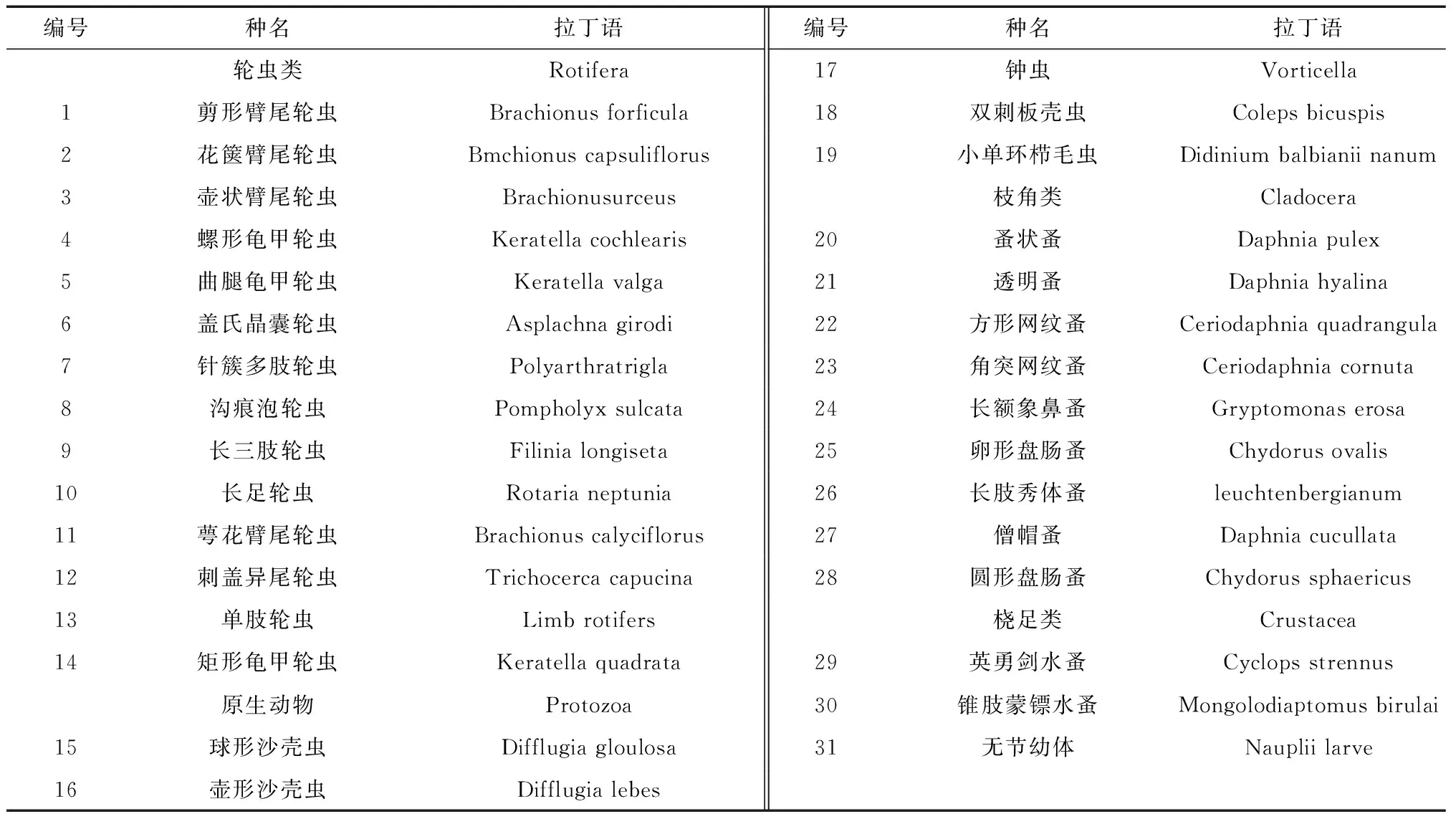
表1 滇池浮游動物種類目錄
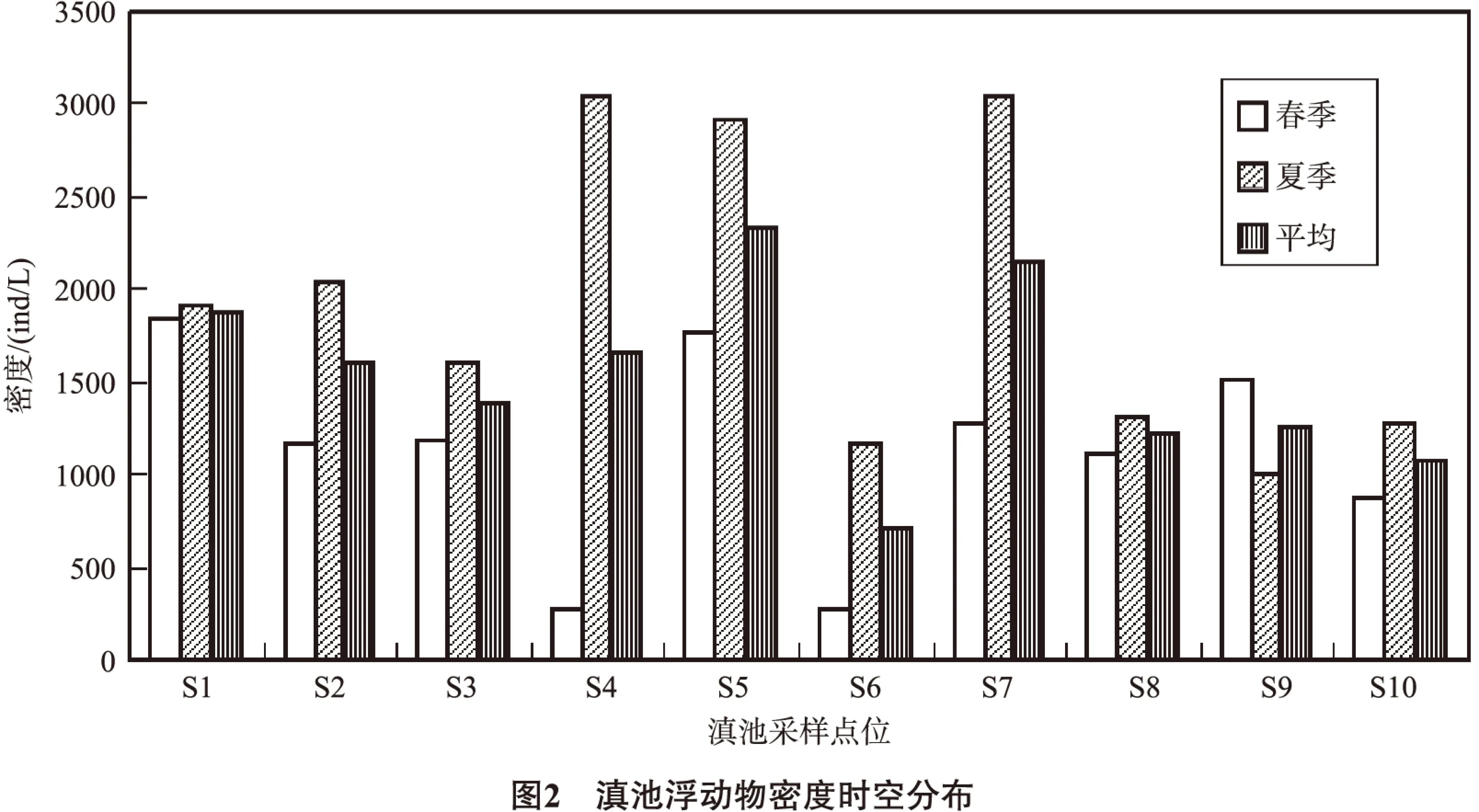
2.2 浮游動物密度及時空分布
結合圖1、2可知,滇池中央(點位6)浮游動物密度最低,浮游動物分布較少;北部區域(點位1)浮游動物密度春夏季無明顯變化;西南區域(點位9)春季浮游動物密度高于夏季,其余點位浮游動物密度夏季高于春季,特別是滇池西、中和東部區域(點位4、5、6、7)夏季密度明顯高于春季。
2.3 生物群落與環境因子典范對應分析
2.3.1 浮游動物與環境因子相關性分析
滇池環境因子監測值見表2。由表2可知:滇池水體偏堿性,春夏水溫變化為15.0~22.9℃,相差7.9℃,夏季水溫、pH 、DO、CODMn、NH4+-N、TP、Chla均高于春季,而TN、電導率夏季低于春季,夏季由于藻類繁殖,透明度降低,葉綠素升高。
由表3可知,各種類浮游動物密度與環境因子間的相關性在不同時間表現有差異。春季輪蟲類密度與水溫表現出顯著正相關,與CODMn為顯著負相關;枝角類密度與TP呈顯著負相關;橈足類密度與水溫、DO、Chla、透明度、電導率呈顯著正相關,與CODMn為顯著負相關;種類數與Chla呈顯著正相關,與CODMn為顯著負相關。夏季輪蟲類密度與水溫、pH、DO表現出顯著正相關,與氨氮、TP、TN、電導率呈顯著負相關;枝角類密度與氨氮、TP、TN、電導率呈顯著正相關,與pH、DO、Chla呈顯著負相關;橈足類密度與CODMn呈顯著負相關;種類數與環境因子無顯著相關性。原生動物密度在春夏季與環境因子均無顯著相關性,這可能是原生動物在滇池分布較少,個體較小,發育快,生命周期短,與滇池水環境相互作用不明顯。
2.3.2 浮游動物與環境因子CCA分析
將春、夏季浮游動物與10種環境因子進行CCA典范對應分析,由表4可知,春季第一排序軸與CODMn顯著正相關,相關系數為0.7327;與第二排序軸顯著相關的環境因子有透明度、電導率、Chla、DO、NH4+-N、TP,相關系數分別為0.8778、0.8778、 0.7739、0.7149、0.6532、0.6270。夏季環境因子與第一排序具相關性的有電導率、pH、TP、DO、TN、NH4+-N、水溫、Chla,其中,電導率、TP、TN、NH4+-N為顯著正相關,相關系數分別為0.9549、0.9413、0.8694、0.8611,與pH、DO、水溫、Chla為極顯著負相關,相關系數分別為-0.9466、-0.8899、-0.8488、-0.8292;第二排序軸只與透明度為顯著正相關,相關系數為0.6431。

表2 滇池環境因子值
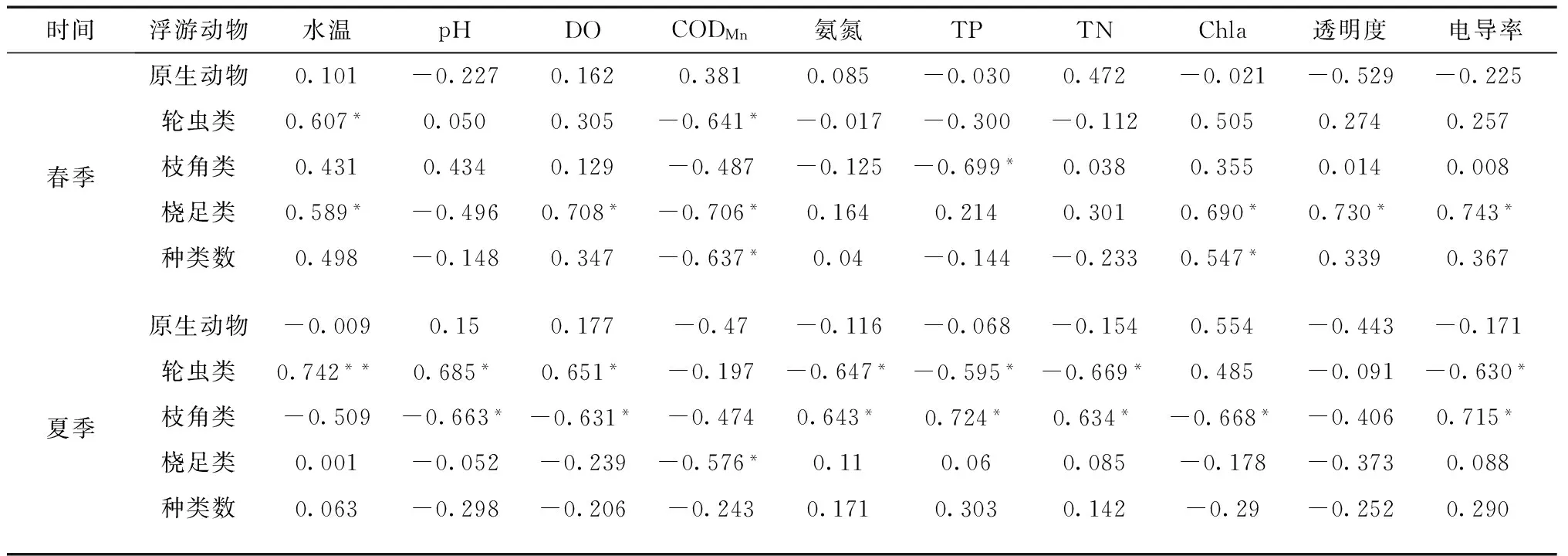
表3 滇池環境因子與浮游動物密度之間相關系數
注:**表示極顯著P<0.01,*表示顯著P<0.05。
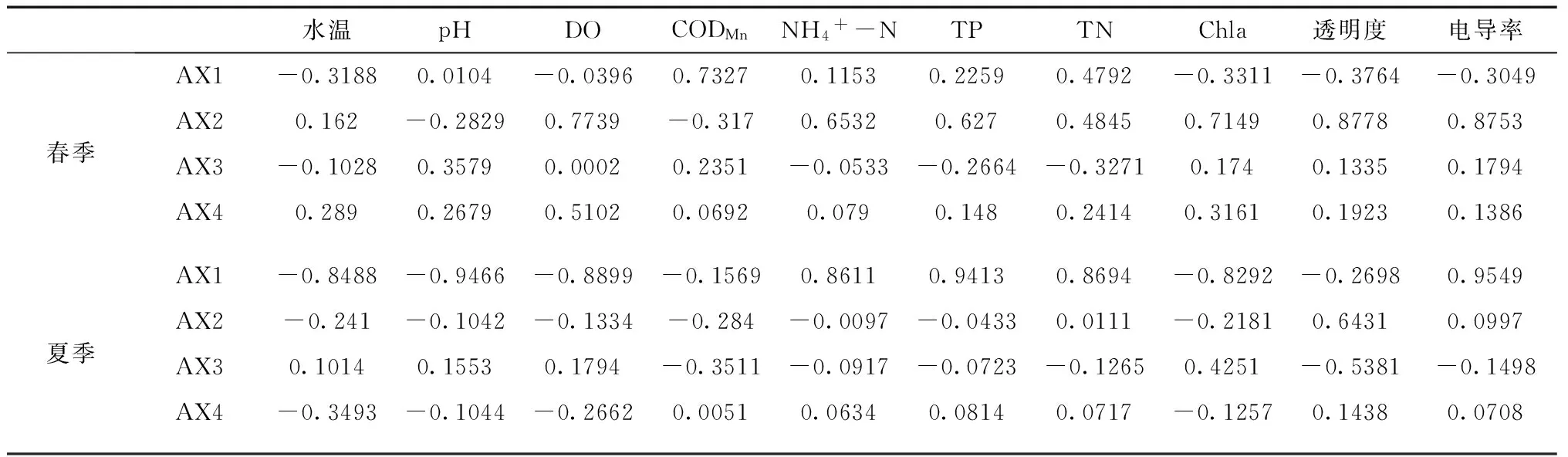
表4 環境因子與CCA排序軸的相關關系
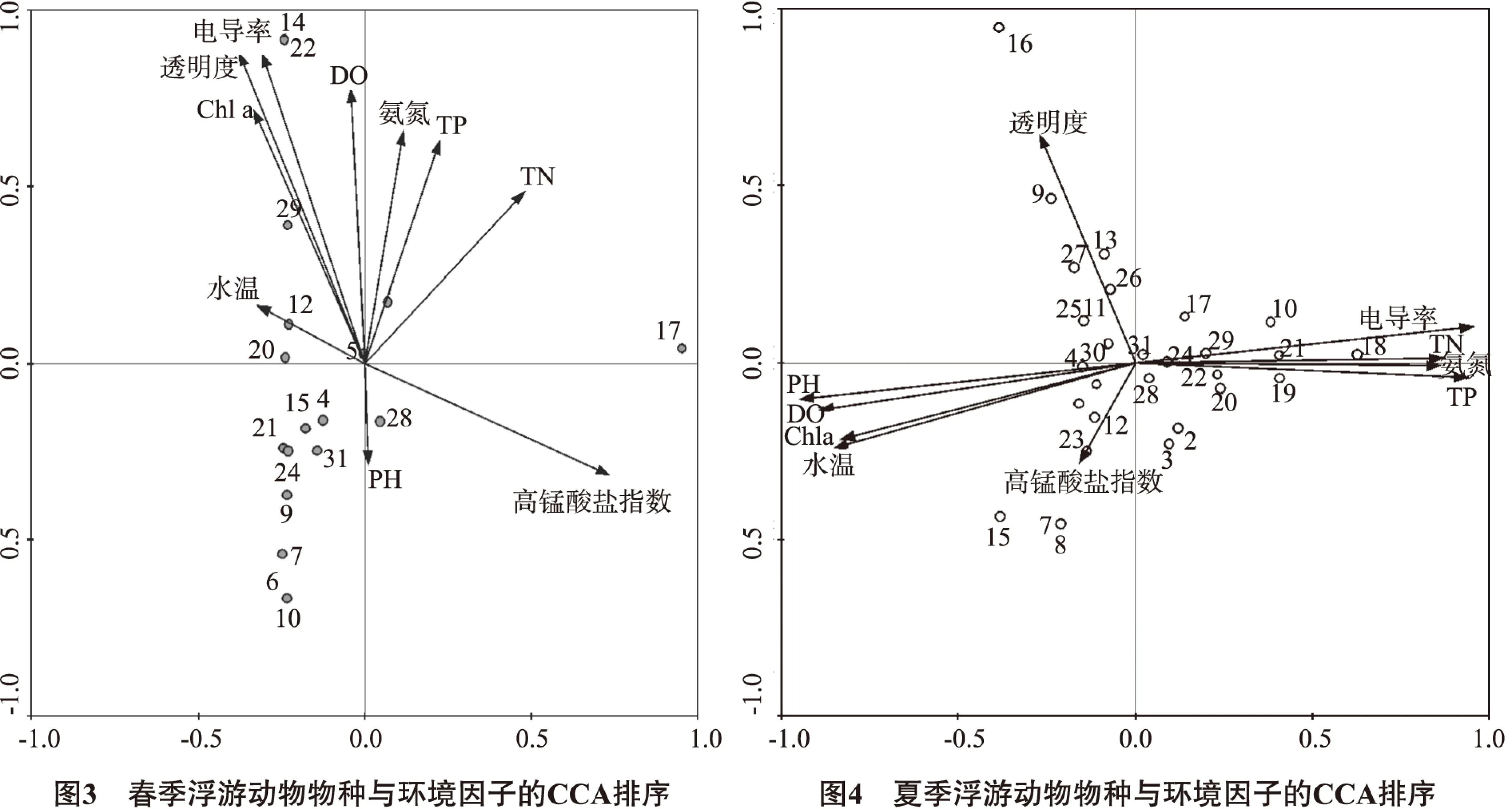
據圖3矢量的長度可知,春季影響浮游動物群落結構的主要環境因子為透明度、電導率、高錳酸鹽指數(CODMn)、葉綠素、氮磷營養鹽、溶解氧,水溫和pH影響較小。據浮游動物物種CCA排序空間上的分布,大部分浮游動物主要集中在第二、第三象限,第二象限與氮磷營養鹽呈負相關,第三象限與透明度、電導率、葉綠素、DO、水溫呈正相關,與CODMn、pH呈負相關。結合排序軸所代表的生態學意義,可以看到春季浮游動物大部分都與營養鹽呈負相關,而與透明度、電導率、葉綠素、水溫、溶解氧呈一定程度正相關。不同物種的浮游動物在環境中的分布呈現較大差異,如曲腿龜甲輪蟲(序號5)在軸中心,能很好適應環境;刺蓋異尾輪蟲(序號12)多分布在溫度較高、營養鹽較低水域;錐肢蒙鏢水蚤(序號30)主要分布在營養鹽高的區域。
據圖4矢量的長度可知,據夏季浮游動物物種CCA排序空間分布,夏季主要環境影響因子為電導率、氮磷營養鹽、Chla、DO、水溫、pH,其次是透明度和CODMn。夏季浮游動物分散于坐標軸四個象限,其中輪蟲類大多分布在第二、第三象限,與Chla、DO、水溫、pH、透明度和CODMn呈顯著正相關,與電導率、氮磷營養鹽呈負相關;枝角類大多分布于第一、第四象限,與電導率、TN、氨氮、TP呈顯著正相關,與Chla、DO、水溫、pH和CODMn呈負相關;橈足類主要分布于第一象限,與電導率、TN呈顯著正相關,與Chla、DO、水溫、pH和CODMn呈負相關;原生動物較分散,與環境因子無明顯相關性,與pearson相關性分析結果一致。夏季不同種類浮游動物分布與環境因子的相關性有一定差異,受影響程度也不同,電導率、氮磷營養鹽、Chla、DO、水溫和pH均是影響其群落結構及分布的環境因子。夏季不同物種的浮游動物在環境中的分布也呈現較大差異,如無節幼體(序號31)分布在軸中心,能很好適應環境;曲腿龜甲輪蟲(序號18)、曲腿龜甲輪蟲(序號19)、刺蓋異尾輪蟲(序號21)等多分布在營養鹽較高、溫度和DO較低水域;角突網紋蚤(序號23)能適應較高CODMn。
2.4 討論
滇池中小型浮游動物(輪蟲類) 的種類數和密度所占比例最高,大型浮游動物( 橈足類) 所占比例較小,這與目前國內外許多湖庫水生態系統中浮游動物的種類組成相似[16-20]。分析其原因為:輪蟲在條件適宜的情況下可采用孤雌生殖模式,繁殖速度加快,數量增加[21];橈足類為兩性生殖,個體發育需經過六個無節幼體階段和五個橈足幼體階段,時間較長;濾食性魚類喜攝食個體較大的浮游動物橈足類[22]。枝角類孤雌生殖,個體發育時間短,繁殖速度快,種群數量增加較快,種類和密度所占比例也較高,因其個體大容易被魚類捕食,種類和密度次于輪蟲類[23]。同一湖泊不同點位環境條件不同,浮游動物的群落結構、種類、組成和數量都存在著的空間和時間的分布差異,滇池夏季浮游動物種類數與密度均高于春季,主要分布于東、西部區域。
浮游動物與環境因素相互作用,不同種類浮游動物與環境因子間的相關性在同一湖泊不同位置、不同季節表現存在差異。水溫可通過改變浮游動物的生理狀態和食物來源進而影響浮游動物的代謝、繁殖及休眠卵的萌發[24,25],滇池春季輪蟲類和橈足類密度與水溫呈顯著正相關,夏季輪蟲類密度與水溫呈顯著正相關,春季溫度較低,輪蟲密度也較少,夏季溫度升高,輪蟲為密度最高。浮游動物對pH的適宜的值不同,滇池夏季輪蟲類和枝角類密度與pH具有顯著相關性。水體中的氮、磷等營養鹽能改變浮游動物的食性,決定其機體的生長和繁殖[26],滇池春季枝角類密度與TP顯著負相關,夏季輪蟲類與TP、TN、氨氮顯著負相關,枝角類密度與TP、TN、氨氮顯著正相關,春季TP較低,反而促進枝角類生長,春季枝角類密度最大,夏季在水溫、氮、磷等相互作用影響下,浮游動物密度增大,輪蟲類最多,枝角類次之。透明度能從一定程度上反映水體中浮游植物的量[27],滇池春季橈足類密度與透明度顯著正相關。Chla是衡量浮游植物的主要指標,浮游動物主要以浮游植物為食,水體中浮游植物的密度與浮游動物的生長繁殖密切相關[28],滇池春季橈足類密度、生物種類數與葉綠素顯著正相關,春季葉綠素較低,橈足類密度少于夏季,夏季枝角類密度與葉綠素顯著負相關,夏季葉綠素增大,對枝角類生長繁殖有一定抑制作用,夏季枝角類少于橈足類。CODMn表示水中還原性污染物的含量水平,與浮游動物密切相關[29],滇池春季輪蟲、橈足類和物種數,夏季橈足類密度均與CODMn顯著負相關,春季CODMn對輪蟲、橈足類生長繁殖有一定制約,夏季對橈足類也為制約影響。電導率可通過影響浮游植物間接作用于浮游動物[30],滇池春季電導率與橈足類密度顯著正相關,夏季電導率與枝角類密度顯著正相關,與輪蟲類密度顯著負相關,間接影響的作用較小。
浮游動物的分布特征是多種環境因素相互作用的結果,不同湖泊影響浮游動物的分布的環境因子不同,相同湖泊不同季節有不同影響因子。結合SPSS相關性分析及CCA分析結果,春季影響滇池浮游動物群落結構及空間分布的主要因子主要是透明度、電導率、Chla、CODMn、DO、NH4+-N、TP ,夏季影響因子主要是電導率、pH、TP、DO、TN、NH4+-N、水溫、Chla。
3 結論
(1)2014年滇池春、夏季共檢出浮游動物31種,其中輪蟲類14種,枝角類9種,原生動物5種,橈足類3種。春季種類數與密度均比夏季少,春季檢出18種,密度為1130ind/L(枝角類>輪蟲類>橈足類>原生動物),優勢種為螺形龜甲輪蟲;夏季檢出28種,密度1932ind/L(輪蟲類> 枝角類>橈足類>原生動物),優勢種為鐘蟲和英勇劍水蚤。
(2)浮游動物與環境因子的相關性,不同季節表現有差異。春季輪蟲類密度與水溫呈顯著正相關,與CODMn為顯著負相關,夏季與水溫、pH、DO顯著正相關,與氨氮、TP、TN、電導率呈顯著負相關;春季枝角類密度與TP呈顯著負相關,夏季與氮磷營養鹽、電導率呈顯著正相關,與pH、DO、Chla為顯著負相關;春季橈足類密度與水溫、DO、Chla、透明度、電導率呈顯著正相關,與CODMn為顯著負相關,夏季與CODMn為顯著負相關;原生動物與環境因子無顯著相關性。
(3)影響春季滇池浮游動物群落結構及分布的主要環境因子為透明度、電導率、高錳酸鹽指數(CODMn)、葉綠素、氮磷營養鹽、溶解氧,其次是水溫和pH。夏季主要環境影響因子為電導率、氮磷營養鹽、Chla、DO、水溫、pH,其次是透明度和CODMn。
[1] 金相燦, 屠清瑛. 湖泊富營養化調查規范[M]. 北京: 中國環境科學出版社, 1990.
[2] 郭沛涌, 沈煥庭, 劉阿成, 等. 長江河口浮游動物的種類組成、群落結構及多樣性[J]. 生態學報, 2003, 23(5): 892-900.
[3] Sousa W, Attayde J L , Rocha E D S, et a1. The response of zooplankton assemblages to variations in the water quality of four man-made lakes in semi-arid northeastern Brazil [J]. Journal of Plankton Research, 2008, 30(6): 699-708.
[4] Lin QQ , Duan SS, Hu R , et a1. Zooplankton distribution in tropical reservoirs, South China[J]. Inernational Review Hydrobiology,2003, 88(6): 602-613.
[5] 吳利, 余育和, 張堂林, 等. 牛山湖浮游生物群落DNA指紋結構與理化因子的關系[J]. 湖泊科學, 2008, 20(2): 235-241.
[6] Echaniz S A, Vignatti A M, De Paggi S J, et a1. Zooplankton seasonal abundance of southAmerican saline shallow lakes[J]. International Review of Hydrobiology, 2006, 91(1): 86-100.
[7] 曾陽, 苗明升, 付秀娥, 等.溫榆河浮游動物多樣性及水質改善效果評價[J]. 環境科學與技術, 2012, 35(3) : 200-205.
[8] Tavemini S, Mura G, Rossetti G. Factors Influencing the seasonal phenology and composition of zooplankton communities in mountain temporary pools[J]. International Review of Hydrobiology, 2005, 90(4): 358-375.
[9] Xu MQ, Cao H, Xie P , et al. The temporal and spatial distribution, composition and abund ance of Protozoa in Chaohu Lake, China: Relationship with e utrophication [J]. European Journal of Protistology, 2005(41): 183-192.
[10] 地表水和污水監測技術規范:HJ/T 91-2002[S].
[11] 章宗涉, 黃祥飛.淡水浮游生物研究方法[M].北京: 科學出版社,1991.
[12] 沈韞芬.微型生物監測新技術[M].北京:中國建筑工業學出版社, 1990.
[13] 王家輯.中國淡水輪蟲志[M].北京:科學出版社,1961.
[14] 沈嘉瑞,戴愛云,張崇洲.中國動物志:淡水橈足類[M]. 北京:科學出版社,1979.
[15] 國家環境保護總局.水和廢水監測分析方法 (第四版) [M].北京: 中國環境科學出版社, 2002: 156-290.
[16] Saunders J F, Lewis W M. Zooplankton abundance in the Caura River , Venezuela[J]. Biotropica,1988,20(3):206-214.
[17] Maria-Heleni Z, Michaloudi E, Bobori D C, et al. Zooplankton abundance in the Aliakmon river, Greece[J]. Belgian Journal of Zoology, 2000, 130(1):29-33.
[18] Arimoro F O, Oganah A O. Zooplankton communtiy responses in a Perturbed Tropical Stream in the Niger Delta,Nigeria[J]. The Open Environmental &Biological Monitoring Journal, 2010(3): 1-11.
[19] 紀煥紅, 葉屬峰, 劉星, 等. 南麂列島海洋自然保護區浮游動物的物種組成及其多樣性[J]. 生物多樣性, 2006, 14 ( 3 ):206-215.
[20] 楊桂軍,秦伯強,高光,等.太湖不同湖區輪蟲群落結構季節變化的比較研究[J]. 環境科學, 2008, 29(10): 263-269.
[21] Akin-Oriola G A. Zooplankton associations and environmental factors in Ogunpa and Ona Rivers,Nigeria[J]. Revista de Biologia Tropical,2003, 51(2) : 391-398.
[22] Havel J E, Medley K A, Dickerson K D, et al. Effect of main-stemdams on zooplankton communities of the Missouri River ( USA) [J]. Hydrobiologia,2009(628):121-135.
[23] Viroux L. Seasonal and Iongitudinal aspects of microcrustaeean (Cladoeera, Copepoda) dynamics in a lowland river[J]. Journal of Plankton Research, 2002, 24(4): 281-292.
[24] Marques S C, Azeiteiro U M, Marques J C, et a1. Zooplanktonand ichthyoplankton communities in a temperate estuary: spatial and temporal patterns[J]. Journal of Plankton Research, 2006, 28 (3): 297-312.
[25] Fmneman P W. Seasonal changes in zooplankton biomass and grazing impact in the Temperate Estuary, South Africa[J]. Estuarine Coastal and Shelf Science ,2001,52(5): 543-553.
[26]Jeppesen E, Jensen J P, Sondergaard M, et a1. Trophic structure, species richness and biodiversity in Danish lakes: Changes along a phosphorus gradient[J]. Fresh water Biology, 2000(45): 201-218.
[27] 張世羊, 周巧紅, 成水平,等. 復合養殖系統中浮游動物種類豐度及其影響因素[J].中國環境科學,2009, 29(7):745-750.
[28] 王慶, 劉麗君, 楊宇峰. 南方某水庫輪蟲群落特征及其對環境因子的響應[J].生態學報, 2010, 30(13): 385-395.
[29] 肖佰財, 孫陸宇, 馮德祥, 等. 溫瑞塘河后生浮游動物群落結構及其與環境因子的關系[J]. 水生態學雜志, 2012, 33(4):15-20.
[30] Christine L W, Pan Y D. Diatom assemblages and their associations with environm ental variables in Oregon Coast Range streams USA[J]. Hydrobiologia,2006(561): 207-219.
Relationship between Zooplankton Community Structure and Environmental Factors in Springand Summer in Dianchi Lake
WANG Hua, LIU Li-ping , LI Ya-ping
(Kunming Environmental Monitoring Center, Kunming Yunnam 650228 ,China)
The relationship between zooplankton species composition and the environmental factors were studied in March and July 2013 in Dianchi Lake. A total of 31 zooplankton species were identified including 14 species of Rotifera (45.2%), 9 species of Cladocera (29%), 5 species of Protozoa (16.1%), and 3 species of Copepoda (9.7%) in 10 sampling sites. The density of zooplankton was 1130 ind/L and the dominant species was Keratellacochlearis in spring; the density was 1932 ind/L and the dominant species was Vorticell and Cyclops strennus in summer. The Pearson correlation analysis revealed that water temperature was significantly positively related to rotifers. Temperature was significant correlated to Rotifera. But chemical oxygen demand was negatively correlated to it in spring. Temperature, pH, and dissolved oxygen were significantly correlated to Rotifera. But nitrogen and phosphorus nutrition, and conductivity were negatively correlated to it in summer. The total phosphorus was negatively related to Cladocera in spring. Nitrogen and phosphorus nutrition and conductivity were significantly correlated to it. But pH, dissolved oxygen, and chlorophyll were negatively correlated to it in summer. Chemical oxygen demand was negatively related to Copepoda, Temperature, dissolved oxygen, chlorophyll, and conductivity were significantly correlated to it in summer. According to the canonical correspondence analysis (CCA), the composition and distribution of zooplankton were affected by dissolved oxygen, nitrogen and phosphorus nutrition, chlorophyll, conductivity. Transparency and chemical oxygen demand were also the main environmental factors in spring. Water temperature and pH were also the fundamental environmental factors in summer.
zooplankton;community structure;environmental factors;correlation analysis;Dianchi Lake
2016-08-15
國家水體污染控制與治理科技重大專項(2010ZX07102-006)。
王華(1985-),女,工程師,碩士,主要從事環境監測及環境數據統計工作。
X52
A
1673-9655(2016)06-0010-07

