葡萄糖對微波水熱合成正極材料LiFePO的結構和性能的影響
夏 傲,于婉茹,談國強
(陜西科技大學 材料科學與工程學院,西安 710021)
?
葡萄糖對微波水熱合成正極材料LiFePO的結構和性能的影響
夏 傲,于婉茹,談國強
(陜西科技大學 材料科學與工程學院,西安 710021)
以FeSO4·7H2O,LiOH·H2O和H3PO4為原料,葡萄糖為改性劑,采用微波水熱法合成具有正交晶系橄欖石結構的LiFePO4/C復合材料。借助XRD,SEM,EDS和電化學性能測試等分析,研究葡萄糖對產物組成、結構、微觀形貌和電化學性能的影響。結果表明:葡萄糖改性后,LiFePO4結構中Fe,P和O原子間的結合增強,顆粒尺寸減小,表面有碳層包覆,電化學性能提高。LiFePO4/C在0.1 C倍率下的首次放電比容量為125.6mAh/g;1.0 C倍率下的首次放電比容量為106.2mAh/g,30次循環后的容量保持率為91.3%。
磷酸鐵鋰;正極材料;微波水熱法;葡萄糖
具有橄欖石結構的鋰離子電池正極材料磷酸鐵鋰(LiFePO4)發現于1997年,被認為是最具發展前景的正極材料之一,有望用于電動汽車(EVs),混合電動汽車(HEVs)和電動自行車等領域。LiFePO4的特點是成本低、無污染、理論可逆容量高(170 mAh/g),循環穩定性和熱穩定性好。然而,LiFePO4在室溫下電子導電率和Li+擴散率低,制約了高倍率下的放電性能。目前主要通過減小顆粒尺寸[1-3]、摻雜金屬離子[4,5]和表面碳包覆等方法[6,7]對LiFePO4進行改性,以改善其電化學性能。目前制備LiFePO4的方法有高溫固相法[8,9]、溶膠-凝膠法[10,11]、水熱法[12,13]和微波水熱法[14]等。相比于其他方法,微波水熱法具有反應速率快、合成時間短、效率高、條件溫和,產物純度高、粒徑分布窄和形貌可控等優點。目前,采用微波水熱法直接一步合成LiFePO4的報道不多。孫瑩[14]采用微波水熱法合成出了LiFePO4準球形微晶,0.2 C倍率下的首次放電比容量可達100mAh/g,然而其在配制前驅液時需先將一定量的氮氣溶解于水中制成溶劑,然后再將其他原料依次溶解于該溶劑中,工序過程較為復雜。
本工作以FeSO4·7H2O,LiOH·H2O和H3PO4為原料,采用微波水熱法直接合成了LiFePO4粉體,并以葡萄糖為改性劑合成了碳包覆LiFePO4粉體,研究了葡萄糖對LiFePO4結構、微觀形貌和電化學性能的影響。
1 實驗
1.1 樣品制備
將LiOH·H2O,H3PO4,FeSO4·7H2O按3∶1∶1的摩爾比依次溶解于去離子水中并混合均勻,得到灰綠色的前驅體溶液,pH值約為9。將前驅液倒入微波水熱釜中,填充比為60%,于200℃反應1h。反應結束后洗滌并干燥樣品得到LiFePO4粉體。在前驅液中加入0.01mol/L的葡糖糖,經同樣條件的微波水熱反應合成了碳包覆LiFePO4粉體(標記為LiFePO4/C)。
1.2 電池組裝
按75∶15∶10的質量比分別稱取一定量的活性物質,導電劑炭黑和黏結劑聚偏氟乙烯(PVDF)。將以上3種物質溶于N甲基吡絡烷酮中制成漿料,再涂布于Al箔表面。將Al箔在80℃真空干燥24h后,裁剪成直徑1.4cm的扣式電池的正極圓片。以金屬鋰片為負極,1mol/L LiPF6/EC+DMC+EMC (體積比1∶1∶1) 溶液作電解液,Celgard 2320微孔聚丙烯膜為隔膜,在充滿氬氣的手套箱中組裝CR2025型扣式電池。
1.3 性能測試
利用D/max2200PC型X射線衍射儀進行物相分析,采用JSM-6390A型掃描電子顯微鏡觀察產物的微觀形貌,并進行EDS分析。采用CT2001A電池測試系統測試電池的充放電容量和循環壽命,測試溫度25℃,測試電壓范圍2.0~4.2V,充放電倍率1.0 C為170mAh/g。采用CHI660E型電化學工作站測試電池的循環伏安(CV)曲線和電化學阻抗(EIS)。
2 結果與討論
2.1 物相分析
圖1為LFP/C和LFP的XRD圖譜,兩種樣品的衍射峰與PDF卡片號 No.83-2092相對應,說明產物為正交晶系橄欖石結構的LiFePO4,屬空間群Pnma。LFP/C的XRD圖譜中沒有出現碳的衍射峰,說明樣品中的碳可能以非晶態形式存在。經對比發現,LFP/C的衍射峰相對于LFP稍向2θ角增大的方向偏移,這說明葡糖糖引入后對LiFePO4的晶格結構產生了影響。為了進一步研究葡萄糖對LiFePO4晶格結構的影響,采用FullProf軟件對LFP/C和LFP的XRD圖譜做了精修,結果如表1所示。從表1可以看出,相比于LFP,LFP/C的a值減小,b和c值略微增大,晶胞體積減小。文獻[15]表明,LiFePO4晶胞體積減小不利于Li+的擴散,從而對電化學性能造成不利影響。但是,樣品LFP/C晶胞結構中的P-O,Fe-O以及P-Fe的平均原子間距均比LFP的小。原子間距反映了原子間的結合強度,原子間距越小說明其結合力越大,結構越牢固,因此LFP/C具有比LFP更加牢固的[FePO4]-結構,這為Li+的脫嵌提供了更有力的保障。此外,LFP/C的Li—O平均原子間距均比LFP的大,意味著LFP/C晶格中的Li—O結合鍵較弱,Li+脫出時需克服的勢壘變小,Li+脫嵌更容易。從原子間結合力變化的角度來看,葡萄糖的引入可能會提高LiFePO4的電化學性能。
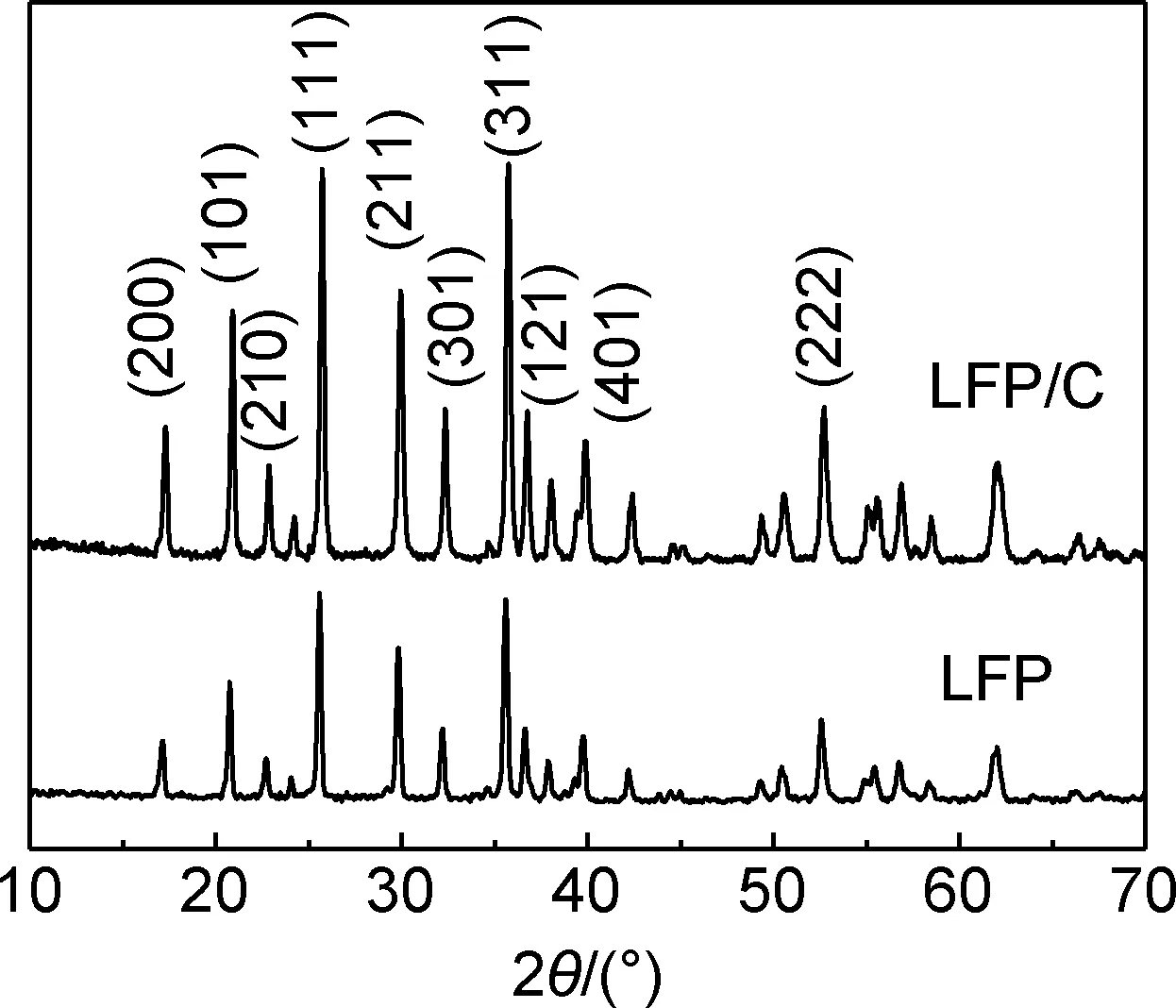
圖1 LFP/C和LFP的XRD圖譜Fig.1 XRD patterns of LFP/C and LFP samples

Samplea/nmb/nmc/nmV/nm3Rwp/%P-Oaverage/nmFe-Oaverage/nmLi-Oaverage/nmFe-P/nmLFP1.03520.59920.47020.291713.670.16232.1160.20760.2830LFP/C1.03440.59940.47030.291613.210.15992.1080.21170.2826
2.2 微觀形貌分析
圖2為樣品LFP和LFP/C的SEM和TEM照片。從SEM照片中可以看出,兩種樣品的顆粒形貌相似,呈菱形塊狀;但是LFP/C(圖2(b-1))的平均顆粒尺寸比LFP(圖2(a-1))小。此外,LFP/C顆粒表面明顯有一層顏色較淺的包覆物,該物質可能是葡萄糖熱解生成的碳。由圖2(a-2)還可以看出,LFP顆粒的最外層包覆一層厚約10nm的非晶態物質。圖2(b-2)表明LFP/C顆粒外層也包覆有非晶態物質,該非晶態層的厚度約為20nm。

圖2 LFP (a)和LFP/C (b)的SEM (1)和TEM (2)照片Fig.2 SEM (1) and TEM (2) images of LFP (a) and LFP/C (b) samples
為了研究非晶態層的組成并對比兩種樣品的外層成分,分別對LFP和LFP/C顆粒的邊緣區域作EDS分析,結果如圖3所示。樣品LFP的EDS結果表明顆粒邊緣處有元素Fe,P和O存在(Li元素原子量小,無法用EDS測得),此外還有極其微量的碳元素存在。本研究在制備LFP的過程中,沒有采用可能引入碳的原料或添加劑,理論上講產物中不可能有碳存在,EDS所測得的微量碳可能與測試條件或樣品被污染有關。因此,LFP顆粒外層的非晶層是由Fe,P和O元素構成的非晶態。而樣品LFP/C中除了含有元素Fe,P和O外,還有一定量的碳元素存在,且C的含量較LFP樣品明顯增多。結合制備工藝可知,LFP/C顆粒邊緣處含有的碳由原料中的葡萄糖在高溫高壓下發生裂解轉變而成。因此,LFP/C顆粒外層的非晶態層是C,O,P和Fe元素共同組成的非晶相。葡萄糖的引入雖然沒有明顯影響LiFePO4的形貌,但使得LiFePO4的顆粒尺寸減小,改變了顆粒外層的元素組成和厚度。LiFePO4顆粒尺寸的減小便于充放電過程中Li+的脫離或嵌入;顆粒減小還意味著粉體的比表面積增大,使得活性材料與電解液接觸更充分,從而降低電極與電解液間的接觸電阻[16]。此外,碳的存在有助于提高LiFePO4的電子電導率,從而有利于改善電化學性能。
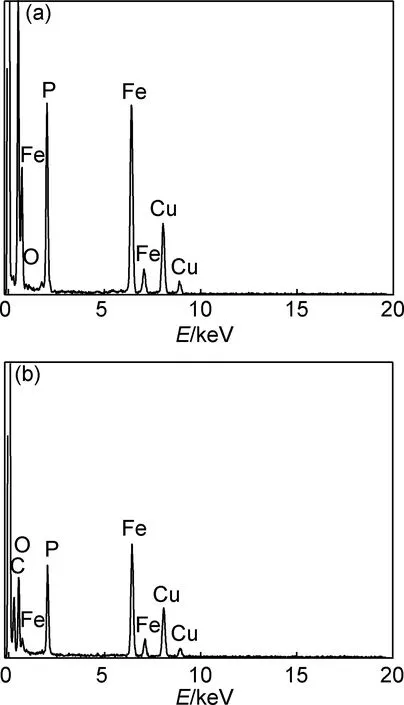
圖3 LFP (a)和LFP/C (b )的EDS譜圖Fig.3 EDS spectra of LFP (a) and LFP/C (b) samples
2.3 電化學性能
圖4為2.0~4.2V電壓區間、0.05mV/s掃描速率時LFP/C和LFP的CV曲線。可以看出,LFP/C和LFP的CV曲線形狀相似,充電過程中位于3.50V附近的氧化峰對應于Li+的脫出,放電過程中位于3.37V附近的還原峰對應于Li+的嵌入。除了這兩個峰外沒有其他峰出現,說明材料中沒有雜質,充放電過程也沒有其他的相轉變發生。但是,LFP/C比LFP的CV曲線更加對稱,電流峰更強、更尖銳,二者的氧化峰和還原峰之間的電位差分別是0.123V和0.163V。在循環伏安曲線中,氧化峰和還原峰的峰間距越大,表明極化越大,電極反應的可逆性越差。因此,LFP/C比LFP具有更好的可逆性。CV曲線測試結果預示著LFP/C比LFP具有更好的充放電性能。
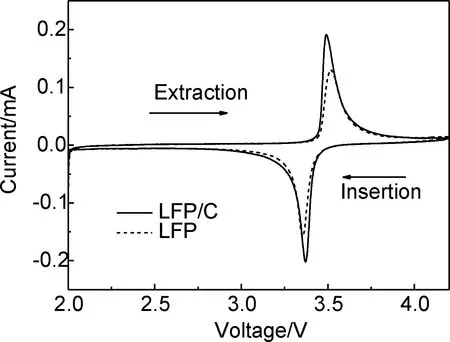
圖4 掃描速率為0.05mV/s時LFP/C和LFP的CV曲線Fig.4 CV curves of LFP/C and LFP at a scan rate of 0.05mV/s
圖5為LFP/C和LFP分別在0.1C和1.0C倍率的首次充放電曲線。0.1C倍率時,LFP和LFP/C均具有比較平穩的充放電平臺,二者的首次放電比容量分別為88.3,125.6mAh/g,庫倫效率分別為93.2%和97.3%,LFP/C的首次放電比容量和庫倫效率明顯高于LFP。充放電倍率增加到1.0C時,二者的首次放電比容量均降低,分別為60.7,106.2mAh/g,庫倫效率分別為89.2%和86.1%。盡管LFP/C的庫倫效率略低于LFP,但其放電比容量卻遠大于后者。葡萄糖的引入使得LiFePO4顆粒周圍形成完全的碳包覆層,LiFePO4顆粒之間的電接觸增強,改善了材料的電子電導率,因而放電比容量增加。從圖5中還可以看出,0.1C倍率時,LFP和LFP/C的充、放電電壓平臺對應的電壓相差很小,僅約為0.089V,說明此時兩種樣品的極化小。倍率增大至1C時,LFP和LFP/C的充、放電電壓平臺對應的電壓差均明顯增大,分別為1.034V和0.439V,前者遠大于后者,說明倍率增大后LFP的極化比LFP/C變得嚴重得多,這與前面的CV測試結果一致。LFP/C在高倍率下的極化較低同樣與其電子電導率較大有關。
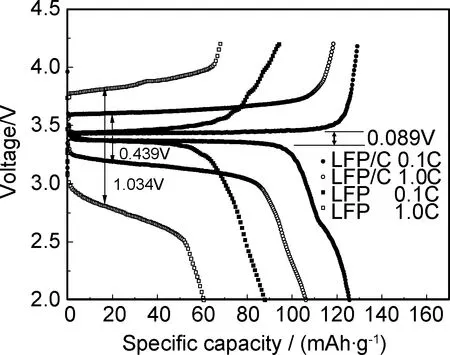
圖5 LFP/C和LFP在不同倍率的首次充放電曲線Fig.5 Initial charge-discharge curves of LFP/C and LFP samples at different rates
圖6為LFP/C和LFP分別在0.1C和1.0C倍率的循環性能曲線。0.1C倍率時,LFP和LFP/C分別經20次和30次循環后的放電比容量為82.8,119.8mAh/g,容量保持率分別為94%和95%。倍率增大為1.0C時,LFP和LFP/C分別經20次和30次循環后的放電比容量為44.5mAh/g和97.0mAh/g,容量保持率分別為73%和91%。由此可見,充放電倍率增大,LFP的循環穩定性降低很快,而LFP/C的循環穩定性仍然較好。
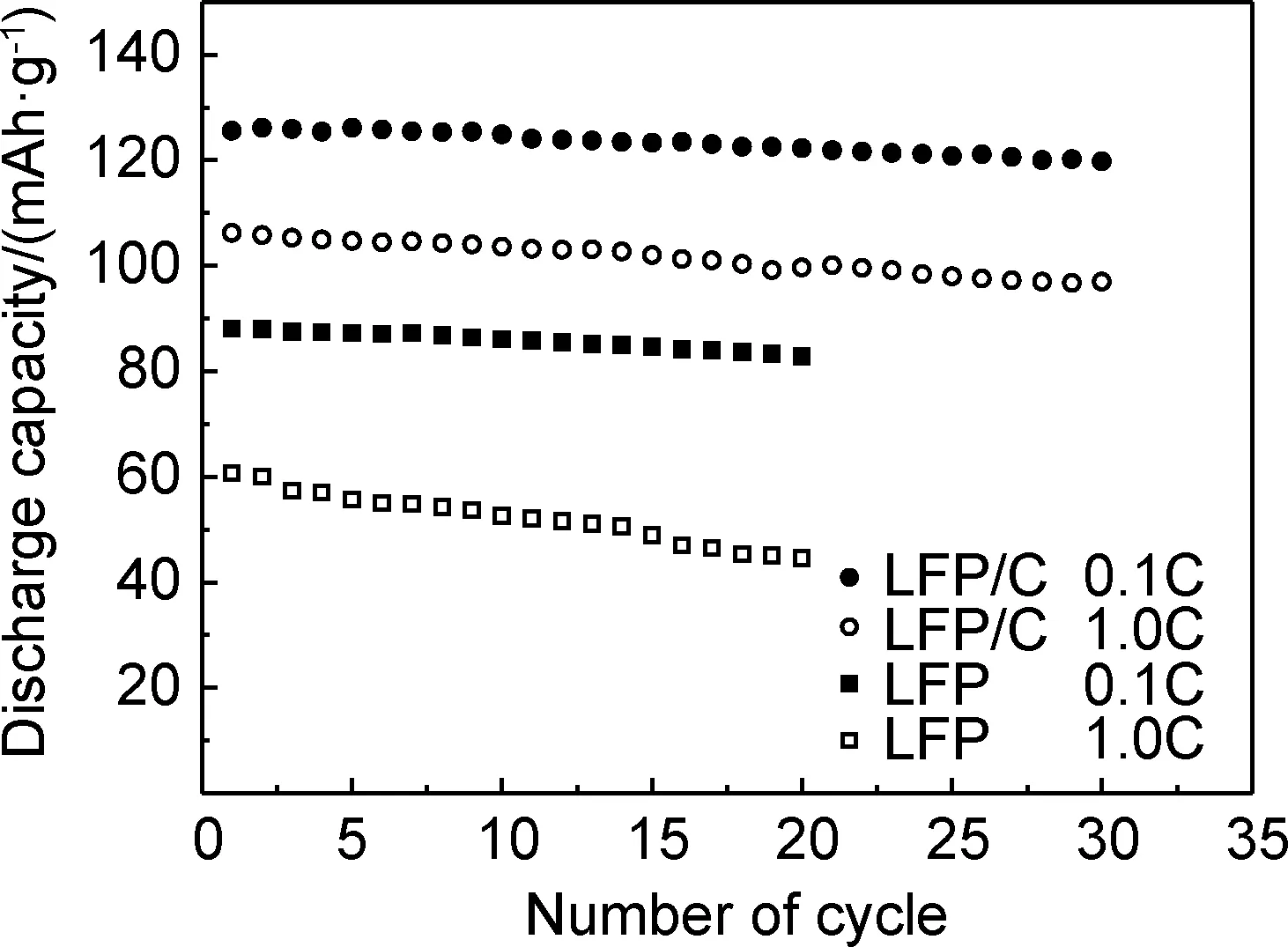
圖6 LFP/C和LFP在不同倍率下的循環性能曲線Fig.6 Cycling performances curves of LFP/C and LFP samples at different rates
2.4 電化學阻抗分析
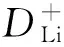
(1)
式中:R為氣體常數;T為絕對溫度;A為電極面積;n為電極反應過程中每摩爾活性材料中參與反應的電子數;F為法拉第常數;C0為電極中鋰離子的濃度;σ為Zre-w-1/2關系圖中低頻部分直線的斜率。
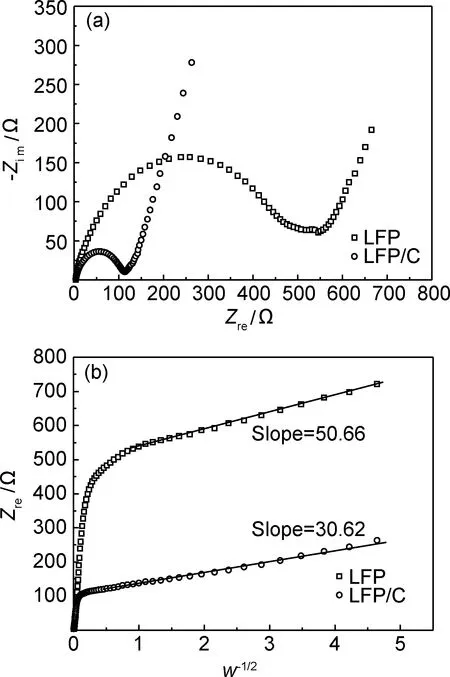
圖7 LFP/C和LFP的Nyquist圖譜(a)和Zre與w-1/2的關系圖(b)Fig.7 Nyquist plots of LFP/C and LFP (a) and the relationship between Zre and w-1/2 (b)
綜合以上分析,本研究認為微波水熱合成LiFePO4的反應中引入葡萄糖使得產物電化學性能改善的原因歸于以下3個方面:首先,葡萄糖引入后,所得產物LFP/C的結構中P,Fe和O原子間的結合加強,且Li原子與O原子的結合變弱,這意味著鋰離子的脫嵌過程中晶體結構更穩定、不易變形,更便于鋰離子脫嵌。其次,產物顆粒尺寸減小,因此鋰離子在LiFePO4顆粒內部擴散路徑變短,脫嵌更容易進行;此外顆粒尺寸減小,比表面積相應增大,活性材料與電解液接觸更充分,使得電極與電解液間的接觸電阻降低,從而減小電荷轉移阻抗。再者,葡萄糖熱解后生成的碳包覆在LiFePO4顆粒表面,使得材料的電子電導率提高,從而減小了高倍率充放電過程中電極極化。以上綜合原因使得葡萄糖改性后的LiFePO4具有更高的充放電比容量和更好的循環穩定性。
3 結論
(1)以葡萄糖為改性劑,采用微波水熱法合成出了橄欖石結構的碳包覆LiFePO4復合材料,工藝簡單,合成時間短。
(2)與純相LiFePO4相比,碳包覆LiFePO4結構中P,Fe和O原子間的結合加強,Li-O結合鍵變弱,顆粒尺寸變小,電化學性能提高。碳包覆LiFePO4在1.0C倍率下的首次放電比容量為106.2mAh/g,30次循環后的放電比容量為97.0mAh/g,容量保持率為91%。
(3)葡萄糖的引入使得LiFePO4的電化學性能提高的原因主要歸于材料結構穩定性加強、電導性以及鋰離子擴散速率的增大。
[1] LIU H, TANG D. The low cost synthesis of nanoparticles LiFePO4/C composite for lithium rechargeable batteries [J]. Solid State Ionics, 2008, 179(7):1897-1901.
[2] LIM S, YOON C S, CHO J. Synthesis of nanowire and hollow LiFePO4cathodes for high-performance lithium batteries [J]. Chemistry of Materials, 2008, 20 (14):4560-4564.
[3] 從長杰, 張向軍, 盧世剛, 等. 納米磷酸鐵鋰的制備及其電化學性能研究[J]. 無機化學學報, 2011, 27 (7):1319-1323.
CONG C J, ZHANG X J, LU S G, et al. Preparation and electrochemical properties of nano-sized LiFePO4/C [J]. Chinese Journal of Inorganic Chemistry, 2011, 27(7):1319-1323.
[4] WU S H, CHEN M S, CHEN C J, et al. Preparation and characterization of Ti4+doped LiFePO4cathode materials for lithium-ion batteries [J]. Journal of Power Sources, 2009, 189(8):440-444.
[5] 王震坡, 劉文, 王悅, 等. Mg、Ti離子復合摻雜改性磷酸鐵鋰正極材料及其電池性能[J]. 物理化學學報, 2012, 28 (9):2084-2090.
WANG Z P, LIU W, WANG Y, et al. Synthesis and characterization of Mg and Ti ions Co-doped lithium iron phosphate and its lithium-ion batteries [J]. Acta Physico-Chimica Sinica, 2012, 28 (9):2084-2090.
[6] 王偉, 趙領, 張崢, 等. 混合鐵源制備碳包覆磷酸鐵鋰 [J]. 電池, 2014, 44 (1):24-27.
WANG W, ZHAO L, ZHANG Z, et al. Preparing carbon coated lithium ferrous phosphate using mixed iron sources [J]. Battery Bimonthly, 2014, 44 (1):24-27.
[7] LIU H, XIE J, WANG K. Synthesis and characterization of LiFePO4/(C+Fe2P) composite cathodes [J]. Solid State Ionics, 2008, 179(8):1768-1771.
[8] KONAROVA M, TANIGUCHI I. Preparation of LiFePO4/C composite powders by ultrasonic spray pyrolysis followed by heat treatment and their electrochemical properties [J]. Materials Research Bulletin, 2008, 43 (12):3305-3317.
[9] YANG M R, TENG T H, WU S H. LiFePO4/carbon cathode materials prepared by ultrasonic spray pyrolysis [J]. Journal of Power Sources, 2006, 159 (1):307-311.
[10] LEE S B, CHO S H, CHO S J, et al. Synthesis of LiFePO4material with improved cycling performance under harsh conditions [J]. Electrochemistry Communications, 2008, 10 (9):1219-1221.
[11] CHOI D, KUMTA P N. Surfactant based sol-gel approach to nanostructured LiFePO4for high rate Li-ion batteries [J]. Journal of Power Sources, 2007, 163(4):1064-1069.
[12] TAJIMI S, IKEDA Y, UEMATSU K, et al. Enhanced electrochemical performance of LiFePO4prepared by hydrothermal reaction [J]. Solid State Ionics, 2004, 175 (1-4):287-290.
[13] WANG Z L, SU S R, YU C Y, et al. Synthesises, characterizations and electrochemical properties of spherical-like LiFePO4by hydrothermal method [J]. Journal of Power Sources, 2008, 184 (2):633-636.
[14] 孫瑩. 微波水熱法制備LiFePO4電池陰極材料的研究[D].西安:陜西科技大學,2012.
SUN Y. Preparation of LiFePO4cathode materials by microwave hydrothermal method[D]. Xi’an: Shaanxi University of Science and Technology, 2012.
[15] GAO H Y, JIAO L F, PENG W X, et al. Enhanced electrochemical performance of LiFePO4/C via Mo-doping at Fe site [J]. Electrochimica Acta, 2011, 56(7):9961-9967.
[16] LIU Y Y, CAO C B. Enhanced electrochemical performance of nano-sized LiFePO4/C synthesized by an ultrasonic-assisted co-precipitation method [J]. Electrochimica Acta, 2010, 55(16):4694-4699.
Effect of Glucose on Structure and Properties of LiFePO Cathode Material Prepared by Microwave Hydrothermal Method
XIA Ao,YU Wan-ru,TAN Guo-qiang
(School of Materials Science and Engineering,Shaanxi University of Science and Technology,Xi’an 710021,China)
Orthorhombic LiFePO4/C composite material with olivine structure was prepared by microwave hydrothermal method using FeSO4·7H2O, LiOH·H2O and H3PO4as raw materials, with glucose as carbon source and modifier. The influence of glucose on the composition, structure, morphology and electrochemical performance of LiFePO4was investigated by means of XRD, SEM, EDS and constant current charge-discharge cycling. The results show that the as-obtained LiFePO4/C exhibits stronger bonding among Fe, P and O atoms, finer particle size and improved electrochemical properties than the pristine LiFePO4. From the SEM image, the LiFePO4is coated by carbon in the LiFePO4/C composite. The LiFePO4/C shows the initial discharge capacity of 125.6mAh/g at 0.1C. Even at a rate of 1.0C, it still can deliver a discharge capacity of 106.2mAh/g, the capacity retention is 91.3% after 30 cycles.
lithium iron phosphate; cathode material; microwave hydrothermal method; glucose
10.11868/j.issn.1001-4381.2016.10.010
TB333
A
1001-4381(2016)10-0068-06
陜西科技大學博士科研啟動基金(BJ15-04);陜西科技大學學術骨干培育項目(XSG(4)005)
2015-10-13;
2016-07-03
夏傲(1981-),女,副教授,博士,研究方向:鋰離子電池電極材料和鐵電薄膜材料,聯系地址:西安市未央區陜西科技大學材料學院(710021),E-mail: xiaao@sust.edu.cn

