基本化學反應形式的系統分類
黃華奇 陳福盛 黃榮彬,*
(1廈門大學化學化工學院,福建廈門361005;2龍海第五中學,福建漳州363000)
·師生筆談·
基本化學反應形式的系統分類
黃華奇1陳福盛2黃榮彬1,*
(1廈門大學化學化工學院,福建廈門361005;2龍海第五中學,福建漳州363000)
現行教材的化學反應分類以繁多的化學反應事實為對象,缺乏系統性。本文以基本化學反應形式為對象對反應進行系統分類,并且用多置換反應取代現行中文教材所稱的復分解反應,而把復分解反應一詞用于指稱新增的一類基本反應形式,即復雜分解反應。對基本化學反應形式進行系統分類有助于發現新的反應。
化學反應;系統分類;多置換反應;復雜分解反應
www.dxhx.pku.edu.cn
1 引言
化學是在分子層次上研究物質的組成、性質、結構與變化規律的科學;在分子層次進行的物質變化涉及化學反應。認識化學反應是化學教育的基本內容。分子由原子組成,原子不滅、質量守恒。化學反應是反應物分子中原子的結合與分離、反應物成分交換的過程,這個過程還涉及有無伴隨電子轉移等特征。所有的化學反應構成化學反應概念的外延,根據化學反應的特征進行系統分類,是明確化學反應概念的重要思維方法。
長期以來,國內化學教學方面對化學反應的介紹,先是初中階段介紹了化合反應、分解反應、置換反應和復分解反應,然后到高中階段,增加了氧化還原反應。然而,氧化還原反應不能與上述4種反應并列。
現行化學教材對化學反應的分類,以繁雜的化學反應事實(內容)為對象,缺乏系統性。例如,沒有對化合反應進一步細分;用復分解反應指稱double replacement reaction(雙置換反應);認為雙置換反應都是非氧化還原反應,忽略了氧化還原的雙置換反應;缺了由多種反應物參與的一類復雜分解反應。本文根據概念劃分的原則,對基本化學反應形式進行系統的分類,用“二分法”把所有反應劃分為氧化還原反應和非氧化還原反應,再把化合反應、分解反應、置換反應進行二分,增設多置換反應一詞,不僅僅限于雙置換反應,把復雜分解反應一詞用于指稱新增的一類基本反應形式。正確的、合乎規則的系統分類有助于全面認識化學反應,防止出現盲點又有助于找出空白點,有利于明晰概念;概念明晰則有利于發現新的反應,促進創新。
2 現行化學教材化學反應的分類及其不足
目前國內通行的基礎化學教材[1,2]以化學反應事實為對象進行分類,把化學反應分為:
①化合反應:兩種或兩種以上的物質生成另一種物質的反應。
A+B+…=C
②分解反應:一種物質生成兩種或兩種以上其他物質的反應。
A=B+C+…
③置換反應:一種單質跟一種化合物反應生成另一種單質和另一種化合物的反應。
A+BC=AC+B
④復分解反應:兩種化合物相互交換成分,生成另外兩種化合物的反應。
AB+CD=AD+CB
復分解反應前后各元素和原子團的化合價都保持不變。
⑤氧化還原反應。
這樣的分類存在一些不足。
首先,前兩個定義使用了“物質”一詞,而后兩個定義使用的是“單質”和“化合物”,這就易于造成混淆。雖然這里的物質容易理解為化學物質,但化學物質除了純凈物還有混合物。單質和化合物是純凈物的全部,化學反應應該明確是在純凈物之間進行,也就是,單質與單質,單質與化合物,化合物與化合物之間進行。
其次,前兩個定義沒有對反應物和生成物進行必要的特征限制,例如,對化合反應的特征應該限定從小到大,或者從簡單到復雜;對分解反應應該限定從大到小,或者從復雜到簡單。
再次,這里定義的分解反應,實際上只是簡單的分解反應,沒有考慮到復雜的分解反應,即多個反應物之間發生的分解反應。在此情形下,多個反應物參與是發生分解反應的必要條件,如果沒有多個反應物參與,那么這個分解反應不會發生,所以這是一類反應,屬于分解反應。而化合反應也可以存在生成多個生成物的復雜化合反應情形。
最后,關于置換反應,顧名思義,就是反應物之間交換成分的反應,這里的成分指的是單質原子,或者構成反應物和產物的原子團、離子等。這里定義的置換反應僅限定在單質和化合物之間進行,是不夠全面的,只概括了單置換反應。實際上,置換反應可以發生在兩種或多種化合物之間的多成分交換,是為多置換反應。可是,這類反應被不恰當地用復分解反應來指稱,復分解反應是分解反應,不是置換反應。如果把雙置換反應稱為復分解反應,而由于其中也存在化合反應,是不是也可以稱為復化合反應?現有分類也忽略了氧化還原的多置換反應。
需要特別指出的是,氧化還原反應與前4類反應并不是并列關系,而是包含或包含于的關系,氧化還原反應和非氧化還原反應都包含這4類反應,或者這4類反應都可以相應地分為氧化還原的和非氧化還原的反應,把“復分解反應”限定于非氧化還原反應缺乏理論支撐,會形成全面認識的盲點。
國外的基礎化學教材[3-5]也沒有對化學反應進行系統的分類。有的教材[4]把化學反應分為5類,即:燃燒反應、化合反應、分解反應、單置換反應和雙置換反應。雖然用雙置換反應取代了復分解反應,但是單置換反應和雙置換反應不是矛盾關系,不能包括所有的置換反應。把燃燒反應獨立出來與化合反應并列并不恰當,因為有的燃燒反應是化合反應,它們不是相異關系不能并列,教材也沒有處理氧化還原反應與這些反應的關系,缺乏系統性。國外教材不再延用“double decomposition reaction”(譯為“復分解反應”),而用“double replacement reaction”即雙置換反應,“metathesis reaction”則指稱非氧化還原的雙置換反應[3]。
3 化學反應形式的分類
3.1分類的原則
化學以分子為研究層次,分子由原子組成。化學變化過程原子不滅、質量守恒。化學反應是相關反應物分子中原子的結合與分離以及成分交換的變化過程,而且,化學反應還有電子轉移(元素原子化合價或氧化數變化)和沒有電子轉移(元素原子化合價或氧化數不變)之分,這是化學反應的基本屬性。根據這些屬性,我們對化學反應形式進行系統的分類。首先以反應是否伴隨電子轉移為特征用“二分法”把所有化學反應劃分為氧化還原反應和非氧化還原反應。而后,把所有以原子之間的結合為主由小變大或由簡單變復雜的反應劃分為化合反應并進一步細分為簡單和復雜;以原子之間的分離為主由大變小或由復雜變簡單的劃分為分解反應并進一步細分為簡單和復雜;以成分交換為特征的劃分為置換反應并進一步細分為單置換和多置換。還可以根據其他特征繼續進行劃分。所有的化學反應都可以分解為基本化學反應的組合。
概念外延的劃分是明確概念外延的思維方法。化學反應的分類屬于概念外延的劃分。進行劃分需要遵守邏輯學關于劃分的規則[6],這些規則是:
①各子項外延之和必須等于母項的外延。
②每次劃分必須使用同一劃分標準。
③每次劃分各子項外延應互不相容。
④劃分應該逐級進行。
化學反應劃分以后形成的基本化學反應類型要互為并列關系(相異關系),例如,分解反應不是化合反應,復分解反應是分解反應(子類的成員是大類的成員,這是公理),不是置換反應。
3.2基本化學反應形式的系統分類和示例
這里所說的化學反應形式指以單質或化合物為參與單位且以其書寫的化學反應方程式所表達的反應形式,化學事實上相同但書寫不同的反應方程式可以被歸入不同的反應形式,例如:
NaHCO3+HCl=NaCl+CO2+H2O
是一種反應形式,如果寫成如下形式:
NaHCO3+HCl=NaCl+H2CO3
則可以被歸入不同的反應形式。
而基本化學反應形式指所書寫的反應方程式不包含其他的反應方程式,也就是說,它不可以被分解為兩個或兩個以上其他反應式的相加。
本文以基本化學反應形式為對象,以反應物和生成物的形式特征為標準進行系統分類,遵守化學理論規則,例如認為H2CO3分子式符合化學規則,是一種化合物,不斷定它不存在。努力把繁多的實驗事實納入系統分類體系。根據系統分類,理論上可以預測一些新反應的例子,促進新發現,化學教學要克服“舉不出例子的就是不存在的”思維模式。
①化合反應:兩種或兩種以上單質或化合物生成一種或多種復雜化合物的反應。可分為簡單化合反應和復雜化合反應。
(a)簡單化合反應:兩種或兩種以上單質或化合物生成一種復雜化合物的反應。反應形式表示如下:
A+B+…=C
這里的反應物A和B是小的或者簡單的純凈物,生成物C是大的或者復雜的化合物。化合反應的基本特征是從小變大、從簡單變復雜。例如:
H2+Cl2=2HCl
雖然上例的反應物和生成物都是雙原子分子,但是單質是小的、簡單的,化合物是復雜的,符合由簡單變復雜的特征,歸為化合反應,但只生成一種復雜的化合物,是簡單化合反應。
(b)復雜化合反應:兩種或兩種以上單質或化合物生成一種或以上復雜化合物的反應。用反應形式表示如下:
A+B+…=C+D+…
這里的反應物A和B至少有一種是小的或者簡單的純凈物,生成物中至少有一種是大的或者復雜的化合物。化合反應的基本特征是從小變大、從簡單變復雜。例如:
CH4+2O2=CO2+2H2O
反應物和生成物在大小和復雜差異程度不顯著的情況下,以有單質反應物作為判斷化合反應的標準。化合反應也有氧化還原的和非氧化還原的反應之分。
②分解反應:由大的或復雜的化合物生成小的或簡單的純凈物的反應。按照參與分解反應的反應物種數量劃分為簡單分解反應和復雜分解反應。
(a)簡單分解反應:由一種大的或復雜的化合物生成小的或者簡單的純凈物的反應,用反應形式表示如下:
A=B+C+…
這里的A代表大的或者復雜的化合物,B和C代表小的或簡單的純凈物,之所以說是純凈物,是因為產物可能是單質,也可能是化合物。例如:
CaCO3=CaO+CO2
2KClO3=2KCl+3O2
前者屬于非氧化還原反應,后者屬于氧化還原反應。
(b)復雜分解反應:即多種化合物之間發生的分解反應。在此情形下,多個化合物參與是發生分解反應的必要條件,所以,它是一類反應。用反應形式表示如下:
A+B+…=C+D+…
這里的A和B代表大的或者復雜的化合物,C和D代表小的或簡單的純凈物。例如:
NaHCO3+HCl=NaCl+CO2+H2O
2KMnO4+3H2C2O4=2MnO2+K2CO3+3H2O+5CO2
前者是非氧化還原的復雜分解反應例子,后者是氧化還原的復雜分解反應。如果這類反應中有一個是大的或者復雜的生成物,顯示出化合的特征,則以化合為劃分標準,把它歸為復雜化合反應。
前面提到的燃燒反應[5]是一個比較籠統的說法,是有單質氧參與的伴隨發光發熱的劇烈氧化反應,在大類上屬于氧化還原反應。但是,有氧參與的氧化反應還有不伴隨發光發熱的、緩和的非燃燒反應。即使是燃燒反應還有燃燒物是小的、簡單的物種參與的化合反應,也有燃燒物是大的、復雜的物種參與的分解反應。化學反應的系統劃分能夠清晰全面地認識化學反應。本文不可能對所有的化學反應進行完整的分類闡述,只是介紹系統劃分的方法和規則。
③置換反應:反應物之間通過交換成分生成產物的化學反應。置換反應的特征是交換成分,這里的成分是原子、原子團、離子,下文的英語字母有的用于表示成分。根據交換成分的數目,可將置換反應劃分為單置換反應和多置換反應。
(a)單置換反應:一種單質與一種化合物反應生成另一種單質和另一種化合物的反應,用反應形式表示如下:
A+B-C=A-C+B
金屬與金屬鹽的反應,金屬與酸的反應,金屬與堿的反應等是其典型例子。所有單置換反應涉及單質變成化合物,一定有電子轉移發生,都是氧化還原反應。例如:
Zn+2HCl=ZnCl2+H2
但是,也存在單質參與反應但不發生電子轉移的單置換反應,屬于非氧化還原反應,例如:
5Ni+4Fe(CO)5=5Ni(CO)4+4Fe
(b)多置換反應:多種化合物相互交換成分,生成另外多種化合物的反應,用反應形式表示如下:
A-B+C-D+…=A-D+C-B+…
盡管反應式包含有反應物的分解,但也包含有化合反應,化合和分解不是它的主要特征,它的主要特征是交換成分,屬于置換反應,不宜用復分解反應來指稱。多置換反應前后各元素的化合價并不要求保持不變,可以是氧化還原反應,也可以不是,這與現行教材的闡述不同。例如:
NaHCO3+HCl=NaCl+H2CO3
AgCl+HBr=AgBr+HCl
2FeCl3+SnCl2=2FeCl2+SnCl4
前兩者是非氧化還原的多置換反應,后者是氧化還原的多置換反應。
以上所列基本化學反應形式的系統分類可用圖1表示,它符合劃分的規則。這個系統劃分也可以用歐拉圖[6](圖2)來表示。
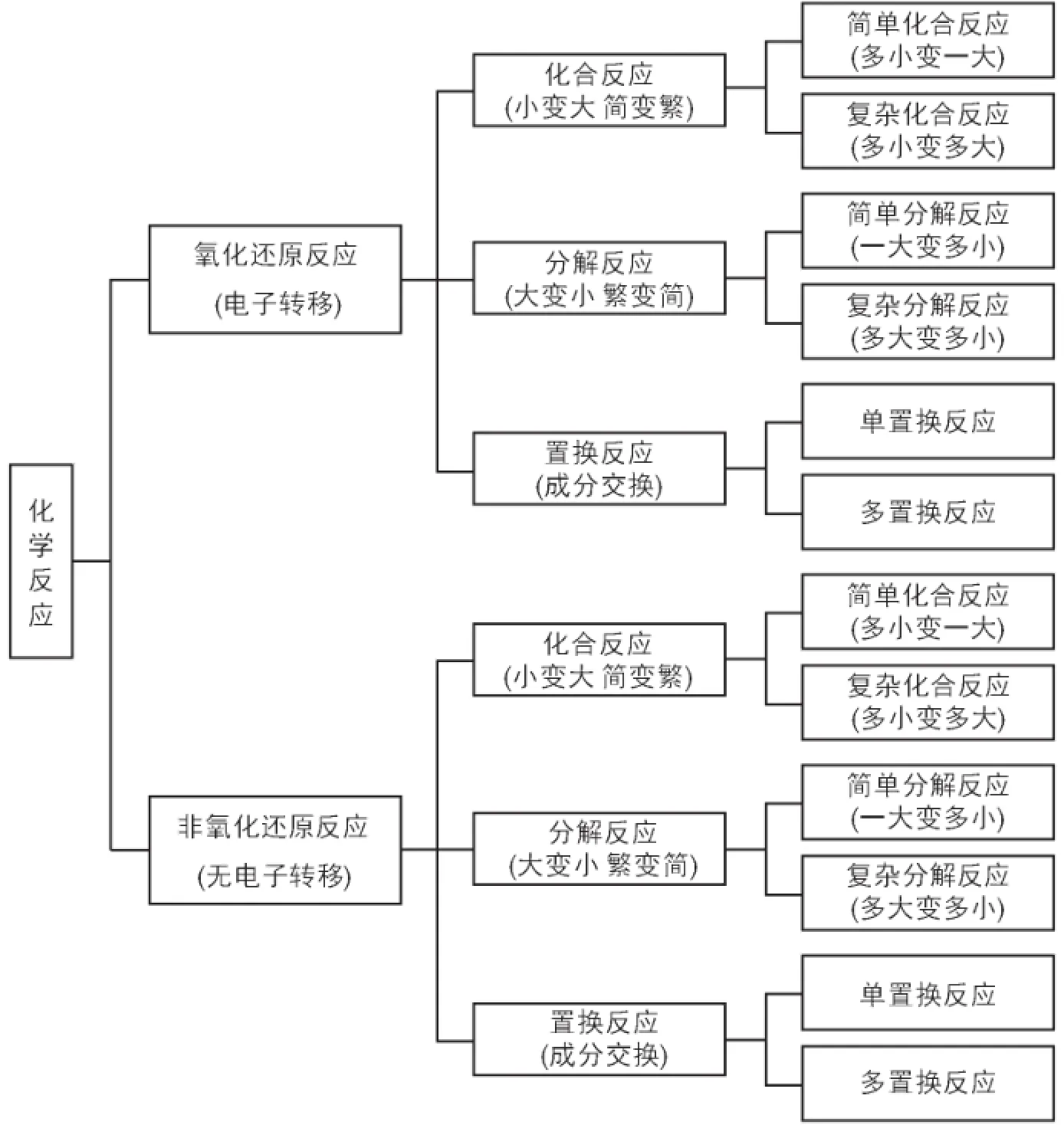
圖1 基本化學反應形式分類樹狀圖
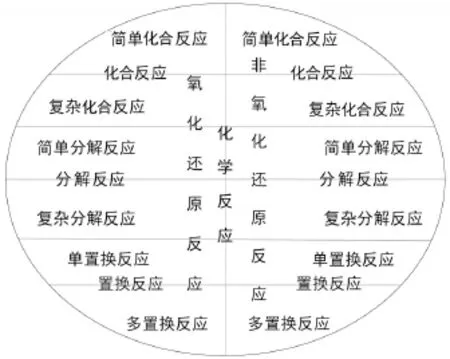
圖2 基本化學反應形式分類歐拉圖
邏輯學用歐拉圖表示概念的外延。圖2中用一個圓圈表示所有的基本化學反應形式,圈外的面積表示非基本化學反應形式(不是基本化學反應形式的事物)。以有無電子轉移為特征,把所有的化學反應形式用“二分法”劃分為氧化還原反應和非氧化還原反應。它們又可以各自劃分為化合反應、分解反應和置換反應,還可繼續進行多級劃分,每級劃分以一個標準為主。本文進行的基本化學反應形式分類還可繼續進行下去。用歐拉圖表示劃分能做到符合劃分規則。
4 結語
本文從思維規則出發,指出了現行化學教材對化學反應的分類缺乏系統性,應用概念外延劃分的方法和規則,初步嘗試了一個基本化學反應形式的系統分類,并用樹狀分類圖和歐拉圖來表示。化學反應形式的系統劃分能防止形成盲點又有助于找出空白之處,能促進新發現。劃分是明確概念的方法之一,概念明確就是對事物本質特征的正確認識,而明確的概念是有效推理的基礎,對促進創新有重要意義。
[1]王晶,鄭長龍.義務教育教科書——化學(上冊).北京:人民教育出版社,2012:35-39.
[2]王晶,鄭長龍.義務教育教科書——化學(下冊).北京:人民教育出版社,2012:11-75.
[3]Bodner,G.M.;Pardue,H.L.Chemistry,an Experimental Science,2nd ed.;John Wiley&Sons,Inc.:New York,1995;pp 312-313.
[4]Brown,T.L.;LeMay,H.E.;Bursten,B.E.Chemistry the Central Science,10th ed.;北京:機械工業出版社,2009:128-129.
[5]Burns,R.A.Fundamentals of Chemistry,4th ed.;北京:Higher Education Press,2004:286-300.
[6]華東師范大學哲學系邏輯學教研室.形式邏輯.上海:華東師范大學出版社,2009:39-43.
A Systematic Classification of Basic Chemical Reactions
HUANG Hua-Qi1CHEN Fu-Sheng2HUANG Rong-Bin1,*
(1College of Chemistry and Chemical Engineering,Xiamen University,Xiamen 361005,Fujian Province,P.R.China;2Longhai Fifth Middle School,Zhangzhou 363000,Fujian Province,P.R.China)
The old classification of basic chemical reactions was evaluated and a new systematic classification of basic reactions was proposed.In the new classification,all the chemical reactions were divided into oxidation-reduction reactions and non-oxidation-reduction reactions,and both can be divided into combination reaction,decomposition reaction and replacement reaction,respectively.In addition,a new class of basic reactions,the complicated decomposition reaction,was appended to reaction system.
Chemical reaction;Classification;Multi-replacement reaction;Complicated decomposition reaction
G64;O61
10.3866/PKU.DXHX201512021
,Email:rbhuang@xmu.edu.cn

