第48屆國際化學奧林匹克試題(續)
江萬權 朱平平 王穎霞 裴 堅,*
(1中國科學技術大學化學與材料科學學院,合肥230026;2北京大學化學與分子工程學院,北京100871)
·競賽園地·
第48屆國際化學奧林匹克試題(續)
江萬權1朱平平1王穎霞2裴堅2,*
(1中國科學技術大學化學與材料科學學院,合肥230026;2北京大學化學與分子工程學院,北京100871)
www.dxhx.pku.edu.cn
第4題 總分的8%
動力學研究在水處理中的應用
工業廢物是導致水污染的主要原因,實驗室開展的動力學研究為廢液處理提供支持。作為工業用溶劑和副產物的1,4-二氧雜環已烷,俗稱二氧六環(C4H8O2),是一種嚴重污染水體的有機物。它可以被氧化劑如過二硫酸根、臭氧或者過氧化氫等氧化成為無害的化學物質。
在溫度T=303.15 K,以AgNO3為催化劑、過二硫酸鉀(K2S2O8)為氧化劑,進行二氧六環氧化的動力學研究,得到如下數據。通過測定未反應的過二硫酸根監控反應過程。研究中所用AgNO3的濃度為1.00×10-3mmol·dm-3。
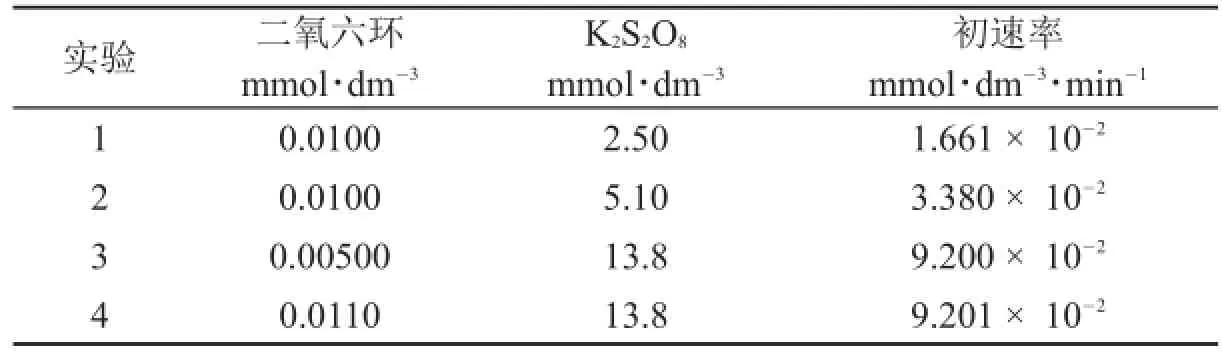
實驗1234二氧六環mmol·dm-30.0100 0.0100 0.00500 0.0110 K2S2O8mmol·dm-32.50 5.10 13.8 13.8初速率mmol·dm-3·min-11.661×10-23.380×10-29.200×10-29.201×10-2
許多國家飲用水中二氧六環的最高許可值設定為0.35 μg·dm-3。
某一水樣,二氧六環起始濃度為40.00 μg·dm-3。假設氧化l mol二氧六環需消耗l mol過二硫酸根。研究中所用AgNO3的濃度為1.00×10-3mmol·dm-3。
4.1.1計算要使水樣中的二氧六環濃度達到許可值,氧化反應過程需要進行多長時間(單位:分鐘),溫度為303.15 K,K2S2O8的起始濃度為5.0×10-6mol·dm-3。假定上述實驗得到的速率關系在這些條件下依然有效。
對于過二硫酸根氧化二氧六環的反應,業有不同的機理。Misra和Ghosh(1963)給出的機理如下:
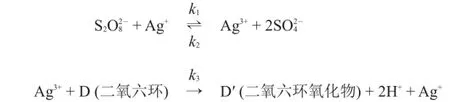
4.1.2假設Ag(III)處于穩態,導出二氧六環氧化過程的速率方程。
4.1.3如下說法哪個或哪些是正確的?
A)在二氧六環濃度非常高時,根據4.1.2所給機理得到的速率方程和4.1.1中的實驗數據相符合。
B)在二氧六環濃度非常低時,根據4.1.2所給機理得到的速率方程和4.1.1中的實驗數據相符合。
C)在二氧六環濃度非常高時,表觀反應速率常數的單位為dm3·mol-1·s-1。
D)在二氧六環濃度非常低時,表觀反應速率常數的單位為dm3·mol-1·s-1。
藥物的降解——動力學縱覽
動力學研究對確定藥物保質期至關重要。一些化學反應會影響藥物的保質期,這些反應的速率依賴于反應條件如pH、溫度、濕度。
賴氨酸的乙酰水楊酸鹽(LAS)是一種有鎮痛和消炎作用的處方藥,商品名稱為Aspegic。LAS水解生成賴氨酸水楊酸鹽和乙酸。
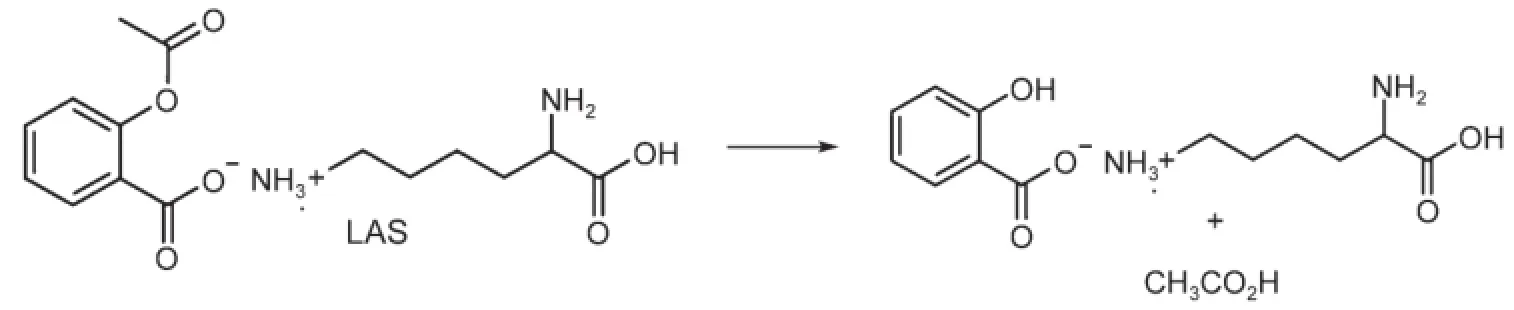
LAS水解有三種途徑:(a)酸催化,(b)非催化以及(c)堿催化。
如果以[LAS]表示“t”時刻LAS的濃度,水解反應的總速率可以寫為:
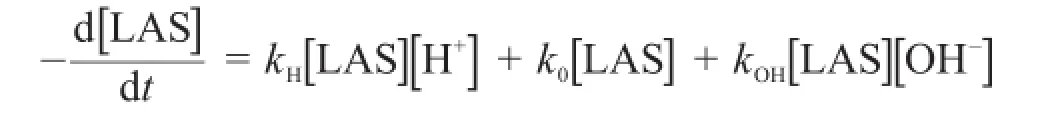
這里,kH、k0和kOH分別為酸催化、非催化和堿催化水解途徑的速率常數。總反應速率可以定義為:
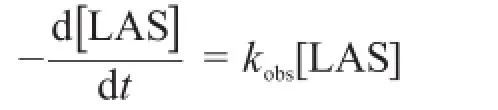
4.2.1寫出含kH、k0、kOH和[H+]的kobs表達式。
在298.15 K、不同pH(從0.50到13.0)條件下進行LAS的水解反應。LAS的起始濃度非常低,可以認為在反應過程中pH不變。
下圖給出LAS水解隨pH的變化關系。
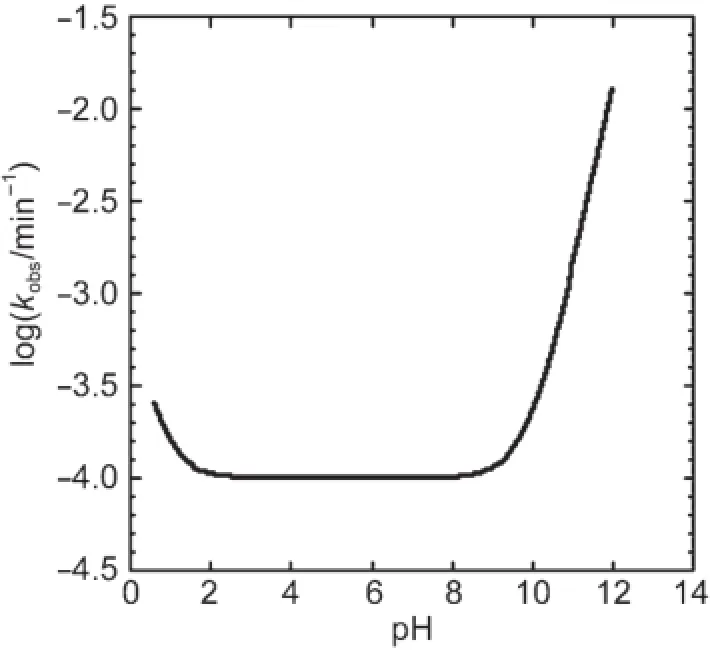
4.2.2下面哪個或哪些說法正確?
A)在pH=12時,kobs≌k0。
B)在pH=5.0時,kobs≌k0。
C)隨pH從0.50變為1.0,反應速率增大。
D)隨pH從10變為12,反應速率增大。
4.2.3利用上圖和下表的數據,計算kH、k0和kOH。必須給出單位。

pH log(kobs/min-1)1.300-3.886 5.300-4.000 12.180-1.726
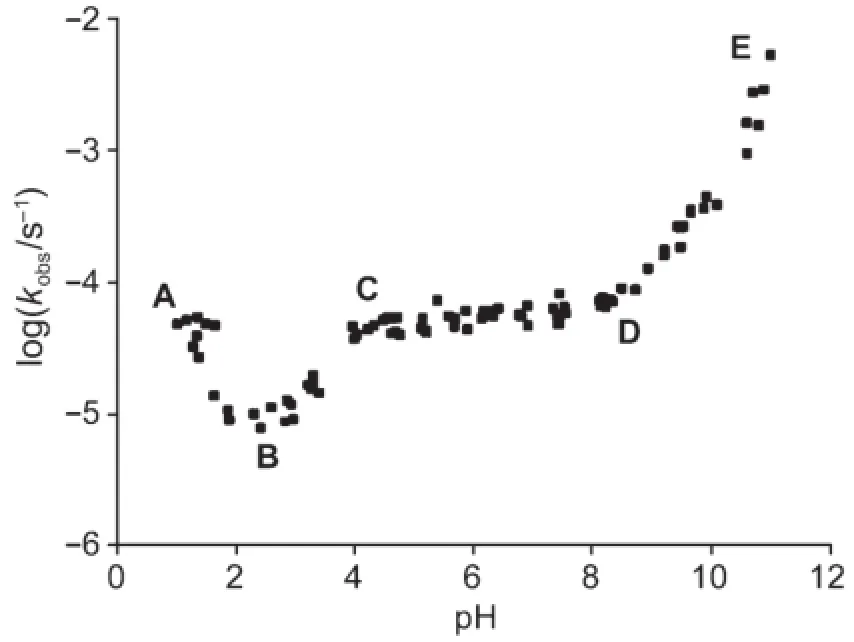
乙酰水楊酸,俗稱阿司匹林,是一種常用來退熱、止痛和消炎的藥物。與LAS類似,阿司匹林的水解隨pH變化也有多種途徑。在333.15 K溫度下,阿司匹林水解與pH的關系如下:
下面給出阿司匹林水解的可能反應。隨pH不同,會有一個或者多個反應占主導地位。
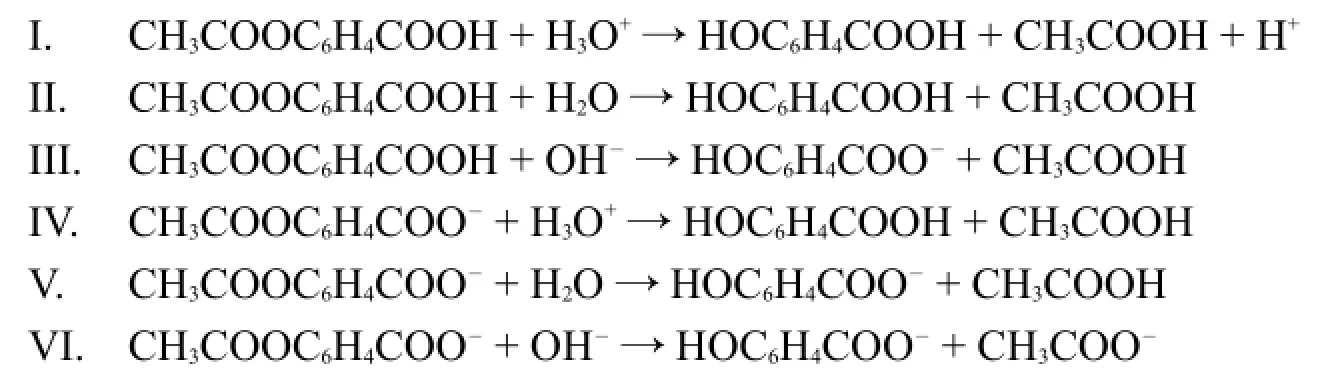
4.3.1利用上面的pH和速率關系曲線和以上所給的反應,指出下面的說法中哪個或哪些是正確的。(在溫度為333.15 K時,阿司匹林pKa=3.57)
a)在C-D區間,反應IV占主導。
b)在C-D區間,反應V占主導。
c)在D-E區間,反應VI占主導。
d)在A-B區間,反應II占主導。
研究表明,阿司匹林水解的速率常數對pH關系曲線在某一特定pH總是存在一個極小值。在290.15 K溫度下,測得反應I、II和III的速率常數如下:
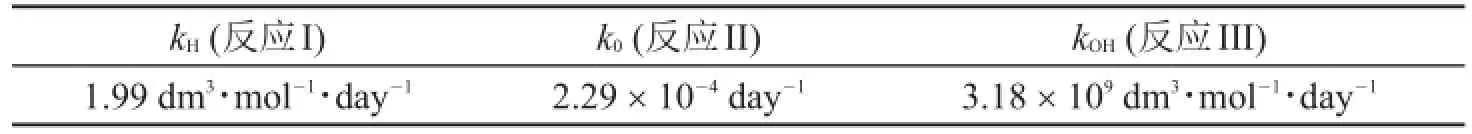
kH(反應I)1.99 dm3·mol-1·day-1k0(反應II)2.29×10-4day-1kOH(反應III)3.18×109dm3·mol-1·day-1
290.15K,水的離子積取1.0×10-14。
4.3.2假設只發生反應I、反應II和反應III,計算速率常數最小處的pH值。
第5題 總分的8%
早在5500年前,古埃及人就知道如何合成藍色顏料,今天我們把這種顏料稱為“埃及藍”。之后約2000年,在古代的中國,另外一種如今被稱作“中國藍”的藍色顏料被廣泛使用。這兩種顏料結構相似,但元素組成不同。
古代制備這兩種顏料的方法在現代的實驗室中很容易重復。
涉及到物質的量的關系,假設本題目中的所有化合物均為純凈物且產物可定量得到。
要制備埃及藍,將10.0 g礦物A與21.7 g SiO2和9.05 g礦物B在800-900°C加熱足夠長的時間,釋放出16.7 dm3由兩種物質組成的混合氣體(體積在溫度850°C,1.013×105Pa下測得),得到34.0 g顏料,沒有其他產物。將以上混合氣體冷卻,其中一種組分發生凝聚。進一步冷卻至0°C,氣體體積減至3.04dm3。
5.1.1計算加熱A和B及SiO2而產生的混合氣體的質量。
5.1.2定量確定氣體混合物的組成。
當10.0 g礦物A和21.7 g SiO2在B不存在的條件下共熱,釋放出8.34 dm3氣體(體積在溫度850°C和1.013×105Pa下測得)。礦物A僅含一種金屬。
5.1.3計算礦物B的摩爾質量并確定B的化學式。提示:這是一種不含結晶水且不溶于水的離子固體。
要制得中國藍,需稱取17.8 g礦物C替代礦物B(礦物A和SiO2的質量保持與制備埃及藍相同),且反應在更高的溫度下進行。除了目標顏料,反應還產生與制備埃及藍時相同種類、相同質量的氣體。
5.1.4確定礦物C的化學式。
5.1.5確定埃及藍和中國藍的化學式。
5.1.6確定礦物A的化學式。
某些中國藍樣品分析結果顯示其中含有痕量硫。這就意味著合成這些樣品時采用的是另一種不同于C的礦物。
5.2.1寫出一種替代C的礦物的化學式。
5.2.2如果采用這種礦物而不是C合成中國藍,反應溫度是否可以降低?
假如在制備中國藍的過程中,二氧化硅的量比前述過程所用的要少,將會得到一種紫色的顏料:中國紫。中國紫被特別用于兵馬俑的著色。
5.3寫出在制備中國紫的條件下可以形成的二元化合物的化學式,此化合物也是顏色發生變化之根源。
第6題 總分的7%
盡管目前還沒有治療老年癡呆癥的方法,但是科學家們已經發展了一些治療神經組織退化性疾病的藥物。在這些乙酰膽堿酯酶抑制劑中,藥物加蘭他敏1就是其中一個。這個分子可以從格魯吉亞當地植物高加索雪蓮中分離得到,但是必須通過人工大量合成才能滿足臨床治療的需求。人工大量制備加蘭他敏的合成路線如下所示。
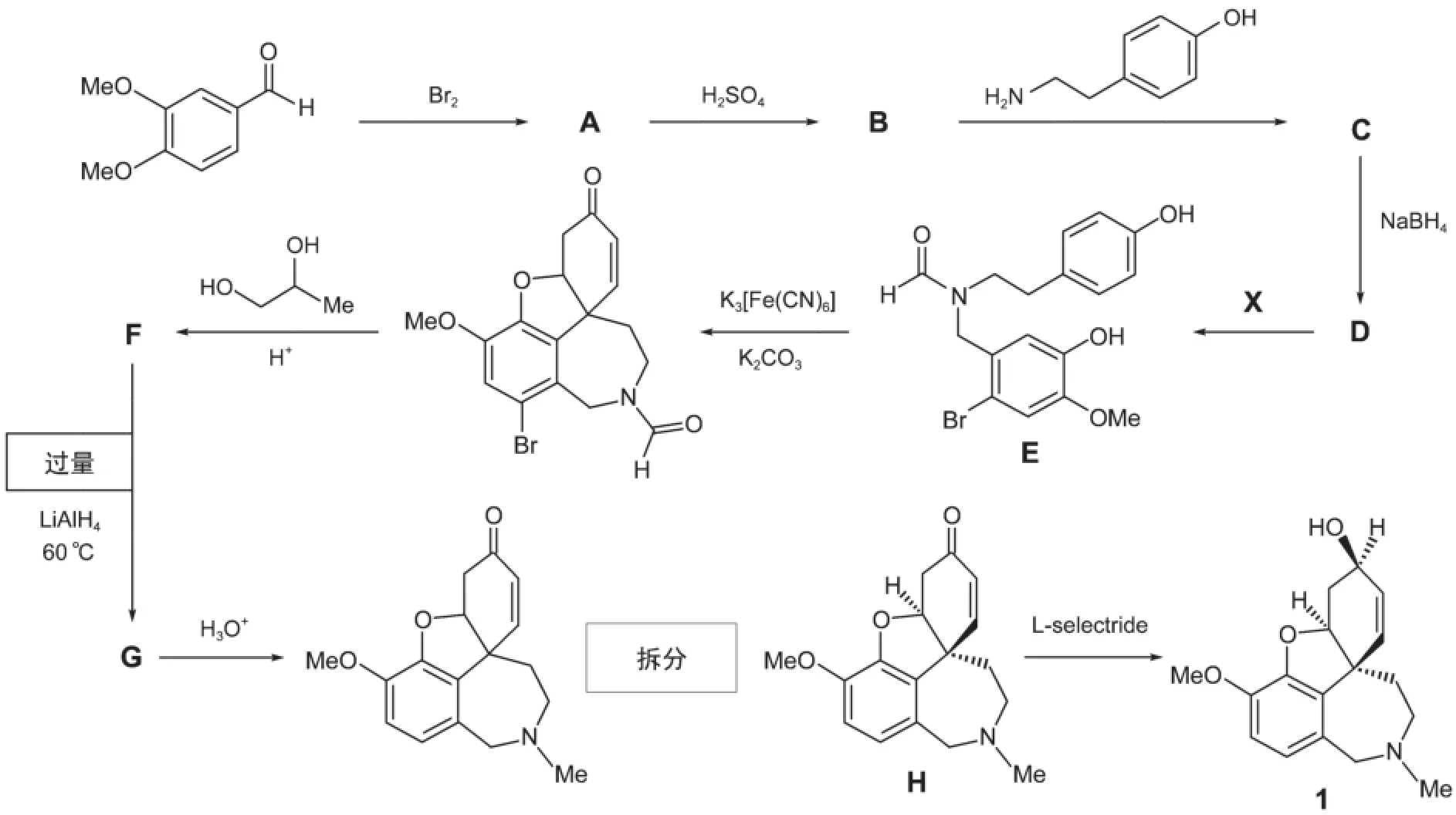
關于此合成的說明:
1H NMR圖譜表明化合物A中苯環上2個氫處在芳環的對位;
在水相中,化合物C易分解,不能分離得到;但是很快能被NaBH4還原為化合物D。
6.1.1畫出化合物A、B、C、D、F以及G的結構簡式;除了最后一步L-selectride的還原反應外,其他反應均不是立體選擇性的。因此,在你的答題中不需要考慮立體化學。
6.1.2給出將化合物D轉化為E的試劑X的化學式。
通過拆分獲得的目標化合物的旋光度為-400(°)·cm2·g-1,但是在相同條件下測量,其對映體純化合物的旋光度為-415(°)·cm2·g-1。你可以假定其光活性不純只歸因于另一個對映體。
其中一種表示光活性純度的方法是對映體過量(ee)值,此值指的是在只由一對對映體組成的混合體系中一個化合物對其對映體的過量的數值。例如,在一個70%R和30%S組成的混合體系中,其ee值為40%。
6.2.1人工制備經拆分后的這個化合物的對映體過量ee值為多少?
用于最后的立體選擇性還原的L-selectride是一個商業化試劑。
6.2.2確定(-)-1化合物標識為(α,β,γ)的立體中心R或S構型。
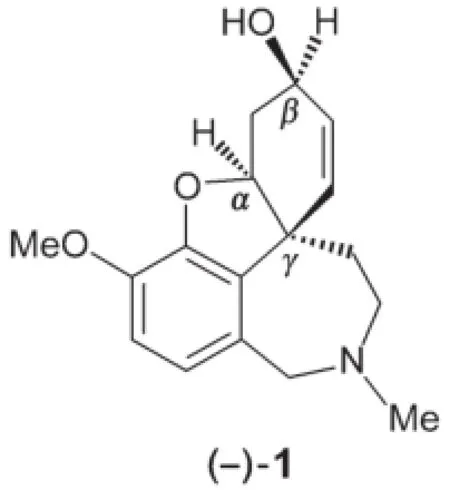
6.2.3給出一個與L-selectride一樣能將H轉化為1的試劑的化學式。無需考慮立體選擇性。另一條生產加蘭他敏的替代性合成路線中最后一步構建了化合物中的七元環。
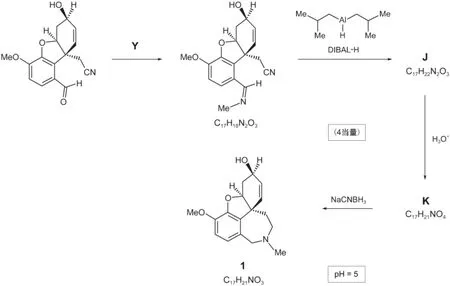
6.3.1給出進行第一步反應的化合物Y的化學式。
6.3.2畫出化合物J和K的結構簡式。
第7題 總分的8%
這個問題主要討論dolasetron mesylate Z的合成(結構式如下圖所示),這個市售藥物的名稱為Anzemet,主要用于治療手術后的惡心和嘔吐。
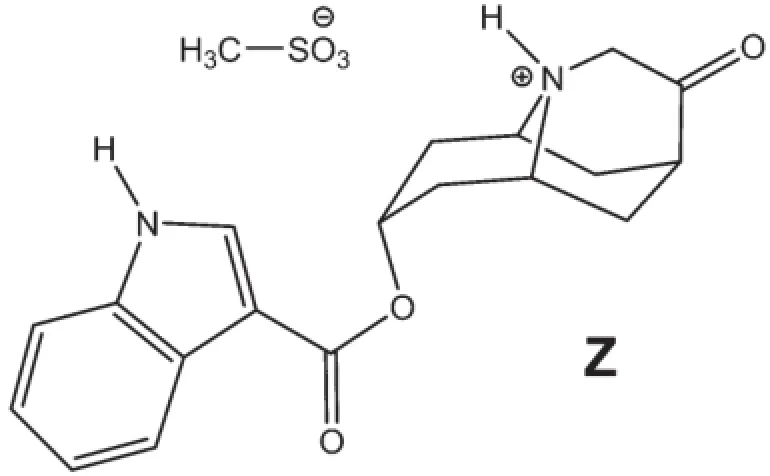
其起始的合成路線如下圖所示。
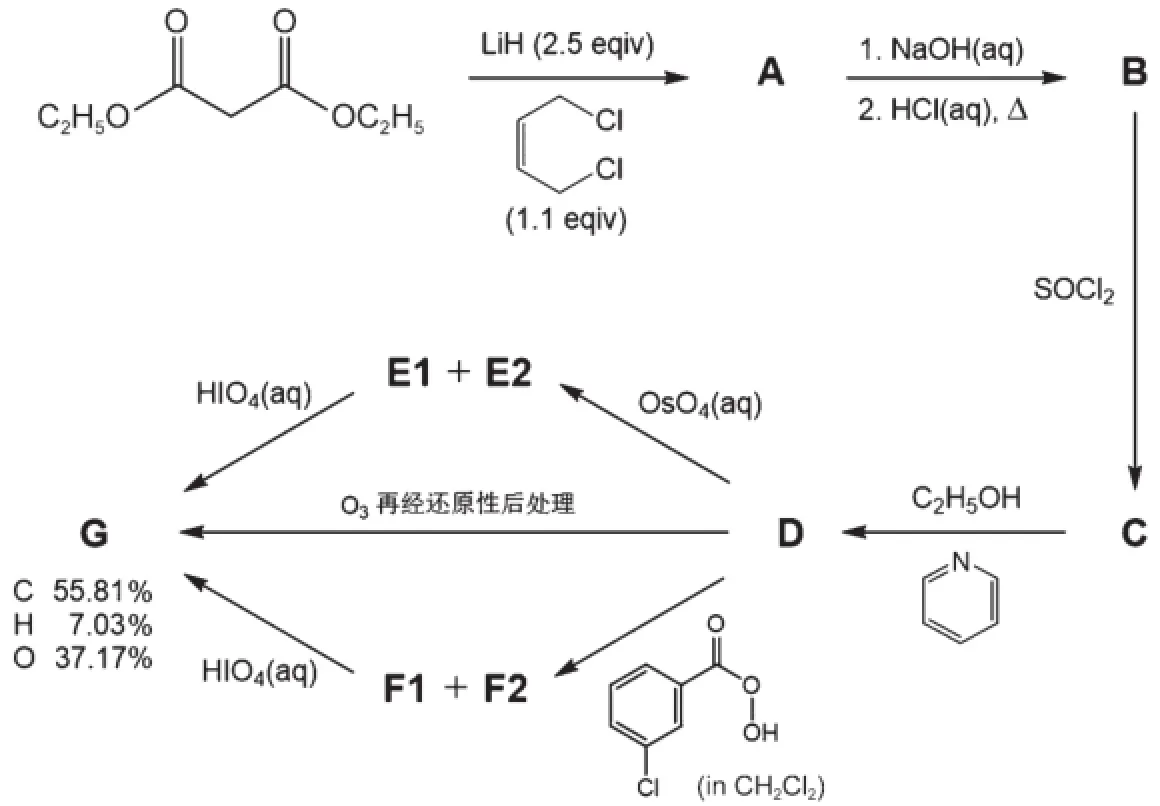
第一步合成了環狀化合物A,其分子中只含C、H以及O原子。化合物G是非手性的,可以直接通過化合物D的臭氧化反應后再經還原后處理得到,也可以通過在OsO4氧化后的立體異構體產物E1和E2再轉化得到,還可以由過酸氧化后的立體異構體產物F1和F2再轉化得到。
7.1依據所給的質量百分數確定化合物G的經驗式。
7.2畫出A、B、C、D、E1、E2、F1、F2和G的結構簡式。
化合物G用于下一步的合成,在緩沖溶液中G轉化為H(是由兩個非手性的非對映異構體組成的混合物)。化合物H被NaBH4還原生成醇I(是由4個非手性的非對映異構體組成的混合物)。I在酸性條件下與四氫吡喃反應生成J(是由更多非對映異構體組成的混合物)。然后,J先經叔丁醇鉀處理,接著再在鹽酸水溶液中回流,在弱堿性條件下進行后處理,分離得到K,K由一對非對映異構體組成,K1為主產物,K2為次要產物。兩者可以分離。K1用于最后的合成。
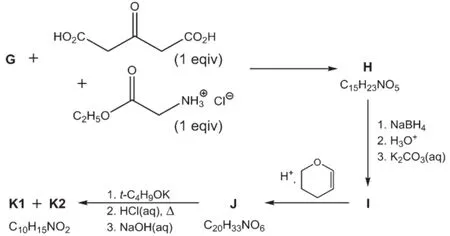
7.3.1畫出化合物H、I和J的結構簡式。此處不需要將形成的所有非對映異構體都一一列出。
7.3.2畫出非對映異構體K1和K2的結構簡式。
在最后的合成中,L與M反應生成中間體N,N接著與K1反應后,分離得到中性胺化合物,再經CH3SO3H質子化反應得到最終藥物Z。
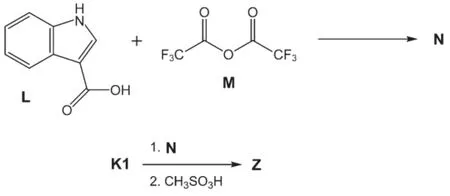
7.4畫出化合物N的結構簡式。
第8題 總分的7%
一個不常見的、但與生理活性相關的糖類似物可以以D-葡萄糖為原料經以下合成路線制備。D-葡萄糖的丙酮溶液加入一滴濃酸加熱后生成二縮酮化合物A。A接著可以選擇性水解轉化為B。
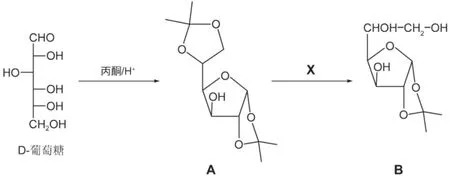
8.1給出答題紙中選擇題的答案。
化合物B與NaIO4反應生成C。C接著與NaCN水溶液反應,再經10%NaOH水溶液加熱處理得到由兩個非對映異構體組成的混合物D1和D2。這兩個化合物可以通過柱色譜分離。
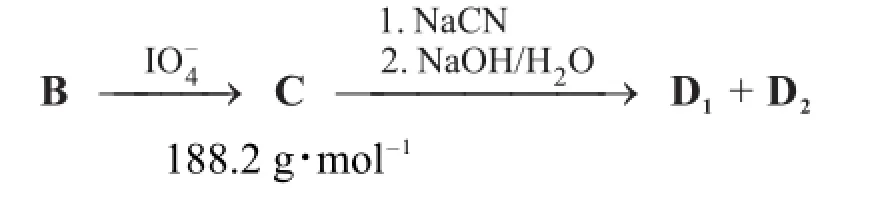
D1被LiAlH4還原后,接著在1 M HCl水溶液中加熱生成糖F,F是目前自然界中含量最高的多糖水解產物。
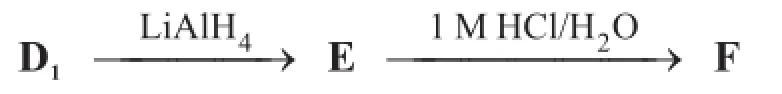
8.2.1畫出化合物C、D1、D2、E以及F的立體結構簡式,在這些結構簡式中須帶有立體化學信息。F中需表示為以穩定的六元環為骨架的異構體。用波浪線表示與絕對立體構型不能確定的手性碳原子相連接的其中一根單鍵。
8.2.2給出答題紙中選擇題的答案。
D2經HCl中和后,接著在甲苯中加熱失水形成化合物G,這是一個在無水溶劑中穩定的三環結構。在1 M HCl溶液中加熱回流,G可以轉化為H(C6H10O7),這是一個含六元環的天然糖類衍生物。H是肝素的構建骨架,肝素是在我們人體中產生的抗凝血多糖化合物。
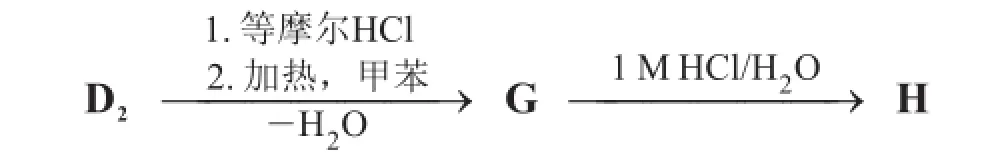
8.3.1畫出包含立體化學信息的化合物G的立體結構簡式。
畫出含有以穩定的六元環為骨架的H的立體結構簡式。用波浪線表示與絕對立體構型不能確定的手性碳原子相連接的一根單鍵。
8.3.2給出答題紙中選擇題的答案。
8.3.3給出答題紙中選擇題的答案。
10.3866/PKU.DXHX201609001
,Email:jianpei@pku.edu.cn

