腦血疏口服液對大鼠腦出血后神經(jīng)功能及血腫周圍半暗帶細胞凋亡的影響
胡 勇,張亞紅,劉重霄 ,周 任 ,師 蔚,郭振宇
?
腦血疏口服液對大鼠腦出血后神經(jīng)功能及血腫周圍半暗帶細胞凋亡的影響
胡 勇1,張亞紅2,劉重霄2,周 任2,師 蔚2,郭振宇2
目的 在建立大鼠腦出血(ICH)模型基礎(chǔ)上,早期應(yīng)用藥物進行干預(yù),觀察大鼠神經(jīng)功能缺失及腦出血血腫周圍半暗帶中細胞凋亡情況。方法 選用SD大鼠78只,隨機分為實驗組、治療組和對照組,各組又隨機分為1 h、6 h、1 d、3 d、7 d和14 d亞組。實驗組注射Ⅳ型膠原酶建立ICH模型,治療組予以藥物干預(yù),后各組分別進行神經(jīng)功能測定及TUNEL法統(tǒng)計檢測細胞。結(jié)果 腦出血模型建立后各組動物均出現(xiàn)不同的神經(jīng)功能缺失癥狀,腦出血組神經(jīng)功能缺失癥狀明顯重于治療組和對照組;對照組腦組織幾乎未見TUNEL陽性細胞,實驗組于6 h可見腦出血灶周圍TUNEL陽性細胞最多,并隨時間的延長逐漸減少,于3 d再次出現(xiàn)TUNEL陽性細胞高峰后下降;治療組僅在腦出血后6 h觀察到腦出血灶周圍TUNEL陽性細胞數(shù)高峰,但其高峰時數(shù)量少于腦出血組,之后漸下降。結(jié)論 腦血疏口服液可以通過抑制神經(jīng)元凋亡,改善神經(jīng)功能缺失及減輕腦出血后繼發(fā)腦損害。
腦出血;腦血疏口服液;細胞凋亡;神經(jīng)功能缺失;大鼠;中風(fēng)
腦出血(ICH)是嚴重危害人類健康的常見病和多發(fā)病,ICH后繼發(fā)性腦損傷是導(dǎo)致ICH病人致殘率和死亡率極高的重要原因之一。既使近年來神經(jīng)影像診斷、神經(jīng)外科微創(chuàng)手術(shù)和神經(jīng)康復(fù)研究等方面均有較大進展,但ICH病人的療效和預(yù)后并未有根本改觀,仍然是目前神經(jīng)科學(xué)研究領(lǐng)域的重要課題[1]。研究證實,ICH后血液成分及其降解產(chǎn)物和炎性細胞大量滲入腦組織中,可通過細胞凋亡造成腦組織進一步損傷[2]。腦血疏口服液(國藥準字Z20070059,國家中藥保護品種)具有益氣、活血、化瘀之功效,臨床應(yīng)用發(fā)現(xiàn)其確實對ICH病人顱內(nèi)血腫吸收及減輕腦損害起到一定作用,但其確切治療機制仍未完全明了[3]。那么腦血疏口服液是否通過抑制ICH后血腫周圍半暗帶中細胞凋亡來改善神經(jīng)功能及減輕繼發(fā)腦損傷,目前缺乏相關(guān)研究證實。本實驗擬在建立大鼠ICH模型基礎(chǔ)上,應(yīng)用腦血疏口服液進行干預(yù),觀察大鼠神經(jīng)功能缺失及腦出血血腫周圍半暗帶中細胞凋亡,為今后闡明ICH后腦損傷的致病機制及治療方案打下一定的基礎(chǔ)。
1 材料與方法
1.1 動物分組 健康清潔SD大鼠78只,體重250 g~300 g,雄性,由西安交通大學(xué)動物實驗中心提供。實驗動物使用隨機數(shù)字表法分組:實驗組、治療組和對照組。實驗組和治療組再隨機分為1 h、6 h、1 d、3 d、7 d和14 d亞組,每亞組6只大鼠,對照組共6只大鼠,各組間大鼠體重?zé)o明顯差異。
1.2 ICH動物模型建立 用Ⅳ型膠原酶建立ICH模型,大鼠術(shù)前12 h禁飲食4 h禁水,0.4%戊巴比妥鈉腹腔麻醉(40 mg/kg),必要時水合氯醛補充麻醉,保證手術(shù)操作期間大鼠有自主呼吸,俯臥位固定于動物頭顱立體定向儀上,頭皮“釘子型”剪開,取前囟為原點,向右3 mm,向后1 mm,深度5 mm為注射點(尾狀核),磨鉆磨開顱骨,進針后緩慢注射Ⅳ型膠原酶、肝素和生理鹽水混合溶液(每1 mL含Ⅳ型膠原酶0.2 U及肝素2 U),留針10 min,緩慢退針,骨蠟封閉顱骨鉆孔,縫合頭皮。術(shù)中注意大鼠呼吸情況并保持呼吸道通暢,大鼠體溫控制在36.5℃~37.5℃,術(shù)畢動物送入有空調(diào)的動物房飼養(yǎng)。對照組按Ⅳ型膠原酶法注入相同劑量生理鹽水;治療組按上述造模方法每8 h灌服腦血疏口服液1 mL/kg,實驗組及對照組灌服生理鹽水。
1.3 觀察指標 采用SPSS 20.0軟件包分析。參照Longa FZ五級評分法,對造模后大鼠進行神經(jīng)功能評分。取腦出血動物模型腦組織標本備用,TUNEL法染色。

2 結(jié) 果
2.1 ICH后各組神經(jīng)功能缺損癥狀 造模后6 h將實驗組大鼠尾部提起,可見大鼠左側(cè)前肢略回收于腹下,而部分大鼠表現(xiàn)為追尾現(xiàn)象,Longa評分1分~2分;術(shù)后2 d~3 d神經(jīng)功能缺失最重,表現(xiàn)為不能站立或有意識障礙,Longa評分3分~4分。治療組動物神經(jīng)功能缺失癥狀與實驗組相比較輕,對照組無明顯神經(jīng)功能缺失表現(xiàn)。
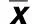
表1 ICH后各時相點神經(jīng)功能評分比較(±s) 分
2.2 出血灶周圍TUNEL陽性細胞 正常腦組織內(nèi)極少見TUNEL陽性細胞,在實驗組中TUNEL陽性細胞核染成藍紫色,對照組腦組織幾乎未見TUNEL陽性細胞;6 h時實驗組出血灶周圍腦組織TUNEL陽性細胞最多,明顯高于治療組(P<0.05);1 d時實驗組TUNEL陽性細胞較6 h時有所下降,但仍高于治療組(P<0.05);3 d時實驗組TUNEL陽性細胞較其1 d時又有所增加,而此時治療組TUNEL陽性細胞隨時間的延長逐漸減少,并且治療組與實驗組同時段相比TUNEL陽性細胞數(shù)減少明顯(P<0.05)。詳見表2。
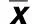
表2 各組血腫周圍缺血半暗帶TUNEL陽性細胞的變化(±s)
3 討 論
有關(guān)ICH后繼發(fā)性腦損傷的研究,目前觀點認為ICH后繼發(fā)性腦損傷的可能機制主要兩大類[4-6]:一是血腫直接作用,引發(fā)神經(jīng)細胞凋亡。其發(fā)病機制可能與下述幾方面因素有關(guān):①血紅蛋白的作用。血紅蛋白是一種含鐵蛋白,出血后該物質(zhì)被釋放到蛛網(wǎng)膜下腔或腦組織內(nèi),并在其代謝過程中產(chǎn)生脂質(zhì)過氧化反應(yīng),導(dǎo)致細胞膜損傷、DNA片段化,最終導(dǎo)致細胞壞死或凋亡。②血液其他成分的刺激。研究證實,血液中凝血酶和纖溶酶可直接導(dǎo)致神經(jīng)組織細胞凋亡。③出血后繼發(fā)的炎性反應(yīng)。大量動物實驗證實ICH后存在炎性細胞增生、釋放炎性因子,并導(dǎo)致正常神經(jīng)元凋亡。二是除了血腫的直接作用外,ICH后血腫對周圍腦組織的壓迫、腦水腫形成、局部腦組織缺血、并發(fā)蛛網(wǎng)膜下腔出血后腦血管痙攣等也可導(dǎo)致神經(jīng)細胞損傷、凋亡。
細胞凋亡是一個形態(tài)學(xué)上的概念,自1972年來病理學(xué)家Kerr等提出“凋亡”概念后,引起人們對這一生物學(xué)現(xiàn)象的廣泛興趣。細胞凋亡與壞死是有本質(zhì)區(qū)別的[7-8]。凋亡被描述成細胞的程序性崩解,細胞皺縮,胞核裂解,染色質(zhì)濃縮,凋亡小體形成。而嚴重缺血、高溫及機械性損傷等主要環(huán)境變化引起的細胞壞死現(xiàn)象是一種變性現(xiàn)象,壞死的特征是細胞質(zhì)和細胞器膨脹、胞膜及胞體破裂。細胞壞死是不可逆過程,細胞結(jié)構(gòu)和功能的損傷是不可逆轉(zhuǎn)的,是被動的過程。而凋亡在一定條件下可被調(diào)控的。既然ICH后神經(jīng)元凋亡是造成繼發(fā)腦損傷的關(guān)鍵因素同時又是可控因素,那么臨床中探尋一種行之有效的治療ICH的方法就成為可能。
本研究提示,實驗組及治療組大鼠均出現(xiàn)了神經(jīng)系統(tǒng)癥狀,具體表現(xiàn)為反應(yīng)淡漠、食欲差,活動減少,肢體癱瘓,對照組大鼠正常。1 h時神經(jīng)功能評分3組間差別無統(tǒng)計學(xué)意義,說明1 h時神經(jīng)功能障礙可能由麻醉引起,沒有實際意義;6 h后神經(jīng)功能評分結(jié)果顯示實驗組明顯高于其余兩組,由于此時麻醉藥物已代謝,故考慮與這一階段血腫的形成、進展、壓迫腦組織、腦水腫產(chǎn)生及局部炎癥介質(zhì)的毒性反應(yīng)等繼發(fā)性腦損傷的嚴重程度有關(guān)。使用腦血疏口服液的治療組大鼠也出現(xiàn)神經(jīng)系統(tǒng)癥狀,但癥狀較未使用藥物實驗組為輕,并且恢復(fù)快。對照組均于造模后6 h恢復(fù)進食和活動,其后未見神經(jīng)系統(tǒng)癥狀出現(xiàn)。ICH后神經(jīng)元細胞凋亡發(fā)生存在并有一定規(guī)律性,實驗組凋亡發(fā)生的時間較早,且出現(xiàn)兩次神經(jīng)元凋亡高峰:早期約6 h時,晚期在3 d左右。而治療組出現(xiàn)一次神經(jīng)元凋亡高峰,約在6 h左右。
腦血疏口服液具有益氣、活血、化瘀的作用,其主要成分為黃芪、水蛭、 石菖蒲、牛膝及川芎,主要用于“氣虛血瘀”所致中風(fēng)病人。近期關(guān)于腦血疏口服液的研究表明[9-13]:ICH血腫周圍及血腫內(nèi)部發(fā)生炎癥反應(yīng),并且有中性粒細胞、巨噬細胞移行至血管外,小膠質(zhì)細胞激活;ICH后1 d~7 d,有大量的多形核白細胞、單核細胞在血腫周圍浸潤;ICH后48 h中性粒細胞黏附于血管壁或從毛細血管和小靜脈內(nèi)游出。滲出的中性粒白細胞能夠釋放各種細胞因子,以腫瘤壞死因子-α(TNF-α)為主的多種致炎因子,破壞血腦屏障(BBB)、加重腦水腫和腦損傷。TNF-α對毛細血管有直接毒性作用,導(dǎo)致微小血管痙攣,增加毛細血管通透性,開放血腦屏障,加重外周白細胞浸潤及腦水腫。腦血疏口服液可以減輕血腫周圍多種細胞因子的參與和表達,如TNF-α、IL-1、IL-6等。
腦血疏口服液可以通過抑制神經(jīng)元凋亡,改善神經(jīng)功能缺失及減輕腦出血后繼發(fā)腦損害,對大鼠腦出血后神經(jīng)功能及血腫周圍半暗帶細胞凋亡調(diào)控,可能是通過抑制炎性因子產(chǎn)生,但該方式是否為唯一渠道,還需進一步研究證實。
[1] 王忠誠.王忠誠神經(jīng)外科學(xué)[M].武漢:武漢科學(xué)技術(shù)出版社, 2005:867.
[2] Morgenstern LB, Hemphill JC, Anderson C, et al.Guidelines for the management of spontaneous intracerebral hemorrhage[J].Stroke, 2015, 5(9):2108-2129.
[3] 謝道珍, 李靜, 羅林, 等.腦血疏通口服液治療出血性中風(fēng)的實驗研究[J].中國中西醫(yī)結(jié)合雜志, 1995,15(1): 354-357.
[4] Torfs CF.Prenatal and perinatal factors in the etiologyor cerebral palsy[J].J Pediatr, 2002, 116: 615-616.
[5] Robertson C, CMT,F(xiàn)iner NN, et al.School performance of surviors of neonatal encephalopathy associated with birth asphyxia at term[J].J Pediatr, 2001, 114: 753-760.
[6] Michael R,Hoane, Shelby A, et al.The effects of nicotimamide on apoptosis and blood-brain barrier breakdown following traumatic brain injury[J].Brain Research, 2006,1125:189-193.
[7] Maiese K.Neuronal survival: cellular and molecular pathways of protection[J].NY Acad Sci, 1997, 835:255-273.
[8] Leist M,Single B, Castoldi, et al.Intracellular ATP concentration: a switch deciding between apoptosis and necrosis[J].J Exp Med, 1997, 185(8): 1481-1486 .
[9] 張汝洋,季東.依達拉奉聯(lián)合腦血疏口服液治療高血壓腦出血臨床研究[J].中外醫(yī)學(xué)研究,2011(7):125-127.
[10] 苗文才,閆睿.腦血疏口服液治療高血壓腦出血療效觀察[J].中國實用神經(jīng)疾病雜志, 2014,14:12-16.
[11] 宋艷玲,原向軍,尚慧娟.高壓臭氧聯(lián)合腦血疏口服液治療腦梗死臨床觀察[J].中西醫(yī)結(jié)合心腦血管病雜志, 2015,13(7):371-372.
[12] 陳尚軍,王海燕,左毅, 等.腦血疏口服液治療腦出血后繼發(fā)神經(jīng)功能損害的療效觀察[J].中西醫(yī)結(jié)合心腦血管病雜志, 2016,14(2):199-202.
[13] 張選國,王凌.腦血疏口服液對氣虛血瘀型急性腦梗死療效及炎性指標的影響[J].中西醫(yī)結(jié)合心腦血管病雜志,2016,14(3):299-300.
(本文編輯王雅潔)
1.陜西省黃陵縣醫(yī)院(西安交通大學(xué)第二附屬醫(yī)院協(xié)管醫(yī)院 陜西黃陵727300);2.西安交通大學(xué)第二附屬醫(yī)院
郭振宇,E-mail:guozhenyu18@sina.com
R743.3 R285.5
A
10.3969/j.issn.1672-1349.2016.15.012
1672-1349(2016)15-1735-03
2016-04-16)

