應用實時熒光PCR檢測甜菜霜霉病菌
張娜,乾義柯,魏霜,張維,焦子偉,張祥林
(1. 伊犁師范學院生物與地理科學學院,新疆伊寧 835000;2. 伊犁出入境檢驗檢疫局,新疆伊寧 835000;3. 汕頭出入境檢驗檢疫局,廣東汕頭 515041;4. 新疆出入境檢驗檢疫局,烏魯木齊 830052)
?
應用實時熒光PCR檢測甜菜霜霉病菌
張娜1,乾義柯2,魏霜3,張維1,焦子偉1,張祥林4
(1. 伊犁師范學院生物與地理科學學院,新疆伊寧 835000;2. 伊犁出入境檢驗檢疫局,新疆伊寧 835000;3. 汕頭出入境檢驗檢疫局,廣東汕頭 515041;4. 新疆出入境檢驗檢疫局,烏魯木齊 830052)
【目的】建立用于快速檢測甜菜霜霉病菌Peronosporafarinosaf. sp.beteaByford的SYBR GreenⅠ實時熒光PCR檢測方法。【方法】根據已報道的P.farinosaf. sp.BeteaByford及近似種 28S rDNA序列同源性比對結果,設計用于檢測甜菜霜霉病菌的SYBR GreenⅠ實時熒光PCR檢測引物。利用所建立的方法對包括P.farinosaf. sp.Betea在內的6種甜菜上的病原菌和5種其他霜霉病菌基因組DNA及12份甜菜種子樣品進行檢測,驗證該方法的檢測特異性、靈敏度及實用性。【結果】所建立的檢測方法僅對甜菜霜霉病菌得到陽性擴增,其它參照菌株及陰性對照均無熒光信號擴增,準確排除了甜菜上其他5種病菌的干擾,其檢測靈敏度顯示最低限量為100 fg病菌DNA,應用該方法對不同來源的12份甜菜種子樣品進行檢測,田間監測結果一致。【結論】所建立的熒光檢測方法能夠對甜菜霜霉病菌進行快速篩查,為甜菜霜霉病菌的早期診斷和防控提供了一種技術手段。
甜菜霜霉病菌;實時熒光PCR;檢測
0 引 言
【研究意義】甜菜霜霉病菌Peronosporafarinosa(Fr.)Fr. f. sp.beteaByford是我國重要的植物檢疫性病原菌,對甜菜生產的危害極大,其病原菌屬鞭毛菌亞門,霜霉目,霜霉屬,粉霜霉,異名P.schachtiiFucke。主要侵染甜菜地上部幼嫩器官,多為害心葉,感病葉片初為淺綠色后為黃色至褐色的不規則形病斑。在潮濕條件下,病斑背面長有灰紫色的霉層,為病原菌從氣孔中伸出的菌絲、孢囊梗和孢囊孢子。糖用甜菜是僅次于甘蔗的重要糖料作物,我國最大的甜菜糖產區在新疆,年產糖50×104t左右[1]。近幾年新疆甜菜制種基地減少,甜菜霜霉病隨環境氣候小面積零星發生,但我國每年從德國、法國、比利時等國進口大量甜菜種子,可能攜帶的檢疫性有害生物嚴重威脅我國甜菜產業的生產安全,高效快速檢測是預防甜菜霜霉病傳入及擴散的技術關鍵。【前人研究進展】該病害在以色列、前蘇聯、肯尼亞、摩洛哥、加拿大、美國、阿根廷、澳大利亞、新西蘭等國家均有分布。1997年甜菜霜霉病菌列入我國檢疫性有害生物目錄,據國內學者調查報道,該病害發生區為西南三省葉用甜菜和新疆伊犁地區糖用甜菜,20世紀90年代新疆糖用甜菜霜霉病引起學者廣泛關注,并對其病原形態特征、危害狀、發病流行規律及檢疫防治措施進行了研究和報道[2-5]。甜菜霜霉病菌為專性寄生菌,很難進行常規的分離培養,有關PCR檢測方面的報道較少,但PCR檢測技術在霜霉目病原菌的檢測方面已廣泛應用。R. loos等[6]基于Plasmoparahalstedii28S rDNA設計了特異性檢測引物,能夠從向日葵種子中特異檢出向日葵霜霉病菌,其靈敏度達到3 pg。秦文韜等[7]基于Plasmoparaviticola細胞色素C氧化酶亞型2基因序列設計特異檢測引物,可以檢測出3.3 pg/μL的葡萄霜霉病菌DNA。劉艷等[8]基于P.manshurica的ITS區設計特異檢測引物,其檢測靈敏度可達到0.1 pg/μL大豆霜霉病菌DNA。Feng C.等[9]基于ITS區間設計了引物和Taqman熒光探針,成功從菠菜種子中檢出菠菜霜霉病菌(P.farinosaf.sp. Spinacia oleracea)。以上研究為建立P.farinosasp.beteaByford的快速檢疫和防控技術措施奠定了基礎。【本研究切入點】SYBR Green是一種小分子 DNA染料,游離時不會發射任何熒光信號,但當與雙鏈DNA特異地結合時,熒光染料摻入 DNA 雙鏈,發射出強烈的熒光信號,同時 PCR產物的特異性可以用熔解曲線分析進一步確認,利用SYBR Green這一特性建立的實時熒光PCR在植物病原菌檢測方面已廣泛應用。【擬解決的關鍵問題】研究利用SYBR GreenⅠ實時熒光PCR技術,對甜菜上的霜霉病菌進行快速篩查,獲得一種靈敏、簡便及快速的檢測方法,為進出口種子檢驗檢疫、病害防治預測提供科學依據。
1 材料與方法
1.1 材 料
1.1.1 供試病原菌
伊犁地區甜菜上采集的6種甜菜病原菌,其他5種霜霉病及健康甜菜葉片。表1
表1 供試病原菌及寄主
Table 1 The selected pathogen and host

編號NO.病原菌Pathogen寄主Host來源Source1甜菜霜霉病菌Peronosporafarinosef.sp.beteaByford甜菜Betavulgaris實驗室保存2甜菜蛇眼病菌Pleosporabetae(Bert)Ncvodovsky甜菜Betavulgaris實驗室保存3甜菜褐斑病菌CercosporabeticolaSacc.甜菜Betavulgaris實驗室保存4甜菜白粉病菌Erysiphebetae(Vanha)Weltziem.甜菜Betavulgaris實驗室保存5甜菜莖點霉根腐病菌PleosporabjoerlingiiByford甜菜Betavulgaris實驗室保存6甜菜黑斑病菌Alternariatenuis甜菜Betavulgaris伊犁職業技術學院7向日葵霜霉病菌Plasmoparahalstedii向日葵Helianthusannuus伊犁檢驗檢疫局8十字花科霜霉病菌Peronsporaparasitica蘿卜Daucuscarota實驗室保存9辣椒霜霉病菌Peronosporacapsici辣椒CapsicumannuumL.實驗室保存10葡萄霜霉病菌Plasmoparaviticola葡萄Vitisvinifera實驗室保存11大豆霜霉病菌Peronosporamanshurica大豆Glycinemax伊犁檢驗檢疫局
1.1.2 試劑
植物基因組提取試劑盒(TIANGEN BIOTECH公司,DP305-02);SuperReal PreMix( SYBR Green)(TIANGEN BIOTECH公司,FP204)。
1.1.3 供試引物
根據GenBank中P.farinosasp.beteaByford及其近似種的28S rDNA基因序列比對結果設計檢測引物PmDF(5'-TCTTGGTGGACTAGTCGTCG-3')/PmDR(5'-GAACGGCAACAAGTTAGAGTCTAC-3')。引物由上海生工生物技術有限公司合成。
1.1.4 主要儀器
LightCycle Roche 480熒光定量PCR儀(瑞士羅氏公司);ND-1000微量紫外分光光度計(美國Therme公司);AIIegra 25R高速冷凍離心機(美國貝克曼公司)。
1.2 方 法
1.2.1 DNA提取
P.farinosasp.beteaByford、Erysiphebetae(Vanha)Weltziem及其他5種霜霉病菌,參照Feng C.等[9]報道的方法提取DNA,研究中略有改動:用滅菌去離子水清洗感病葉片組織,將病菌孢子及菌絲洗下,再5 000 r/min離心10 min富集病原菌,后參照試劑盒操作(天根生物科技有限公司試劑盒,DP305-02)。其它菌株分離純化后挑取菌絲冷凍干燥用液氮研磨,取30 mg參照試劑盒提取DNA。 種子帶菌DNA提取參照喬志文等[10]報道的方法,研究略有改動:取甜菜種子50 g,加蒸餾水100 mL,200 r/min振蕩4 h,用雙層滅菌紗布過濾入滅菌試管中,5 000 r/min離心10 min富集病原菌,后參照試劑盒操作。表1
1.2.2 實時熒光PCR反應體系及程序
反應體系為25.0 μL:12.5 μL 2×SuperReal PreMix、10 μM PmDF/PmDR引物各1.0 μL、1.0 μL 模板DNA、RNase-free ddH2O 9.5 μL。PCR反應程序:95℃ 預變性15 min;然后以95℃ 10 s,60℃ 30 s(熒光信號收集),進行40個循環。
1.2.3 實時熒光PCR特異性檢測
按1.2.2實時熒光PCR反應體系及程序,對11個供試菌株DNA進行熒光PCR檢測,同時用健康甜菜植株DNA做陰性對照,對所建立的熒光PCR檢測體系的特異性進行評價。
1.2.4 熒光PCR靈敏度檢測
用核酸濃度測定儀ND-1000測定提取的甜菜霜霉病菌DNA濃度,標定至10.0 ng/μL,再按10倍梯度稀釋為1.0×106、1.0×105、1.0×104、1.0×103和1.0×102fg/μL,每個梯度重復3次,分別取1.0 μL DNA做模板進行實時熒光PCR檢測,并做空白對照。
2 結果與分析
2.1 特異性檢測
11個供試菌株熒光PCR特異性檢測結果顯示,僅供試菌株甜菜霜霉病菌出現熒光信號增加,表現為陽性擴增,而甜菜上的其他5種病菌都沒有檢測到熒光信號的增加,5種其他霜霉病菌也沒有檢測到熒光信號的增加,陰性對照甜菜健康植株DNA也沒有檢測到熒光信號增加,結果表現為陰性。研究所建立的檢測方法可以將P.farinosasp.beteaByford與甜菜上其他5種病原菌進行區分。圖1
2.2 靈敏度檢測
對梯度稀釋的甜菜霜霉病菌DNA進行實時熒光PCR靈敏度檢測,結果表明,當甜菜霜霉病菌DNA濃度稀釋到1.0×102fg/μL時,取1.0 μL DNA做模板仍可以檢測到熒光信號的增加,CT值在30~35,表現為陽性擴增,而空白對照沒有熒光信號增加。說明研究建立的實時熒光 PCR 的方法至少可檢測到甜菜霜霉病菌DNA 為100 fg。圖2
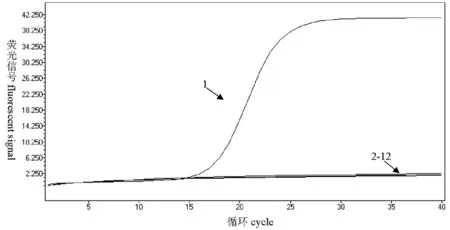
1:甜菜霜霉病菌;2~11:甜菜蛇眼病菌、甜菜褐斑病菌、甜菜白粉病菌、甜菜莖點霉根腐病菌、甜菜黑斑病菌、向日葵霜霉病菌、蘿卜霜霉病菌、辣椒霜霉病菌、葡萄霜霉病菌、大豆霜霉病菌;12:陰性對照
1:P.farinosef. sp. betea Byford;2-11:Pleosporabetae(Bert) Ncvodovsky,CercosporabeticolaSacc.,Erysiphebetae(Vanha)Weltziem,PleosporabjoerlingiiByford,Alternariatenuis,Plasmoparahalstedii,P.parasitica,P.capsici,Plasmoparaviticola,P.manshurica;12:Negative control
圖1 實時熒光PCR的特異性檢測
Fig.1 The detection specificity of real-time PCR
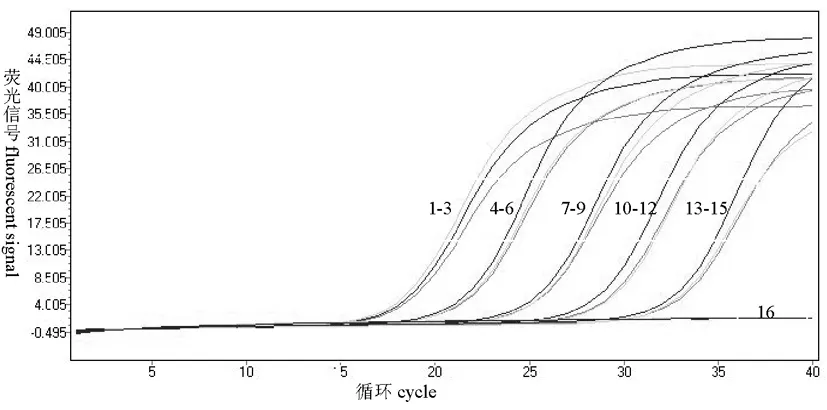
1~3:DNA濃度1.0×106fg/μL;4~6:1.0×105fg/μL;7~9:1.0×104fg/μL;10~12:1.0×103fg/μL;13~15:1.0×102fg/μL;16:空白對照
1-3:The concentration of DNA 1.0×106fg/μL;4-6:1.0×105fg/μL;7-9:1.0×104fg/μL;10-12:1.0×103fg/μL;13-15:1.0×102fg/μL;16:Blank control
圖2 實時熒光PCR的檢測靈敏度
Fig.2 The detection sensitivity of real-time PCR
2.3 樣品DNA的檢測
按照1.2.1中種子帶菌DNA提取方法,對伊犁地區田間采集的3份甜菜種子和進口的9份甜菜種子進行DNA提取,取1.0 μL作模板做實時熒光PCR檢測,檢測結果為樣品12-8和13-6出現熒光信號的增加,CT值均小于25,檢測結果為陽性;其它樣品及陰性對照沒有熒光信號增加,檢測結果判為陰性。熒光PCR檢測結果與田間實際監測及形態鑒定結果一致,田間調查及形態鑒定方法參照嚴進[4],乾義柯等[11]報道。表2
表2 甜菜種子樣品中P. farinosa sp. betea Byford檢測
Table 2 The detection of P. farinosa sp. betea Byford in beet seeds
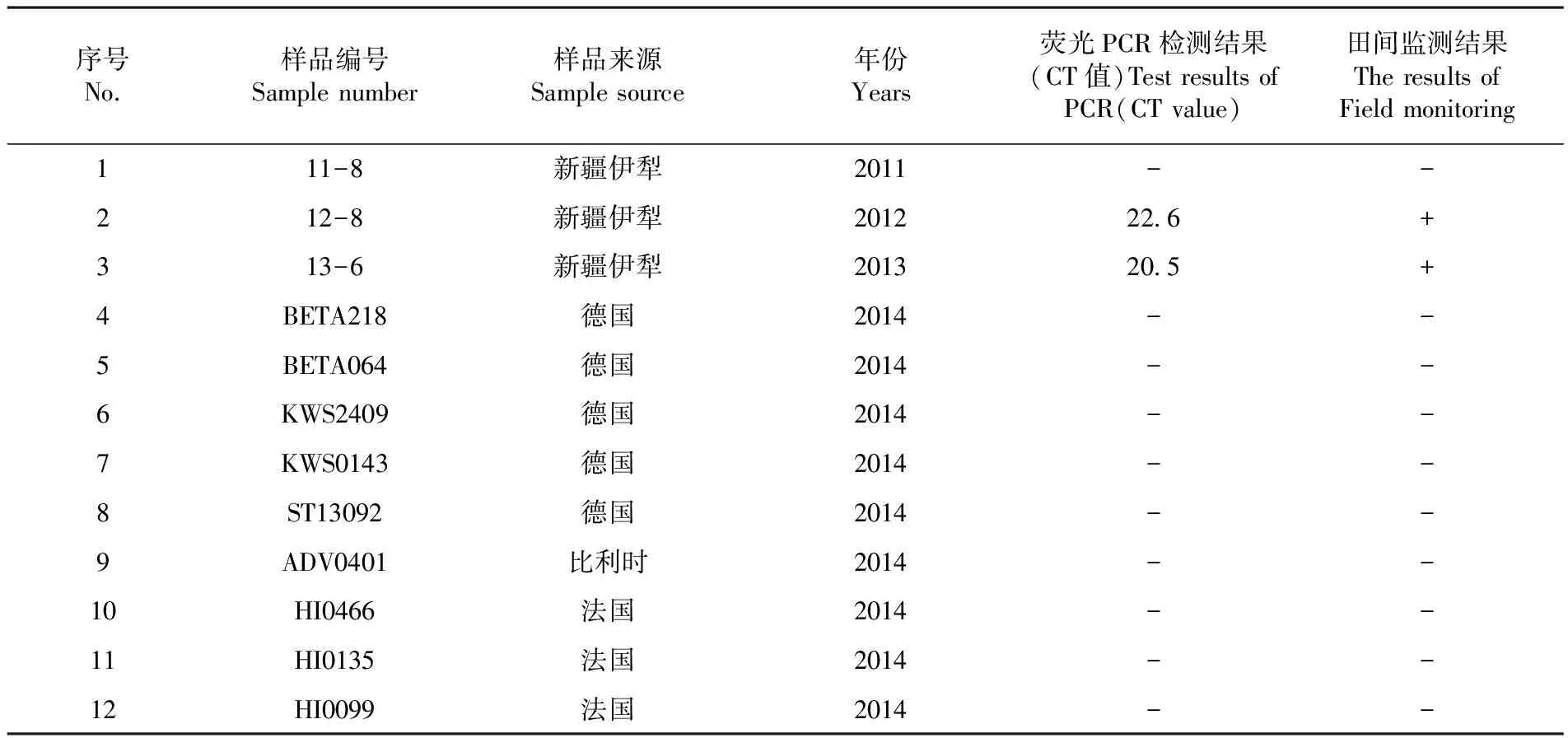
序號No.樣品編號Samplenumber樣品來源Samplesource年份Years熒光PCR檢測結果(CT值)TestresultsofPCR(CTvalue)田間監測結果TheresultsofFieldmonitoring111-8新疆伊犁2011--212-8新疆伊犁2012226+313-6新疆伊犁2013205+4BETA218德國2014--5BETA064德國2014--6KWS2409德國2014--7KWS0143德國2014--8ST13092德國2014--9ADV0401比利時2014--10HI0466法國2014--11HI0135法國2014--12HI0099法國2014--
注:“-”為陰性;“+”為陽性
Note:“-”negative;“+”positive
3 討 論
準確定義植物病原菌的分類是對其檢疫和防控的先決條件,只有準確定義病原菌的分類才能進一步評估其對作物的潛在威脅。乾義柯等[11]對新疆伊犁地區甜菜霜霉病菌28S rDNA序列進行測定及系統發育分析,從分子水平確認其為粉霜霉(P.farinose)。國外在P.farinosa的系統發育分類上做較為廣泛的研究,2007年Choi Y J等[12]對亞洲、歐洲、大洋洲等17個國家的58份P.farinosaf.sp. Spinacia oleracea進行了系統發育分析,研究結構證明P.farinosaf.sp. Spinacia oleracea形成一個明顯的單群系,認為菠菜霜霉病菌應該恢復以Peronosporaeffusa命名。2015年Choi Y J等[13]利用多基因系統發育和物種樹,結合形態學數據分析,證明甜菜和菠菜不同于其它藜科的霜霉病寄主,P.farinosasp.beteaByford是濱藜上一個獨立的物種,且很明顯只發生在甜菜上,甜菜霜霉(P.farinosasp.beteaByford)和菠菜霜霉(P.farinosaf.sp. Spinacia oleracea)應分別做為一個獨立物種。Testen A L等[14]利用PCR及測序技術對南美洲藜麥上霜霉病病原菌P.farinosaf.sp. Chenopodum quinoa進行了檢測,進一步證明了P.farinosaf.sp. Chenopodum quinoa的地理多樣性和宿主特異性[15-16]。基于以上研究,幾種P.farinosa在寄主專化型上的明顯差異,研究建立的方法主要針對甜菜上的P.farinosasp. betea Byford的檢測,對P.farinosasp.beteaByford的檢測特異性驗證主要以區分甜菜上5種真菌病害為主,同時在引物設計上兼顧寄主專化型基因間的差異,但還需收集更多霜霉病菌對其特異性進行廣泛驗證。
專性寄生菌不能像疫霉、炭疽病菌那樣可以獲得純培養,所以研究對感病葉片采用洗滌后離心富集方法提取DNA進行靈敏度試驗,靈敏度試驗表明所建立的SYBR GreenⅠ實時熒光PCR方法可以檢測出102fg/μL水平的基因組DNA,與Feng C.等[9]報道的利用熒光探針法對P.farinosaf.sp. Spinacia oleracea檢測靈敏度為 100 fg/μL DNA值一致。對種子帶菌進行檢測時,也采用洗滌后離心富集方法提取DNA,且實驗室檢測結果與田間實際監測結果一致,表明該檢測方法具有較強的適用性。
4 結 論
研究根據P.farinosa28S rDNA基因序列設計合成引物,建立的SYBR GreenⅠ實時熒光PCR方法可以區分甜菜上P.farinosasp.beteaByford與其它5種真菌病害,該方法檢測靈敏度可以達到102fg/μL水平的病原菌基因組DNA值。利用洗滌后離心富集方法提取DNA,可以對甜菜種子中霜霉病菌進行檢測,具有一定的適用性,在甜菜霜霉病菌的快速篩查、早期診斷和防控上具有一定的實踐意義。
References)
[1] 孫軍利, 趙寶龍, 樊新民. 新疆甜菜生產現狀及存在問題與解決對策[J]. 中國種業, 2008,(5):37-38.
SUN Jun-li, ZHAO Bao-long, FAN Xin-ming. (2008). Production status and problems and solutions on beet in Xingjiang [J].ChineseSeed, (5):37-38. (in Chinese)
[2] 查紅英, 孫長明. 新疆伊犁地區發現甜菜霜霉病[J]. 植物檢疫, 1996,(1):41-42.
ZHA Hong-ying, SUN Chang-ming. (1996),Peronosporafarinosaf. sp.beteaByford was found in Yili area of XingjianG [J].PlantQuarantine, (1):41-42. (in Chinese)
[3] 郭文超, 楊秀榮, 謝浩. 新疆甜菜霜霉病的初步研究[J]. 新疆農業科學, 1996,(3):127-129.
GUO Wen-chao, YANG Xiu-rong, XIE Hao. (1996). Preliminary study onPeronosporafarinosaf. sp.beteaByford in Xinjiang [J].XinjiangAgriculturalSciences, (3):127-129. (in Chinese)
[4] 嚴進. 甜菜霜霉病[J]. 植物檢疫, 1999,13(2):94-95.
YANG Jin. (1999).Peronosporafarinosaf. sp.beteaByford [J].PlantQuarantine, 13(2):94-95. (in Chinese)
[5] 胡白石, 翟圖娜, 孫長明, 等. 甜菜霜霉病研究初報[J]. 植物保護, 1999,(1):19-21.
HU Bai-shi, ZHAI Tu-na, SUN Chang-ming, et al. (1999). The first report onPeronosporafarinosaf. sp.beteaByford [J].PlantProtection, (1):19-21. (in Chinese)
[6] Ioos, R., Laugustin, L., Rose, S., Tourvieille, J., & Labrouhe, D. T. D. (2007). Development of a pcr test to detect the downy mildew causal agent plasmopara halstedii, in sunflower seeds.PlantPathology, 56(2):209-218.
[7] 秦文韜, 黃曉慶, 孔繁芳, 等. 葡萄霜霉病菌PCR檢測方法的建立與應用[J]. 植物保護, 2014,40(2):102-108.
QIN Wen-tao, HUANG Xiao-qing, KONG Fan-fang, et al. (2014). Establishment and application of PCR for detection ofPlasmoparaviticola[J].PlantProtection, 40(2):102-108. (in Chinese)
[8] 劉艷, 沙愛華, 陳海峰, 等. 大豆霜霉病菌rDNA ITS區的分子探針的設計與應用[J]. 華北農學報, 2012,27(2):230-233.
LIU Yan, SHA Ai-hua, CHEN Hai-feng, et al. ,(2012). Development and application of molecular probe of soybean downy mildew based onPeronosporamanshurica(Naoun.) sydow rDNA ITS [J].ActaAgriculturaeBoreali-Sinica, 27(2):230-233. (in Chinese)
[9] Feng, C., Mansouri, S., Bluhm, B. H., Toit, L. J. D., & Correll, J. C. (2014). Multiplex real‐time pcr assays for detection of four seedborne spinach pathogens.JournalofAppliedMicrobiology, 117(2):472-484.
[10] 喬志文, 韓英, 張振忠, 等. 甜菜種子帶銹病菌和褐斑病菌檢測方法的研究[J]. 中國糖料, 2002,21(3):21-23.
QIAO Zhi-wen, HAN Ying, ZHANG Zhen-zhong, et al. (2002). The examination method of seed with rust and leaf spot of sugar beet [J].SugarCropsofChina, 21(3):21-23. (in Chinese)
[11] 乾義柯, 張祥林, 克衣木, 等. 甜菜霜霉病菌形態鑒定及28S rDNA序列分析研究[J]. 新疆農業科學,2012,49(2):249 -254.
QIAN Yi-ke, ZHANG Xiang-lin, Keyimu, et al. (2012).Morphological detection and sequence analysis of 28S ribosomal DNA ofPeronosporafarinosaf. sp.beteaByford [J].XinjiangAgriculturalSciences, 49(2):249-254. (in Chinese)
[12] Choi, Y. J., Hong, S. B., & Shin, H. D. (2007). Re-consideration of peronospora farinosa, infecting spinacia oleracea, as distinct species, peronospora effusa.MycologicalResearch, 111(Pt 4):381-391.
[13] Choi, Y. J., Klosterman, S. J., Kummer, V., Voglmayr, H., Shin, H. D., & Thines, M. (2015). Multi-locus tree and species tree approaches toward resolving a complex clade of downy mildews (straminipila, oomycota), including pathogens of beet and spinach.MolecularPhylogenetics&Evolution, (86):24-34.
[14] Testen, A. L., Del, M. J. M., Ochoa, J. B., & Backman, P. A. (2014). Molecular detection of peronospora variabilis in quinoa seed and phylogeny of the quinoa downy mildew pathogen in south america and the united states.Phytopathology, 104(4):379-386.
[15] Danielsen, S., & Lübeck, M. (2010). Universally primed-pcr indicates geographical variation of peronospora farinosa ex. chenopodium quinoa.JournalofBasicMicrobiology, 50(1):104-109.
[16] Danielsen, S. (2001). Heterothallism in peronospora farinosa, f.sp. chenopodii, the causal agent of downy mildew of quinoa ( chenopodium quinoa ).JournalofBasicMicrobiology, 41(41):305-308.
Fund project:Supported by science and technology research projects of Yili Teachers'University (2013YSYB13) and national public welfare industry (quality control) research project (201310091)
Detection of Peronospora farinosa sp. betea Byford by Real-time PCR
ZHANG Na1, QIAN Yi-ke2, WEI Shuang3, ZHANG Wei1, JIAO Zi-wei1, ZHANG Xiang-lin4
(1. College of Biology and Geography, Yili Normal University, Yining Xinjiang 835000, China;2.YiliEntry-ExitInspectionandQuarantineBureau,YiningXinjiang835000,China;3.ShantouEntry-ExitInspectionandQuarantineBureau,ShantouGuangdong515041,China;4.XinjiangEntry-ExitInspectionandQuarantineBureau,Urumqi830052,China)
【Objective】 The objective of this study is to develop a SYBR GreenⅠreal-time PCR for the detection ofPeronosporafarinosaf. sp.beteaByford rapidly.【Method】The real-time PCR primers were designed based on the reported 28S rDNA gene sequences ofP.farinosasp.beteaByford and similar species. Totally 6 pathogens of beet and other 5 pathogens and 12 samples of beet seeds were screened to test the specificity and sensitivity and applicability in this assay.【Result】The SYBR GreenⅠreal-time PCR assay could detect positive amplification fromP.farinosaf. sp.beteaByford only, negative results from other pathogens and negative control, and more than 100 fg genomic DNA ofP.farinosasp.beteaByford could be detected. The 12 samples of beet seeds from different sources were detected by this assay, suggesting that the results were consistent with the field monitoring results.【Conclusion】This assay can detectP.farinosasp.beteaByford rapidly, and offer a technology to early diagnosis and controlP.farinosasp.beteaByford.
Peronosporafarinosasp.beteaByford;Real-Time PCR;detection
10.6048/j.issn.1001-4330.2016.11.015
2016-04-13
伊犁師范學院科研項目(2013YSYB13);國家公益性行業(質檢)科研項目(201310091)
張娜(1983-),女,山西翼城人,實驗師,研究方向為植物保護,(E-mail)yucixue@163.com
張祥林(1964-),男,新疆烏魯木齊人,研究員,碩士生導師,研究方向為植物檢疫,(E-mail)xl6479@163.com
S432.1
A
1001-4330(2016)11-2077-06

