桃花中黃酮含量的測定及超聲波輔助下提取工藝優化

摘要:為建立測定桃花中黃酮含量的紫外分光光度法和探索超聲波輔助下黃酮最佳提取工藝條件,以槲皮素為標準品,用紫外可見分光光度計UV-2450進行黃酮含量測定,測定波長為372 nm;通過單因素試驗和正交試驗,優化超聲波下提取桃花中黃酮的最佳工藝。結果表明,槲皮素的回歸曲線方程為D=11.625C+0.028,在0.004~0.048 mg/mL 線性關系良好,相關系數為r=0.999 7,桃花中黃酮含量為5.24%;最佳工藝條件:超聲功率為80 W,料液比為1 g ∶20 mL,乙醇體積分數為60%;超聲波時間為75 min。由結果可知:以槲皮素為對照品,用紫外可見分光光度計測定桃花中黃酮含量操作簡便,準確性好;用超聲波輔助法提取桃花中黃酮工藝簡單,提取率高。
關鍵詞:桃花;紫外分光光度法;黃酮;含量測定;提取工藝
中圖分類號: R284.2 文獻標志碼: A
文章編號:1002-1302(2016)09-0329-03
桃花是薔薇科落葉喬木——桃樹的花,無論是中醫經典著作,還是在民間的實踐經驗方面,都認為桃花具有較好的藥用和食療價值,如最早的藥學專著《神農本草經》里就提到桃花具有“令人好顏色”之功效;李時珍在《本草綱目》中記載:“桃花,性走泄下降,利大腸甚快,用以制氣室入病水飲腫滿,積滯、大小便閉塞者,則有功無害,若久服即耗人陰血,損元氣”“桃花,性平無毒,活血利水;可輕身,令人好顏”;現代醫學研究表明:桃花具有廣泛的藥理活性,能疏通經絡,擴張末稍毛細血管、改善血液循環,促進皮膚營養和氧供給,滋潤皮膚、防止色素在皮膚內慢性沉積,有效地清除體表中的黃褐斑、雀斑、黑斑等功效[1-2]。研究表明,桃花中含有山奈酚、多糖、黃酮等成分[3]。黃酮類化合物具有抗腫瘤、抗炎鎮痛、免疫調節、降血糖、治療骨質疏松、抗輻射等多種藥理作用[4-8]。本試驗通過對桃花中黃酮含量測定方法和提取工藝進行探索,為進一步研究桃花的藥理和開發桃花的藥用價值提供參考。
1 材料與方法
1.1 材料與試劑
桃花(采于寧夏固原市原州區寧夏師范學院校園),將所采桃花樣品用蒸餾水洗凈,瀝干,放入恒溫箱中,在60 ℃烘干至恒質量,自然陰干、粉碎,作為供試樣品。槲皮素標準(上海源葉生物科技有限公司提供,批號:20121113,質量分數98%)、無水乙醇、亞硝酸鈉、硝酸鋁、氫氧化鈉,均為分析純。
1.2 主要試驗儀器
SK300LHC超聲波清洗器(上海科導超聲儀器有限公司);UV-2450型紫外可見分光光度計(日本島津);FA2204B電子天平(上海精科天美科學儀器有限公司)。
1.3 方法
1.3.1 槲皮素標準曲線的建立
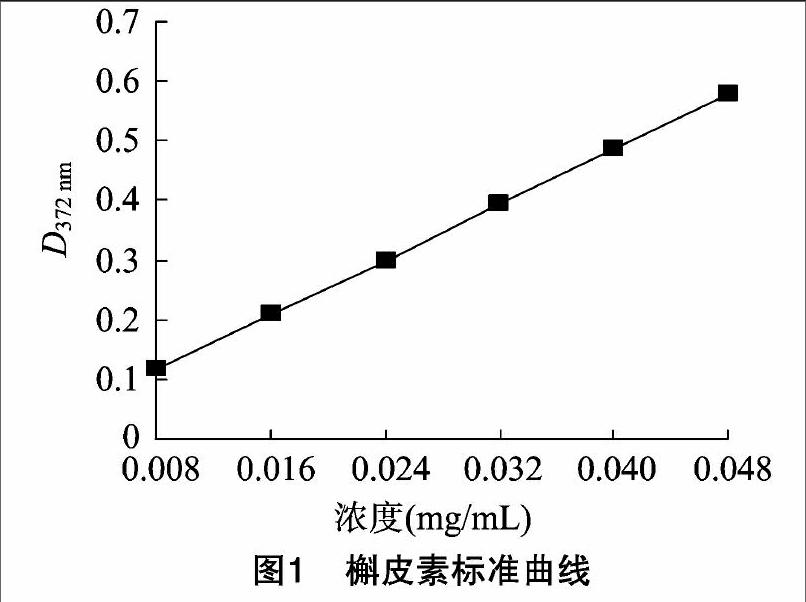
用電子天平準確稱取120℃干燥至恒質量的槲皮素對照品5.0 mg,置于25 mL容量瓶中,加體積分數為60%的乙醇至刻度,搖勻,轉移至棕色試劑瓶中,即得槲皮素儲備液(0.2 mg/mL)。分別吸取槲皮素儲備液0、1、2、3、4、5、6 mL移入25 mL容量瓶中,加體積分數為90%乙醇補至6 mL;分別加1 mL 5%亞硝酸鈉混勻,放置6 min,加1 mL 10% 硝酸鋁溶液搖勻,放置6 min,加10 mL 4%氫氧化鈉溶液,再加體積分數為60%乙醇至刻度,搖勻,放置15 min。以試劑作空白參比液,在250~600 nm波長范圍內進行光譜掃描,發現最大吸收波長為372 nm,在372 nm下測吸光度,以槲皮素濃度(C)為橫坐標、吸光度(D)為縱坐標建立標準曲線(圖1),得回歸方程:D=11.625C+0.028,r=0.999 7,表明在0.008~0.048 mg/mL濃度內與吸光度具有良好的線性關系。
1.3.2 桃花中黃酮的提取
準確稱取適量預處理過的桃花樣品,按一定的乙醇體積分數、料液比浸潤30 min,在一定的功率下,超聲波處理數分鐘,浸提過濾,將濾渣在同樣條件下再浸提1次,合并2次所得濾液,將濾液轉移到100 mL容量瓶中,用90%乙醇定容至刻度,作為供試液待測。
1.3.3 桃花中黃酮含量的測定
準確移取1 mL提取黃酮樣品液置于25 mL容量瓶中,參照槲皮素對照品標準曲線溶液的方法配制樣品溶液,并定容至25 mL,在372 nm下測樣品的吸光度,相關公式:
黃酮的提取量(g/mL)=稀釋倍數×10-3×黃酮濃度(mg/mL)×100 mL;
黃酮含量=黃酮的提取量×100 mL/桃花樣品質量×100%。
1.3.4 精密度試驗
準確稱取1.00 g預處理的桃花樣品,加入體積分數為60%的乙醇20 mL浸潤30 min,在功率80 W下,超聲處理60 min,精確吸取提取液1 mL,置于25 mL容量瓶中,參照槲皮素對照品標準曲線溶液的方法配制樣品溶液,并定容至25 mL,以試劑作空白參比液,在372 nm下測其吸光度。連續測定6次,RSD=0.61%,表明該試驗方法精密度較好。
1.3.5 穩定性試驗
取“1.3.4”節所得黃酮提取液1 mL,以試劑作空白參比液,每隔30 min,在372 nm處測其吸光度,連續測定6次,RSD=0.46%,表明提取液在3 h內較穩定。
1.3.6 重復性試驗
準確稱取預處理的桃花樣品1 g,按“1.3.4”節方法平行制備3份黃酮提取液,并按“1.3.5”節方法試驗,RSD=0.28%,說明該方法重復性較好。
1.3.7 加樣回收率試驗
取6份已知黃酮含量(5.24%)的桃花樣品0.2 g,分別精密加入低、中、高濃度的槲皮素對照品,用體積分數60%的乙醇,料液比1 g ∶20 mL浸潤30 min,固定超聲功率80 W,超聲時間60 min,制備供試樣品溶液。準確取供試溶液1 mL,置于5 mL容量瓶中,并按照槲皮素對照品標準曲線溶液的方法顯色,在372 nm處測定吸光度,平均回收率為101.62%,RSD=1.63%。
1.3.8 桃花中黃酮提取工藝優化
利用單因素試驗法分別考察溶劑體積分數、料液比、超聲波功率和超聲波時間4個因素對黃酮提取率的影響。同時為了綜合考察多因素對提取過程中提取率的影響,采用4因素3水平正交試驗對提取過程中溶劑體積分數(A)、料液比(B)、超聲時間(C)和超聲功率(D)進行研究。
2 結果與分析
2.1 單因素對桃花中黃酮提取率的影響
2.1.1 溶劑體積分數對黃酮提取率的影響 準確稱取預處理過的桃花樣品1.00 g,各4份,分別用體積分數為20%、40%、60%、80%乙醇,料液比為1 g ∶10 mL浸潤30 min,然后在超聲波功率80 W、超聲波時間60 min條件下進行試驗。黃酮的提取率分別為4.13%、4.24%、4.56%、4.29%。結果表明,試驗開始隨著乙醇體積分數的增大,桃花中黃酮的提取率也隨之增大。原因可能是隨著乙醇體積分數增加,黃酮類化合物的溶解度隨之增大,當乙醇體積分數為60%時達到最大值;隨后,隨乙醇體積分數的升高,提取率開始逐漸降低,可能是較大體積分數的乙醇會使細胞內蛋白質凝固,黃酮類化合物難以溶出,綜合結果,提取率又開始降低。綜合結果,確定提取桃花中黃酮最佳的乙醇體積分數為60%。
2.1.2 料液比對黃酮提取率的影響 準確稱取預處理過的桃花樣品1.00 g,各4份,固定乙醇的體積分數為60%,按料液比為1 g ∶10 mL、1 g ∶15 mL、1 g ∶20 mL、1 g ∶25 mL浸潤30 min,然后在超聲波功率80 W、超聲波時間為60 min條件下進行試驗,黃酮的提取率依次為3.35%、3.52%、4.38%、4.02%。試驗表明,桃花中黃酮的提取率開始隨著料液比的增大而提高,但當料液比大于1 g ∶20 mL時,黃酮的提取率開始下降。這可能是因為料液比越大,溶劑與原料接觸越充分,兩者的傳質作用增強,黃酮的提取率升高。但當料液比大于1 g ∶20 mL時,隨著料液比的增大,提取物中雜質會增加,而這些雜質會吸附部分黃酮,造成黃酮損失,提取率下降。因此確定1 g ∶20 mL是桃花中黃酮提取最佳的料液比。
2.1.3 超聲波時間對黃酮提取率的影響 準確稱取桃花樣品1.00 g,各4份,固定乙醇的體積分數為60%、料液比為1 g ∶20 mL 浸潤30 min,超聲波功率80 W,依次在超聲波時間為30、45、60、75 min下進行試驗,黃酮的提取率依次為4.29%、4.43%、4.62%、4.63%。試驗結果表明,黃酮的提取率隨著超聲時間的增加而提高,這是由于隨著超聲時間的延長,黃酮被萃取的程度增大,當超聲時間大于60 min時,隨著超聲時間的再增加,提取率增大的趨勢明顯趨于緩慢,為了節約時間,確定60 min是超聲波的適宜時間。
2.1.4 超聲功率對黃酮提取率的影響 準確稱取桃花樣品1.00 g,各4份,固定乙醇的體積分數為60%,料液比為1 g ∶20 mL 浸潤30 min,超聲時間60 min,依次在超聲功率為40、60、80、100 W下進行試驗,黃酮的提取率依次為4.14%、4.28%、4.72%、4.64%。試驗結果表明,隨著超聲功率的升高,黃酮的提取率先升高后降低,在80W時黃酮的提取率達到最大值。這可能是隨著超聲功率的增大,對細胞壁的破碎作用加強,在加速黃酮溶解的同時雜質的溶解量也在增大,由于雜質對黃酮的吸附,黃酮的提取率沒有提高反而下降。故確定提取桃花中黃酮適宜的超聲功率為80 W。
2.2 多因素對桃花中黃酮提取率的影響
根據單因素試驗結果確定各因素的合理水平見表1,本試驗為3水平4因素的試驗,故選用L9(34)正交表安排試驗,試驗方案及結果見表2。
表2直觀分析表明,影響超聲波輔助下桃花中黃酮提取的主要因素是乙醇的體積分數,影響因素大小依次為A>D>C>B,即乙醇體積分數>超聲波功率>超聲波時間>料液比,最佳工藝條件是A2B2C3D2。
方差分析結果表明,溶劑體積分數和超聲功率是超聲波提取桃花中黃酮主要的影響因素,而料液比和超聲波時間對提取率影響不明顯(表3)。因此,在提取過程中應該控制好乙醇的體積分數和超聲波功率,而可以適當減少超聲波時間,降低料液比。
2.3 驗證性試驗
稱取適量預處理過的桃花樣品,在正交試驗所得優化提取工藝條件下進行驗證試驗,黃酮的得率為5.24%(n=3)。
3 結論
試驗表明,以槲皮素為對照品,用紫外可見分光光度法測定桃花中黃酮的含量操作簡便,加樣平均回收率為101.62%,穩定性、重復性好、精密度和準確度高。
用超聲波輔助法提取桃花中黃酮工藝簡單,提取率高,根據直觀分析和方差分析結果,綜合考慮超聲波輔助法提取桃花中黃酮的最佳工藝條件:乙醇的體積分數60%,料液比1 g ∶20 mL,超聲時間60 min,超聲功率80 W。
試驗表明,桃花中黃酮含量較高,可以作為提取黃酮的原料之一。通過對桃花中黃酮提取工藝的探索,既為提取桃花中黃酮積累了經驗,同時又為進一步開發桃花的藥用價值和經濟價值奠定了基礎。
參考文獻:
[1]馬建中,張有成,徐小東,等. 桃花的藥用價值研究[J]. 中藥學報,2013,28(7):1020-1022.
[2]Kim Y H ,Yang H E,Park B K,et al. The extract of the flowers of Prunus persica,a new cosmetic ingredient,protects against solar ultraviolet-induced skin damage in vivo[J]. J Cosmet Sci,2002,53(1):27-34.[HJ1.65mm]
[3]Takagi S,Yamaki M,Masuda K,et al. Studies on the purgative clrugs.Ⅲ.On the constituents of the flowers of Prunus persica Batsch[J]. Yakugaku Zasshi,1977,97(1):109-110.
[4]黃河勝,馬傳庚,陳志武. 黃酮類化合物藥理作用研究進展[J]. 中國中藥雜志,2000,25(10):589-5921.
[5]董蒙蒙,喻 樊,劉 佳,等. 中華91、血草5種黃酮類化合物抗氧化和抗腫瘤活性的比較[J]. 江蘇農業科學,2015,43(2):297-299.
[6]張 睿,徐雅琴,時 陽. 黃酮類化合物提取工藝研究[J]. 食品與機械,2003,19(1):21-22.
[7]伏勁松,王 博,蔡光華,等. 香柏總黃酮的提取工藝優化[J]. 食品科學,2011,27(2):3-5.
[8]梁 萱,趙建軍,梁永鋒. 金銀花中黃酮提取工藝研究及野生與人工種植金銀花中黃酮含量比較[J]. 中南藥學,2013,11(3):173-175.

