雙吡啶吡咯Cu(Ⅱ)配合物與DNA相互作用研究
馬 立, 易小藝, 張壽春
(中南大學(xué) 化學(xué)化工學(xué)院, 長(zhǎng)沙 410083)
?
雙吡啶吡咯Cu(Ⅱ)配合物與DNA相互作用研究
馬 立, 易小藝, 張壽春*
(中南大學(xué) 化學(xué)化工學(xué)院, 長(zhǎng)沙 410083)
合成了1種單核雙吡啶吡咯Cu(Ⅱ)配合物[Cu(PDPH)2] (1),其中配體HPDPH為2,5-二(2′-吡啶基)吡咯.該配合物晶體屬于單斜晶系,空間群為C2/c,a=39.1242(16) ?,b=8.6574(5) ?,c=33.7687(14) ?,β=123.0305(16)°,中心離子Cu2+處于變形八面體配位環(huán)境.采用紫外-可見(jiàn)光譜、熒光光譜及圓二色譜等方法,分別研究了單核配合物[Cu(PDPH)2] (1)、雙核配合物[Cu2(PDPH)2(NO3)2] (2)和多聚配合物{[Cu2(PDPH)2(N3)2]}n(3)與DNA之間的相互作用.結(jié)果表明,3個(gè)Cu(Ⅱ)配合物均以溝面鍵合方式與CT-DNA結(jié)合,其結(jié)合強(qiáng)弱順序?yàn)? > 2 > 1.此外,采用凝膠電泳法研究了3種Cu(Ⅱ)配合物對(duì)超螺旋pBR322 DNA的切割作用.結(jié)果表明,3種配合物均能將pBR322 DNA切割為開(kāi)口缺刻型或者線型DNA,表現(xiàn)出良好的切割活性.
銅配合物; 雙吡啶吡咯配體; DNA鍵合; DNA切割
自上世紀(jì)70年代順鉑被發(fā)現(xiàn)具有抗腫瘤活性并成功應(yīng)用于臨床以來(lái),小分子金屬配合物作為抗癌藥研究成為經(jīng)久不衰的熱門研究課題[1-2].DNA是生物的基本遺傳物質(zhì)和遺傳信息的載體,在前藥研究中,DNA常作為抗腫瘤藥、抗菌藥、抗病毒藥等研究的重要靶點(diǎn).小分子過(guò)渡金屬配合物與DNA的相互作用研究是無(wú)機(jī)化學(xué)和生物學(xué)交叉的研究領(lǐng)域,通過(guò)它們相互作用研究有助于從分子水平上理解某些疾病的發(fā)病機(jī)理,也可以通過(guò)分子設(shè)計(jì)來(lái)尋找新的有效的治療藥物.
銅是人體一種必需的元素,在人體許多生理過(guò)程中發(fā)揮著重要作用.研究表明,許多銅配合物能夠與DNA之間發(fā)生鍵合,并能夠有效地切割DNA[3-7].研究表明,具有大環(huán)芳香結(jié)構(gòu)的配合物可以更好地插入DNA堿基對(duì),從而使配合物與DNA的結(jié)合能力增強(qiáng)[8-9].本課題組報(bào)道了多種含大環(huán)芳香結(jié)構(gòu)配體菲咯啉或其衍生物的銅配合物具有很好的DNA結(jié)合能力與切割活性[10-12].此外,有課題組研究了系列三聯(lián)吡啶銅配合物(Cu-terpy)可通過(guò)嵌入或溝面鍵合的方式與DNA結(jié)合[13-15].
本文利用紫外-可見(jiàn)光譜、熒光光譜及圓二色譜等方法,考察了與三聯(lián)吡啶結(jié)構(gòu)相似的雙吡啶吡咯化合物為配體的幾種銅配合物與DNA之間的相互作用,并通過(guò)凝膠電泳法研究了配合物對(duì)超螺旋DNA的切割能力.
1 實(shí)驗(yàn)部分
1.1試劑與儀器
小牛胸腺DNA(CT-DNA)、瓊脂糖(agarose)、溴化乙錠(EB)、三羥甲基氨基甲烷(Tris)和抗壞血酸(H2A)均購(gòu)自Sigma,超螺旋pBR322 DNA購(gòu)自寶生物工程(大連)有限公司.其它試劑均為分析純,用前未作進(jìn)一步處理.紫外-可見(jiàn)光譜用UV-2450紫外-可見(jiàn)分光光度計(jì)測(cè)定,熒光光譜用Hitachi F4600熒光光譜儀測(cè)定,圓二色譜(CD)用Jasco J-815圓二色譜儀測(cè)定,凝膠電泳實(shí)驗(yàn)用北京六一DYY6C電泳儀測(cè)定.
1.2配合物的合成
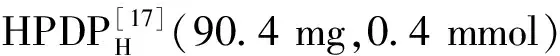
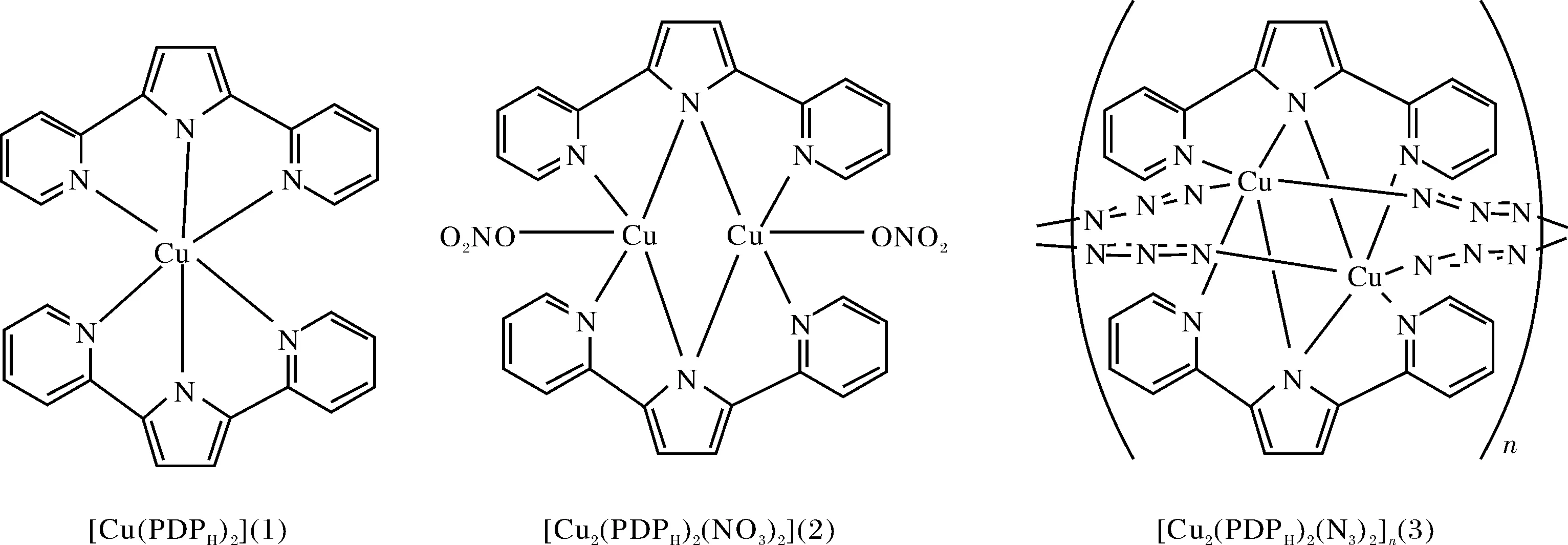
圖1 雙吡啶吡咯銅(Ⅱ)配合物1~3 的結(jié)構(gòu)圖Fig.1 Structures of the dipyridylpyrrole copper(Ⅱ) complexes 1~3
配合物2和配合物3均根據(jù)本課題組以前發(fā)表的論文中的方法合成[18].
1.3晶體結(jié)構(gòu)測(cè)定
配合物1的晶體結(jié)構(gòu)是用Bruker SMART APEX 1000 CCD單晶衍射儀進(jìn)行測(cè)量.將測(cè)試樣品置于X射線單晶衍射儀上,使用石墨單色器單色化的Mo-Kα射線(λ=0.71073 ?),在296 K的溫度下,掃描收集配合物的晶體衍射數(shù)據(jù).收集到的數(shù)據(jù)通過(guò)SAINT軟件處理,SADABS進(jìn)行吸收矯正處理,由SHELXTL-97軟件利用直接法解出,從而得到確定的晶體結(jié)構(gòu),所有非氫原子坐標(biāo)通過(guò)各向異性參數(shù)確定,有機(jī)配體的氫原子位置使用理論加氫得到,配合物結(jié)構(gòu)的各向異性參數(shù)進(jìn)行全矩陣最小二乘法修正.配合物的詳細(xì)晶體學(xué)數(shù)據(jù)列于表1中.劍橋晶體數(shù)據(jù)中心(CCDC)數(shù)據(jù)編號(hào):1474009.
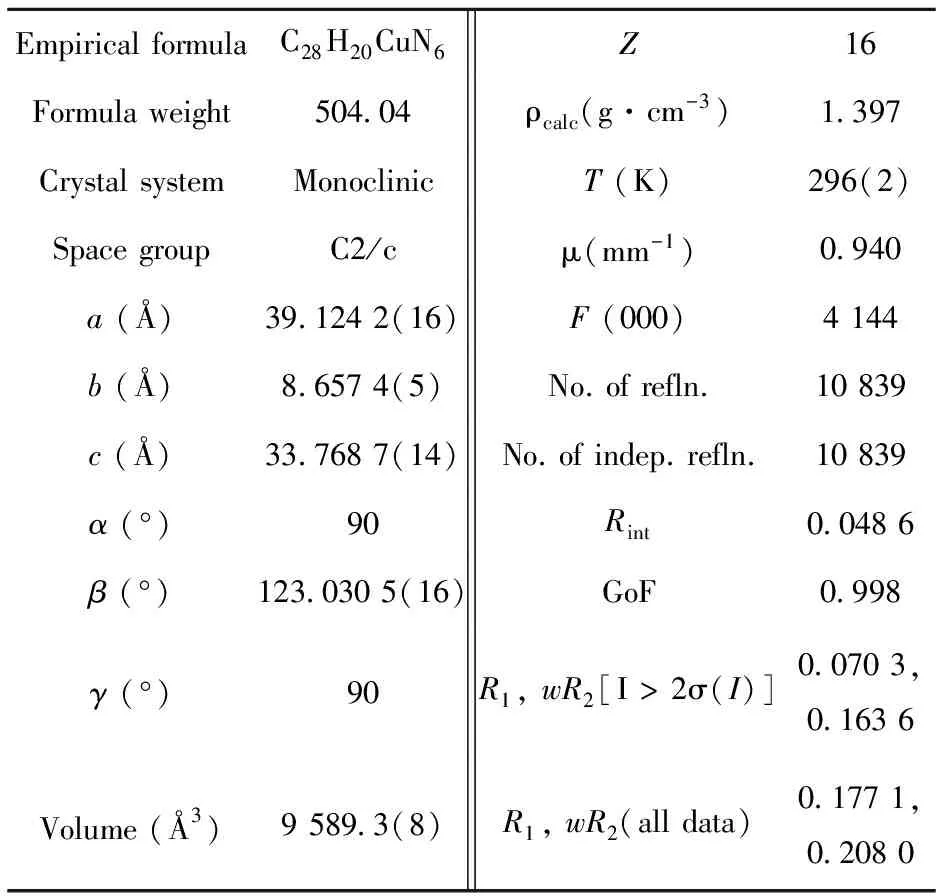
表1 配合物[Cu(PDPH)2] (1)的晶體學(xué)數(shù)據(jù)
1.4配合物與DNA相互作用
1.4.1紫外-可見(jiàn)光譜 用pH 為7.2的5.0 mmol·L-1Tris-HCl/50 mmol·L-1NaCl 的緩沖溶液溶解一定量的CT-DNA,測(cè)定該DNA溶液的紫外吸收光譜,并計(jì)算其在260 nm和280 nm處的吸光度比值為1.82,表明該CT-DNA中不含蛋白質(zhì)[19].DNA溶液的濃度通過(guò)測(cè)定在260 nm處的吸光度來(lái)確定(DNA在260 nm處的摩爾吸光系數(shù)為6 600 L·mol-1·cm-1).配制3.0×10-5mol·L-1的3種銅(Ⅱ)配合物溶液,將DNA溶液按一定比例(r=0.00,0.05,0.10,0.15,0.20,0.25,0.30,0.35,r為DNA與配合物的物質(zhì)的量之比)加入其中,在紫外-可見(jiàn)分光光度計(jì)上測(cè)定配合物溶液的紫外-可見(jiàn)光譜變化.通過(guò)以下公式計(jì)算出配合物與DNA的結(jié)合常數(shù)Kb[20].
[DNA]/(εa-εf)=[DNA]/(εb-εf)+
1/kb(εb-εf),
其中,εa表示配合物的表觀摩爾吸光系數(shù),其值為Aobsd/ccomplex,εb表示配合物與DNA完全結(jié)合后的摩爾吸光系數(shù),εf為純配合物的摩爾吸光系數(shù).以[DNA]/(εb-εf)對(duì)[DNA]作圖,得到的直線斜率和截距的比值即為結(jié)合常數(shù)Kb.1.4.2熒光光譜 用pH為7.2的5.0 mmol·L-1Tris-HCl/50 mmol·L-1NaCl 的緩沖溶液溶解配合物,配制成濃度為6.0×10-4mol·L-1的溶液,然后將配合物溶液慢慢滴加到含有1.0×10-5mol·L-1EB和1.0×10-4mol·L-1CT-DNA的混合溶液中,在室溫下,分別測(cè)定每次加樣后的熒光光譜(激發(fā)波長(zhǎng)為530 nm,發(fā)射波長(zhǎng)為600 nm).
1.4.3CD光譜 取3 mL 1.0×10-4mol·L-1的CT-DNA溶液,按r=0.00,0.05,0.10,0.15(r為配合物和DNA的物質(zhì)量之比)的比例分別加入一定量的3.0×10-5mol·L-1的配合物溶液,在圓二色譜儀上設(shè)定波長(zhǎng)220~320 nm,掃描速度10 nm/min,數(shù)據(jù)記錄間隔0.1 nm,分別測(cè)定這幾組溶液的CD曲線,樣品測(cè)試前需要先拿Tris緩沖液作為參比液掃描基線.
1.4.4凝膠電泳實(shí)驗(yàn) 將配合物按照不同的濃度與pBR322 DNA混合,然后在配好的樣品中分別加入1 μL抗壞血酸(H2A),在37 ℃、pH為7.4條件下恒溫水浴1 h.加入2 μL的上樣緩沖液(30 mmol·L-1EDTA,36%丙三醇,0.05%溴酚藍(lán))終止反應(yīng).利用EB染色的1.0%瓊脂糖電泳分析切割結(jié)果.電泳液為TAE緩沖液(40 mol·L-1Tris-HAc/1 mmol·L-1EDTA ),電泳圖用UVP凝膠成像系統(tǒng)分析.
2 結(jié)果與討論
2.1晶體結(jié)構(gòu)
配合物[Cu(PDPH)2]的晶體結(jié)構(gòu)如圖2所示,其主要鍵長(zhǎng)和鍵角列于表2.該配合物分子由1個(gè)金屬中心Cu2+離子和2個(gè)PDPH配體鍵合而成,Cu2+中心處于六配位的畸變八面體構(gòu)型的配位環(huán)境中,其中2個(gè)PDPH配體吡啶環(huán)上氮原子N(1)、N(3)、N(5)、N(6)位于赤道平面,鍵角分別為
N(3)-Cu(1)-N(1) (150.16(17)°)和N(6)-Cu(1)-N(5) (150.43(16)°)均小于180°,2個(gè)PDPH配體吡咯環(huán)上氮原子N(2)和N(4)占據(jù)2個(gè)極軸上的頂點(diǎn),與中心原子Cu構(gòu)成的鍵角N(4)-Cu(1)-N(2)為176.5(2)°,也偏離180°,這與已經(jīng)報(bào)道的三聯(lián)吡啶銅配合物[Cu(terpy)2]2+的結(jié)構(gòu)非常相似[21].兩個(gè)吡咯N原子與中心Cu2+離子間的鍵長(zhǎng)比四個(gè)吡啶N原子與中心Cu2+離子間的鍵長(zhǎng)明顯更短,說(shuō)明在該配合物中,中心Cu2+離子與吡咯N原子的相互作用能力強(qiáng)于吡啶N原子.
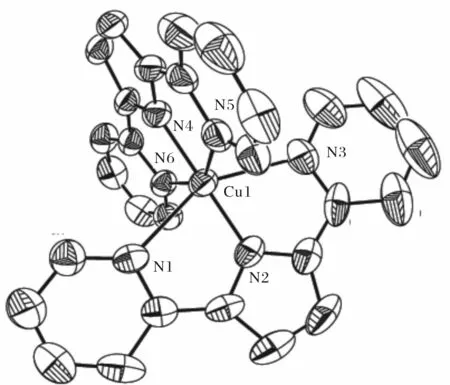
圖2 配合物[Cu(PDPH)2](1)的分子結(jié)構(gòu)圖(為清晰可見(jiàn),分子中氫原子已被省略掉)Fig.2 The molecular structure of complex[Cu(PDPH)2] (1)

Cu(1)-N(1)2349(4)Cu(1)-N(2)1861(4)Cu(1)-N(3)2315(4)Cu(1)-N(4)1874(4)Cu(1)-N(5)2365(5)Cu(1)-N(6)2268(5)N(1)-Cu(1)-N(5)9028(15)N(2)-Cu(1)-N(1)7466(19)N(2)-Cu(1)-N(3)7554(19)N(2)-Cu(1)-N(4)1765(2)N(2)-Cu(1)-N(5)10913(18)N(2)-Cu(1)-N(6)10044(18)N(3)-Cu(1)-N(1)15016(17)N(3)-Cu(1)-N(5)9791(15)N(4)-Cu(1)-N(1)10704(18)N(4)-Cu(1)-N(3)10280(17)N(4)-Cu(1)-N(5)7404(19)N(4)-Cu(1)-N(6)764(2)N(6)-Cu(1)-N(1)9804(16)N(6)-Cu(1)-N(3)8888(15)N(6)-Cu(1)-N(5)15043(16)
2.2紫外-可見(jiàn)光譜
金屬配合物與DNA作用前后紫外-可見(jiàn)吸收譜帶的位置及強(qiáng)弱會(huì)發(fā)生一定程度的變化,不同的作用方式對(duì)應(yīng)著特定的譜帶變化規(guī)律,據(jù)此可以判斷二者的相互作用方式.研究表明,金屬配合物中加入DNA后,配合物與DNA分子發(fā)生嵌插作用會(huì)造成其紫外-可見(jiàn)光譜的吸收峰強(qiáng)度減小(減色效應(yīng)),且吸收峰位置顯著紅移[22-23].本實(shí)驗(yàn)中的3個(gè)銅(Ⅱ)配合物中芳香環(huán)之間的π-π躍遷以及金屬中心與配體之間的電荷遷移躍遷能夠在紫外可見(jiàn)區(qū)域形成強(qiáng)烈的電子吸收譜帶.配合物與CT-DNA相互作用的紫外-可見(jiàn)光譜如圖3所示.隨著配合物中CT-DNA濃度的逐漸升高,配合物的吸收強(qiáng)度均逐漸減弱(減色效應(yīng)).配合物1~配合物3在388 nm處的減色率分別為20.48%,22.77%和27.31%,且未見(jiàn)明顯的紅移,說(shuō)明該3個(gè)銅(Ⅱ)配合物不是通過(guò)經(jīng)典的插入方式與DNA發(fā)生相互作用.配合物1~配合物3與CT-DNA的結(jié)合常數(shù)Kb分別為4.8×104L·mol-1,5.01×104L·mol-1和5.61×104L·mol-1,均低于經(jīng)典插入試劑EB的結(jié)合常數(shù)1.0×106L·mol-1[24].說(shuō)明3個(gè)銅(Ⅱ)配合物與DNA的鍵合作用較EB要弱,可能是通過(guò)非經(jīng)典嵌入方式,如溝槽鍵合等方式與DNA相互作用.根據(jù)鍵合常數(shù)(Kb)比較,3個(gè)配合物與DNA的作用強(qiáng)弱順序?yàn)?>2>1.
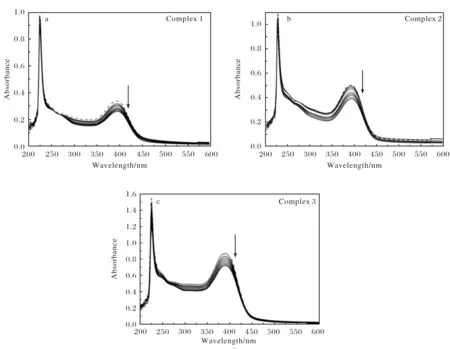
圖3 配合物1~配合物3在不同CT-DNA濃度下的紫外-可見(jiàn)光譜圖(圖中箭頭表示CT-DNA濃度逐漸增大時(shí)的吸光度的變化趨勢(shì))Fig.3 UV-Vis absorption spectra of complex 1~ complex 3 in the absence (---) and presence (-) of increasing concentration of CT-DNA
2.3熒光光譜
進(jìn)一步通過(guò)熒光光譜法研究配合物與CT-DNA之間的相互作用及鍵合強(qiáng)弱.EB是研究小分子化合物與DNA相互作用最常用的熒光探針.DNA分子本身的熒光強(qiáng)度很弱,EB在溶液中的熒光強(qiáng)度也不高,但當(dāng)EB插入到DNA的堿基對(duì)之間后,其熒光強(qiáng)度大大增強(qiáng);當(dāng)EB從DNA雙螺旋堿基對(duì)間出來(lái)時(shí),熒光強(qiáng)度則顯著降低.因此,可以根據(jù)化合物對(duì)EB-DNA復(fù)合物熒光的影響來(lái)研究?jī)烧唛g的相互作用.
配合物1~配合物3與DNA相互作用的熒光光譜如圖4所示.隨著配合物的不斷加入,EB-DNA復(fù)合物的熒光強(qiáng)度逐步減弱(熒光強(qiáng)度減弱率分別為18.35%,19.16%和23.66%),表明這3個(gè)銅(Ⅱ)配合物與DNA有較弱的鍵合作用,并可能是通過(guò)溝槽模式與CT-DNA相結(jié)合[25].配合物作用在雙螺旋DNA的大溝或者小溝區(qū),競(jìng)爭(zhēng)了EB與DNA的結(jié)合,引起了DNA結(jié)構(gòu)微環(huán)境的變化,使得部分EB從DNA復(fù)合物中游離出來(lái),從而引起其熒光強(qiáng)度的降低.配合物與DNA的結(jié)合強(qiáng)弱還可通過(guò)如下Stern-Volmer方程式,計(jì)算淬滅常數(shù)進(jìn)行比較[26].
I0/I=1+KSV.[Complex],
其中,KSV為淬滅常數(shù),I0/I為加入和未加入配合物時(shí)EB-DNA體系的熒光強(qiáng)度的比值,[Complex]為體系中配合物的濃度.以加入和未加入配合物時(shí)體系的熒光強(qiáng)度的比值I0/I為縱坐標(biāo),[Complex]為橫坐標(biāo),作出Stern-Volmer曲線,如圖4(d)所示,得到配合物1~配合物3的淬滅常數(shù)KSV分別為6 422,7 398和13 977 L·mol-1.淬滅常數(shù)的大小反映了配合物與DNA的結(jié)合能力,即淬滅常數(shù)越大,結(jié)合力越大.因此,3個(gè)銅(Ⅱ)配合物與DNA的結(jié)合能力的大小順序?yàn)?>2>1,該結(jié)論與紫外光譜所得結(jié)論一致.
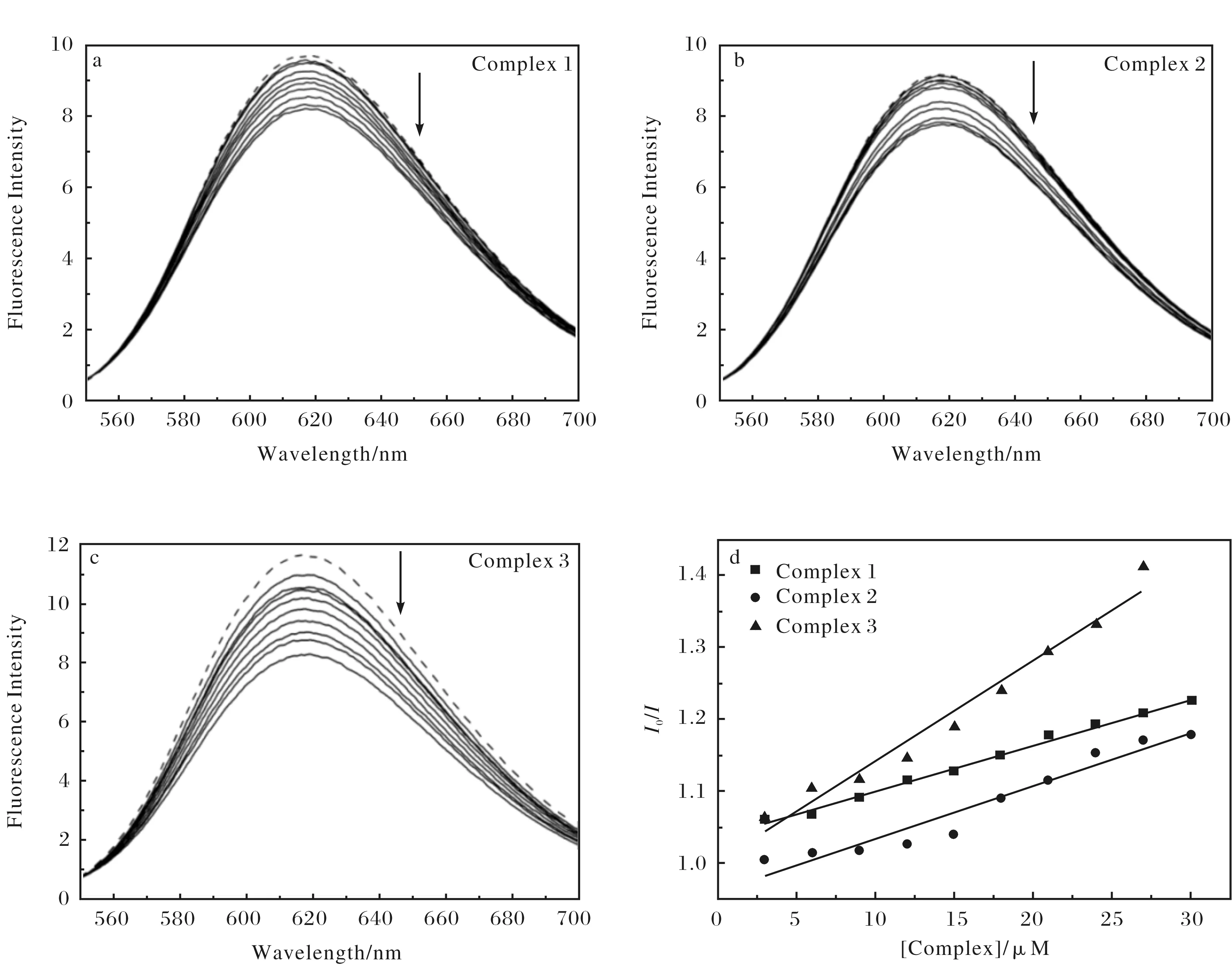
圖4 EB-DNA體系在不同配合物濃度下的熒光光譜圖(圖中箭頭表示配合物濃度逐漸增大時(shí)的變化趨勢(shì))(a~c)和配合物1~配合物3對(duì)EB-DNA 體系的熒光淬滅圖(d)Fig.4 (a~c)Fluorescence emission spectra of EB-DNA system in the absence (---) and presence (-) of increasing amounts of complex 1 ~ complex 3; (d) Fluorescence quenching of EB-DNA system by complex 1 ~ complex 3
2.4圓二色譜
將不同濃度的配合物溶液分別加入到CT-DNA溶液中,測(cè)量其圓二色譜(CD)的變化,其結(jié)果如圖5所示.隨著配合物濃度的增加,DNA的CD譜圖發(fā)生了明顯的變化.245 nm處的負(fù)峰與275 nm處的正峰的強(qiáng)度均有明顯的降低,但是沒(méi)有明顯的位移.說(shuō)明銅(Ⅱ)配合物的加入使DNA雙螺旋結(jié)構(gòu)部分被破壞,雙螺旋結(jié)構(gòu)變得松散.結(jié)果表明,銅(Ⅱ)配合物1~3對(duì)DNA均有鍵合作用.
2.5DNA切割活性
在pH 7.4和37 °C,并以抗壞血酸(H2A)還原劑條件下,配合物1~配合物3均可將超螺旋pBR322 DNA(Form I,I型)切割成缺刻型(Form Ⅱ,Ⅱ型)和線型(Form Ⅲ,Ⅲ型)DNA.隨著配合物濃度的增大,DNA的切割活性顯著增強(qiáng),I型DNA逐漸減少甚至是最終完全轉(zhuǎn)變?yōu)棰蛐秃廷笮虳NA,其結(jié)果如圖6所示.配合物1當(dāng)濃度達(dá)到40 μmol·L-1時(shí),開(kāi)始有Ⅲ型DNA產(chǎn)生,濃度達(dá)到48 μmol·L-1時(shí),Ⅱ型DNA和Ⅲ型DNA同時(shí)存在,而I型DNA基本消失.配合物2在32 μmol·L-1時(shí)開(kāi)始出現(xiàn)Ⅲ型 DNA;當(dāng)濃度為40 μmol·L-1時(shí),I型DNA完全變?yōu)棰蛐虳NA和Ⅲ型DNA.配合物3在28 μmol·L-1時(shí)開(kāi)始出現(xiàn)Ⅲ型 DNA;當(dāng)濃度為32 μmol·L-1時(shí),I型DNA即完全降解為Ⅱ型及Ⅲ型DNA;而當(dāng)其濃度增大到48 μmol·L-1或更大時(shí),DNA已被切割成碎片.以上結(jié)果表明,配合物1~配合物3均有良好的DNA切割活性,且3個(gè)配合物的切割活性大小順序?yàn)? > 2 > 1.與單核配合物1相比,雙核配合物2和多聚配合物3具有更強(qiáng)的DNA結(jié)合能力及更好的DNA切割活性,這可能歸因于在雙核及多聚配合物中,兩個(gè)或多個(gè)中心金屬離子之間存在協(xié)同效應(yīng)[27-28].一個(gè)配合物的金屬中心離子數(shù)目愈多,這種協(xié)同效應(yīng)可能愈明顯,從而可能呈現(xiàn)愈強(qiáng)的DNA結(jié)合能力及DNA切割活性.
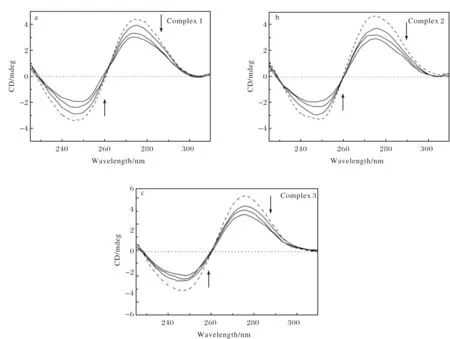
圖5 CT-DNA在不同配合物濃度下的圓二色譜圖(圖中箭頭表示配合物濃度逐漸增大時(shí)的變化趨勢(shì))Fig.5 CD spectra of CT-DNA in the absence (---) and presence (-) of increasing amounts of complex 1~ complex 3
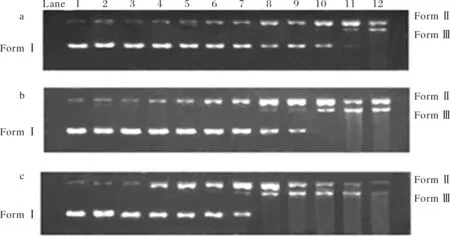
(a) 泳道1,DNA;泳道2,DNA+H2A;泳道3,DNA+配合物1 (44 μmol·L-1);泳道4~12,DNA+H2A+配合物1 (8,16,24,28,32,36,40,44,48 μmol·L-1);(b) 泳道1,DNA;泳道2,DNA+H2A;泳道3,DNA+配合物2 (44 μmol·L-1);泳道4~12,DNA+H2A+配合物2 (8,16,24,28,32,36,40,44,48μmol·L-1);(c) 泳道1,DNA;泳道2,DNA+H2A;泳道3,DNA+配合物3 (44 μmol·L-1) ;泳道4~12,DNA+H2A+配合物3 (8,16,24,28,32,36,40,44,48 μmol·L-1).圖6 配合物(1~3)濃度對(duì)超螺旋pBR332DNA切割活性的影響Fig.6 Gel eletrophoresis diagram showing the cleavage of pBR322 DNA
3 結(jié)論
本文采用多種方法研究了3個(gè)不同雙吡啶吡咯Cu(Ⅱ)配合物與DNA之間的相互作用.光譜研究結(jié)果表明,配合物與CT-DNA相互作用的主要模式是溝槽結(jié)合,即配合物作用在雙螺旋DNA的大溝或者小溝區(qū),引起DNA結(jié)構(gòu)微環(huán)境的變化,配合物與DNA作用的強(qiáng)弱順序3>2>1.3個(gè)配合物均能有效地切割超螺旋pBR322 DNA為缺刻型或者線型DNA,且隨著配合物濃度的增大,切割活性顯著增強(qiáng).
[1] 王曉勇, 郭子建. 金屬抗癌藥物設(shè)計(jì)的新策略和新趨勢(shì)[J]. 化學(xué)進(jìn)展, 2009, 21(5): 845-855.
[2] MUHAMMAD N, GUO Z J. Metal-based anticancer chemotherapeutic agents[J]. Curr Opin Chem Biol, 2014, 19:144-153.
[3] SIGMAN D S, GRAHAM D R, AURORA V D, et al. Oxygen-dependent cleavage of DNA by the 1,10-phenanthroline. cuprous complex. Inhibition of Escherichia coli DNA polymerase I [J]. J Biol Chem, 1979, 254(24): 12269-12272.
[4] BALDINI M, BELICCHI-FERRARI M, BISCEGLIE F, et al. Copper(Ⅱ) complexes with substituted thiosemicarbazones of α-ketoglutaric acid: Synthesis, X-ray structures, DNA binding studies, and nuclease and biological activity [J]. Inorg Chem, 2004, 43(22): 7170-7179.
[5] 王 芳, 張萬(wàn)舉, 徐志花, 等. 單核銅(Ⅱ)配合物[Cu(phen)(C2O4)]·H2O的合成、晶體結(jié)構(gòu)及與DNA相互作用研究[J]. 華中師范大學(xué)學(xué)報(bào)(自然科學(xué)版),2011, 45(3): 435-438.
[6] JAYAMANI A, THAMILARASAN V, SENGOTTUVELAN N, et al. Synthesis of mononuclear Copper(Ⅱ) complexes of acyclic Schiff’s base ligands: Spectral, structural, electrochemical, antibacterial, DNA binding and cleavage activity [J]. Spectrochimica Acta Part A, 2014, 122C: 365-374.
[7] MA T L, XU J, WANG Y, et al. Ternary Copper(Ⅱ) complexes with amino acid chains and heterocyclic bases: DNA binding, cytotoxic and cell apoptosis induction properties[J]. J Inorg Biochem, 2015, 144: 38-46.
[8] LIU H K, SADLER P J. Metal complexes as DNA intercalators[J]. Accounts Chem Res, 2011, 44(5): 349-359.
[9] MANIKANDAMATHAVAN V M, UNNI N B. DNA binding and cytotoxicity of copper(Ⅱ) imidazole terpyridine complexes: Role of oxyanion, hydrogen bonding and π-π interaction[J]. Eur J Med Chem, 2013, 68: 244-252.
[10] ZHANG S C, ZHU Y G, TU C, et al. A novel cytotoxic ternary Copper(Ⅱ) complex of 1,10-phenanthroline and L-threonine with DNA nuclease activity[J]. J Inorg Biochem, 2004, 98(12): 2099-2106.
[11] ZHANG S C, ZHOU J L. Ternary Copper(Ⅱ) complex of 1,10-phenanthroline and L-glycine: crystal structure and interaction with DNA[J]. J Coord Chem, 2008, 61(15): 2488-2498.
[12] ZHANG S C, CHUN X G, CHEN Y, et al. Synthesis,crystal structure and DNA cleavage activity of a ternary Copper(Ⅱ) complex of dipyrido-quinoxaline and glycine[J]. Chin J Chem, 2011, 29(1): 65-71.
[13] PATEL M N, DOSI P A, BHATT B S. Antibacterial,DNA interaction and superoxide dismutase activity of drug based Copper(Ⅱ) coordination compounds[J]. Polyhedron, 2010, 29(17): 3238-3245.
[14] MANIKANDAMATHAVAN V M, RAJAPANDIAN V, FREDDY A J, et al. Effect of coordinated ligands on antiproliferative activity and DNA cleavage property of three mononuclear Cu(Ⅱ)-terpyridine complexes[J]. Eur J Med Chem, 2012, 57: 449-458.
[15] ALVAREZ N, VEIGA N, IGLESIAS S, et al. Synthesis,structural characterization and DNA interaction of new Copper-terpyridine complexes[J]. Polyhedron, 2014, 68: 295-302.
[16] MIN R, HU X, YI X, et al. Synthesis, structure, DNA binding and cleavage activity of a new copper(Ⅱ) complex of bispyridylpyrrolide[J]. Journal of Central South University, 2015, 22(5):1619-1625.
[17] JONES R A, KARATZA M, VORO T N, et al. Cheminform abstract: Extended heterocyclic systems. Part 1. The synthesis and characterization of pyrrolylpyridines, alternating pyrrole:Pyridine oligomers and polymers, and related systems[J]. Tetrahedron, 1996, 27(43):8707-8724.
[18] FANG W Z, WANG Y P, WANG Y F, et al. Anion-directed assembly of helical Copper(Ⅱ) complexes based on a bispyridylpyrrole ligand: synthesis,structural and magnetic properties[J]. Rsc Advances, 2015, 5: 8996-9001.
[19] MARMUR J. A procedure for the isolation of deoxyribonucleic acid from microorganisms[J]. J Mol Biol, 1961, 3: 208-218.
[20] WOLFE A, SHIMER G H, MEEHAN T. Polycyclic aromatic hydrocarbons physically intercalate into duplex regions of denatured DNA[J]. Biochemistry, 1987, 26(20): 6392-6396.
[21] ALLMANN R, HENKE W, REINEN D. Presence of a static Jahn-Teller distortion in copper(Ⅱ) terpyridine complexes 1. Crystal structure of diterpyridinecopper(Ⅱ) nitrate[J]. Inorg Chem, 1978, 17(2): 378-382.
[22] BARTON J K, DANISHEFSKY A, GOLDBERG J. Tris(phenanthroline) ruthenium(Ⅱ):stereoselectivity in binding to DNA[J]. J Am Chem Soc, 1984, 106(7): 2172-2176.
[23] NAIR R B, TENG E S, KIRKLAND S L, et al. Synthesis and DNA-binding properties of [Ru(NH3)4dppz]2+[J]. Inorg Chem, 1998, 37(1): 139-141.
[24] WARING M J. Complex formation between ethidium bromide and nucleic acids[J]. J Mol Biol, 1965, 13(1): 269-282.
[25] BOGER D L, FINK B E, BRUNETTE S R, et al. A simple,high-resolution method for establishing DNA binding affinity and sequence selectivity[J]. J Am Chem Soc, 2001, 123(25): 5878-5891.
[26] LAKOWICZ J R, WEBER G. Quenching of fluorescence by oxygen. Probe for structural fluctuations in macromolecules[J]. Biochemistry, 1973, 12(21): 4161-4170.
[27] ANBU S, KANDASWAMY M. Electrochemical, magnetic, catalytic, DNA binding and cleavage studies of new mono and binuclear copper(Ⅱ) complexes[J]. Polyhedron, 2011, 30 (1): 123-131.
[28] 張壽春, 邵 穎. 雙核銅(Ⅱ)配合物在H2O2存在下對(duì)DNA的氧化切割活性[J].無(wú)機(jī)化學(xué)學(xué)報(bào),2006, 20(9): 1733-1739.
Interaction betweeen dipyridylpyrrole copper(Ⅱ) complexes and DNA
MA Li, YI Xiaoyi, ZHANG Shouchun
(School of Chemistry and Chemical Engineering, Central South University, Changsha 410083)
A new mononuclear copper complex, [Cu(PDPH)2](1) was synthesized and characterized. The complex was crystallized in a monoclinic system with space group C2/c,a=39.1242(16) ?,b=8.6574(5) ?,c=33.7687 (14) ?, β=123.0305(16)°. The interaction of [Cu(PDPH)2] (1), dinuclear [Cu2(PDPH)2(NO3)2] (2) and polymer {[Cu2(PDPH)2(N3)2]}n(3) with CT-DNA was investigated respectively by UV-Vis absorption spectra, fluorescence spectra and circular dichroism (CD) spectra. The results indicated that these complexes bind to CT-DNA via groove binding mode, and the binding ability followed an order of 3 > 2 > 1. In addition, these copper(Ⅱ) complexes exhibited efficient DNA cleavage property and were able to promote the conversion of supercoiled DNA to nicked or linear form in the presence of ascorbate as a reducing agent.
copper(Ⅱ) complex; dipyridylpyrrole ligand; DNA-binding; DNA cleavage
2016-03-19.
國(guó)家自然科學(xué)基金項(xiàng)目(21571190).
1000-1190(2016)04-0551-08
O614.121
A
*通訊聯(lián)系人. E-mail: zhang_shch@sina.cn.
 華中師范大學(xué)學(xué)報(bào)(自然科學(xué)版)2016年4期
華中師范大學(xué)學(xué)報(bào)(自然科學(xué)版)2016年4期
- 華中師范大學(xué)學(xué)報(bào)(自然科學(xué)版)的其它文章
- GNSS-R海冰遙感的模擬和試驗(yàn)驗(yàn)證
- 基于氣象數(shù)據(jù)的洱海藍(lán)藻水華驅(qū)動(dòng)因子及預(yù)警研究
- 礦區(qū)城鎮(zhèn)居民的農(nóng)地保護(hù)異質(zhì)性偏好及其影響因素研究——以江西省九江縣沙河街鎮(zhèn)為實(shí)證
- Structural investigation, Hirshfeld surface analysis and quantum mechanical study of Piperazinium bis(4-chlorophenoxyacetate)
- 面向作業(yè)車間調(diào)度問(wèn)題的改進(jìn)型蝙蝠算法
- 大規(guī)模零擔(dān)物流軸輻式網(wǎng)絡(luò)決策優(yōu)化
