雌激素在地下環境中的歸宿及其生態調控
宋曉明,楊悅鎖,2*,溫玉娟, M. Adeel,王園園,楊新瑤(.沈陽大學,區域污染環境生態修復教育部重點實驗室,遼寧 沈陽 0044;2.吉林大學環境與資源學院,吉林 長春 3002)
雌激素在地下環境中的歸宿及其生態調控
宋曉明1,楊悅鎖1,2*,溫玉娟1, M. Adeel1,王園園1,楊新瑤1(1.沈陽大學,區域污染環境生態修復教育部重點實驗室,遼寧 沈陽 110044;2.吉林大學環境與資源學院,吉林 長春 130021)
綜述了環境中典型的結合態與游離態類固醇雌激素的來源、危害以及環境歸趨,探討了其在地下環境(土壤和淺層地下水系統)中的吸附、微生物降解等遷移轉化過程及其影響因素,總結了常見的環境雌激素處理方法與危害控制措施.最后,針對目前環境中類固醇雌激素在包氣帶與淺層地下水中的穿透過程及其生態效應研究工作的基礎上,對未來相關方面的研究進行了展望.
類固醇雌激素;地下環境;吸附;微生物降解;遷移轉化
類固醇雌激素(SEs)作為一類典型的內分泌干擾物,具有極強的內分泌干擾作用,產生的生態環境影響也尤為顯著[1],SEs對土壤與地下水系統的生態效應也成為國內外的研究熱點.研究表明,環境中的SEs約90%來源于畜禽糞便[2].集約化畜禽養殖業中大量使用促生長激素與畜禽自身生理代謝將產生大量SEs[3],而集約化、設備化農牧畜業生產方式進一步促使 SEs進入土壤與水環境.中國作為畜禽養殖業第一大國,每年將近40億 t的畜禽糞便被施用到土壤進而釋放到環境中[4],造成的土壤與水環境功能的改變、生態環境風險和人體健康風險不言而喻.本文總結了國內外關于SEs的最新研究進展,深入探討SEs的種類、排放特征與危害,并詳細闡述其在土壤與地下水系統中的環境行為及控制措施,為進一步認識SEs在包氣帶與淺層地下水中的穿透機制、開發高效低耗的控制和修復技術提供科學依據.
1 環境中的類固醇雌激素
1.1 類固醇雌激素的種類
天然環境中的 SEs根據其結構可分為游離態(Free)和結合態(Conjugate).其中最具代表性的包括雌酮(E1)、雌二醇(17α-E2、17β-E2)、雌三醇(E3)和乙炔基雌二醇(17α-EE2、17β-EE2).雖然人與動物排泄的雌激素主要為雌激素活性較低的結合態,但環境中的微生物能夠將其水解轉化為游離態而重現雌激素活性[5],游離態雌激素也可與硫酸根或葡萄糖苷酸通過酯化作用生成結合態.常見SEs的化學性質見表1[6-7].
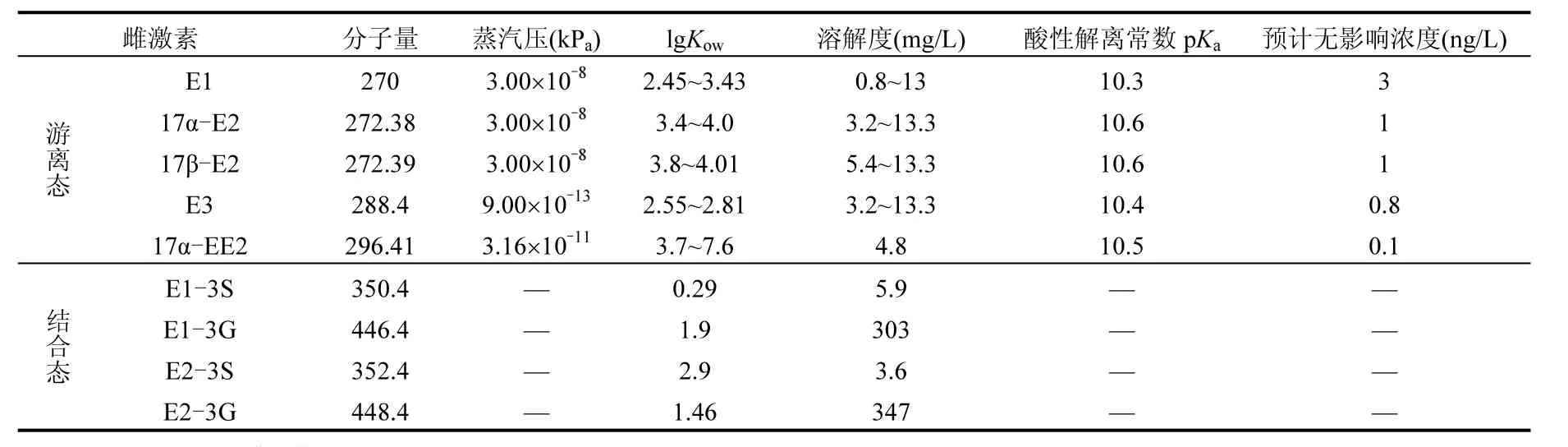
表1 典型類固醇雌激素化學性質Table 1 Chemical properties of the typical SEs
1.2 環境中類固醇雌激素的來源與歸趨
SEs一般通過人畜排泄物進入環境.對比人畜排放特征可見(表2),畜禽的排放顯著高于人類,成為環境中SEs的主要來源[8-9].不同類型畜禽在不同生長階段SEs排放量不同.通常孕期或妊娠階段排放量顯著高于正常生長期;牛和豬排泄雌激素的量一般高于羊、雞等.不同畜禽排放的SEs種類也有明顯差異,牛主要排放 17α-E2,而豬和家禽主要排放17β-E2,據此可以作為不同SEs來源的指示劑[10].一般人畜糞便中的SEs主要以游離態存在,而在尿液中主要為結合態[2].一些研究表明,人畜排放的SEs多以結合態為主,可達SEs總排放量的95%[11],而游離態中有相當一部分來自結合態的水解[12-13].Hoffmann等[14]研究牛的SEs排放形態發現,其體內SEs主要以E1-3S和17β-E2-3G形式存在,在排出的尿液中含量較高.雖然人畜排泄的 SEs以雌激素活性較低的結合態為主,但其在環境中易被微生物水解為游離態而產生內分泌干擾作用,且其溶解度更大,遷移性更強、帶來的長期污染效應更嚴重.
人畜排放的 SEs可以通過多種方式進入環境,并在不同的環境介質間進行遷移轉化.目前在國內外各種水體、畜禽糞漿、污水處理廠、河流沉積物、土壤等環境介質中已頻繁檢出(表3).污水處理廠是人畜排泄物的重要接納場所之一.通常污水處理廠進水中 SEs含量一般為幾~幾百ng/L,且與其它環境樣品相比,EE2的含量較高.對比污水廠進出水可以看出,大部分SEs能在污水處理系統中被去除,但出水中仍然可能含有SEs.
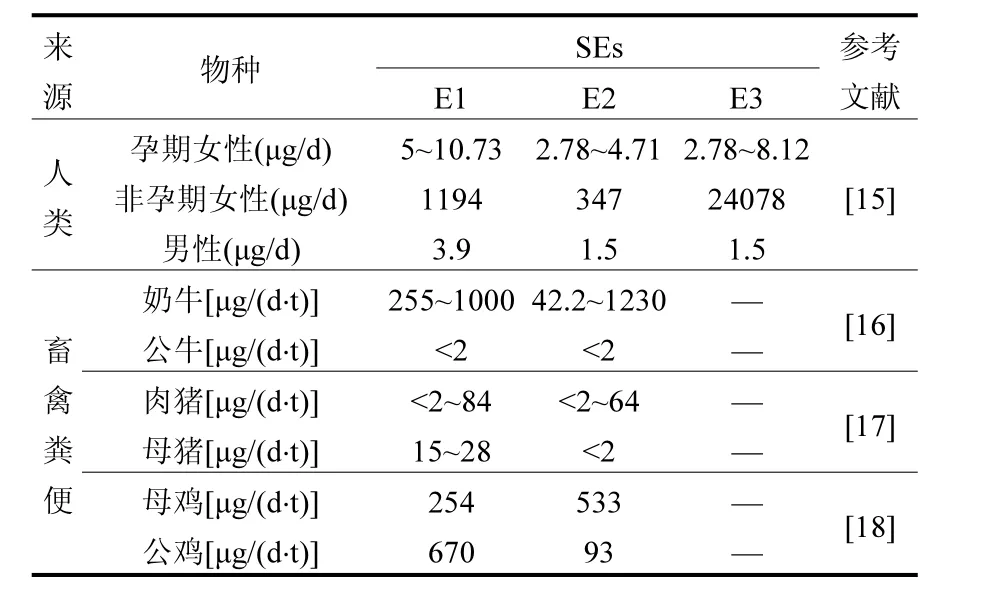
表2 人畜SEs排放特征對比Table 2 Comparison of SEs releases between human and livestock
畜禽養殖場是SEs的另一個重要來源,從表3可以看出,由于畜禽種類、養殖規模、糞便處理方式、以及檢測方法的不同,養殖場(氧化塘)廢水中的SEs含量差異很大,但均以E1、E2形式存在, E3與EE2很少檢出.相對于污水處理廠,畜禽養殖廢水的SEs含量更高.地表水體作為污水廠出水的直接受體,也一定程度上受到的 Ses的潛在危害.例如,Kolpin等[19]對美國30個州的139處地表水進行了詳細調查取樣,約40%的水體不同程度的受到SEs污染;Tabata等[20]人對日本100余條河流中的SEs進行調查,發現近80%的河水樣品中均檢測到 SEs.因此,如果利用含有SEs的河水進行灌溉,將使SEs進入農田系統并進一步遷移.此外,利用畜禽糞便進行施肥的集約化綠色農業也是土壤中 SEs的主要來源,糞便中大部分SEs會被降雨與灌溉水淋洗,重新隨地表徑流進入地表水體[21-22],剩余的SEs一部分透過土壤包氣帶進入地下水[23],其他另一部分則殘留在包氣帶中.也有研究在飲用水中檢測到SEs. Kuch等[24]在德國某些飲用水中檢測E1和E2的濃度分別為0.2~0.6和0.2~2.1ng/L. Roefer等[25]也在飲用水水源中檢測到了 E2,其濃度約為2.6ng/L.雖然飲用水中SEs濃度很低,但足以產生內分泌干擾作用.可見,SEs可以在各環境要素之間遷移、并對生態造成威脅(圖1),這也為評價其環境風險,預測其環境歸趨提出了新的挑戰.
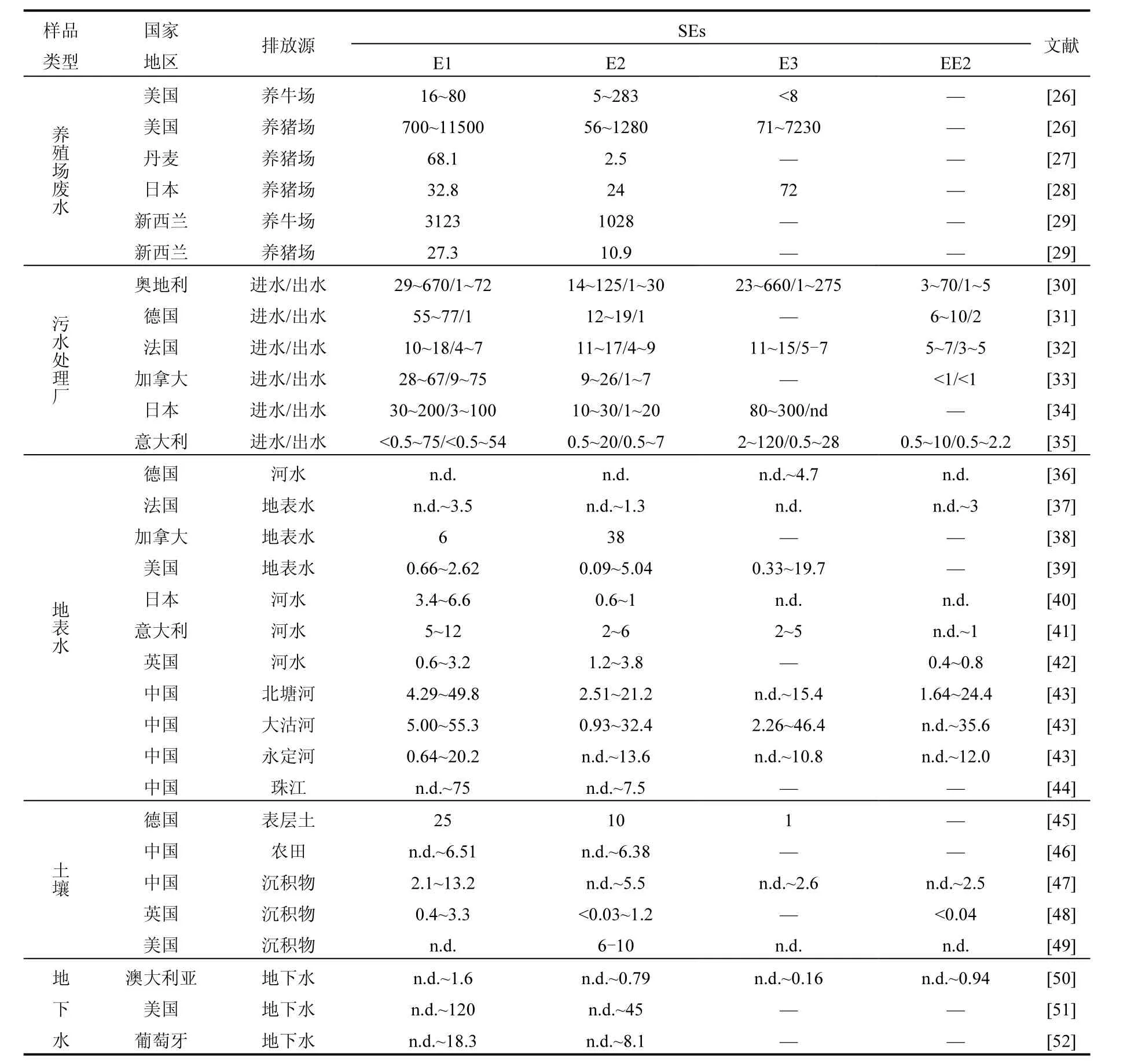
表3 不同環境樣品中SEs濃度分布特征Table 3 The concentrations of SEs in various environmental samples
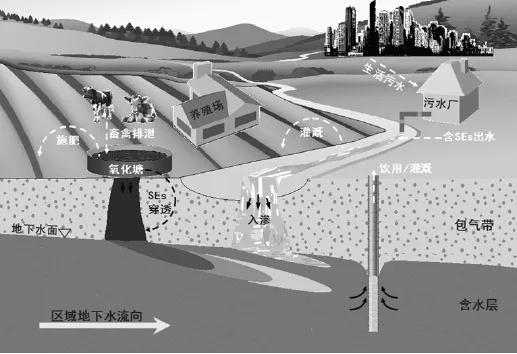
圖1 環境中SEs遷移及其生態效應概念模型Fig 1 The conceptual model of transport and ecological effect of SEs in environment
1.3 類固醇雌激素的危害
SEs的危害多以水生生物為主,水體中極低的濃度(1ng/L)就會影響水生生物體內正常內分泌代謝[53].SEs最常見的危害效應是導致生物個體雌性化,在許多哺乳類生物中都已經發現了因SEs暴露而導致雄性個體體內出現卵黃蛋白原或雌性化器官的現象[54].Biegel等[55]研究證實,長期暴露于E2可以使雄性虹鱷魚的斑紋轉變為雌性斑紋,且生殖活動也向雌性特點轉變. Korsgaard等[56]在研究英國某接受工廠排污河流中石斑魚的生長發育特征時發現,約 60%的雄魚出現了雌性化特征,兩性魚與雌性魚比例明顯增高,而這一現象的產生與水體中 EE2的含量增高顯著相關.其次SEs對生長發育、生殖健康和生物繁衍的影響亦尤為顯著.Biegel等[55]發現一定劑量的E2暴露可以造成小鼠卵巢和睪丸的發育異常,也會造成鳥類和魚類生殖系統的發育畸形.除了影響生殖系統發育之外,雌激素暴露還會干擾生物體生殖系統的正常功能.Angus等[32]發現長期暴露于SEs會造成小鼠卵巢和睪丸的功能障礙導致卵泡減少、精子數量減少和精子活性降低,降低鳥類繁殖成功率,延遲鳥類產卵時間,以及干擾魚類產卵.戴璇穎等[57]調查了我國北京、上海、天津等地上萬名男性生殖健康狀況發現,從 1981~1996年,該地區男性精液量、精子數目、精子活動率指標分別下降了10.0%、18.6%和10.4%,該變化不可能是遺傳因素引起的,毫無疑問與環境中雌激素增多相關.此外,高濃度的暴露還會對生物體產生致癌或致畸變效應,如提高乳腺癌、睪丸癌、卵巢癌和子宮內膜瘤等發病概率[58];也有研究發現高濃度雌激素暴露可以導致幼魚的死亡率增加[32].除了對生長發育、生殖系統影響較大之外,SEs也在許多其他方面對生物體產生影響,例如,生物體的免疫系統在SEs長期作用下會發生免疫失調和病理反應;過量 SEs暴露也能夠對生物體的神經系統產生侵害,從而影響大腦皮層,下丘腦,腦垂體等對激素分泌的調節作用,導致激素合成、釋放異常[59].值得注意的是,SEs可通過生物富集、空氣吸入和皮膚接觸等多種途徑侵入人體,而且 SEs對人體健康的影響并不只局限于受暴露的個體本身,在一定的條件下具有遺傳效應.
2 類固醇雌激素對土壤與地下水環境的脅迫
針對 SEs對地下環境(土壤與地下水)的潛在危害研究可追溯到20世紀90年代末,Ternes等
[60]研究發現SEs可通過地表水與排污管道泄漏遷移至地下水,進而對土壤與淺層地下水造成潛在危害. Peterson等[23]檢測到某喀什特地區地下水中17β-E2含量達65ng/L,通過污染源分析最終確定主要來源于畜禽糞便污染.Wicks等[61]也發現在地表水與地下水交互頻繁地區,地下水中17β-E2的濃度為達80ng/L,且其含量與地表水中17β-E2含量有顯著相關性.Labadie等[62]最先開展了SEs在河底沉積物中垂直遷移的原位實驗,發現沉積物底部界面上的E為表層沉積物的9倍,從而證實了SEs可以穿透到地下含水層系統,及其遷移過程中的界面效應.可見,盡管土壤對SEs具有較好的吸附性,但其仍會隨著農田澆灌、降雨等過程穿透包氣帶進入到地下水系統,從而對土壤與地下水生態系統以及人類健康造成潛在的威脅.
3 類固醇雌激素在土壤-地下水系統中的遷移轉化
由于SEs的蒸汽壓很低(表1),在常溫常壓下的揮發可以忽略;雖然有關于SEs光解的研究,但基本都是基于紫外光或有TiO2等催化劑存在的催化條件下的光解,SEs在自然條件下的光解十分有限.因此,影響SEs在環境中遷移轉化的主要因素為吸附與微生物降解/轉化,下面主要基于這兩方面對SEs在土壤與地下水中的環境行為展開綜述.
3.1 土壤對SEs的吸附
SEs溶解度較低,疏水性較強,極易于吸附在固相介質中,土壤或沉積物成為其在環境中主要的“源”和“匯”.
在吸附動力學方面,大部分實驗研究表明,SEs可以快速地被吸附到土壤或土壤有機質(SOM)上,通常幾個小時內便可達到或接近表觀吸附平衡[63].不同SEs在土壤中的吸附特征相似,吸附明顯分2個階段:即前期吸附較快,后期緩慢降低.李建中[64]利用雙室一級動力學模型研究了不同SEs在多種土壤介質中的吸附規律,發現實驗初始階段,快吸附居于主要地位,隨后慢吸附貢獻逐漸上升,直至吸附達到平衡,不同土壤中慢吸附的貢獻率可達 18%~60%.在此基礎上一些學者針對SEs后期的慢吸附過程進行了研究,認為SEs在土壤礦物以及土壤有機質中的微孔擴散機制是導致慢吸附的主要原因[65-66].
環境因素對土壤中SEs吸附影響顯著.在酸性條件下,SEs羥基去質子化能力減弱,腐殖酸中官能團的解離能力減弱,利于有機物的吸附[67]. SEs的吸附為放熱過程[68],較高的溫度會抑制SEs的吸附.離子濃度會影響土壤的表面特征和疏水性化合物的溶解度.一般離子強度較高時,SEs與土壤介質間的雙電層斥力減小,且離子強度增高使得SEs的溶解度降低,從而促進SEs的吸附[69].土壤礦物是吸附SEs的主要載體之一,因此礦物成分對SEs吸附影響也尤為重要. Francis等[70]研究認為,SEs在土壤中的吸附與土壤礦物組成,礦物粒徑、比表面積以及陽離子交換能力等顯著相關,粘土礦物含量越高、粒徑越小、比表面積越大,則吸附能力越強.Lai等[71]發現鐵鋁氧化物的離子交換能力較強,因此對SEs的吸附能力也較高.
起初人們研究 SEs在土壤中的吸附時發現吸附親合力與辛醇-水分配系數高度相關[63],吸附特征符合線性等溫吸附方程,表明疏水分配作用是其主要吸附機制.然而,由于SEs具有羥基等極性官能團,推測疏水分配作用并非唯一的吸附機制[72].一些研究發現,SEs的吸附行為主要受羥基影響.Bedard等[73]在研究 SEs與腐殖酸(HAs)之間的吸附時發現,SEs主要通過芳香環上的羥基與 HAs結合,且 HAs濃度很低時也會發生. Diana[74]等研究炔雌醇在經過堆肥處理的土壤中吸附規律時發現,其吸附等溫線呈非線性,這是因為炔雌醇苯環上C-3的酚羥基和C-17上的羥基與土壤中有機質的羧基官能團反應的結果. Yamamoto等[75]利用熒光猝滅技術研究了SEs在DOC中的吸附,發現吸附能力與SEs的溶解度以及lgKow相關性較弱,表明SEs與有機物的相互作用不僅是疏水分配,還有 π健與 H健.此外,SOM的非均質性也是導致土壤吸附非線性的主要原因[76].SOM 通過去質子化官能團提供吸附點位;或者通過極性官能團形成氫鍵;或者與金屬離子形成鍵橋等來影響吸附過程.可見,SEs與有機質之間的吸附機理復雜,如何全面揭示不同來源以及不同種類的土壤有機物對 SEs的吸附機理尚待研究.
3.2 微生物對SEs的降解/轉化
土壤和水體中豐富的微生物與 SEs的相互作用無需置疑.在不同的環境條件下,例如濕度、溫度和 pH 值等可以影響微生物的活性,進而影響雌激素的降解.土壤中大部分SEs生物降解的半衰期小于1個月,SEs在環境中持久性較弱[77].通常土壤中濕度和溫度的增高,以及 pH較低的酸性條件下,能提高SEs的生物利用率,降低其持久性[78].氧化還原條件對SEs的降解/轉化影響顯著.與好氧條件相比,厭氧條件下雌激素的降解速率較低[79].E1可通過外消旋化作用生成E2;E2也可以通過 SO42-、NO3-和 CO32-等電子受體轉化為E1,但是SEs的降解總量較小,說明在厭氧條件下,雌激素可以進行積累.因此,通常將長期處于厭氧狀態下的沉積物稱為雌激素物質的天然儲庫[80].SEs的生物降解過程通常沒有觀測到 CO2的顯著產生,說明 SEs的礦化作用較弱[81].Fan等
[82]利用14C標注的E2培養實驗發現在好氧條件下,僅有6%的E2發生礦化,而在厭氧條件下不發生礦化.
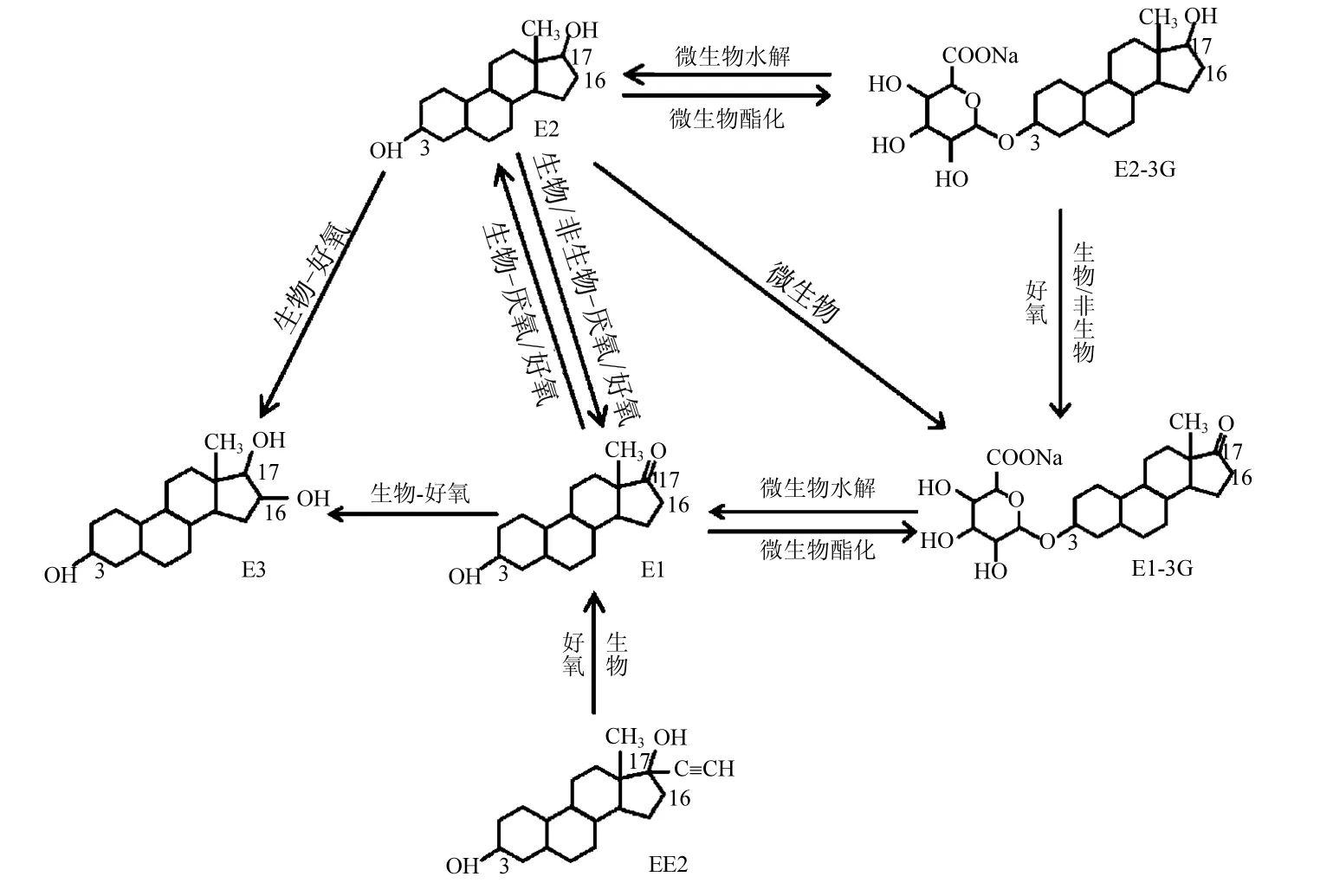
圖2 SEs之間的相互轉化與轉化條件Fig.2 Transformation and the corresponding conditions among various SEs
很多研究表明,不同SEs組分之間會發生相互轉化(圖2).如E2與E1在生物降解過程中的相互轉化或單向轉化[83],同時,在E1和17α-E2的降解過程中發現了E3[78].此外,一些 SEs之間的相互轉化也可以通過非生物過程實現.Fan等[82]研究證實E2可以通過非生物過程轉化為一種未知的極性物質,但E2氧化為E1只能在生物作用下進行.而Colucci等[84]發現17β-E2先是被非生物途徑氧化為E1,隨后被微生物降解,說明E2轉化為E1也可是非生物過程.Goeppert等[85]研究E2在土壤中的遷移轉化發現,當有微生物存在時其降解產物主要為E1與E1-3S,無微生物存在時降解產物只有E1,首次證實了E2的遷移轉化過程伴隨E1-3S的形成,但對該過程的機理尚不明確,有待進一步研究.結合態SEs之間也會發生相互轉化,Shrestha等[12]在研究E2-3G在農業土壤中的遷移轉化時監測到E1-3G,說明E2-3G發生了氧化,但無法確定該過程是否是生物過程.
已經有學者發現,由于土壤及其有機組分的非均質性,吸附作用對SEs的生物利用度影響顯著,且常常得到矛盾的結論.Casey等[86]研究不同來源的土壤對E2的吸附性和生物降解試驗發現,吸附于固相的 SEs可以快速解吸到液相并被降解.Das等[87]研究SEs在分別填充了土壤、淡水沉積物和2種砂子的柱試驗發現,較強的吸附作用沒有阻礙生物降解.但是,也有學者發現吸附作用會導致SEs的生物可利用性明顯降低,從而影響生物降解率.Fan等[88]精確模擬了E2在土壤中的遷移轉化,E2需要以溶解態或從固相中解吸才能被生物利用.因此,膠體結合的 E2不能被微生物降解.Lee等[89]研究了E2在不同濃度HAs上的吸附,并利用E-screen Bioassay估算了E2的雌激素活性及其去除,發現隨著HAs濃度的增加E2的吸附增強,但生物降解率及其轉化成 E1的效率顯著降低.這表明土壤吸附作用對SEs的生物降解作用的影響,需要結合試驗土壤的吸附特性與微生物降解特性具體分析.
縱觀SEs的降解/轉化過程可以得出,SEs的代謝產物可能仍然具有內分泌干擾性;SEs代謝產物可能與母體發生競爭性吸附,從而有可能增加母體的遷移轉化.
3.3 SEs在地下環境中的“穿透”過程
大部分室內實驗認為,土壤介質對SEs具有較強的吸附作用,且土壤微生物對SEs的降解迅速,因此,SEs在包氣帶內的穿透能力有限,最終能進入地下水體的SEs只是少數.Fan等[90]研究E2在25cm土柱中的遷移規律時發現,土壤對E2吸附較強,約70%的E2被截留于土柱中,且主要截留在土柱表層5cm.這與批試驗中土壤對E2有較強吸附能力結果是一致的.土壤有機質對SEs的截留作用更為顯著,Larsen等[91]利用柱實驗研究了17β-E2在砂土和富含有機質的粉質壤土中的遷移轉換時發現,在粉質壤土中出水無 17β-E2,其主要被截留在土柱表層5cm內,而沙土中90%的17β-E2可穿透土柱,說明隨著SOM的增加吸附作用增強,SEs移動性減小.
但在對實際場地的研究中發現,在施肥后的土壤與地下水中SEs含量很高,且長期存在,說明SEs在環境中具有一定的持久性.針對這種場地實驗與室內實驗研究結果相矛盾的現象,一些學者認為由于大部分室內實驗所用土樣破壞了土壤的天然結構,因此,沒有考慮天然土壤結構中優先流對SEs遷移的影響.D'Alessio等[92]對比SEs在原狀土與非原狀土柱中的遷移轉化發現,原狀土中的根孔等大空隙的存在使 SEs與土壤的接觸時間減少,促進了SEs的遷移.此外,土壤膠體的攜帶遷移也是導致包氣帶內 SEs遷移能力及持久性增強的另一主要原因. 例如,Thompson等[93]發現農業土壤中E2的移動性較強且能在土壤中長期存在,結果與許多室內實驗相矛盾,推測這可能是土壤膠體促進了 E2在土壤中的遷移. Holbrook等[94]監測污水處理系統中SEs存在形態時發現,水中可有60%的E2與有機膠體結合;Yamamoto等[95]也發現河水中15%~30%的E2與DOM結合;龔劍等[96]研究了珠江2 條河流中E1的含量分布、膠體/水相間的分配作用,結果發現:珠江河水中約24%~26%的E1存在于膠體相.說明膠體對SEs具有較強的親和力,從而增強其遷移能力.
可見,SEs會在各環境因素影響下隨水體不斷遷移,并進入底泥進一步穿透至地下水環境,擴大了其環境危害的范圍,加大了其環境污染的風險.只有不斷深入掌握SEs在環境介質中吸附、降解和遷移的特征及影響因素,才能有效控制其危害.
4 環境中SEs的危害控制措施
目前針對環境中 SEs治理主要集中于污水處理系統與水體的處理與去除,而針對畜禽糞便中 SEs的處理以及利用畜禽糞便施肥進入土壤系統后的修復措施研究很少.
4.1 水體中SEs的去除方法
目前針對水體中 SEs的去除方法主要有光降解、物理化學方法與微生物降解等.
4.1.1 光降解 SEs結構非常穩定,在自然環境下光降解的程度有限.關于SEs光降解的研究多數是基于紫外光(UV)等外加光源或有催化劑存在條件下的光催化降解.常用的催化劑有TiO2、Ti、Fe(III)等.Coleman等[97]在利用紫外光光照降解E2的實驗中發現,在體系中加入Ti能顯著提高 E2的光降解速率.Layton等[98]發現在紫外燈照射下,加入1g/L的TiO2能顯著催化E2的光解,經過3h E2能完全礦化.馬曉雁等[99]采用3種UV體系,即UV、UV/H2O2和UV/H2O2/TiO2降解水中E1、E2和EE2,結果表明,降解過程均符合一級反應動力學,單獨 UV 系統中,E1降解效果良好,降解率高于80%,E2與EE2的降解率較差,低于40%;H2O2和催化劑TiO2的投加可提高3種SEs的降解率, UV/H2O2/TiO2系統中3種SEs的降解率均高于80%,且E1幾乎完全降解.劉彬等[100]研究了在不同光源、光照強度與時間、pH、Fe3+等因素對水體中 EE2光降解的影響,發現紫外燈光照下的光降解速率比高壓汞燈光照下的大,且在弱酸性條件下與 Fe3+的存在能促進 EE2光降解.Colucci等[84]研究了水環境中E1的光降解效率,并證實了Fe(III)對E1光降解的促進作用;通過對 E1的降解機理與途徑進行研究發現,E1在光降解時破壞了苯環結構,生成了含有羥基的氧化產物.
4.1.2 物理-化學方法處理 (1)吸附:大多數SEs溶解度比較低,辛醇-水分配系數較高,因此在環境中易于從水相中分配到土壤/沉積物等固相中通過吸附和沉淀作用去除.水處理中常用的吸附劑有活性炭、活性污泥或失活污泥離子交換樹脂、殼聚糖等有機物.Synder等[101]發現活性炭對E2的吸附能力很強,吸附去除率高于50%,且吸附去除率隨 E2初始濃度的減少而降低.紀樹蘭等[102]研究了好氧活性污泥對E1、E2、EE2的吸附,40min達到吸附平衡,吸附率約為60%,且去除率隨溫度升高而降低.Yamamoto等[94]研究了SEs在多種吸附介質中的去除效率,發現 E2和EE2在單寧酸上的吸附最高,logKOC值分別為5.28和 5.22;在多糖酸上的吸附最弱,其 logKOC值分別為 2.62 和 2.53;而在腐殖酸上的 logKOC值一定程度上低于單寧酸;此外,進一步發現了SEs與含有苯環的物質具有較高的親和力,這是由于π-電子之間的相互作用所致.
(2)膜分離:利用膜工藝去除水體SEs以被廣泛研究與應用.Cartinella[103]用直接接觸膜蒸餾和反滲透膜研究了廢水中SEs去除特征,直接接觸膜的去除效率較高且穩定,截留率大于 99.5%;反滲透膜的截留率介于 77%~99%,與實驗持續時間和溶液中的化學成分有關.Yoon等[104]用納濾膜和超濾膜研究了不同飲用水源水中 SEs的去除,對E1、E2、E3和EE2的平均截留率約為40%左右.Chang 等[105]研究了疏水性中空纖維膜對E1的去除效率, E1的去除率介于46%~95%.各種膜工藝對水體中SEs的去除率差別明顯,這既與膜的種類、材質、孔徑等特性有關,還與水體的物化性質如pH值、離子強度等有關.
(3)高級氧化法:高級氧化法技術種類繁多,目前研究多集中于氧化處理條件的優化、氧化降解動力學以及SEs降解途徑3個方面的研究.常用的氧化劑有 O3、H2O2、NaClO、K2FeO4等.許多研究發現,將不同氧化劑進行優化組合后可顯著提高SEs的去除率,例如H2O2/O3、UV/H2O2、UV/Fendon等.Huber等[106]研究了臭氧對EE2的氧化機理,發現臭氧能選擇性的攻擊官能團,EE2分子苯環上的1/2鍵與O3反應活性最高,反應速率快,其次是乙炔基,且降解反應的中間產物雌激素活性不及EE2的0.5%.Ternes等[107]研究了O3及O3/H2O2對地表水中EE2的降解,O3氧化時二級降解速率常數為7×109/(M·s),而O3/H2O2組合氧化時為 9.8×109/(M·s).Rosenfeldt等[108]研究了UV與UV/H2O2對E2和EE2的去除特性,發現在利用UV降解時加入15mg/L的H2O2后,雌激素去除率由20%增加到90%以上.
4.1.3 微生物降解法 利用微生物降解去除SEs研究相對較多.Khanal等[2]研究發現污水處理系統中的活性污泥吸附和生物降解可以降低污水中的雌激素,如對E2的去除率可達90%,但對E1的去除率較低,為25%~80%.Ternes[109]等研究了多種 SEs在污水處理廠的活性污泥好氧處理過程中的生物降解特征,24h后1mg/L的E1、E2降解均高于50%;EE2經過24h降解20%,說明EE2 相對穩定.Kjoholt等[110]在研究缺氧條件下活性污泥降解SEs的實驗中發現,E1、E2和EE2的半衰期分別為 1.20h、2.01min和 4.13d,而在E1與E2共存的混合體系中,其半衰期為37.5min,介于兩者單獨降解時半衰期之間,其降解快慢順序為:E2>E1>EE2,與好氧降解時一致.在此基礎上,一些學者從環境樣品與活性污泥中分離出了SEs高效降解菌,并對其代謝途徑和影響因素進行了深入研究.Yoshimoto等[111]從污水處理廠分離得到了能夠同時降解E1、E2、E3與EE2 的紅球屬菌株(Rhodococcus zopfii和 Rhodococcus equi).Xiong 等[112]從土壤中分離出了一株雌激素 高 效 降 解 菌 Comamonas testosterone ATCC11996,并通過分子生物學手段鑒定并分離出了羥化類固醇脫氫酶/碳酰還原酶的抑制子和活化子.楊俊等[113]從廢水中分離出了一株對 E2具有高效降解能力的芽孢桿菌,對降解條件優化后其可在7d 內將初始濃度為50mg/L的E2完全降解.Yu等[114]從活性污泥中分離出 8株不同的E2的高效降解菌株,并對其降解特性進行了詳細的研究.Zheng等[115]發現了一株以 E2為唯一碳源的降解菌株Pseudomonas aeruginosa TJ1,并在次基礎上研究了吸附作用與生物作用對 E2 降解的影響.
4.2 土壤中SEs的去除方法
畜禽糞便通過堆肥或氧化塘過程可以自然降解 SEs. Zheng[83]等監測奶牛養殖場糞便的降解過程時發現,新鮮牛糞經過 3個月堆肥處理后,SEs由2100μg/kg降低到160μg/kg,同時監測氧化塘中SEs降解特征時發現,在第1氧化塘經過26h左右停留后SEs由26μg/L降低到450ng/Ll;經過第3氧化塘后低于檢出限.說明堆肥處理與氧化塘能有效去除畜禽糞尿中的SEs.Furuichi等[28]利用厭氧處理和滴流生物濾池好氧處理組合工藝對養豬廢水中SEs,去除效率可達90%以上,其中滴流生物濾池起關鍵作用,且對 17β-E2 和E1 的去除率優于17-αE2 和E3.Shappell等[116]基于濕地處理系統去除養豬糞便廢液中的 E1、E2 和E3,去除率分別為86%、46%和59%,在此基礎上將濕地處理與氧化塘相結合,SEs總去除率超過 80%.張真[117]利用污水土地處理系統-土壤凈化槽技術對農村污水中典型 SEs的去除效果進行了研究,E1、E2 和 E3平均去除率均能達到90%以上,EE2平均去除率為70%.雖然這些新處理技術能有效的去除畜禽糞便與土壤中的SEs,但仍不能處理完全,且還會產生二次污染的可能.
5 研究展望
5.1 對SEs的環境行為的研究主要集中在游離態,而針對結合態雌激素環境行為的研究幾乎空白.雖然結合態雌激素對生物的內分泌干擾性較低,但它在環境微生物作用下易轉化成游離態而重獲雌激素活性,其潛在污染風險不可忽略.
5.2 目前針對污水處理系統中SEs的遷移轉化與去除研究日趨成熟,而對其主要環境來源——畜禽糞便中的 SEs及其在農田土壤與地下水環境中的遷移轉換以及污染修復等研究相對薄弱.
5.3 由于對SEs在土壤中多種吸附過程的研究不夠深入和系統,未能深入闡明其吸附機制;此外,缺乏多 SEs溶質體系下環境行為研究,使得對SEs在土壤中的吸附與降解研究以實驗現象解釋為主,未能深入揭示其機理.
5.4 雖然針對SEs在土壤中的遷移轉化研究取得一定進展,但缺乏反映場地實際條件,如不同巖性組成的界面效應、降雨與灌溉影響下的干濕交替補給方式、包氣帶與毛細帶特征等影響下SEs在包氣帶與地下水含水層系統的穿透機制.
[1] Liu R, Zhou J L, Wilding A. Simultaneous determination of endocrine disrupting phenolic compounds and steroids in water by solid phase extraction gas-chromatography-mass spectrometry [J]. J. Chromatogr. A, 2004,1022(1/2):179-189.
[2] Khanal S K, Xie B, Thompson M L, et al. Fate, transport and biodegradation of natural estrogens in the environment and engineered systems [J]. Environmental Science and Technology,2006,40(21):6537-6546.
[3] Wilson V S, Lambright C, Ostby J, et al. In vitro and in vivo effects of 17β- trenbolone: a feedlot effluent contaminant [J]. Toxicol. Sci., 2002,70:202-211.
[4] 劉姝芳,李艷霞,張雪蓮,等.東北三省畜禽養殖類固醇激素排放及其潛在污染風險 [J]. 環境科學, 2013,34(8):3180-3187.
[5] Zuo Y G, Zhang K, Deng Y W. Occurrence and photochemicaldegradation of 17α-ethinylestradiol in Acushernet River estuary[J]. Chemosphere, 2006,63:1583-1590.
[6] 李曉曼,黃 斌,孫雯雯,等.類固醇雌激素環境行為研究進展[J]. 環境化學, 2014,33(8):1276-1286.
[7] Young W F, Whitehouse P, Johnson I, et al. Proposed predicted no effect concentrations (PNECs) for natural and synthetic steroid oestrogens in surface waters [M]. Environment Agency, 2002.
[8] Raman D R, Williams E L, Layton A C, et al. Estrogen Content of Dairy and Swine Wastes [J]. Environmental Science & Technology, 2004,38(13):3567-3573.
[9] Johnson A C, Williams R J, Matthiessen P. The potential steroid hormone contribution of farm animals to freshwaters, the United Kingdom as a case study [J]. Science of the Total Environment,2006,362(1-3):166-178.
[10] Zheng W, Li X, Yates S R, et al. Anaerobic transformation kinetics and mechanism of steroid estrogenic hormones in dairy lagoon water [J]. Environmental Science & Technology, 2012, 46(10):5471-5478.
[11] Liu Z H, Kanjo Y, Mizutani S. Urinary excretion rates of natural estrogens and androgens from humans, and their occurrence and fate in the environment: A review [J]. Sci. Total. Environ., 2009,407(18):4975-4985.
[12] Shrestha S L, Casey F X, Hakk H, et al. Fate and transformation of an estrogen conjugate and its metabolites in agricultural soils[J]. Environmental Science & Technology, 2012,46(20):11047-11053.
[13] Adler P, Steger-Hartmann T, Kalbfus W. Distribution of natural and synthetic estrogenic steroid hormones in water samples from Southern and Middle Germany [J]. Acta Hydrochimica et Hydrobiologica, 2001,29(4):227-241.
[14] Hoffmann B, dePinho T G, Schuler G. Determination of free and conjugated oestrogens in peripheral blood plasma, feces and urine of cattle throughout pregnancy [J]. Experimental and Clinical Endocrinology & Diabetes, 1997,105(5):296-303.
[15] LiuZ H, KanjoY, Mizutani S.Urinary excretion rates of natural estrogens and androgens from humans,and their occurrence and fate in the environment: A review [J]. Sci. Total Environ., 2009,407(18):4975-4985.
[16] Sophie D L, David L J. Biodegradation of estrone and 17b-estradiol in grassland soils amended with animal wastes [J]. Soil Biology & Bioehemistry, 2006,38:2803-2815.
[17] Farrell M, Jones D L. Critical evaluation of municipal solid waste composting and potential compost markets [J]. Bioresource Technology, 2009,100:4301-4310.
[18] Hobe G, Schon R, Goneharov N, et al. Some new aspects of 17a-estradiol metabolism in man [J]. Steroids, 2002,67(11):883-893.
[19] Kolpin D W, Furlong E T, Meyer M T, et al. Pharmaceuticals,hormones, and other organic wastewater contaminants in US streams, 1999~2000: A national reconnaissance [J]. Environmental Science & Technology, 2002,36(6):1202-1211.
[20] Tabata A, Kashiwada S, Ohnishi Y, et al. Estrogenic influences of estradiol-17b, p-nonylphenol and bis-phenol-A on Japanese Medaka (Oryzias latipes) at detected environmental concentrations [J]. Water Science and Technology, 2001,43(2):109-116.
[21] Shore L S, Shemesh M, Cohen R. The role of oestradiol and oestrone in chicken manure silage in hyperoestrogenism in cattle[J]. Australian Veterinary Journal, 1988,65(2):68-68.
[22] Finlay-Moore O, Hartel P G, Cabrera M L. 17β-estradiol and testosterone in soil and runoff from grasslands amended with broiler litter [J]. Journal of Environmental Quality, 2000,29(5):1604-1611.
[23] Peterson E W, Davis R K , Orndorff H A. 17β- estradiol as an indicator of animal waste contamination in mantled karst aquifers[J]. J. Environ. Qual., 2000,29:826-834.
[24] Kuch H M, Ballschmiter K. Determination of endocrine disrupting phenolic compounds and estrogens in surface and drinking water by HRGC-(NCI)-MS in the picogram per liter range [J]. Environ. Sci. Technol., 2001,35(15):3201-3206.
[25] Roefer P, Snyder S, Zegers R E, et al. Endocrine-disrupting chemicals in a source water [J]. American Water Works Association Journal, 2000,92(8):52.
[26] Hutchins S R, White M V, Hudson F M, et al. Analysis of lagoon samples from different concentrated animal feeding operations for estrogens and estrogen conjugates [J]. Environmental Science & Technology, 2007,41(3):738-744.
[27] Kj?r J, Olsen P, Bach K, et al. Leaching of estrogenic hormones from manure-treated structured soils [J]. Environmental Science & Technology, 2007,41(11):3911-3917.
[28] Furuichi T, Kannan K, Suzuki K, et al. Occurrence of estrogenic compounds in and removal by a swine farm waste treatment plant[J]. Environmental Science & Technology, 2006,40(24):7896-7902.
[29] Sarmah A K, Northcott G L, Leusch F D L, et al. A survey of endocrine disrupting chemicals (EDCs) in municipal sewage and animal waste effluents in the Waikato region of New Zealand [J]. Science of the Total Environment, 2006,355(1):135-144.
[30] Clara M, Kreuzinger N, Strenn B, et al. The solids retention time—a suitable design parameter to evaluate the capacity of wastewater treatment plants to remove micropollutants [J]. Water Research, 2005,39(1):97-106.
[31] Andersen H, Siegrist H, Halling-S?rensen B, et al. Fate of estrogens in a municipal sewage treatment plant [J]. Environmental Science & Technology, 2003,37(18):4021-4026.
[32] Angus R A, Stanko J, Jenkins R L, et al. Effects of 17αethynylestradiol on sexual development of male western mosquitofish (Gambusia affinis) [J]. Comparative Biochemistryand Physiology Part C: Toxicology & Pharmacology, 2005,140(3):330-339.
[33] Lee H B, Peart T E, Chan J, et al. Occurrence of endocrinedisrupting chemicals in sewage and sludge samples in Toronto,Canada [J]. Water Quality Research Journal of Canada, 2004,39(1):57-63.
[34] Nakada N, Tanishima T, Shinohara H, et al. Pharmaceutical chemicals and endocrine disrupters in municipal wastewater in Tokyo and their removal during activated sludge treatment [J]. Water Research, 2006,40(17):3297-3303.
[35] Johnson A C, Belfroid A, Di Corcia A. Estimating steroid oestrogen inputs into activated sludge treatment works and observations on their removal from the effluent [J]. Science of the Total Environment, 2000,256(2):163-173.
[36] Prietoa A, Vallejoa A, Zuloaga O, et al. Selective determination of estrogenic compounds in water by microextraction by packed sorbents and a molecularly imprinted polymer coupled with large volume injection-in-port-derivatization gas chromatographymass spectrometry [J]. Analytica Chimica Acta, 2011,703:41-51.
[37] Vulliet E, Wiest L, Baudot R, et al. Multi-residue analysis of steroids at sub-ng/L levels in surface and ground-waters using liquid chromatography coupled to tandem mass spectrometry [J]. J. Chromatogr. A, 2008,1210(1):84-91.
[38] Cathurn S, Sabik H. Determination of steroids and coprostanol in surface water, effluent and mussel using gas chromatographymass spectrometry [J]. Chromatographia, 2001,53:394-399.
[39] Velicu M, Suri R. Presence of steroid hormones and antibiotics in surface water of agricultural, suburban and mixed-use areas [J]. Environ. Monit. Assess, 2009,154(1/4):349-359.
[40] Isobe T, Shiraishi H, Yasuda M, et al. Determination of estrogens and their conjugates in water using solid-phase extraction followed by liquid chromatography-tandemmass spectrometry [J]. J. Chromatogr. A, 2003,984(1/2):195-202.
[41] Laganà A, Bacaloni A, Leva I D, et al. Analytical methodologies for determining the occurrence of endocrine disrupting chemicals in sewage treatment plants and natural waters [J]. Anal. Chim. Acta, 2004,501(1):79-88.
[42] Grovera D P, Zhou J L, Frickers P E, et al. Improved removal of estrogenic and pharmaceutical compounds in sewage effluent by full scale granular activated carbon: Impact on receiving river water [J]. J. Hazard. Mat., 2011,185:1005-1011.
[43] Lei B L, Huang S B, Zhou Y Q, et al. Levels of six estrogens in water and sediment from three rivers in Tianjin area, China [J]. Chemosphere, 2009,76(1):36-42.
[44] Wang L, Ying G G, Chen F, et al. Monitoring of selected estrogenic compounds and estrogenic activity in surface water and sediment of the Yellow River in China using combined chemical and biological tools [J]. Environ. Pollut., 2012,165:241-249.
[45] Beck J, Totsche K U, K?gel-Knabner I. A rapid and efficient determination of natural estrogens in soils by pressurised liquid extraction and gas chromatography—mass spectrometry [J]. Chemosphere, 2008,71(5):954-960.
[46] 韓 偉.奶牛及肉牛雌激素的排放及其環境遷移特征 [D]. 北京:北京師范大學, 2010:1-2.
[47] Huang B, Wang B, Ren D, et al. Occurrence, removal and bioaccumulation of steroid estrogens in Dianchi Lake catchment,China [J]. Environ. Int., 2013,59:262-273.
[48] Labadie P, Hill E M. Analysis of estrogens in river sediments by liquid chromatography-electrospray ionisation mass spectrometry comparison of tandem mass spectrometry and time-of-flight mass spectrometry [J]. J. Chromatogr. A, 2007,1141(2):174-181.
[49] Stanford B D, Weinberg H S. Isotope dilution for quantitation of steroid estrogens and nonylphenols by gas chromatography with tandem mass spectrometry in septic, soil, and groundwater matrices [J]. J. Chromatogr. A, 2007,1176(1/2):26-36.
[50] Hohenblum P, Gans O, Moche W, et al. Monitoring of selected estrogenic hormones and industrial chemicals in groundwaters and surface waters in Austria [J]. Science of the Total Environment, 2004,333(1):185-193.
[51] Swartz C H, Reddy S, Benotti M J, et al. Steroid estrogens,nonylphenol ethoxylate metabolites, and other wastewater contaminants in groundwater affected by a residential septic system on Cape Cod, MA [J]. Environ. Sci. Technol., 2006,40(16):4894-4902.
[52] Mansilha C, Melo A, Ferreira I M P L, et al. Groundwater from Infiltration Galleries Used for Small Public Water Supply Systems: Contamination with Pesticides and Endocrine Disruptors [J]. B Environ. Contam. Tox., 2011,87(3):312-318.
[53] Purdom C E, Hardiman P A, Bye V V J, et al. Estrogenic effects of effluents from sewage treatment works [J]. Chemistry and Ecology, 1994,8(4):275-285.
[54] Nimrod A C, Benson W H. Reproduction and development of Japanese medaka following an early life stage exposure to xenoestrogens [J]. Aquatic Toxicology, 1998,44(1):141-156.
[55] Biegel L B, Flaws J A, Hirshfield A N, et al. 90-day feeding and one-generation reproduction study in Crl: CD BR rats with 17β-estradiol [J]. Toxicological Sciences, 1998,44(2):116-142.
[56] Korsgaard B, Andreassen T K, Rasmussen T H. Effects of an environmental estrogen, 17α-EE2, on the maternal-fetal trophic relationship in the eelpout Zoarces viviparous [J]. Marine Environmental Research, 2002,54(3):735-739.
[57] 戴璇穎,徐世清.環境激素對生物的影響及其預防措施 [J]. 四川環境, 2003,22(6):13-16.
[58] Cargouet M, Perdiz D, Mouatassim-Souali A, et al. Assessment of river contamination by estrogenic compounds in Paris area(France) [J]. Science of the Total Environment, 2004,324(1):55-66.
[59] Brown R J, Conradi M, Depledge M H. Long-term exposure to 4-nonylphenol affects sexual differentiation and growth of the amphipod Corophium volutator (Pallas, 1766) [J]. Sci. Total Environ., 1999,223(1-3):77-88.
[60] Ternes T A, Stumpf M, Mueller J, et al. Behavior and occurrence of estrogensin municipal sewage treatment plants:I. Investigations in Germany, Canada and Brazil [J]. The Science of the Total Environment, 1999,225(1/2):81-90.
[61] Wicks C, Kelley C, Peterson E. Estrogen in a karstic aquifer [J]. Ground Water, 2004,42(3):384-389.
[62] Labadie P, Cundy A B, Stone K, et al. Evidence for the migration of steroidal estrogens through river bed sediments [J]. Environmental Science & Technology, 2007,41(12):4299-4304.
[63] Lee L S, Strock T J, Sarmah A K, et al. Sorption and dissipation of testosterone, estrogens, and their primary transformation products in soils and sediment [J]. Environmental Science & Technology, 2003,37(18):4098-4105.
[64] 李建中.典型內分泌干擾物在土壤中遷移轉化規律研究 [D].北京:清華大學, 2013.
[65] Van Emmerik T, Angove M J, Johnson B B, et al. Sorption of 17β-estradiol onto selected soil minerals [J]. Journal of Colloid and Interface Science, 2003,266(1):33-39.
[66] Shareef A, Angove M J, Wells J D, et al. Sorption of bisphenol A,17α-ethynylestradiol and estrone to mineral surfaces [J]. Journal of Colloid and Interface Science, 2006,297(1):62-69.
[67] 馬偉芳,陳 斌,曾凡剛,等.17β-雌二醇和炔雌醇在土壤中的吸附特性研究 [J]. 環境工程, 2014,32(9):109-114.
[68] Ren Y X, Nakano K ,Nomura M ,et al. A thermodynamic analysis on adsorption of estrogens in activated sludge process [J]. Water Research, 2007,41(11):2341-2348.
[69] 岳 波,靳 青,黃澤春,等.雌酮(E1)在土壤中的吸附特性 [J].環境科學研究, 2013,26(2):208-213.
[70] Francis X M, CaseY, Gerald L L, et al. Fate and transport of 17βestradiol in soil- water systems [J]. Environ. Sci. Technol, 2003,37:2400-2409.
[71] Lai K M, Johnson K L, Scrimshaw M D, et al. Binding of waterborne steroid estrogens to solid phases in river and estuarine systems [J]. Environmental Science & Technology, 2000,34(18):3890-3894.
[72] Takigami H, Taniguchi N, Shimizu Y. Sorption and desorption of 17beta-estradiol to natural sediment [J]. Water. Sci. Technol.,2011,64(7):1473-1478.
[73] Bedard M, Giffear K A, Ponton L, et al. Characterization of binding between 17β-estradiol and estriol with humic acid via NMR and biochemical Analysis [J]. Biophysical Chemistry, 2014,189:1-7.
[74] Diana L D L, Rudolf J S, Valdemar I E. Sorption behavior of EE2 on soils subjected to different long-termorganic amendments [J]. Science of the Total Environment, 2012,23:120-124.
[75] Yamamoto H, Liljestrand H M, Shimizu Y, et al. Effects of physical-chemical characteristics on the sorption of selected endocrine disruptors by dissolved organic matter surrogates [J]. Environmental Science & Technology, 2003,37(12):2646-2657.
[76] 姜 魯,王繼華,李建忠,等.炔雌醇和壬基酚在土壤中的吸附-吸特征 [J]. 環境科學, 2012,33(11):3885-3892.
[77] Combalbert S, Hernandez-Raquet G. Occurrence, fate, and biodegradation of estrogens in sewage and manure [J]. Appl. Microbiol. Biotechnol, 2010,86:1671-1692.
[78] Xuan R, Blassengale A A, Wang Q. Degradation of estrogenic hormones in a silt loam soil [J]. Journal of Agricultural and Food Chemistry, 2008,56(19):9152-9158.
[79] Ying G G, Kookana R S, Dillon P. Sorption and degradation of selected five endocrine disrupting chemicals in aquifer material[J]. Water Research, 2003,37:3785-3791.
[80] Peck M, Gibson R W, Kortenkamp A, et al. Sediments are major sinks of steroidal estrogens in two United Kingdom rivers [J]. Environmental Toxicology & Chemistry, 2004,23:945-952.
[81] Colucci M S, Topp E. Persistence of estrogenic hormones in agricultural soils: II. 17alpha-ethynylestradiol [J]. J. Environ. Qual., 2001,30(6):2077-2080.
[82] Fan Z, Casey F X M, Hakk H, et al. Persistence and fate of 17β-estradiol and testosterone in agricultural soils [J]. Chemosphere, 2007,67(5):886-895.
[83] Zheng W, Yates S R, Bradford S A. Analysis of steroid hormones in a typical airy waste disposal system [J]. Environ. Sci. Technol.,2008,42(2):530-535.
[84] Colucci M S. Topp E. Persistence of estrogenic hormones in agricultural soils: I. 17β- estradiol and estrone [J]. J. Environ. Qual., 2001,30:2070-2076.
[85] Goeppert N, Dror I, Berkowitz B. Detection, fate and transport of estrogen family hormones in soil [J]. Chemosphere, 2014,95:336-345.
[86] Casey F X M, Larsen G L, Hakk H, et al. Fate and Transport of 17β-Estradiol in Soil-Water Systems [J]. Environ. Sci. Technol.,2003,37(11):2400-2409.
[87] Das B S, Lee L S, Rao P, et al. Sorption and degradation of steroid hormones in soils during transport: Column studies and model evaluation [J]. Environ. Sci. Technol., 2004,38(5):1460-1470.
[88] Fan Z, Casey F X M, Hakk H, et al. Discerning and modeling the fate and transport of testosterone in undisturbed soil [J]. Journal of Environmental Quality, 2007,36(3):864-873.
[89] Lee J H, Zhou J L, Kim S D. Effects of biodegradation and sorption by humic acid on the estrogenicity of 17β-estradiol [J]. Chemosphere, 2011,85(8):1383-1389.
[90] Fan Z S, Casey F, Hakk H, et al. Modeling coupled degradation,sorption, and transport of 17beta-estradiol in undisturbed soil A-2135-2010 [J]. Water Resour. Res., 2008,44(W084248).
[91] LARSEN G, CASEY F, MAGELKY B, et al. Second International Conference on Pharmaceuticals and Endocrine Disrupting Chemicals in Water [R]. October 9-11, Minneapolis,MN, 2001.
[92] D'Alessio M, Vasudevan D, Lichwa J, et al. Fate and transport of selected estrogen compounds in Hawaii soils: Effect of soil type and macropores [J]. Journal of Contaminant Hydrology, 2014,166 1-10.
[93] Thompson M L, Casey F X M, Khan E, et al. Occurrence and pathways of manure-borne 17β-estradiol in vadose zone water[J]. Chemosphere, 2009,76(4):472-479.
[94] Holbrook R D, Love N G, Novak J T. Sorption of 17β-estradiol and 17α-ethinylestradiol by colloidal organic carbon derived from biological wastewater treatment systems [J]. Environmental Science & Technology, 2004,38(12):3322-3329.
[95] Yamamoto H, Liljestrand H. The fate of estrogenic compounds in the aquatic environment: sorption onto organic colloids [J]. Water Science & Technology, 2003,47(9):77-84.
[96] 龔 劍,黃 文,楊 娟,等.珠江河流膠體中的典型內分泌干擾物 [J]. 中國環境科學, 2011,31(11):1904-1909.
[97] Coleman M, Eggins R, Byrne J, et al. Photocatalytic Degradation of 17β-estradiol onimmobilized Ti O2[J]. Applied Catalysis B:Environmental, 2000,24(2):L1-L5.
[98] Layton A. C, Gregory B. W, Seward J. R, et al. Mineralization of steroidal hormones by biosolids in waste water treatment systems in Tennessee USA [J]. Environmental Science & Technology,2000,34(18):3925-3931.
[99] 馬曉雁,倪夢婷,倪永炯,等.UV體系中3種微量類固醇雌激素的競爭降解及同趨轉化 [J]. 中國環境科學, 2014,34(4):904-911.
[100] 劉 彬,劉先利,吳 峰,等.水溶液中 17α-乙炔基雌二醇的光降解 [J]. 環境科學學報, 2003,23(4):508-511.
[101] Snyder S A, Westerhoff P, Yoon Y, et al. Pharmaceuticals,personal care products, and endocrine disruptors in water:implications for the water industry [J]. Environmental Engineering Science, 2003,20(5):449-469.
[102] 紀樹蘭,楊媛媛,秦振平,等.好氧顆粒污泥等溫吸附甾體雌激素[J]. 北京工業大學學報, 2009,(11):1537-1542.
[103] Cartinella J L, Cath T Y, Flynn M T, et al. Removal of natural steroid hormones from wastewater using membrane contactor processes [J]. Environmental Science & Technology, 2006,40(23):7381-7386.
[104] Yoon Y, Westerhoff P, Snyder S A, et al. Removal of endocrine disrupting compounds and pharmaceuticals by nanofiltration and ultrafiltration membranes [J]. Desalination, 2007,202(1):16-23.
[105] Chang S, Waite T D, Sch?fer A I, et al. Adsorption of the endocrine-active compound estrone on microfiltration hollow fiber membranes [J]. Environmental Science & Technology, 2003,37(14):3158-3163.
[106] Huber M M, Ternes T A, Von Gunten U. Removal of estrogenic activity and formation of oxidation products during ozonation of 17α-ethinylestradiol [J]. Environmental Science & Technology,2004,38(19):5177-5186.
[107] Ternes T A, Stüber J, Herrmann N, et al. Ozonation: a tool for removal of pharmaceuticals, contrast media and musk fragrances from wastewater [J]. Water Research, 2003,37(8):1976-1982.
[108] Rosenfeldt E J, Linden K G. Degradation of endocrine disrupting chemicals bisphenol A, ethinyl estradiol, and estradiol during UV photolysis and advanced oxidation processes [J]. Environmental Science & Technology, 2004,38(20):5476-5483.
[109] Ternes T A, Kreckel P, Mueller J. Behaviour and occurrence of estrogens in municipal sewage treatment plants—II. Aerobic batch experiments with activated sludge [J]. Science of the Total Environment, 1999,225(1):91-99.
[110] Kj?lholt J. Degradation of estrogens in sewage treatment processes [M]. Danish Environmental Protection Agency, 2004.
[111] Yoshimoto T, Nagai F, Fujimoto J, et al. Degradation of estrogens by Rhodococcus zopfii and Rhodococcus equi isolates from activated sludge in wastewater treatment plants [J]. Appl. Environ. Microbiol., 2004,68(4):2057-2060.
[112] Xiong G M, Draus E, Luo Y, et al. 3α-hydroxysteroid dehydorgenase/carbonyl reductase as a tool for isolation and characterization of a new marine steroid degrading bacterial strain[J]. Chemico-Biological Interactions, 2009,178:206-210.
[113] 楊 俊,姜理英,陳建孟.1株17β-雌二醇高效降解菌的分離鑒定及降解特性 [J]. 環境科學, 2010,31(5):1313-1319.
[114] Yu C P, Roh H, Chu K H. 17β-Estradiol-degrading bacteria isolated from activated sludge [J]. Environ. Sci. Technol.,2007,41(2):486-492.
[115] Zeng Q, Li Y, Gu G, et al. Sorption and biodegradation of 17β-estradiol by acclimated aerobic activated sludge and isolation of the bacterial strain [J]. Environmental Engineering Science, 2009,26(4):783-790.
[116] Shappell N W, Billey L O, Forbes D, et al. Estrogenic activity and steroid hormones in swine wastewater through a lagoon constructedwetland system [J]. Environ. Sci. Technol., 2007,41:444-450.
[117] 張 真.14C-BPA 及雌激素在污水土地處理系統中吸附降解研究 [D]. 上海:上海交通大學, 2013.
Fate and ecological regulation of steroidal estrogens in subsurface environment.
SONG Xiao-ming1, YANG Yue-suo1,2*, WEN Yu-juan1, M. Adeel1, WANG Yuan-yuan1, YANG Xin-yao1(1.Key Laboratory of Regional Environment and Eco-restoration, Ministry of Education, Shenyang University, Shenyang 110044, China;2.College of Environment and recourses, Changchun 130012, China). China Environmental Scinence, 2016,36(9):2828~2840
This paper reviewed the sources, hazard and environmental fate of typical steroidal estrogens, both conjugate and free phases, in environment. The migration and transformation processes of steroidal estrogens through soil and shallow groundwater system, such as sorption and biodegradation, were thoroughly reviewed. The most popular treatment technologies and risk management practices were also critically summarized. Finally, based on current studies on the penetration and ecological impact of steroidal estrogens in vadose zone and shallow groundwater system, the perspectives of future research was proposed.
steroidal estrogens;subsurface environment;sorption;microbial degradation;fate and transport
X171.5
A
1000-6923(2016)09-2828-13
2016-01-05
國家自然科學基金項目(41272255,41472237);遼寧省創新團隊項目(LT201502);沈陽市科技計劃項目(F14-133-9-00, F15-113-9-00)
* 責任作者, 教授, YangYuesuo@jlu.edu.cn
宋曉明(1985-),男,吉林柳河人,沈陽大學環境學院博士研究生,主要從事有機污染物在環境中的遷移轉化及污染場地生態修復等研究.

