液相色譜-線性離子阱-靜電場軌道阱回旋共振組合質譜法鑒定乙胺嘧啶在大鼠體內的代謝物
懷彬彬 郭春娜 李 強 郜 進 謝 順 黃顯會
(華南農業大學獸醫學院,國家獸藥殘留基準實驗室,廣州 510640)
?
液相色譜-線性離子阱-靜電場軌道阱回旋共振組合質譜法鑒定乙胺嘧啶在大鼠體內的代謝物
懷彬彬 郭春娜 李 強 郜 進 謝 順 黃顯會*
(華南農業大學獸醫學院,國家獸藥殘留基準實驗室,廣州 510640)
研究乙胺嘧啶在大鼠體內的代謝方式與途徑。大鼠以5 mg/kg單劑量口服乙胺嘧啶后,在不同時間點分別采集其血液、尿液和糞便樣品。采用液相色譜-線性離子阱-靜電場軌道阱回旋共振組合質譜儀(LC-LTQ-Orbitrap)檢測乙胺嘧啶在大鼠體內的代謝物,結合相關代謝軟件,共鑒定出10種代謝產物,主要的代謝途徑包括苯環上的羥基化、N-氧化、雙氧化、N-葡萄糖醛酸結合、甲基化+葡萄糖醛酸結合、羥基化+葡萄糖醛酸結合和N-氧化+葡萄糖醛酸結合。除乙胺嘧啶3-N-氧化物已經在大鼠體外代謝研究中被發現外,其余9種代謝產物均首次在大鼠體內發現。 根據其精確分子量及多級質譜的碎片特征,對這些代謝產物的化學結構做出推斷,并建立乙胺嘧啶在大鼠體內的代謝譜系。研究表明,乙胺嘧啶在大鼠體內的Ⅰ相代謝方式主要是羥基化和N位氧化,Ⅱ相代謝方式主要是甲基化和葡萄糖醛酸結合。
乙胺嘧啶; 大鼠; 線性離子阱-靜電場軌道阱回旋共振質譜; 代謝物
1 引 言
乙胺嘧啶(Pyrimethamine,PYR)又稱2,4-二氨基-6-乙基-5-對氯苯基嘧啶,分子式為C12H13CIN4,是一種二氨基嘧啶的衍生物。二氨基嘧啶類化合物(Dia minopyrimidines)包括許多二氫葉酸還原酶抑制劑藥物,除乙胺嘧啶外,還有三甲曲沙和吡曲克辛等[1],其中以乙胺嘧啶的抗原蟲活性最強。乙胺嘧啶主要作用于二氫葉酸還原酶,阻斷四氫葉酸的產生,導致核酸合成減少,使得原生生物的細胞核分裂受阻,繁殖受到抑制。因此,它被普遍用于瘧疾的預防和治療,另外乙胺嘧啶與磺胺類的聯用也被認為是針對人畜共患的弓形蟲病最有效的治療方式[2]。在獸醫臨床,乙胺嘧啶還可用于防治禽類球蟲病、瘧原蟲病和雞的住白細胞原蟲病等。但是, 許多研究表明,乙胺嘧啶對不同動物都表現出生殖毒性或基因毒性并且有著不同程度的致畸能力[3~7]。然而,關于乙胺嘧啶在動物體內代謝研究的基礎資料卻非常少。 除早期少量國外文獻對大鼠體外代謝研究中可見代謝物乙胺嘧啶3-N-氧化物的報道[8,9],目前,對乙胺嘧啶在大鼠體內其它代謝方式并不明確,因此難以對乙胺嘧啶做進一步的毒性評估。
隨著技術的成熟和發展,高分辨質譜儀越來越多地應用于藥物的代謝研究[10~13]。本研究選用的分析儀器是線性離子阱-靜電場軌道阱回旋共振組合質譜儀(LTQ-Orbitrap MS),其中LTQ能夠獲得化合物多級質譜(MSn)下的碎片離子,可提供化合物豐富的結構信息,而Orbitrap則保證了高質量精度和分辨率[14~16],再結合藥物原型成分的質譜裂解行為和相應分析軟件,可快速分析鑒定出可能的代謝產物[17]。采用本方法,在大鼠的生物樣品中共鑒定出10種代謝產物,并建立起乙胺嘧啶在大鼠體內可能的代謝譜系。
2 實驗部分
2.1 儀器與試劑
液相色譜系統配置FINNAGAN SURVEYOR MS Pump Plus和Autosampler Plus(美國Thermo Fisher公司);線性離子阱-靜電場軌道阱回旋共振組合質譜儀(LTQ Orbitrap Discovery,美國Thermo Fisher公司); Xcalibur工作站和Mass Frontier 5.0軟件(美國Thermo Fisher公司);Milli-Q 超純水系統(美國Millipore公司);AUW120D型電子分析天平(日本島津公司);HS250 Basic型旋渦振蕩器(馬來西亞IKA公司);N-EVAPTM11型氮氣吹干儀(Organomation Asscociate公司);HS10260D型超聲儀(Benchtop公司)。
乙胺嘧啶(99.6%,批號20140729,金壇市鑫達醫藥化工有限公司); 6mL Poly-Sery MCX小柱(上海安譜科學儀器有限公司); 甲醇、乙腈和甲酸為色譜純(美國ThermoFisher公司),其它試劑均為分析純。
2.2 實驗動物與樣品采集
SD大鼠10只,雌雄各半,體重為(203.8±6.4) g,購自南方醫科大學實驗動物中心。PYR按5 mg/kg單劑量灌服給藥。給藥前12 h及給藥后4 h禁食,僅提供自由飲水。給藥前經眼眶靜脈采集空白血樣,收集空白尿液和糞便。分別在給藥3, 6, 12和24 h后采集血樣, 并收集6, 12, 24, 36和48 h各時間段內的全部尿液和糞便。每次采血1 mL左右,置于含肝素鈉生理鹽水的 1.5 mL 塑料離心管中,混勻。在4℃下,4000 r/min離心10 min制備血漿;糞便70℃下烘干之后,研磨成粉末。所有血漿、尿液和糞便樣品-20℃保存,待測。
2.3 實驗方法
2.3.1 色譜-質譜條件 Agilent ZORBAX SB-Aq色譜柱(50 m×2.1 mm,3.5 μm);流動相:乙腈(A)和0.1%甲酸(B),梯度洗脫: 0~2 min,100% B; 2~13 min,100%~45% B; 13~17 min,45% B; 17~18 min,45%~100% B; 18~25 min,100% B。柱溫35℃ ,流速0.25 mL/ min,進樣量10 μL。
離子源:電噴霧電離(ESI);離子化方式:正離子模式;掃描范圍:m/z50~800 Da; 質譜參數:噴霧電壓4.5 kV;毛細管溫度300℃;毛細管電壓4.0 kV;鞘氣(N2)流速25 units;輔助氣(N2)流速:11 units;管狀透鏡電壓:120 V;碰撞能:30~50 eV。
2.3.2 代謝產物的鑒定與分析 首先,對原形進行質譜分析,找出特征碎片離子,初步預測原形可能存在的代謝過程與途徑。然后,結合軟件Mass Frontier 5.0得到的結構式和通過Xcalibur 2.0軟件優化色譜與質譜條件得到理想的樣品色譜圖,對軟件 MetWorks 1.2的預測代謝途徑與數據后處理參數進行設置,經質量虧損過濾(MMDF),若分子離子峰與預測代謝物分子量的誤差范圍在±5 mDa以內,則可初步判定該預測代謝物的存在。最后,對初步判定的預測代謝物進行MSn結構分析,如果預測代謝物具有與原形相同或相似的特征碎片離子,可確定其為代謝物。
2.3.3 樣品的前處理 (1)血漿和尿液 取0.5 mL血漿或尿液樣品于15 mL塑料離心管中,加入10%三氯乙酸(TCA)3 mL,渦旋10 s,超聲提取10 min,振蕩20 min,8000 r/min離心10 min,轉移提取液至另一塑料離心管,重復一次,合并上清液,備用。選用MCX SPE小柱凈化萃取,程序如下:依次加入5 mL甲醇,5 mL水活化小柱,然后加入備用提取液,待過濾完后,依次加入5 mL水,3 mL甲醇淋洗,真空抽干,最后加入5 mL氨化甲醇(氨水-甲醇,5∶95,V/V)洗脫,收集洗脫液于10 mL玻璃試管。在45℃下,N2吹干,之后用0.5 mL 50%乙腈復溶,過0.22 μm微孔濾膜,待測。(2)糞便 取1 g糞便樣品于15 mL塑料離心管中,加入10%三氯乙酸(TCA)5 mL,渦旋10 s,超聲提取10 min,振蕩20 min,8000 r/min離心10 min,轉移提取液,重復一次,合并上清液。殘渣加入3 mL二氯甲烷-正己烷(1∶1,V/V), 渦旋10 s,超聲提取10 min,振蕩20 min ,6000 r/min離心10 min,轉移提取液于玻璃試管,在45℃下,N2吹干,用1 mL 50%甲醇復溶后,合并至收集的提取液中,備用。選用MCX SPE小柱凈化萃取,程序如下:依次加入5 mL甲醇、5 mL水活化小柱,然后加入提取液,待過完后,依次加入5 mL水,3 mL甲醇淋洗,真空抽干,最后加入5 mL氨化甲醇洗脫,收集洗脫液于10 mL玻璃試管。在45℃下,N2吹干,用 1 mL 50%乙腈復溶,過0.22 μm微孔濾膜,待測。
3 結果與討論
3.1 乙胺嘧啶的代謝概況
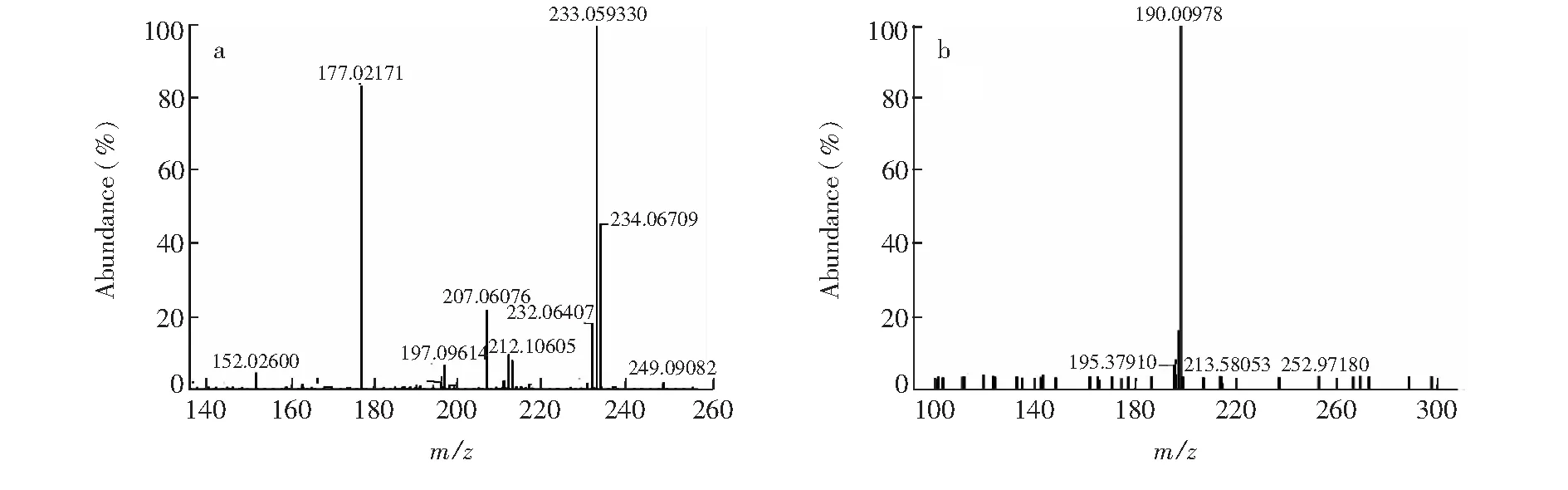
圖1 PYR的MS2(a)和MS3(b)碎片離子的質譜圖(m/z 234.07, 233.06, 177.02和198.09)Fig.1 MS2(a) and MS3 (b) spectra of pyrimethamine (PYR) showing product ions at m/z 234.07, 233.06, 177.02 and 198.09
3.1.1 乙胺嘧啶的主要碎片離子和裂解途徑 PYR的一級準分子離子峰[M+H]+為m/z249.09015。如圖1所示,其主要二級碎片離子有[M+H-CH4]+(m/z233.06),[M+H-C3H8N2]+(m/z177.02),[M+H-CH3]+(m/z234.07),以m/z233.06為先導碎片離子的三級碎片離子主要是[M+H-CH4-Cl]+(m/z198.09)。根據以上結果,推斷 PYR可能的裂解途徑,見圖2。而所有這些碎片離子是用來鑒定PYR代謝物的重要依據。PYR及各碎片離子的分子量預測值和實測值,環和雙鍵數及誤差等信息見表1。
表1 PYR及其碎片離子的分子式、測定值、預測值、環和雙鍵數及誤差
Table 1 Elemental composition, observed and calculated masses, ring and double-bond equivalents (RDBs), and mass errors of protonated PYR and its fragmentations
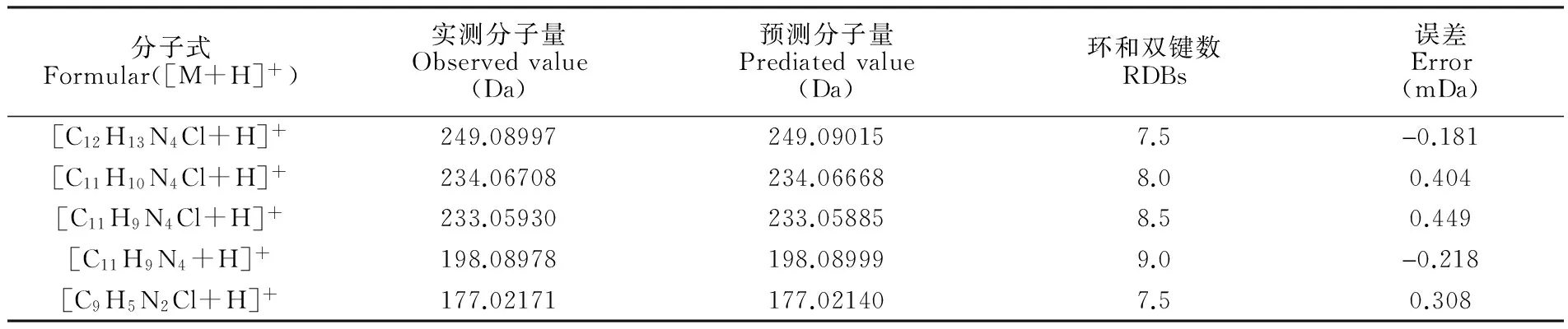
分子式Formular([M+H]+)實測分子量Observedvalue(Da)預測分子量Prediatedvalue(Da)環和雙鍵數RDBs誤差Error(mDa)[C12H13N4Cl+H]+249.08997249.090157.5-0.181[C11H10N4Cl+H]+234.06708234.066688.00.404[C11H9N4Cl+H]+233.05930233.058858.50.449[C11H9N4+H]+198.08978198.089999.0-0.218[C9H5N2Cl+H]+177.02171177.021407.50.308
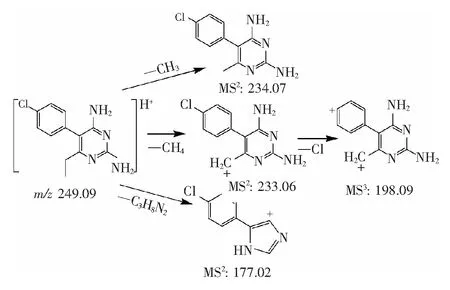
圖2 PYR可能的裂解途徑Fig.2 Fragmentation pathways for PYR
3.1.1 乙胺嘧啶在血漿中的代謝產物 如圖3所示,大鼠單劑量內服PYR(5 mg/kg)后,在6 h的血漿樣品中檢測出最多代謝物,共8種可能代謝物。其中PM1,PM2, PM3和PM4是PYR的I相代謝物,而PM5, PM6, PM9和PM10為PYR的Ⅱ相代謝物。
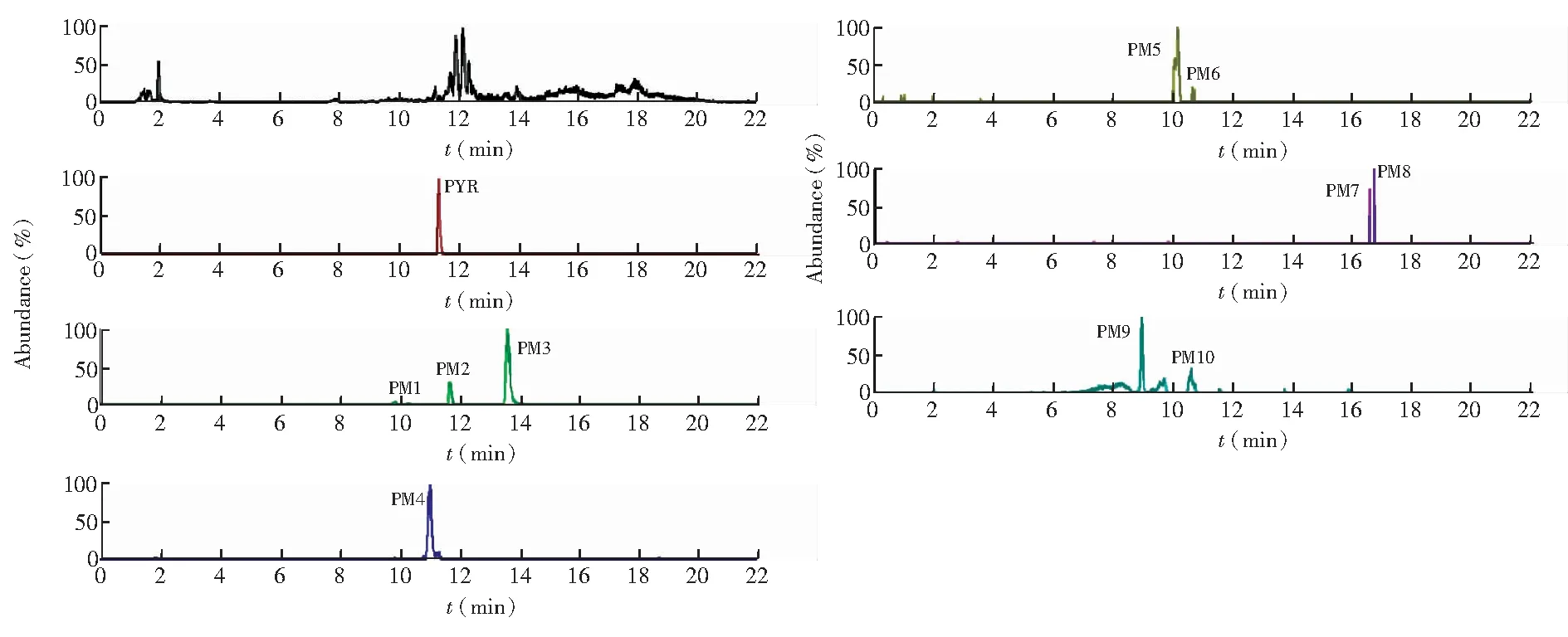
圖3 大鼠單劑量內服PYR(5 mg/kg)后6 h血漿中代謝物的精確提取離子色譜圖Fig.3 Ion chromatograms (EIC) of plasma from rat at 6 h after oral administration of PYR at 5 mg/kg
3.1.2 乙胺嘧啶在排泄物中的代謝產物 在12~24 h時間段的尿液樣品中,檢測出最多的10種代謝產物,其中PM7和PM8只在尿液種檢出,見圖4。而在12~24 h時間段糞便樣品中,共檢出9種代謝物,相比尿液中少了PM10,見圖5。各代謝物的分子式、預測分子量、實測分子量,碎片離子信息及誤差見表2。各代謝物實測精確分子量的誤差均在5 ppm以內,表明各代謝物元素組成的可信度很高。
3.2 乙胺嘧啶的Ⅰ相代謝物
乙胺嘧啶Ⅰ相代謝物的精確MSn質譜圖如圖6。Ⅰ相代謝物PM1, PM2和PM3的保留時間(tR)分別為10.48,11.86和 13.77 min,質子分子離子峰[M+H]+均為m/z265.09,比質子化的PYR多16 Da,提示均為氧化所得,但氧化方式則可能是芳環上的氧化或嘧啶環N位的配位氧化。對三者進行MSn分析,發現PM2和PM3的主要二級碎片離子脫掉一分子H2O和OH-得到[M+H-H2O]+(m/z247.07)和[M+H-OH]+(m/z248.08),而m/z248.08恰好是未質子化的PYR的分子量,將m/z248.08繼續碎裂得到的主要三級碎片離子為在苯環的3、4號位去掉HCl而得到的[M+H-OH-HCl]+(m/z212.11),從而推測PM2和PM3分別為PYR嘧啶環上3-N位和1-N位發生氧化的產物(3 or 1-N-oxide-PYR);而PM1的主要二級碎片離子只有[M+H-H2O]+(m/z247.07),其三級碎片離子[M+H-H2O-Cl]+(m/z212.11)卻與PM2和PM3的相同,這說明PM1較PM2和PM3在氧化方式上可能有所不同,加之PM1的保留時間最早,故推測PM1為極性較強的苯環上羥基化產物。而芳環上的羥基化是芳香化合物首先被代謝為相應的環氧化物,之后發生NIH遷移重排成酚。有研究表明,含鹵素的芳環也會發生NIH遷移,例如對-氯安非他明在大鼠肝臟中可代謝為3-氯-4-羥基安非他明[18]。據此推測出PM1的化學結構(4′-OH-PYR),見圖8。
表2 PYR及其代謝物的可能分子式、保留時間、實測分子量、預測分子量和主要碎片離子
Table 2 Predicated formula, retention time, observed mass, predicated mass, mass errors and major fragment ions of PYR and its metabolites
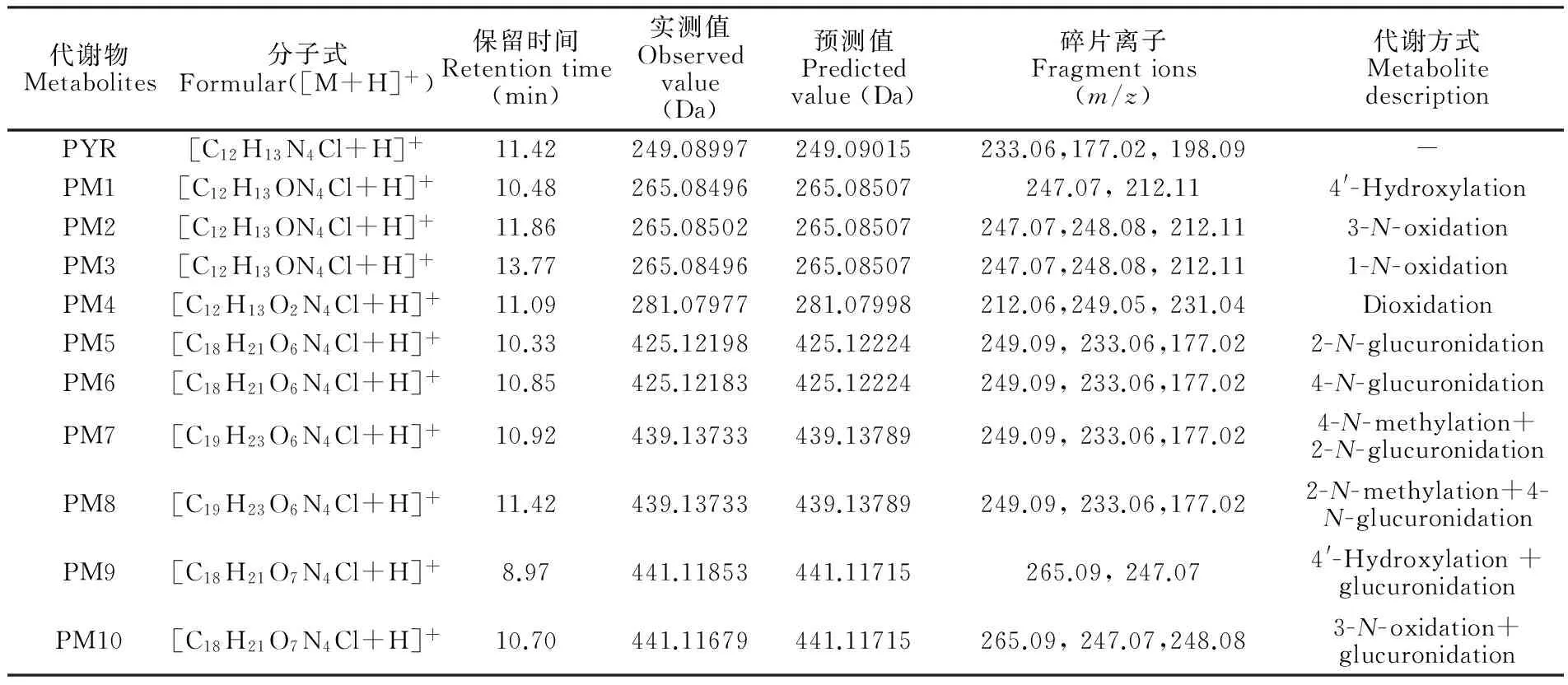
代謝物Metabolites分子式Formular([M+H]+)保留時間Retentiontime(min)實測值Observedvalue(Da)預測值Predictedvalue(Da)碎片離子Fragmentions(m/z)代謝方式MetabolitedescriptionPYR[C12H13N4Cl+H]+11.42249.08997249.09015233.06,177.02,198.09-PM1[C12H13ON4Cl+H]+10.48265.08496265.08507247.07,212.114'-HydroxylationPM2[C12H13ON4Cl+H]+11.86265.08502265.08507247.07,248.08,212.113-N-oxidationPM3[C12H13ON4Cl+H]+13.77265.08496265.08507247.07,248.08,212.111-N-oxidationPM4[C12H13O2N4Cl+H]+11.09281.07977281.07998212.06,249.05,231.04DioxidationPM5[C18H21O6N4Cl+H]+10.33425.12198425.12224249.09,233.06,177.022-N-glucuronidationPM6[C18H21O6N4Cl+H]+10.85425.12183425.12224249.09,233.06,177.024-N-glucuronidationPM7[C19H23O6N4Cl+H]+10.92439.13733439.13789249.09,233.06,177.024-N-methylation+2-N-glucuronidationPM8[C19H23O6N4Cl+H]+11.42439.13733439.13789249.09,233.06,177.022-N-methylation+4-N-glucuronidationPM9[C18H21O7N4Cl+H]+8.97441.11853441.11715265.09,247.074'-Hydroxylation+glucuronidationPM10[C18H21O7N4Cl+H]+10.70441.11679441.11715265.09,247.07,248.083-N-oxidation+glucuronidation
PM4(tR=11.09 min)的質子分子離子峰[M+H]+為m/z281.08,比質子化的PYR多32 Da。PM4的二級碎片離子主要有[M+H-O-CH4]+(m/z249.05)和[M+H-O2-C2H4]+(m/z212.06),
以m/z249.05為先導離子的主要三級碎片為[M+H-O-CH4-H2O]+(m/z231.04),因此,推測PM4是PYR的雙氧化產物(Dioxide-PYR),考慮其保留時間介于PM1和PM2之間,最可能是PYR經3-N-氧化和苯環上羥基化所得。
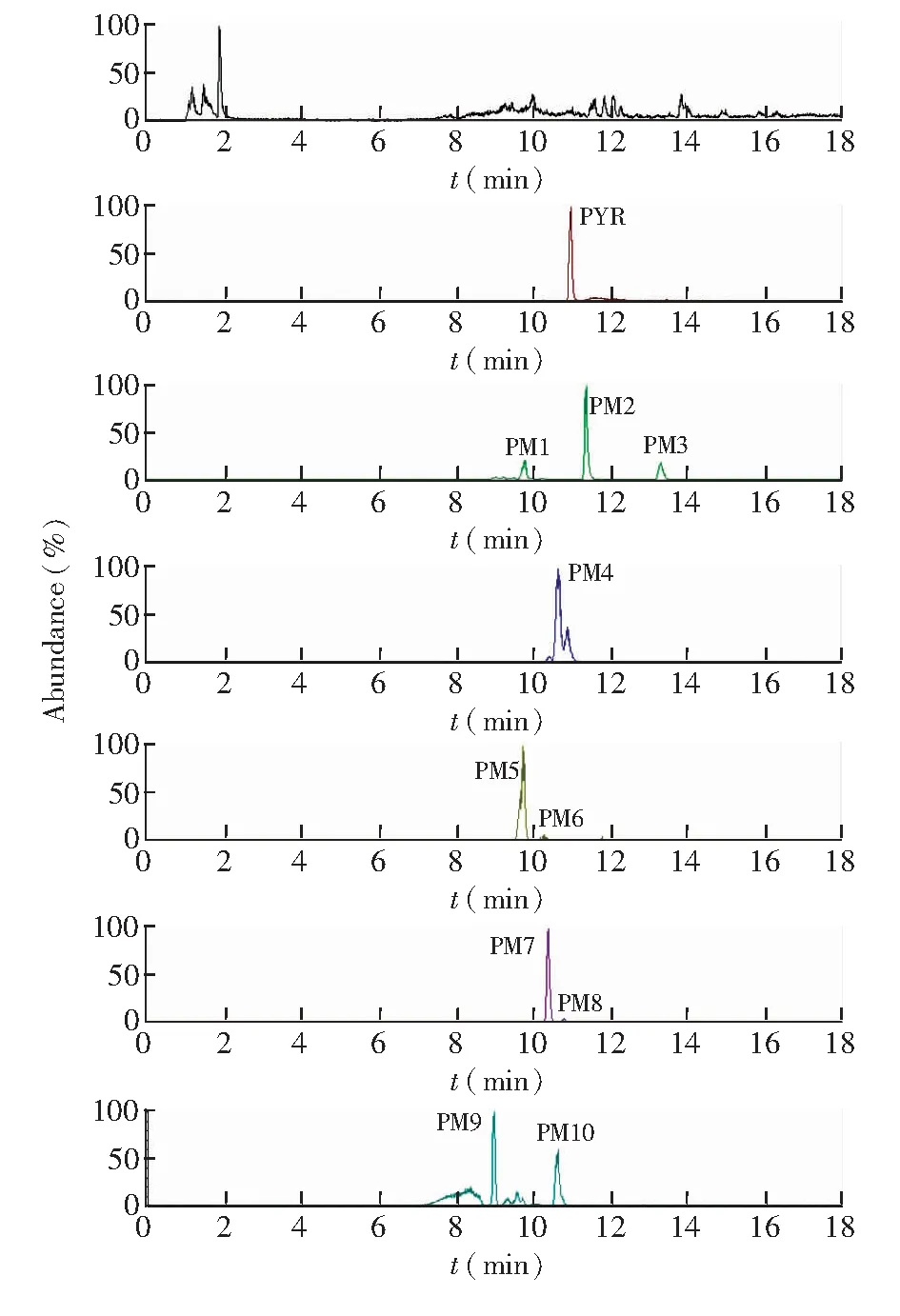
圖4 大鼠單劑量內服PYR(5 mg/kg)后12~24 h尿液中代謝物的精確提取離子色譜圖Fig.4 Ion chromatograms (EIC) of urine between 12 and 24 h from rat after oral administration of PYR at 5 mg/kg
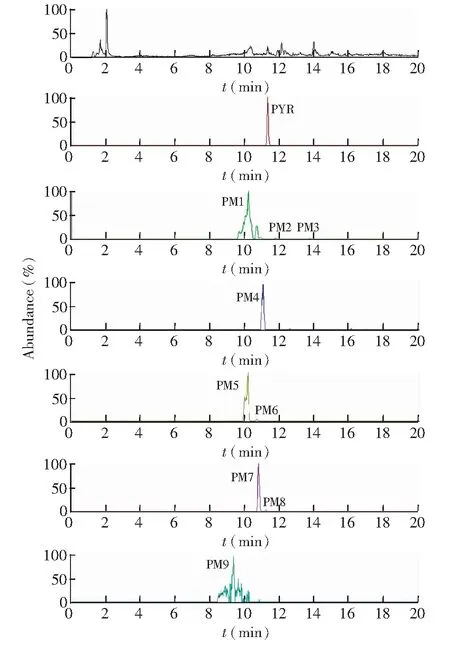
圖5 大鼠單劑量內服PYR(5 mg/kg)后12~24 h糞便中代謝物的精確提取離子色譜圖Fig.5 Ion chromatogram (EIC) of feces between 12 and 24 h from rat after oral administration of PYR at 5 mg/kg
3.3 乙胺嘧啶的Ⅱ相代謝物
乙胺嘧啶Ⅱ相代謝物的精確MSn質譜圖如圖7。
PM5(tR=10.33 min)和PM6(tR=10.85 min)的質子分子離子峰[M+H]+均為m/z425.12,比質子化的PYR多176 Da,恰是葡萄糖醛酸(C6H8O6)的分子量。在MSn分析中,二者的二級碎片離子主要有[M+H- C6H8O6]+(m/z249.09),并且以m/z249.09作為先導離子的三級質譜中得到了m/z233.06和177.02,這與質子化PYR的一級和二級質譜完全相同。由此判斷PM5和PM6分別為PYR的2或4-N-葡萄糖醛酸結合物(2 or 4-N-Glucuronide-PYR)。
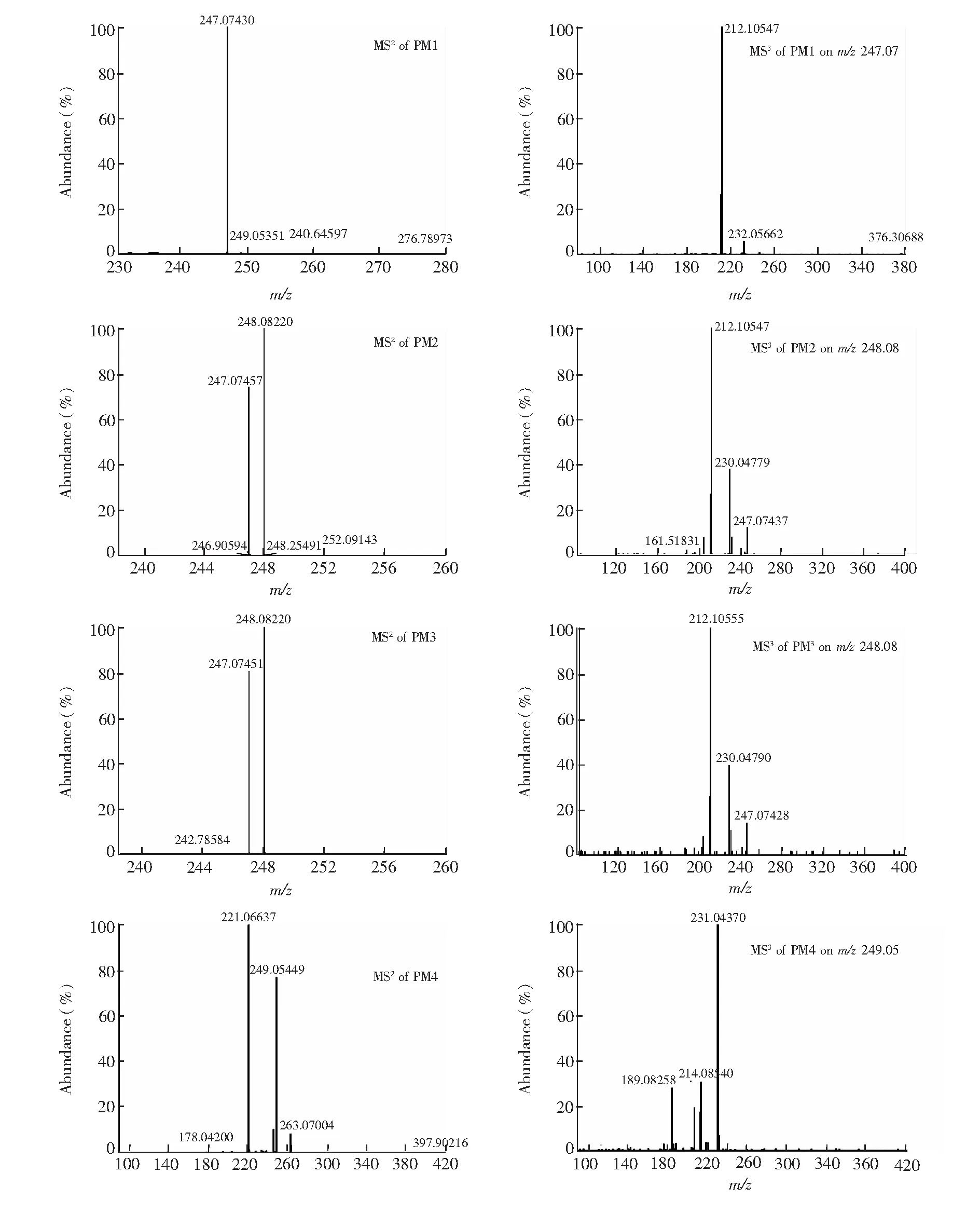
圖6 PYRⅠ相代謝物的MSn質譜圖(PM1~PM4)Fig.6 MSn spectra of phaseⅠPYR metabolites (PM1-PM4)
PM7(tR=10.92 min)和PM8(tR=11.42 min)的質子分子離子峰[M+H]+均為m/z439.14,比PM5和PM6多14 Da,恰與CH2的分子量相同,提示PM7和PM8可能分別是PM5和PM6的甲基化產物。在MSn分析中,兩者的二級質譜也得到碎片離子[M+H-C6H8O6-CH2]+(m/z249.09),以m/z249.09作為先導離子的三級質譜掃描中同樣得到與質子化PYR的二級質譜完全相同的碎片離子m/z233.06和177.02。由此推斷PM7和PM8分別是PM5和PM6的2或4-N-甲基化產物(2-N-Methyl-4-N-Glucuronide-PYR or 4-N-Methyl-2-N-Glucuronide-PYR)。
PM9(tR=8.97 min)和PM10 (tR=10.70 min)的質子分子離子峰[M+H]+為m/z441.12,比m/z265.09(PM1, PM2和PM3)多176Da,比m/z425.12(PM5和PM6)多16 Da,提示PM9和PM10可能是PYR經過氧化和葡萄糖醛酸結合后的代謝產物。在MSn分析中,PM9和PM10的二級質譜均得到了碎片離子m/z265.09,但是以m/z265.09作為先導離子的三級碎片離子,兩者略有不同。PM9的主要三級碎片是m/z247.07,而PM10的主要三級碎片卻得到m/z247.07和 248.08,分別與PM1和PM2主要二級碎片離子相同,因此,推斷PM9是PYR經過4′-羥基化,進一步葡萄糖醛酸結合后的產物(4′-OH-N-Glucuronide-PYR),PM10則是PYR經過3-N氧化,進一步葡萄糖醛酸結合后的產物(3-N-oxide-N-Glucuronide-PYR)。
3.4 乙胺嘧啶在大鼠體內可能的代謝譜系
綜上所述,PYR在大鼠體內的所有可能Ⅰ相和Ⅱ相代謝途徑,見圖7。PYR的Ⅰ相代謝方式主要包括苯環上的羥基化,嘧啶環上N位的氧化;Ⅱ相代謝方式則主要是嘧啶環上NH2位的葡萄糖醛酸結合和NH2位的甲基化(見圖8)。

圖7 PYRⅡ相代謝物的MSn質譜圖(PM5~PM10)Fig.7 MSn spectra of phase II metabolites of PYR (PM5-PM10)
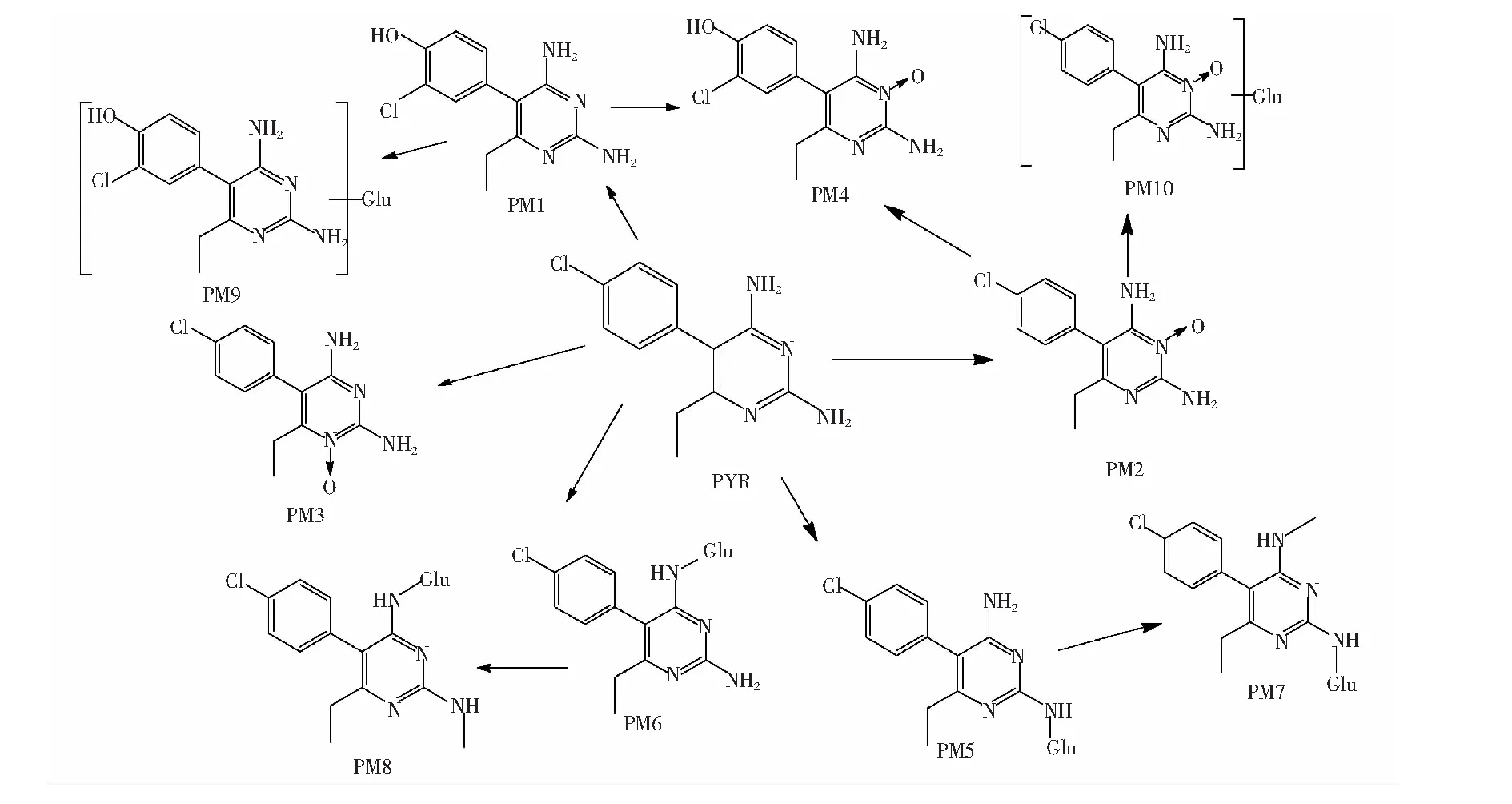
圖8 PYR在大鼠體內可能的代謝途徑Fig.8 Metabolic pathways of PYR in rats
4 結 論
在PYR早期的大鼠體外肝臟灌流代謝研究中,Coleman等[8]運用C14同位素標記法結合HPLC檢測的方法,發現灌流液的PYR及PYR的3-N氧化物的AUC0~5h之和僅占C14總標記量AUC0~5 h的57%,表明PYR除3-N氧化物在肝臟中還被代謝成其它一些結構不明的代謝物。本研究以具有高分辨率和高精確度的LTQ-Orbitrap-MS的儀器方法結合MetWorks 1.2軟件,分析鑒定出PYR在大鼠體內的代謝產物。除3-N-oxide-PYR外,首次發現了另外9種代謝物,分別是4′-OH-PYR(PM1), 1-N-Oxide-PYR(PM3), Dioxide-PYR (PM4), 2 or 4-N-Glucuronide-PYR(PM5和PM6), 2-N-Methyl-4-N-Glucuronide-PYR(PM7), 4-N-Methyl-2-N-Glucuronide-PYR(PM8), 4′-OH-N-Glucuronide-PYR(PM9)以及N-Oxide-N-Glucuronide-PYR(PM10)。
HPLC-LTQ-Orbitrap在本研究中展現出在復雜基質中鑒定未知代謝物的優勢,提供了精確可靠的數據,使得PYR在大鼠體內的代謝產物得以順利被鑒定出,這為PYR進一步的毒性評估和食品動物藥物殘留的研究提供了重要實驗依據。
1 Nelson R G, Rosowsky A.AntimicrobAgentsChemother, 2001, 45(12): 3293-3303
2 Steeve G, Antimicrobial Therapy in Veterinary Medicine.Wiley-BlackwellPress, 2013: 293
3 Satoh K, Kojima N, Furuno M, Kokue E, Hayama T.CongenitalAnomalies, 1991, 31(4): 323-328
4 Kalla N R, Saggar S K, Puri R, Mehta U.Res.Exp.Med. (Berl), 1997, 197(1): 45-52
5 Vijayalaxmi K K, Vishalakshi M.TeratogCarcinogMutagen, 2000, 20(2): 65-71
6 Sullivan G E, Takacs E.Teratology, 1971, 4(2): 205-209
7 Peters P J, Thigpen M C, Parise M E, Newman R D.DrugSaf., 2007, 30: 481-501
8 Coleman M D, Mihaly G W, Ward S A, Edwards G, Howells R E, Breckenridge A M.Biochem.Pharmacol., 1985, 34(12): 2193-2197
9 El-Ghomari K, Gorrod J W.Eur.J.DrugMetab.Pharmacokinet, 1987, 12(4): 253-258
10 Junza A, Montane A, Barbosa J, Minguillon C, Barron D.J.Chromatogr.A, 2014, 1368: 89-99
11 GUO Yan-Lei, WU Ming-Jun, LI Wen-Juan, JIANG Zheng, YE Fang-Ting, YU Chao.ChineseJ.Anal.Chem., 2013, 41(7): 1074-1079
郭延壘, 吳明軍, 李文娟, 江 崢, 葉芳挺, 于 超. 分析化學, 2013, 41(7): 1074-1079
12 Caprioli G, Logrippo S, Cahill M G, James K J.Int.J.FoodSci.Nutr., 2014, 65(8): 942-947
13 Shan Q, Liu Y, He L, Ding, H, Huang X, Yang F, Li Y, Zeng Z.J.Chromatogr.B, 2012, 881-882: 96-106
14 Van Meulebroek L, Bussche J V, Steppe K, Vanhaecke L.J.Chromatogr.A, 2012, 1260: 67-80
15 DING Tao, Lü Chen, LIU Han, GUO Ling, WU Bin, CHEN Guo-Song, SHEN Chong-Yu, ZHANG Rui, FEI Xiao-Qing, ZHANG Xiao-Yan, YU Jin-Liang.JournalofInstrumentalAnalysis, 2014, 33(1): 27-32
丁 濤, 呂 辰, 柳 菡, 郭 玲, 吳 斌, 陳國松, 沈崇鈺, 張 睿, 費曉慶, 張曉燕, 庾金良. 分析測試學報,2014, 33(1): 27-32
16 Wang H, Yuan B, Zeng Z, He L, Ding H, Guo C, Kong X, Wang W, Huang X.J.Chromatogr.B, 2014, 965: 91-99
17 JIANG Yan-Bin, SHAN Ji-Hao, WANG Ying, CAI Ying-Hua, TIAN Ya-Ping.Chin.J.Pharm.Anal., 2014, (3): 385-391
姜艷彬, 單吉浩, 王 瑩, 蔡英華, 田亞平. 藥物分析雜志, 2014, (3): 385-391
18 Silverman R B.TheOrganicChemistryofDrugDesignandDrugAction, Translated by GUO Zong-Ru, XIAO Zhi-Yan, LIU Zhan-Zhu, YU Xiao-Ming, XU Bo-Ling, Beijing: Chemical Industry Press, 2007: 320-322
Silverman R B. 有機藥物化學(第二版). 郭宗儒, 肖志艷, 劉站柱, 俞曉明, 徐柏玲譯. 北京: 化學工業出版社, 2007: 320-322
(Received 17 April 2015; accepted 12 September 2015)
In vivo Identification of Metabolites of Pyrimethamine in Rats by Liquid Chromatography-Linear Ion Trapped-Orbitrap Mass Spectrometry
HUAI Bin-Bin, GUO Chun-Na, LI Qiang, GAO Jin, XIE Shun, HUANG Xian-Hui*
(CollegeofVeterinaryMedicine,NationalReferenceLaboratoryofVeterinaryDrugResidues,SouthChinaAgriculturalUniversity,Guangzhou510640,China)
The metabolism of pyrimethamine (PYR) after a single oral administration at a dose of 5 mg/kg in rats was investigated. In vivo samples including rat plasma, urine and feces were collected respectively at different times. We performed liquid chromatography tandem two-dimensional linear ion trapped orbitrap mass spectrometry spectrometer (LC-LTQ-Orbitrap MS) to identify the unknown metabolites of PYR. Then 10 metabolites of PYR were found in rats with this approach, which indicates that hydroxylation on benzene ring,N-oxidation, dioxidation,N-glucuronidation, methylation+glucuronidation, hydroxylation+glucuronidation andN-oxidation+glucuronidation were the major metabolic pathways of PYR in rats. 9 of these metabolites were identified in vivo for the first time while the PYR 3-N-oxide was ever detected in vitro metabolism of PYR in isolated rat liver. We identified the structure of the metabolites according to their accurate mass data and the characteristic MSn product ions. Based on the above analyses, we proposed the phase I and II metabolic pathways for PYR in rat. The major phase I metabolites were formed via hydroxylation andN-oxidation pathways, and the major phase II metabolites were methylation and glucuronidation.
Pyrimethamine; Rats; Liquid chromatography tandem two-dimensional linear ion trapped-orbitrap mass spectrometry; Metabolites
10.11895/j.issn.0253-3820.150309
2015-04-17收稿;2015-09-12接受
本文系農業行業標準制修訂項目(No.201391194)資助
* E-mail: xhhuang@scau.edu.cn

