化學中考“金屬(材料)”考點歸類評析
陸桂斌
摘要:從金屬常識性知識積累、金屬活動性順序表的應用、金屬的銹蝕與防護、金屬的冶煉等多角度歸納初中化學中考有關“金屬(材料)”的試題特點,剖析試題命制指導思想、考查重點、解題思路,提高學生綜合解題能力。
關鍵詞:金屬 中考考點 評析
金屬與金屬礦物是初中化學的重要內(nèi)容,教材比較系統(tǒng)地介紹了有關金屬的化學知識,歷年各地化學中考圍繞“金屬(材料)”考點編制了許多經(jīng)典試題,仔細審視這類試題發(fā)現(xiàn)其考查重點突出,主要體現(xiàn)在以下幾個方面:
一、考查學生對合金、金屬材料等核心概念的理解,對金屬常識性知識的積累
例1、(2014年廣東廣州)下列關于金屬材料的說法中,不正確的是
A.生鐵、硬鋁、焊錫都屬于合金
B.銅有良好的導電性,因而大量用于制作電線
C.鋁表面易生成致密氧化鋁薄膜,因而具有良好的抗腐蝕性
D.銹蝕后的鐵制品沒有回收價值
評析:這類試題不僅考查學生對基本概念、基礎知識的理解和掌握,同時還能增進學生節(jié)約資源、保護環(huán)境的責任意識和科學素養(yǎng)。試題本身一般難度不大,解答這類試題,既要準確理解概念的內(nèi)涵,也要注重常識性知識的積累。
比如:對“合金”概念的理解應正確把握兩點:(1)合金一定含金屬,但不只有金屬,也可能含非金屬;(2)合金是混合物,氧化鐵等化合物不是合金。“金屬材料”包括合金和純金屬,但合金與其組成金屬比較具有許多特殊性能(如硬度大、熔點低等),所以其實際應用遠比純金屬廣泛。鋁的“自我保護”是因其能與空氣中氧氣反應,在表面形成一層致密而結實的氧化鋁膜,阻止鋁繼續(xù)與氧氣反應,生活中所謂“電化鋁”亦即用特殊化學方法使鋁表面形成加厚的氧化鋁保護層,所以這一保護層不能隨意破壞;而鐵銹卻因其具有疏松、多孔的結構,不僅不能自我保護,反而會加快鐵的銹蝕,所以必須及時除去。廢舊金屬回收再利用是趨勢也是必然,既能節(jié)約寶貴的金屬資源,也能減少冶煉金屬時對能源的消耗、對環(huán)境的傷害。答案:D
二、以金屬活動性順序為依據(jù),實驗探究金屬與酸、鹽發(fā)生置換反應的規(guī)律
例2、(2013年湖南婁底)小聰同學家新?lián)Q了水龍頭,從說明書上了解到該水龍頭是銅質(zhì)鍍鉻。好奇的小聰想探究鉻(Cr)與金屬鐵、銅的活動性強弱,邀請你一同參加。
【知識回放】金屬活動性順序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,請你在橫線上填寫對應金屬的元素符號。
【作出猜想】猜想1.Cr>Fe>Cu;猜想2. Fe>Cu >Cr;猜想3.你的猜想是 。
【查閱資料】
(1)鉻是銀白色有光澤的金屬,在空氣中其表面能生成抗腐蝕的致密的氧化膜。
(2)鉻能與稀硫酸反應,生成藍色的硫酸亞鉻(CrSO4)溶液。
【設計與實驗】小聰同學取大小相等的三種金屬片,用砂紙打磨光亮;再取三支試管,分別放入等量的同種稀硫酸。
【結論與解釋】(1)小聰?shù)玫降慕Y論是猜想 正確。
(2)實驗前用砂紙打磨金屬片的目的是 。
【知識運用】將鉻片投入FeSO4溶液中,反應 (填“能”或“不能”)進行。若能進行,請你寫出反應的化學方程式 。
評析:金屬活動性順序是初中化學的重要知識點,學生不僅要熟記其內(nèi)容、正確書寫元素符號,更要了解金屬活動性順序在實際解題中的應用:(1)判斷金屬與酸反應規(guī)律:順序表中排在H前面(或后面)的金屬能(或不能)與稀鹽酸、稀硫酸等發(fā)生置換反應,金屬活動性越強(即位置越靠前)則反應(或放出H2)速度越快。(2)判斷金屬與鹽反應規(guī)律:順序表中,除K、Ca、Na等非常活潑金屬外,排在前面的金屬一般可將位于其后面的金屬從它們的鹽溶液中置換出來(簡而言之:前面的置換后面的);反應中鹽要可溶,而與金屬的位置是排在H前還是排在H后無關。學習時還要掌握反應中典型的實驗現(xiàn)象(如:金屬鎂與酸反應放熱現(xiàn)象明顯,鐵與酸、鐵與硫酸銅、銅與硝酸銀反應中溶液顏色的變化等),熟練書寫化學方程式。
試題的獨特之處是加入了教材中沒有介紹的金屬鉻參與實驗探究,既否定了死記硬背的粗糙學習方法,也有效考查了學生處理加工新信息、靈活運用所學知識解決新問題的能力,充分體現(xiàn)了中考試卷“由知識立意向能力立意轉變” 的命題指導思想。
答案:Fe、Cu;Fe>Cr>Cu;無明顯實驗現(xiàn)象(或無氣泡生成,溶液不變色等);猜想1、除去金屬表面的氧化膜(或油污、銹跡等)以利于反應;能,Cr+FeSO4=Fe+CrSO4
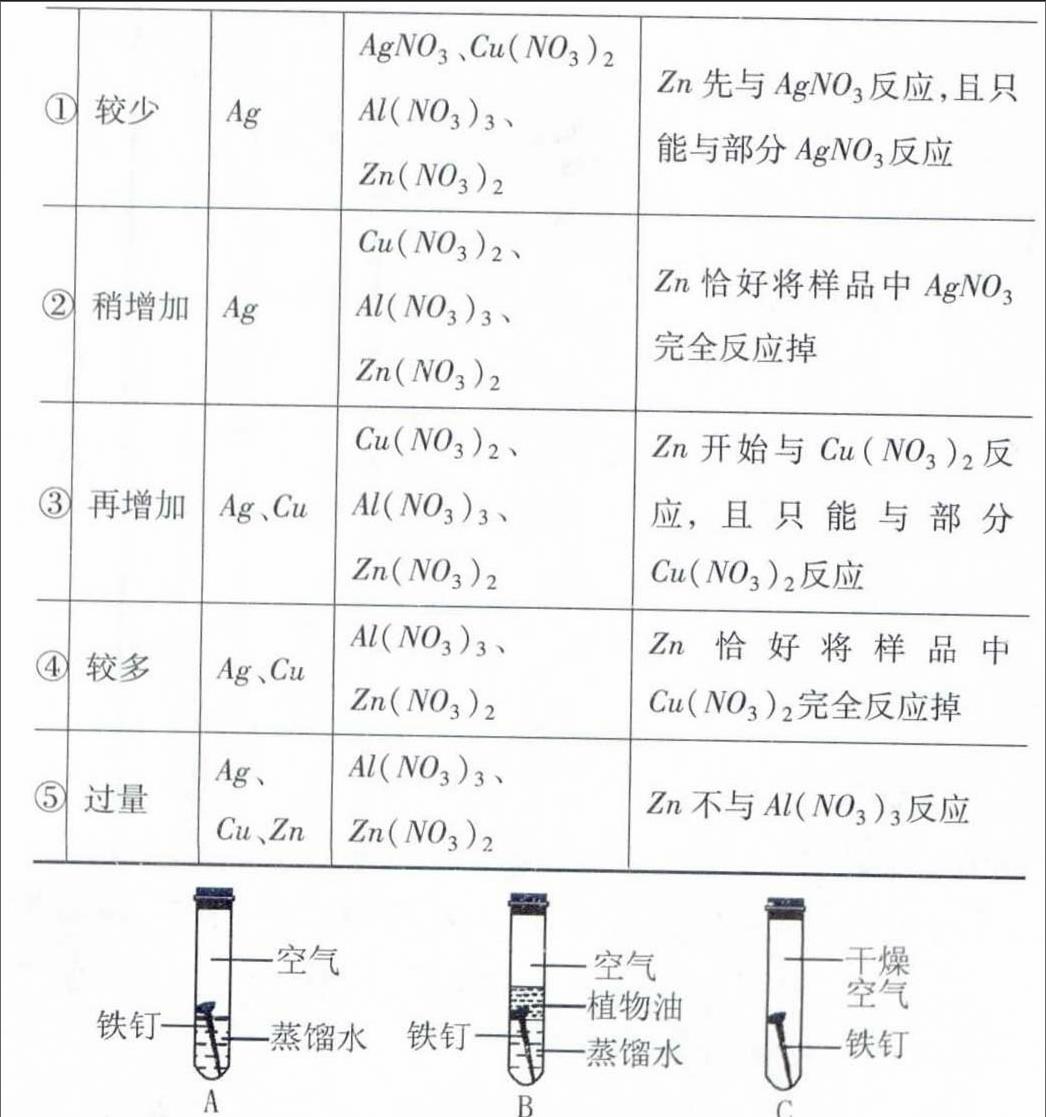
例3、(2015年湖北黃岡)王老師在某廢水處理池中提取一瓶含有AgNO3、Cu(NO3)2和Al(NO3)3的工業(yè)廢水樣品帶回實驗室。靜置,取上層清液,加入鋅粉,充分反應后過濾,得到濾液甲和濾渣乙。請你和你的化學小組完成以下探究(不考慮雜質(zhì)干擾)。
【提出問題】濾渣乙是什么?
【做出猜想】小明認為濾渣乙是銀,小東認為濾渣乙是銀和銅,小華認為濾渣乙是銀、銅和鋁,你認為濾渣乙還可能是__________。
【交流討論】大家經(jīng)過討論后,認為小華的猜想錯誤,理由是_________。
【實驗探究】設計實驗探究濾渣乙的成分,請?zhí)顚懴铝锌瞻祝?/p>
【反思交流】略
評析:試題不再單純考查利用金屬活動性順序表對有關反應進行簡單判斷,同時要求學生能正確分析:隨著向水樣加入鋅的量的不同,反應后的沉淀物、溶液中溶質(zhì)也發(fā)生著變化(備注:金屬與不同鹽溶液反應的先后順序也與金屬活動性有關):
對照表格內(nèi)容可知“小華猜想”錯誤:鋅的活動性較鋁弱,所以鋅不能置換出Al(NO3)3中的鋁;“做出猜想”時也缺少了一種合理猜想——加入鋅過量(情形⑤)。“實驗探究”階段,先分析實驗1現(xiàn)象,可排除表格中⑤的情形(其中Zn能與鹽酸反應產(chǎn)生氫氣),即濾渣乙成分有兩種可能(①②或③④情形);再分析實驗2現(xiàn)象,排除了濾液甲中存在Cu(NO3)2的可能性(情形①、②、③的濾液中都有硝酸銅),從而確定是表格中情形④,則濾渣乙是Ag、Cu的混合物。答案:銀、銅和鋅;鋅活動性比鋁弱,不能與硝酸鋁反應;實驗1:濾渣乙可能是銀或銀和銅;實驗2:NaOH(或KOH等),濾渣乙一定是銀和銅。
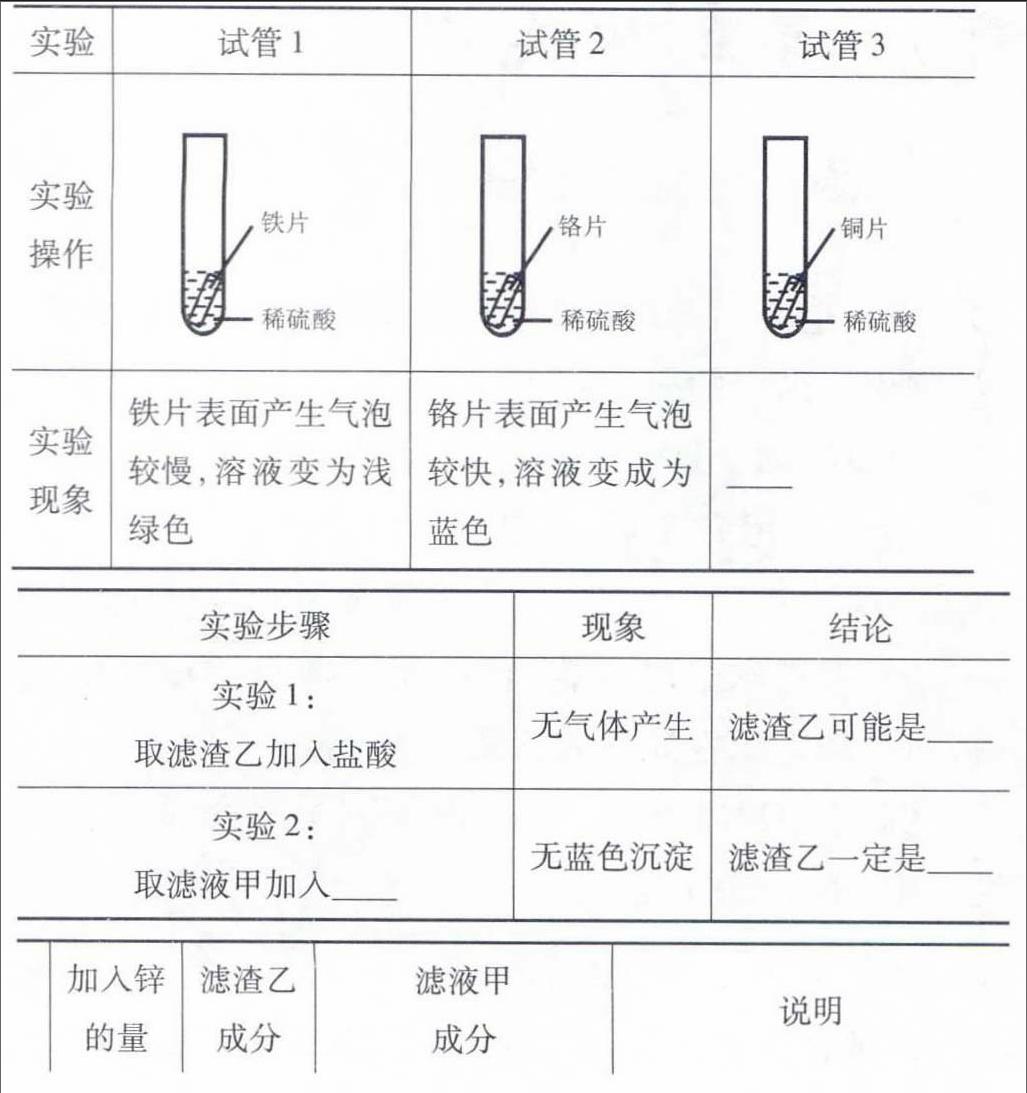
例4、(2015內(nèi)蒙古通遼)某同學設計了探究Fe、Cu、Ag三種金屬活動性順序的實驗方案,僅用組內(nèi)試劑,無法完成的是
A.Fe、Cu、Ag、稀硫酸 B.Cu、FeSO4溶液、AgNO3溶液
C.Fe、Ag、CuSO4溶液 D.Fe、Cu、稀硫酸、AgNO3溶液
評析:設計實驗比較金屬的活動性是近年來化學中考命題的熱點,也是學生學習的難點。其實驗方案設計主要從以下兩方面考慮:(1)利用金屬與稀酸(稀鹽酸或稀硫酸,下同)反應比較活動性。即取待測金屬樣品適量,分別加入適量稀酸,觀察金屬是否與酸反應、金屬與酸反應的快慢(能反應的金屬比不反應金屬活動性強,反應速度越快金屬活動性越強)。選項A即屬于此情形,但樣品中Cu、Ag都不與稀硫酸反應,無法比較二者活動性強弱,本題中該方案不可行。(2)利用金屬與鹽溶液反應比較金屬活動性。此情形中選擇試劑不外乎“兩金夾一鹽”(如選項C,三種金屬活動性為Fe>Cu>Ag,所以取兩側純金屬樣品和含中間金屬的鹽溶液,F(xiàn)e與CuSO4反應,推知活動性Fe>Cu;Ag放入CuSO4溶液中無現(xiàn)象,推知活動性Ag
三、圍繞金屬的銹蝕實驗探究,考查學生設計評價實驗方案、理解提煉文本中有效信息等能力
例5、(2015年四川眉山) 某化學興趣小組進行鐵生銹的實驗探究活動。
【探究一】 鐵生銹的條件
(1)該興趣小組將潔凈無銹的鐵釘分別置于上圖所示裝置中,經(jīng)過一段時間觀察, (填裝置序號)裝置中出現(xiàn)了明顯的銹跡。他們的結論:鐵生銹是因為鐵與空氣中的 等發(fā)生了化學反應。
(2)甲同學提出了疑問:空氣中的氮氣、二氧化碳沒有參與鐵的生銹過程嗎?請設計實驗為甲同學釋疑。 ,觀察并記錄現(xiàn)象即可證明。
【探究二】影響鐵生銹速率快慢的因素
乙同學說:媽媽常說菜刀沾有鹽水生銹更快。這種說法對嗎?同學廣泛查閱資料。
資料一:導電性強的溶液都可加速鐵的生銹。
資料二:海上航行的輪船在與海水接觸的部分鑲嵌一鋅塊,能有效降低鋼材被腐蝕的速率。
(3)將上述A裝置中的蒸餾水改為下列液體中的 ,可使鐵生銹的速率加快。
a、硫酸鈉溶液 b、無水乙醇 c、蔗糖溶液
(4)一些鐵制品表面覆蓋了某些涂層。不同的涂層被破壞后,鐵生銹的速率不同。你認為下列 涂層破壞后,鐵生銹的速率較快。
a、鍍鋅鐵 b、鍍錫鐵
(5)一些建筑的大門刷上了一層銀白色的金屬,你認為該金屬可能是 。
a、銀粉 b、銅粉 c、鎂粉
【交流與思考】(6)寫出一種防止鐵生銹的方 。
評析:“鐵生銹的條件” 探究實驗方案的設計多采用“控制變量法”(也叫單一變量法),即圍繞可能影響鐵生銹的“量”——氧氣、水、氮氣、二氧化碳等,每個實驗只改變其中一個“量”,同時保證其它“量”都相同,設計出一組對比實驗,通過比較不同實驗現(xiàn)象,歸納得出正確結論。
《全日制義務教育化學課程標準(實驗稿)》明確要求:學生要初步學會運用調(diào)查、查閱資料等方式收集解決問題所需證據(jù)。在此思想指導下,“探究二”側重對學生能力的考查,試題設計的問題比較新穎、獨創(chuàng),要求學生自主學習題干中資料內(nèi)容,提煉出有效信息,再結合自己的經(jīng)驗,找出解題依據(jù)。命制這類經(jīng)典試題同時也明確了一個事實:機械、僵化的“題海戰(zhàn)術”既堵塞、固化了學生思維,在現(xiàn)在的中考亦或高考中也不可能占到便宜。
“探究二”解題思路如下:(3)中選擇溶液時以資料一中“導電性強”為依據(jù),硫酸鈉溶液能導電,而無水乙醇、酒精溶液都不導電;分析資料二可推知:一般活潑金屬比不活潑金屬更易腐蝕,(4)中鐵比錫活潑,錫層破壞后,鐵銹蝕速度加快;根據(jù)資料二、結合問題(4),要防止鐵銹蝕,可在其覆蓋一層活潑性比鐵強的金屬涂層。答案:(1)A,氧氣和水蒸氣;(2)將A裝置中的氧氣換作氮氣或二氧化碳;(3) a;(4)b;(5)c;(6)刷油漆(合理答案均可)。
四、綜合考查CO還原氧化鐵實驗現(xiàn)象、操作注意事項、常見氣體的凈化與檢驗等
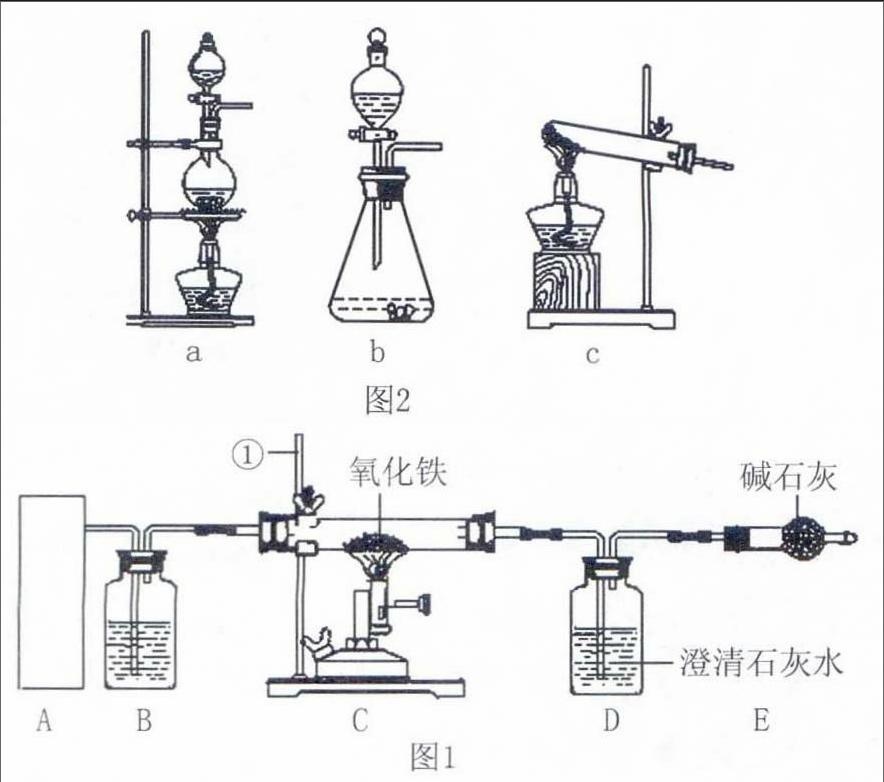
例6、(2014年江蘇揚州)某校化學研究性學習小組通過實驗研究高爐煉鐵的化學原理,設計了如圖1實驗裝置:
(1)略;
(2)裝置中儀器①的名稱是 ;裝置B內(nèi)所盛放的試劑是 ;E裝置的作用為 ;
(3)實驗開始時應先點燃 (填“A”或“C”)的熱源;反應后 C裝置的現(xiàn)象是 ,D裝置中發(fā)生反應的化學方程式為 ;待硬質(zhì)粗玻璃管內(nèi)物質(zhì)冷卻后再停止通CO的目的是 ;
(4)該裝置有一個明顯的缺陷是 。改進的方法為 。
評析:試題以鐵的冶煉為載體,既考查了常見氣體的制取、除雜、檢驗等基礎實驗,也考查了綜合性實驗中各組成裝置的作用與設計意圖;既考查了“CO與鐵的氧化物反應”這一重要實驗的特征現(xiàn)象、實驗操作注意事項,也促進了學生積極的情感態(tài)度與價值觀的形成。
圖1中各裝置的作用都是明確的:裝置A制取還原劑CO;裝置B干燥CO,這種類型的干燥裝置其試劑瓶中只能放液態(tài)的濃硫酸;利用C裝置完成CO還原鐵的氧化物,反應前氧化鐵是紅棕色固體,反應后生成的鐵粉呈黑色;裝置D檢驗產(chǎn)物中的CO2;裝置E(其中堿石灰是氧化鈣和氫氧化鈉的混合物)吸收空氣中的CO2、H2O等物質(zhì),確保裝置D中實驗現(xiàn)象更加明顯、準確。該實驗中多處使用到CO,如:開始時先通入CO排盡裝置內(nèi)空氣,后點燃裝置C的酒精噴燈,以防CO與空氣的混合物遇熱爆炸;氧化鐵被完全反應(即熄滅酒精噴燈)后,還要繼續(xù)通CO直至玻璃管完全冷卻,以防生成的鐵在較高溫度下再次被空氣中氧氣氧化,同時防止裝置D中石灰水倒吸入熱的玻璃管使其炸裂。實驗需要使用足量的CO,但CO有劇毒,所以實驗產(chǎn)生的含較多CO的尾氣必須作無害化處理,處理的方法可用儲氣袋收集或用酒精燈點燃。答案:(2)鐵架臺,濃硫酸,吸收空氣中CO2以避免對裝置D中實驗的干擾;(3)A,紅棕色固體逐漸變黑,CO2+Ca(OH)2=CaCO3↓+H2O,既防止生成的鐵被氧化,也防止石灰水倒吸;(4)缺少尾氣處理裝置,將尾氣點燃或收集。
參考文獻:
[1] 中華人民共和國教育部 .全日制義務教育化學課程標準(2011年版)[M].北京:北京師范大學出版社,2012

