利拉魯肽對非酒精性脂肪肝大鼠IR及SOCS-3表達的影響
侯洪濤,裘艷梅,張建,胡義亭,王玉珍
(1 河北省人民醫院,石家莊050051;2 河北醫科大學第二醫院)
?
利拉魯肽對非酒精性脂肪肝大鼠IR及SOCS-3表達的影響
侯洪濤1,裘艷梅2,張建1,胡義亭1,王玉珍1
(1 河北省人民醫院,石家莊050051;2 河北醫科大學第二醫院)
目的 探討利拉魯肽對非酒精性脂肪肝(NAFLD)的治療作用及其機制。方法 制備NAFLD大鼠模型20只,隨機分為高脂組、利拉魯肽組各10只,另取10只正常大鼠作為對照組。高脂組、利拉魯肽組高脂飼料飼養16周,對照組普通飼料飼養16周。利拉魯肽組飼養12周末腹腔注射利拉魯肽 600 μg/(kg·d)4周;飼養第16周末,三組均心臟取血,檢測血清ALT、AST、TG、TC和空腹血糖(FPG)、空腹胰島素(FINS)水平,計算胰島素抵抗指數(HOMA-IR)。處死大鼠,稱量體質量及肝質量,計算肝指數;取部分肝臟,HE染色,光鏡下觀察肝組織病理變化;另取部分肝組織,RT-PCR法檢測細胞因子信號轉導抑制物3(SOCS-3)mRNA表達,分析SOCS-3 mRNA表達與HOMA-IR的關系。結果 與對照組比較,高脂組肝脂數、ALT、AST、TG、TC、FPG、FINS及HOMA-IR均明顯升高(P均<0.05);與高脂組比較,利拉魯肽組上述指標均明顯降低(P均<0.05)。對照組肝組織無異常病理改變;高脂組肝細胞排列紊亂,細胞內有較多脂滴,部分肝細胞變性,有炎性細胞浸潤;利拉魯肽組肝細胞脂肪變明顯輕于高脂組。高脂組肝組織SOCS-3 mRNA相對表達量明顯高于對照組、利拉魯肽組(P均<0.05),對照組、利拉魯肽組比較差異無統計學意義(P>0.05)。直線相關分析顯示,肝組織SOCS-3 mRNA表達與HOMA-IR呈正相關(r=0.445,P<0.05)。結論 利拉魯肽治療NAFLD有一定效果,其作用機制可能與減輕胰島素抵抗及抑制SOCS-3 mRNA表達有關。
非酒精性脂肪肝;胰島素抵抗;胰高血糖素樣肽1;細胞因子信號轉導抑制物3
非酒精性脂肪肝(NAFLD)是與代謝性疾病相關的肝臟疾病,與胰島素抵抗(IR)、糖尿病、肥胖、高脂血癥等因素密切相關,被認為是代謝綜合征的肝臟表現。近年來我國NAFLD發病率顯著升高,并呈年輕化趨勢。NAFLD的發病機制尚未完全闡明,二次打擊學說是NAFLD發病機制的經典學說[1]。IR被認為是導致肝臟脂質過度沉積的原發病因,在NAFLD的發生、發展過程中具有重要作用[2]。近年研究發現,細胞因子信號轉導抑制物3(SOCS-3)可影響胰島素信號轉導,導致脂肪酸代謝紊亂,并參與IR及NAFLD的發病過程[3]。胰高血糖素樣肽1(GLP-1)能改善IR及肝臟脂質沉積,已被臨床用于NAFLD的治療[4]。利拉魯肽是GLP-1類似物,是一種治療糖尿病的新型藥物,其能否用于治療NAFLD尚不十分清楚。2015年7~11月,本研究探討了利拉魯肽對NAFLD的治療作用及其機制。
1 材料與方法
1.1 材料 健康雄性SD大鼠32只,6周齡,體質量140~150 g,購自河北醫科大學實驗動物中心,動物許可證號:SCXK(冀)2013-1-003。飼養環境:溫度22~24 ℃,濕度50%左右,12 h晝夜交替,分籠飼養。普通飼料及豬油,由河北醫科大學實驗動物中心提供;膽固醇,購自河北醫科大學海森醫藥有限公司;利拉魯肽,購自丹麥諾和諾德公司;胰島素酶聯免疫試劑盒,購自南京建成生物工程研究所;TRIzol試劑盒、逆轉錄體系、擴增體系及引物,購自北京賽百盛基因技術有限公司。
1.2 模型制備及干預 所有大鼠適應性飼養1周,隨機取22只給予高脂飼料(普通飼料88%、豬油10%、膽固醇2%)飼養制備NAFLD模型,飼養12周隨機處死2只,取肝組織制作切片,行HE染色,觀察到肝細胞出現明顯脂肪變性,證實NAFLD模型制備成功。將20只成模大鼠隨機分為高脂組、利拉魯肽組,每組10只;兩組繼續高脂飼料飼養,利拉魯肽組腹腔注射利拉魯肽600 μg/(kg·d),高脂組腹腔注射等體積生理鹽水,連續4周。剩余10只大鼠作為對照組,予普通飼料飼養。三組均飼養至第16周。
1.3 相關指標觀察
1.3.1 血生化學指標 飼養至第16周末,腹腔注射麻醉,迅速心臟取血,靜置2 h,以3 000 r/min離心10 min,取上層血清,-70 ℃冰箱凍存備用。采用全自動生化分析儀檢測血清TG、TC、ALT、AST,快速血糖儀測定空腹血糖(FPG);酶聯免疫法測定空腹胰島素(FINS),計算胰島素抵抗指數(HOMA-IR)。HOMA-IR=FPG×FINS/22.5。
1.3.2 肝組織病理檢查 飼養至第16周末,處死大鼠,迅速取出肝臟,觀察肝臟大體情況,并稱質量,計算肝指數(肝指數=肝臟濕質量/體質量×100%)。每只大鼠取相同部位肝組織,4%多聚甲醛固定,常規脫水,石蠟包埋,4 μm厚切片,HE染色,光鏡下觀察肝組織病理變化。
1.3.3 肝組織SOCS-3 mRNA表達 取凍存肝組織100 mg,置于玻璃勻漿器中,加入TRIzol 1 mL冰上研磨,徹底勻漿。按照TRIzol試劑盒說明書提取肝組織總RNA,在逆轉錄酶的催化下合成cDNA,以cDNA為模板在Taq DNA聚合酶催化下進行PCR擴增。擴增產物150 bp。擴增條件:95 ℃預變性3 min,95 ℃變性30 s,55 ℃退火40 s,72 ℃延伸60 s,循環40次,最后72 ℃延伸10 min。PCR產物在2%的瓊脂糖凝膠中電泳,凝膠成像儀采集圖像,PCR儀獲得產物Ct值,采用2-ΔΔCt法計算SOCS-3 mRNA相對表達量。
2 結果
2.1 各組一般狀態、體質量及肝指數比較 三組均全部存活;對照組皮毛光澤,靈活好動;高脂組不喜活動,皮毛光澤度差;利拉魯肽組對外界反應靈敏,皮毛光澤度明顯好于高脂組。各組體質量、肝質量及肝指數比較見表1。
2.2 各組血生化指標比較 見表2。
2.3 各組肝組織病理觀察 光鏡下對照組肝小葉結構清晰,肝細胞索呈放射狀排列, 胞質均勻,無脂滴浸潤,匯管區及小葉內無炎性細胞浸潤;高脂組肝細胞排列紊亂,細胞內有較多脂滴,部分肝細胞變性,有炎性細胞浸潤;利拉魯肽組肝細胞脂肪變性明顯改善,肝細胞內有少量脂肪滴,炎性細胞浸潤改善。
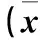
表1 各組體質量、肝質量及肝指數比較±s)
注:與對照組比較,*P<0.05;與高脂組比較,#P<0.05。
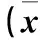
表2 各組血生化指標比較±s)
注:與對照組比較,*P<0.05;與高脂組比較,#P<0.05。
2.4 各組肝組織SOCS-3 mRNA表達比較 對照組肝組織SOCS-3 mRNA相對表達量為1.30±0.44,高脂組為3.06±1.62,利拉魯肽組為2.00±0.75。高脂組肝組織SOCS-3 mRNA相對表達量明顯高于對照組、利拉魯肽組(P均<0.05),而對照組、利拉魯肽組比較差異無統計學意義(P>0.05)。
2.5 肝組織SOCS-3 mRNA表達與HOMA-IR的關系 直線相關分析顯示,各組肝組織SOCS-3 mRNA表達與HOMA-IR呈正相關(r=0.45,P<0.05)。
3 討論
NAFLD是與代謝性疾病相關的肝臟疾病,其發生、發展受代謝、遺傳、環境、腸道微生物和生活方式等多種因素調節,與IR、肥胖、高脂血癥等密切相關。NAFLD的發病機制目前尚未完全清楚,其理論研究還停留在假說階段,“二次打擊學說”是目前最為人們接受和認可的觀點。第一次打擊是以IR為中心環節導致的肝細胞脂肪變性、肝臟脂質沉積;在此基礎上發生的,以線粒體反應氧體系為核心的氧化應激和脂質過氧化對肝臟的損傷是NAFLD發病中的第二次打擊。
IR是NAFLD發病的中心環節,貫穿于NAFLD的全過程,不僅參與首次打擊,也參與二次打擊。IR引起NAFLD的可能機制:IR可減弱胰島素對脂肪代謝的調節,使外周脂肪分解增強,血清中游離脂肪酸(FFA)濃度上升,FFA隨血液循環進入肝臟增多,導致肝內TG大量合成并堆積;肝臟增多的FFA會導致肝細胞線粒體氧化超載,從而加重肝細胞內脂肪變性[5]。此外,增多的FFA還可通過抑制胰島素信號轉導,減少胰島素清除,而加重IR。
SOCSs是一類具有抑制Janus 激酶信號轉導子與轉錄激活子(JAK/STAT)信號轉導的蛋白質家族,目前對SOCS-1和SOCS-3的研究較多。SOCS-3在體內廣泛分布于肝、腎、腦、心等組織器官[6]。SOCS-3由225個氨基酸組成,分子量約為24.75 ku。人類SOCS-3基因位于17q25.3,長度為850 bp,與大鼠、小鼠的同源性約為90%。正常組織中SOCS-3低表達,許多細胞因子,如紅細胞生成素、生長激素、IL-6等可誘導SOCS-3表達。這些細胞因子誘導SOCS-3表達后,其表達產物又抑制細胞因子介導的JAK/STAT信號通路。胰島素信號傳導受阻或減弱是IR的主要原因之一,SOCS-3通過多種途徑參與IR:①與STAT5b競爭性結合胰島素受體,抑制STAT5b的磷酸化及其胰島素受體底物的磷酸化,使下游的胰島素信號轉導受阻[7];②通過SH2結構域與信號蛋白受體上磷酸化的酪氨酸結合,干擾胰島素信號的轉導[8];③與信號蛋白耦聯,從而被蛋白酶體降解,抑制胰島素信號的轉導[9]。SOCS-3還參與抵抗素誘導的IR,抵抗素可使SOCS-3表達升高,并促進其與胰島素受體結合,從而抑制胰島素信號的傳導[10]。應用拮抗SOCS-3的寡核苷酸對db/db小鼠進行干預,肝組織SOCS-3表達下降,脂肪肝程度明顯減輕[11]。本研究結果顯示,對照組肝組織SOCS-3 mRNA低表達,高脂組SOCS-3 mRNA表達顯著高于對照組,說明SOCS-3參與了NAFLD的發病過程。
GLP-1是由腸道L細胞分泌的腸道激素,具有促進胰島素釋放、延緩胃排空、抑制胰高血糖素的釋放等作用。GLP-1的生物學作用是靠GLP-1和細胞上的GLP-1受體結合來實現,GLP-1受體在人體內主要分布于胰島α、β細胞,胃、小腸、肺、心臟、腎臟、垂體及下丘腦等組織。研究表明,人肝細胞亦有GLP-1受體表達[12]。利拉魯肽和艾塞那肽均為GLP-1類似物,均通過增加胰島素分泌、改善胰島細胞功能、減少食物攝入量等多種機制發揮降糖作用,已廣泛應用于2型糖尿病的治療[13]。近年研究發現,GLP-1類似物對代謝綜合征有治療作用,NAFLD是代謝綜合征在肝臟的表現。有研究發現,應用艾塞那肽干預ob/ob小鼠,可使小鼠體質量減輕,改善胰島素敏感性,減輕肝內脂質沉積[14~18]。本研究結果顯示,與對照組比較,高脂組體質量、肝指數明顯升高,肝臟脂肪變性及炎癥程度明顯增加,其血清ALT、AST、FPG、FINS及HOMA-IR明顯升高,表明IR在NAFLD的發生、進展過程中具有重要作用。而利拉魯肽組上述指標及肝組織SOCS-3 mRNA表達均明顯低于高脂組,說明利拉魯肽能夠改善NAFLD大鼠肝臟脂肪變性。
綜上所述,利拉魯肽對NAFLD有治療作用,其作用機制可能與減輕IR及抑制SOCS-3 mRNA表達有關。
[1] 施軍平.非酒精性脂肪性肝病研究前沿[J].浙江大學學報(醫學版),2016,45(1):98-101.
[2] Day CP, James OF. Steatohepatitis: a tale of two hits[J]. Gastroenterology, 1998,114(4):842-845.
[3] Varela-Rey M, Embade N, Ariz U, et al. Non-alcoholic steatohepatitis and animal models: understanding the human disease[J]. Int J Biochem Cell Biol, 2009,41(5):969-976.
[4] Bloomgarden ZT. Second world congress on the insulin resistance syndrome: insulin resistance syndrome and nonalcoholic fatty liver disease[J]. Diabetes Care, 2005,28(6):1518-1523.
[5] van Wagner LB, Rinella ME. The role of insulin-sensitizing agents in the treatment of nonalcoholic steatohepatitis[J]. Therap Adv Gastroenterol, 2011,4(4):249-263.
[6] 方南元,孫曉琦,薛博瑜,等.腸道微生物在非酒精性脂肪肝發病中的研究進展[J].中國老年學雜志,2016,36(2):469-471.
[7] Neuschwander-Tetri BA. Nonalcoholic steatohepatitis and the metabolic syndrome[J]. Am J Med Sci, 2005,330(6):326-335.
[8] Pittas AG, Joseph NA, Greenberg AS. Adipocytokines and insulin resistance[J]. J Clin Endocrinol Metab, 2004,89(2):447-452.
[9] Emanuelli B, Peraldi P, Filloux C, et al. SOCS-3 is an insulin-induced negative regulator of insulin signaling[J]. J Biol Chem, 2000,275(21):15985-15991.
[10] Yoshimura A, Naka T, Kubo M. SOCS proteins, cytokine signalling and immune regulation[J]. Nat Rev Immunol, 2007,7(6):454-465.
[11] Rui L, Yuan M, Frantz D, et al. SOCS-1 and SOCS-3 block insulin signaling by ubiquitin-mediated degradation of IRS1 and IRS2[J]. J Biol Chem, 2002,277(44):42394-42398.
[12] Steppan CM, Wang J, Whiteman EL, et al. Activation of SOCS-3 by resistin[J]. Mol Cell Biol, 2005,25(4):1569-1575.
[13] Ueki K, Kondo T, Tseng YH, et al. Central role of suppressors of cytokine signaling proteins in hepatic steatosis, insulin resistance, and the metabolic syndrome in the mouse[J]. Proc Natl Acad Sci U S A, 2004,101(28):10422-10427.
[14] 李春君,于德民.GLP-1受體激動劑治療非酒精性脂肪肝的新進展[J].天津醫藥,2015,43(11):1230-1234.
[15] Gupta NA, Mells J, Dunham RM, et al. Glucagon-like peptide-1 receptor is present on human hepatocytes and has a direct role in decreasing hepatic steatosis in vitro by modulating elements of the insulin signaling pathway[J]. Hepatology, 2010,51(5):1584-1592.
[16] Prasad-Reddy L, Isaacs D. A clinical review of GLP-1 receptor agonists: efficacy and safety in diabetes and beyond[J]. Drugs Context, 2015(4):212283.
[17] Kim SH, Abbasi F, Lamendola C, et al. Benefits of liraglutide treatment in overweight and obese older individuals with prediabetes[J]. Diabetes Care, 2013,36(10):3276-3282.
[18] Ding X, Saxena NK, Lin S, et al. Exendin-4, a glucagon-like protein-1 (GLP-1) receptor agonist, reverses hepatic steatosis in ob/ob mice[J]. Hepatology, 2006,43(1):173-181.
Effects of liraglutide on insulin resistance and SOCS-3 expression in rats with nonalcoholic fatty liver disease
HOUHongtao1,QIUYanmei,ZHANGJian,HUYiting,WANGYuzhen
(1People′sHospitalofHebeiProvince,Shijiazhuang050051,China)
Objective To investigate the effects of liraglutide (Lira) on insulin resistance and expression of SOCS-3 in rats with nonalcoholic fatty liver disease (NAFLA). Methods Twenty NAFLD rat models were prepared and then randomly divided into high fat group (HF) and HF+Lira group. Meanwhile, another 10 normal rats were selected as the normal control (NC) group. HF group, HF+Lira group were given high fat diet for 16 weeks. After 12 weeks of high fat feeding in HF+Lira group, 600 μg/(kg·d) Lira was administered by intraperitoneal injection for 4 weeks. At the end of the 16 weeks, the rats were killed. The changes of liver pathology were observed by optical microscope. The serum levels of alanine aminotransferase (ALT), aspartate aminotransferase (AST), total triglyceride (TG), cholesterol (TC) and fasting blood glucose (FPG) were detected by automatic biochemical analyzer. The fasting insulin (FINS) was determined by radioimmunoassay, and insulin resistance index (HOMA-IR) was assessed by homeostasis mode assessment. The liver expression of SOCS-3 mRNA was detected by RT-PCR. The relationship between SOCS-3 mRNA and HOMA-IR was analyzed. Results Compared with NC group, liver index, HOMA-IR, and the levels of ALT, AST, TG, TC, FPG and FINS were significantly increased in HF group (allP<0.05); compared with HF group, the above indexes of the HF+Lira group were all decreased, and the difference was statistically significant (allP<0.05). No abnormal pathological changes in the liver tissues of the NC group. In the HF group, the liver cells were arranged in disorder, there were more lipid droplets in the cells, and some hepatocytes degenerated and had inflammatory cells infiltration. The hepatic steatosis in the HF+Lira group was lighter than that in the HF group. The expression level of SOCS-3 mRNA in HF group was significantly higher than that in NC group and the HF+Lira group (allP<0.05); and no significant difference was found between the NC group and the HF+Lira group (P>0.05). HOMA-IR was positively correlated with of the expression of SOCS-3 mRNA (r=0.445,P<0.05). Conclusion Lira has certain effect in treatment of NAFLD, whose mechanism may be related to the decrease of IR and inhibition of SOCS-3 mRNA expression.
nonalcoholic fatty liver; insulin resistance; glucagon-like peptide 1; suppressor of cytokine signaling 3
河北省醫學科學研究重點課題計劃(ZL20150117)。
侯洪濤(1980-),男,碩士,主治醫師,研究方向為消化系統疾病診治。E-mail: llvzi@126.com
10.3969/j.issn.1002-266X.2016.40.005
R575.5
A
1002-266X(2016)40-0017-04
2016-01-18)

