葡聚糖延緩草魚肌原纖維蛋白冷凍變性的機理分析
魯耀彬,熊光權(quán),李 新,吳文錦,喬 宇,丁安子,廖 李,王 俊,汪 蘭,*
(1.湖北省農(nóng)業(yè)科學(xué)院農(nóng)產(chǎn)品加工與核農(nóng)技術(shù)研究所,湖北省農(nóng)業(yè)科技創(chuàng)新中心農(nóng)產(chǎn)品加工研究分中心,湖北 武漢 430064;2.武漢輕工大學(xué)食品科學(xué)與工程學(xué)院,湖北 武漢 430023)
葡聚糖延緩草魚肌原纖維蛋白冷凍變性的機理分析
魯耀彬1,2,熊光權(quán)1,李 新1,吳文錦1,喬 宇1,丁安子1,廖 李1,王 俊1,汪 蘭1,*
(1.湖北省農(nóng)業(yè)科學(xué)院農(nóng)產(chǎn)品加工與核農(nóng)技術(shù)研究所,湖北省農(nóng)業(yè)科技創(chuàng)新中心農(nóng)產(chǎn)品加工研究分中心,湖北 武漢 430064;2.武漢輕工大學(xué)食品科學(xué)與工程學(xué)院,湖北 武漢 430023)
以草魚肌原纖維蛋白為研究對象,通過研究鹽溶性蛋白質(zhì)量濃度、Ca2+-ATPase活性、表面疏水性、總巰基和活性巰基含量在冷凍貯藏條件下的變化,比較不同分子質(zhì)量葡聚糖(添加量0.5%)和傳統(tǒng)商業(yè)抗凍劑(4%蔗糖+4%山梨糖醇)對凍藏過程中肌原纖維蛋白的冷凍保護效果。結(jié)果表明,在凍藏過程中,葡聚糖能有效延緩草魚肌原纖維蛋白的冷凍變性,效果優(yōu)于傳統(tǒng)商業(yè)抗凍劑;分子質(zhì)量小的葡聚糖(T7)對Ca2+-ATPase活性和活性巰基的保護作用要整體優(yōu)于分子質(zhì)量大的葡聚糖(T20),凍藏超過15 d后延緩表面疏水性的上升和總巰基的保護上的效果也顯著優(yōu)于后者;因此,在工業(yè)中選用分子質(zhì)量小的葡聚糖作為淡水魚及相關(guān)制品的冷凍保護劑效果更佳。
草魚;肌原纖維蛋白;葡聚糖;分子質(zhì)量;冷凍變性
淡水魚營養(yǎng)豐富、味道鮮美,其肌肉中含有大量的n-6必需脂肪酸和抗動脈硬化的n-3系列脂肪酸,組織含水量大,肉質(zhì)鮮嫩,易在微生物和酶的作用下腐敗變質(zhì),常采用冷凍的方式貯藏[1]。淡水魚肌肉在凍結(jié)狀態(tài)下,部分結(jié)合水易形成冰晶,體積膨脹,導(dǎo)致肌肉組織被破壞,而肌原纖維蛋白是魚肉蛋白質(zhì)的主要成分,其聚集變性會使得魚肉品質(zhì)劣化,例如:鹽溶性蛋白質(zhì)聚集不易溶出、Ca2+-ATPase活性下降、表面疏水性增大、巰基被氧化等[2]。因此,工業(yè)上冷凍貯藏淡水魚及相關(guān)制品時,常采用添加抗凍劑的方式延緩魚肉蛋白的冷凍變性。蔗糖和山梨糖醇的組合是最常見的商業(yè)抗凍劑,能延緩魚肉蛋白質(zhì)的冷凍變性,但由于甜味高、熱量大,不適宜于糖尿病、高血壓等特定消費人群,同時破壞了產(chǎn)品原有的風(fēng)味,使產(chǎn)品的加工性能下降[3-4]。目前國內(nèi)外已經(jīng)開展了關(guān)于海藻糖、殼聚糖、明膠、乳酸鈉等抗凍劑替代品,能在保證抗凍效果的前提下,降低添加量,最大程度地保護淡水魚及相關(guān)制品的最佳感官特性[5-8]。
葡聚糖又稱右旋糖酐,具有較高的分子質(zhì)量,存在于某些微生物在生長過程中分泌的黏液中,主要由D-葡萄吡喃糖以(α,1→6)鍵連接,具有甜度低、熱量小的特點,可作為新型的天然抗凍保護劑應(yīng)用于淡水魚抗凍保鮮,而葡聚糖種類繁多,不同種類葡聚糖結(jié)構(gòu)差異大、分子質(zhì)量不同,其抗凍效果也不盡相同。本研究以草魚肌原纖維蛋白作為研究對象,分別采用常見的分子質(zhì)量為7 000 D和20 000 D的葡聚糖與蔗糖和山梨糖醇組合的傳統(tǒng)商業(yè)抗凍劑相比較,應(yīng)用于草魚肌原纖維蛋白凍藏后的抗凍性能差異研究,旨在為不同分子質(zhì)量葡聚糖在魚類抗凍保鮮中的應(yīng)用提供理論依據(jù)。
1 材料與方法
1.1 材料與試劑
原料草魚 市購,質(zhì)量為(1 800±200) g。屠宰后剔除內(nèi)臟、魚皮、主刺、紅肉,只取白肉部分,用絞肉機絞碎,于4 ℃條件下保藏15 min,即刻用于肌原纖維蛋白的提取。
葡聚糖T7(Mw為7 000 D)、葡聚糖T20(Mw為20 000D) 上海金穗生物科技有限公司;超微量ATP酶(Ca2+)測試盒 南京建成生物工程研究所;DTNB、牛血清蛋白、考馬斯亮藍G250、山梨糖醇 美國Biosharp公司;其他試劑均為分析純。
1.2 儀器與設(shè)備
U-3802紫外-可見分光光度計 尤尼克儀器有限公司;F93熒光分光光度計 上海市核光技術(shù)有限公司;GL-21M高速冷凍離心機 湖南湘儀實驗室儀器開發(fā)有限公司;T18 basic均質(zhì)機 德國IKA公司;HJ-3數(shù)顯恒溫磁力攪拌器、HH-6數(shù)顯恒溫水浴鍋 國華電器有限公司;XMTD-8222電熱恒溫鼓風(fēng)干燥箱 上海精宏實驗設(shè)備有限公司;FE20/EL20酸度計、AL104電子天平梅特勒-托利多儀器有限公司;TGL-24MC低速臺式離心機 長沙平凡儀器儀表有限公司。
1.3 方法
1.3.1 草魚肌原纖維蛋白液提取
取160 g草魚肉,加入10 倍體積經(jīng)過預(yù)冷過的20 mmol/L Tris-馬來酸緩沖液(50 mmol/L KC1-20 mmol/L Tris-馬來酸,經(jīng)0.5 mol/L的NaOH溶液中和),用攪拌機勻漿,9 000 r/min低溫4 ℃離心10 min,取出后棄去上清液,按此方法重復(fù)洗滌2 次。沉淀與20 mmol/L Tris-馬來酸緩沖液(0.6 mol/L KC1-20 mmol/L Tris-馬來酸,經(jīng)0.5 mol/L的NaOH溶液中和)用攪拌機勻漿,放入冰箱于4 ℃提取60 min,取出后9 000 r/min低溫4 ℃離心30 min,所得上清液為實驗用肌原纖維蛋白溶液[9]。
1.3.2 實驗設(shè)計
將所得的草魚肌原纖維蛋白液(9.61 mg/mL)分成4 組進行處理。A組為對照組,不額外添加抗凍劑;B組為商業(yè)抗凍劑組,向草魚肌原纖維蛋白溶液中添加4%蔗糖和4%山梨糖醇;C組為葡聚糖T7組,添加0.5%葡聚糖T7(Mw為7 000 D);D組為葡聚糖T20組,添加0.5%葡聚糖T20(Mw為20 000 D)。將上述樣品分裝于10 mL凍存管中,置于-20 ℃的冷庫中凍藏30 d,每5 d測定各組樣品生化指標(biāo)的變化情況。
1.3.3 鹽溶性蛋白質(zhì)量濃度的測定
采用考馬斯亮藍G250法[10]測定樣品鹽溶性蛋白,測定過程中用20 mmol/L Tris-馬來酸緩沖液(0.6 mol/L KC1-20 mmol/L Tris-馬來酸溶液,經(jīng)0.5 mol/L的NaOH溶液中和)稀釋。采用牛血清蛋白作為標(biāo)準(zhǔn)品繪制標(biāo)準(zhǔn)曲線計算鹽溶性蛋白含量。
1.3.4 Ca2+-ATPase活性的測定
采用南京建成生物工程研究所提供的超微量ATP酶(Ca2+)測試盒測定。
1.3.5 表面疏水性的測定
用考馬斯亮藍G250法測定蛋白質(zhì)量濃度,取已知質(zhì)量濃度的蛋白采用同樣的緩沖液(0.6 mol/L KCl-20 mmol/L Tris-馬來酸溶液,pH 7.0)稀釋至4 個不同質(zhì)量濃度。分別取上述蛋白液2 mL加入10 μL 8-苯胺-1-萘磺酸溶液(8 mmol/L,溶解在0.1 mol/L,pH 7.0 Tris-馬來酸溶液中)。混勻后采用熒光光譜儀測定,操作條件為:激發(fā)波長385 nm,掃描范圍400~700 nm,掃描速率500 nm/min,激發(fā)狹縫和發(fā)射狹縫寬均為3 nm,響應(yīng)時間0.1 s,記錄波長470 nm處的熒光發(fā)射強度(FI’),并測定不加8-苯胺-1-萘磺酸的蛋白溶液熒光強度(FI0),(FI’)與FI0的差值記為FI,以蛋白質(zhì)量濃度為橫坐標(biāo),F(xiàn)I為縱坐標(biāo)作圖,曲線初始短的斜率即為蛋白分子的表面疏水性指數(shù)S[11]。0
1.3.6 總巰基含量的測定
總巰基質(zhì)量摩爾濃度(b(總巰基))的測定參考劉蕾等[12]的方法并稍作修改。取0.5 mL 4 mg/mL的肌原纖維蛋白溶液加到4.5 mL pH 8.0,0.2 mol/L Tris-HCl緩沖液(8 mol/L尿素,10 mmol/L乙二胺四乙酸,2 g/mL十二烷基磺酸鈉)充分混勻。取4 mL混合液,加入0.5 mL 0.2 mol/L Tris-HCl(0.1 g/mL 5,5’-二硫代雙(2-硝基苯甲酸)(5,5’-dithiobis-(2-nitrobenzoic acid),DTNB),pH 8.0)緩沖液,于412 nm波長處測定其吸光度。空白組用20 mmol /L Tris-馬來酸緩沖液(0.6 mol /L KC1-20 mmol /L Tris-馬來酸,pH 7.0)代替樣品。每組樣品測6 組平行,b(總巰基)計算見公式(1):
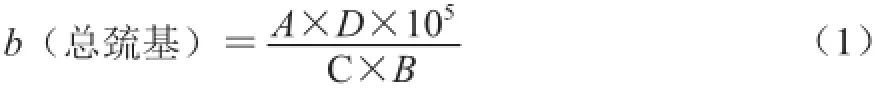
式中:b(總巰基)為總巰基質(zhì)量摩爾濃度/(10-5mol/g pro);A為吸光度;B為待測液蛋白質(zhì)質(zhì)量濃度/(mg/mL);C為分子吸光系數(shù),其值為13 600 L/(mol·cm);D為稀釋倍數(shù)。
1.3.7 活性巰基含量的測定
活性巰基質(zhì)量摩爾濃度(b(巰基))的測定參考劉蕾等[12]的方法并稍作修改。取0.5 mL 4 mg/mL的肌原纖維蛋白溶液加到4.5 mL pH 8.0、0.2 mol/L Tris-HCl緩沖液(10 mmol/L乙二胺四乙酸,2 g/mL十二烷基磺酸鈉)充分混勻。取4 mL混合液,加入0.5 mL 0.2 mol/L Tris-HCl(0.1g/mL DTNB,pH 8.0)緩沖液,于412 nm波長處測定其吸光度。空白組用20 mmol/L Tris-馬來酸緩沖液(0.6 mol /L KC1-20 mmol/L Tris-馬來酸,pH 7.0)代替樣品。每組樣品測6 組平行,b(巰基)計算見公式(2):

式中:b(巰基)為活性巰基質(zhì)量摩爾濃度/(10-5mol/g pro);A為吸光度;B為待測液蛋白質(zhì)質(zhì)量濃度/(mg/mL);C為分子吸光系數(shù),其值為13 600 L/(mol·cm);D為稀釋倍數(shù)。
1.4 數(shù)據(jù)統(tǒng)計
采用SPSS 17.0統(tǒng)計分析軟件對結(jié)果進行方差分析。在進行顯著性差異分析時,采用最小顯著極差方法進行所有處理均數(shù)間的相互比較。
2 結(jié)果與分析
2.1 凍藏過程中鹽溶性蛋白含量的變化
如圖1所示,隨著肌原纖維蛋白凍藏時間的延長,其鹽溶性蛋白 質(zhì)量濃度呈下降的趨勢。其中,凍藏30 d后,對照組、商業(yè)抗凍劑組、葡聚糖(T7)組和葡聚糖(T20)組的鹽溶蛋白含量下降到只有0 d初始值的60.01%、72.66%、64.86%和62.58%。凍藏過程中,導(dǎo)致肌原纖維鹽溶性蛋白含量下降的因素有很多。1)鹽溶性肌原纖維蛋白最初在0.6 mol/L濃度的高離子強度溶液體系中呈溶解狀態(tài),隨著凍藏時間的延長,鹽溶蛋白冷變性程度提高,肌原纖維蛋白開始出現(xiàn)聚集析出的現(xiàn)象,導(dǎo)致肌原纖維蛋白含量下降[13];2)鹽溶蛋白的少量的結(jié)合水易在凍藏過程中形成冰晶,促使蛋白析出,也間接促進了肌動球蛋白分子之間疏水鍵和氫鍵的形成,進而聚集成更大的分子結(jié)構(gòu),導(dǎo)致肌原纖維蛋白含量下降[14]。結(jié)果表明糖類抗凍劑的添加,能延緩肌原纖維蛋白凍藏過程中鹽溶性蛋白含量的下降程度。凍藏過程中,鹽溶性蛋白質(zhì)量濃度的下降趨勢和凍藏時間不完全呈標(biāo)準(zhǔn)的線性關(guān)系。在0~15 d期間,鹽溶性蛋白含量下降速率較緩慢;在15~20 d期間,有明顯加速下降趨勢,20 d后下降速率放緩。其原因可能是,在-20 ℃凍結(jié)條件下,生成的冰晶體積增大,對蛋白形成內(nèi)壓,隨著凍藏時間的延長,在15~20 d達到了臨界點,促使巰基大量氧化生成二硫鍵導(dǎo)致蛋白多肽鏈的聚合,加速了鹽溶性蛋白含量的降低,釋放了由于冰晶體積增大而形成的內(nèi)壓,使得20 d后鹽溶蛋白含量的下降速率再次減緩[15]。

圖1 不同分子質(zhì)量葡聚糖在凍藏過程中對草魚肌原纖維蛋白鹽溶性蛋白含量的影響Fig. 1 Effect of dextran with different molecular weights on the content of salt soluble protein of myofi brillar protein from grass carp
如圖1所示,3 組實驗組在凍藏過程中,其鹽溶性蛋白含量均顯著大于對照組(P<0.05)。其中,商業(yè)抗凍劑組的鹽溶蛋白含量最高,葡聚糖T7組略高于T20組,但組間差異不顯著(P>0.05)。結(jié)果表明,葡聚糖分子質(zhì)量較小的T7組鹽溶性蛋白含量略高于分子質(zhì)量較大的T20組;葡聚糖添加量只有商業(yè)抗凍劑組的1/16,因此在延緩鹽溶性蛋白含量下降的效果暫不及小分子質(zhì)量的4%蔗糖+4%山梨糖醇組合。同時,分子質(zhì)量小的葡聚糖對延緩鹽溶性蛋白含量下降的效果優(yōu)于分子質(zhì)量大的葡聚糖。
2.2 凍藏過程中Ca2+-ATPase活性的變化
如圖2所示,隨著肌原纖維蛋白凍藏時間的延長,其Ca2+-ATPase活性呈下降的趨勢;凍藏5 d,對照組
Ca2+-ATPase活性的下降程度最顯著(P<0.05);5~30 d期間,其Ca2+-ATPase活性的變化不顯著(P>0.05),下降速率趨緩,這與Zhou Aimei等[16]的研究結(jié)果一致,羅非魚糜在-20 ℃環(huán)境條件下凍藏時,其Ca2+-ATPase活性在前2周快速下降,之后下降速率趨緩,最終基本沒有活性。草魚在凍藏的過程中由于其離子強度的增大和凍結(jié)初期冰晶的形成,會導(dǎo)致肌球蛋白頭部的結(jié)構(gòu)發(fā)生了聚合,在蛋白質(zhì)的相互作用下引起的分子重排或肌球蛋白活性部位—SH氧化,使Ca2+-ATPase活性下降[17-18]。對照組在凍藏過程中,其Ca2+-ATPase活性均顯著低于其他抗凍劑組(P<0.05),說明商業(yè)抗凍劑或葡聚糖的添加一定程度上能延緩草魚肌原纖維蛋白的冷凍變性,進而減緩Ca2+-ATPase活性下降程度。

圖2 不同分子質(zhì)量葡聚糖在凍藏過程中對草魚肌原纖維蛋白CaCa2+-ATPase活性的影響Fig. 2 Effect of dextran with different molecular weights on the Ca2+-ATPase activity of myofi brillar protein from grass carp
隨著肌原纖維蛋白凍藏時間的延長,葡聚糖T7組的Ca2+-ATPase活性在5~25 d顯著大于T20組(P<0.05),在第30天的差異不顯著(P>0.05),而且2 組均在5~25 d期間下降不顯著(P>0.05);而商業(yè)抗凍劑組的Ca2+-ATPase活性在前15 d均大于其他組,但在15 d后仍持續(xù)線性下降,最終小于葡聚糖T7和T20組。說明在延緩Ca2+-ATPase活性下降方面,商業(yè)抗凍劑在凍藏前2 周抗凍效果優(yōu)于葡聚糖,基本呈線性趨勢,但是隨著凍藏時間延長至20 d后,效果不及葡聚糖組;同時,分子質(zhì)量較小的葡聚糖對延緩Ca2+-ATPase活性下降的效果優(yōu)于分子質(zhì)量較大的葡聚糖。
2.3 凍藏過程中表面疏水性的變化
蛋白質(zhì)的疏水作用對肽鏈的表達,蛋白質(zhì)的傳送及定位起著重要的作用[19]。蛋白質(zhì)的表面疏水性則反映了蛋白質(zhì)表面疏水殘基的數(shù)量和蛋白質(zhì)的聚集情況。正常情況下,蛋白質(zhì)分子從內(nèi)到外,疏水殘基逐漸減少。但是在凍藏狀態(tài)下,蛋白質(zhì)分子的持水性下降,部分結(jié)合水也開始凍結(jié),使得蛋白質(zhì)分子的疏水側(cè)鏈避開水相而聚集在一起,因此蛋白質(zhì)分子的表面疏水性可作為反映蛋白質(zhì)冷凍變性的重要指標(biāo)[20]。如圖3所示,隨著肌原纖維蛋白凍藏時間的延長,其表面疏水性呈線性上升趨勢。在30 d的凍藏過程中,對照組的表面疏水性顯著大于其他抗凍劑組(P<0.05),從初始的104.31增大到30 d時的558.24,而表面疏水性增大幅度最小的商業(yè)抗凍劑組,30 d后為407.95,說明商業(yè)抗凍劑與葡聚糖的添加有助于延緩由草魚肌原纖維蛋白凍藏過程中冷凍變性所導(dǎo)致的表面疏水性增大。葡聚糖T7組與葡聚糖T20組在前15 d的組間差異并不顯著(P>0.05),而葡聚糖T7組在15 d后開始顯著小于葡聚糖T20組(P<0.05),商業(yè)抗凍劑組從20 d開始,顯著小于葡聚糖T7與T20組(P<0.05)。說明在延緩凍藏過程中草魚肌原纖維蛋白的表面疏水性上升方面,葡聚糖與商業(yè)抗凍劑在的前15 d效果差異不大,但在15~30 d期間,商業(yè)抗凍劑的抗凍效果優(yōu)于葡聚糖;分子質(zhì)量小的葡聚糖,對延緩表面疏水性上升的效果優(yōu)于分子質(zhì)量大的葡聚糖。
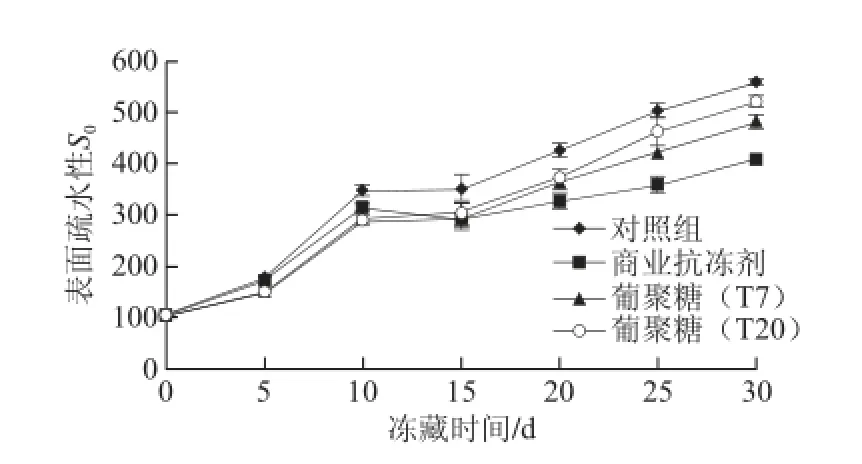
圖3 不同分子質(zhì)量葡聚糖在凍藏過程中對草魚肌原纖維蛋白表面疏水性的影響Fig. 3 Effect of dextran with different molecular weights on the surface hydrophobicity of myofi brillar protein from grass carp
2.4 凍藏過程中總巰基含量的變化

圖4 不同分子質(zhì)量葡聚糖在凍藏過程中對草魚肌原纖維蛋白總巰基含量的影響Fig. 4 Effect of dextran with different molecular weights on the total sulfhydryl group content of myofi brillar protein from grass carp
巰基是淡水魚蛋白質(zhì)中最具反應(yīng)活性的功能性基團,巰基對于草魚肌原纖維蛋白空間結(jié)構(gòu)的穩(wěn)定具有重要的意義,其中總巰基包括活性巰基和隱藏巰基[21],是表征蛋白質(zhì)分子變性的重要指標(biāo)。如圖4所示,隨著肌原纖維蛋白凍藏時間的延長,其總巰基呈波動下降趨勢。對照組總巰基含量下降幅度最大,商業(yè)抗凍劑組的總巰基含量在15 d前顯著大于葡聚糖組(P<0.05),在20 d后其總巰基含量開始趨于穩(wěn)定。葡聚糖T7組與T20組在0~10d,總巰基含量呈不規(guī)則波動下降趨勢;其中葡聚
糖T7組在10 d開始緩慢趨于穩(wěn)定,在20 d后總巰基含量顯著大于商業(yè)抗凍劑組(P<0.05);而葡聚糖T20組的總巰基含量在20 d時趨于穩(wěn)定,與商業(yè)抗凍劑組差異不顯著(P>0.05)。一般來說,蛋白質(zhì)分子聚合體的形成會覆蓋一些巰基,使能夠檢測到游離的巰基部分減少,導(dǎo)致了巰基含量下降[22]。另外凍藏過程中形成的冰晶使得肌原纖維蛋白分子的空間結(jié)構(gòu)發(fā)生改變,使埋藏在分子內(nèi)部的巰基暴露出來,進而被氧化形成二硫鍵導(dǎo)致巰基的減少,圖3所示的Ca2+-ATPase活性也有相同的下降趨勢驗證了這一說法。
綜上所述,葡聚糖和商業(yè)抗凍劑的添加能一定程度延緩草魚肌原纖維蛋白的總巰基下降程度;其中,凍藏0~15 d,商業(yè)抗凍劑延緩總巰基含量下降的效果略優(yōu)于葡聚糖;而15~30 d,總巰基含量漸趨于穩(wěn)定,此時葡聚糖對總巰基含量下降的延緩效果相對更好,且分子質(zhì)量較小的葡聚糖,能更好地保護巰基不被氧化,總巰基含量更早趨于穩(wěn)定。
2.5 凍藏過程中活性巰基含量的變化

圖5 不同分子質(zhì)量葡聚糖在凍藏過程中對草魚肌原纖維蛋白活性巰基含量的影響Fig. 5 Effect of dextran with different molecular weights on the active sulfhydryl group content of myofi brillar protein from grass carp
如圖5所示,隨著肌原纖維蛋白凍藏時間的延長,其活性巰基呈下降趨勢。活性巰基含量在第5天顯著性下降(P<0.05)。第15天,對照組的活性巰基含量顯著小于其他抗凍劑組(P<0.05),而葡聚糖組和商業(yè)抗凍劑組間活性巰基差異不顯著(P>0.05)。第2天,葡聚糖T7組與商業(yè)抗凍劑組活性巰基含量差異不顯著(P>0.05),而葡聚糖T20組與對照組的活性巰基含量卻顯著地小于前2 組(P<0.05)。說明葡聚糖T20組是活性巰基含量最先下降到對照組水平的抗凍劑組,30 d時,4 組間差異均不顯著。在凍藏過程中,肌動球蛋白頭部結(jié)構(gòu)發(fā)生了變化,導(dǎo)致了巰基的暴露,巰基被氧化而形成二硫化合物,同時伴隨著氫鍵和疏水鍵的形成,掩蓋肌動球蛋白中的活性巰基結(jié)構(gòu),使得巰基含量下降[23],由于分布在蛋白質(zhì)分子表明的緣故,相比于隱藏巰基,活性巰基更易被氧化,其下降速率也更易趨于穩(wěn)定。
在草魚肌原纖維蛋白凍藏過程的0~5 d,活性巰基含量下降最為顯著(P<0.05);葡聚糖和商業(yè)抗凍劑的添加在0~20 d對活性巰基含量下降速率的減緩較顯著(P< 0.05),20 d后則不顯著(P>0.05);分子質(zhì)量較大的葡聚糖T20組最先下降到對照組水平。說明葡聚糖和商業(yè)抗凍劑的添加對活性巰基含量在凍藏的20 d前有顯著的影響,20 d后則不顯著,分子質(zhì)量較大的葡聚糖相對于分子質(zhì)量小的葡聚糖更早使活性巰基含量下降到對照組水平。
3 結(jié) 論
在凍藏過程中,葡聚糖能有效延緩草魚肌原纖維蛋白的冷凍變性;其中,葡聚糖對保護Ca2+-ATPase活性,延緩鹽溶性蛋白含量下降和表面疏水性上升的效果較為顯著,在凍藏階段的前20 d對總巰基和活性巰基也體現(xiàn)出了較好的保護作用。此外,分子質(zhì)量小的葡聚糖對Ca2+-ATPase活性和活性巰基的保護作用優(yōu)于分子質(zhì)量大的葡聚糖;在延緩表面疏水性的上升和總巰基的保護上在凍藏超過15 d后的效果也體現(xiàn)出了明顯優(yōu)勢。
而葡聚糖和常用商業(yè)抗凍劑(4%蔗糖+4%山梨糖醇)對肌原纖維蛋白冷凍變性的影響也有一定的差異。雖然葡聚糖在延緩鹽溶性蛋白含量下降方面的效果暫不如商業(yè)抗凍劑,在表面疏水性和活性巰基含量方面沒有表現(xiàn)出顯著差異;但實驗結(jié)果顯示,小分子質(zhì)量的葡聚糖(T7)在凍藏超過20 d情況下,對Ca2+-ATPase活性和總巰基的保護效果要好于商業(yè)抗凍劑。并且在相同情況下,葡聚糖的添加量(0.5%)僅為傳統(tǒng)商業(yè)抗凍劑的1/16,避免了傳統(tǒng)小分子糖類冷凍保護劑甜味較重、熱量較高、易影響產(chǎn)品口味和再加工性能差的弊端,更能適合糖尿病、肥胖等部分特定消費人群;因此,在延緩草魚肌原纖維蛋白冷凍變性方面,以葡聚糖為代表的多糖類冷凍保護劑整體優(yōu)于傳統(tǒng)商業(yè)抗凍劑,小分子質(zhì)量葡聚糖比大分子質(zhì)量葡聚糖效果更佳,在淡水魚及相關(guān)制品的冷凍貯藏中的應(yīng)用前景十分廣闊。
[1] 唐裕芳. 魚肉的腐敗機理及其防腐措施[J]. 肉類工業(yè), 2000, 25(2): 30-32. DOI:10.3969/j.issn.1008-5467.2000.02.015.
[2] DYER W J. Protein denaturation in frozen and stored fi sha[J]. Journal of Food Science, 1951, 16(1/6): 522-527. DOI:10.1111/j.1365-2621.1951.tb17416.x.
[3] 潘錦鋒, 羅永康. 鰱魚魚糜在凍藏過程中理化特性的變化[J]. 肉類研究, 2008, 22(9): 45-49. DOI:10.3969/j.issn.1001-8123.2008.09.014.
[4] LESLIE S B, IISRAELI E, LIGHTHART B, et al. Trehalose and sucrose protect both membranes and proteins in intact bacteria during drying[J]. Applied and Environmental Microbiology, 1995, 61(10): 3592-3597.
[5] SANKAR T V, RAMACHANDRAN A. Thermal stability of myofibrillar protein from Indian major carps[J]. Journal of the Science of Food and Agriculture, 2005, 85(4): 563-568. DOI:10.1002/ jsfa.1956.
[6] WU Jinhong, WANG Shaoyun, WU Yan, et al. Cryoprotective effect of sericin enzymatic peptides on the freeze-induced denaturation of grass carp surimi[J]. Applied Mechanics and Materials, 2012, 140: 291-295. DOI:10.4028/www.scientifi c.net/AMM.140.291.
[7] 潘錦鋒. 草魚肌原纖維蛋白在凍藏與加熱 過程中理化特性的變化及蛋白變性保護劑的研究[D]. 北京: 中國農(nóng)業(yè)大學(xué), 2009.
[8] 張志遠. 冷凍對養(yǎng)殖大黃魚品質(zhì)影響的研究[D]. 杭州: 浙江工商大學(xué), 2010.
[9] XIONG Guangquan, CHENG Wei, YE Lixiu, et al. Effects of konjac glucomannan on physicochemical properties of myofibrillar protein and surimi gels from grass carp (Ctenopharyngodon idella)[J]. Food Chemistry, 2009, 116(2): 413-418. DOI:10.1016/ j.foodchem.2009.02.056.
[10] CANDIANO G, BRUSCHI M, MUSANTE L, et al. Blue silver: a very sensitive colloidal Coomassie G-250 staining for proteome analysis[J]. Electrophoresis, 2004, 25(9): 1327-1333. DOI:10.1002/ elps.200305844.
[11] BENJAKUL S, SEYMOUR T A, MORRISSEY M T, et al. Physicochemical changes in Pacific whiting muscle proteins during iced storage[J]. Journal of Food Science, 1997, 62(4): 729-733. DOI:10.1111/j.1365-2621.1997.tb15445.x.
[12] 劉蕾, 王航, 羅永康, 等. 復(fù)合魚肉肌原纖維蛋白加熱過程中理化特性變化的研究[J]. 淡水漁業(yè), 2012, 42(3): 88-91. DOI:10.3969/ j.issn.1000-6907.2012.03.018.
[13] 侯溫甫, 薛長湖, 楊文鴿, 等. 低溫速凍處理對美國紅魚-20 ℃凍藏生化特性的影響[J]. 水產(chǎn)科學(xué), 2006, 25(2): 55-58. DOI:10.3969/ j.issn.1003-1111.2006.02.001.
[14] 郭藹光. 基礎(chǔ)生物化學(xué)[M]. 北京: 高等教育出版社, 2001.
[15] 侯溫甫, 薛長湖, 楊文鴿, 等. 低溫速凍處理對鯔魚凍藏生化特性的影響[J]. 海洋水產(chǎn)研究, 2006, 27(3): 73-77. DOI:10.3969/ j.issn.1000-7075.2006.03.014.
[16] ZHOU Aimei, BENJAKUL S, PAN Ke, et al. Cryoprotective effects of trehalose and sodium lactate on tilapia (Sarotherodon nilotica) surimi durin g frozen storage[J]. Food Chemistry, 2006, 96(1): 96-103. DOI:10.1016/j.foodchem.2005.02.013.
[17] OKADA T, INOUE N, AKIBA M. Electron microscopic observation and biochemical properties of carp myosin B during frozen storage[J]. Nippon Suisan Gakkaishi, 1986, 52(2): 345-353. DOI:10.2331/ suisan.52.345.
[18] JIANG S T, HWANG D E R C, CHEN C S A N. Effect of storage temperatures on the formation of disulfides and denaturation of milkfish actomyosin (Chanos chanos)[J]. Journal of Food Science, 1988, 53(5): 1333-1335. DOI:10.1111/j.1365-2621.1988.tb09270.x.
[19] ROMERO A, CORDOBES F, GUERRERO A, et al. Crayfi sh protein isolated gels. A study of pH infl uence[J]. Food Hydrocolloids, 2011, 25(6): 1490-1498. DOI:10.1016/j.foodhyd.2011.02.024.
[20] 王克夷. 疏水作用和蛋白質(zhì)[J]. 生命的化學(xué), 1999, 19(5): 233-235. DOI:10.3969/j.issn.1000-1336.1999.05.011.
[21] BENJAKUL S, SUTTHIPAN N. Muscle changes in hard and soft shell crabs during frozen storage[J]. LWT-Food Science and Technology, 2009, 42(3): 723-729. DOI:10.1016/j.lwt.2008.10.003.
[22] 郭園園, 孔保華. 冷凍貯藏引起的魚肉蛋白質(zhì)變性及物理化學(xué)特性的變化[J]. 食品科學(xué), 2011, 32(7): 335-340.
[23] SHIGERU H, SHURYO N. Contribution of hydrophobicity, net charge and sulfhydryl groups to thermal properties of ovalbumin[J]. Canadian Institute of Food Science and Technology Journal, 1985, 18(4): 290-295. DOI:10.1016/S0315-5463(85)71960-8.
Cryoprotective Effect and Mechanism of Dextran with Different Molecular Weights on Denaturation of Myofi brillar Protein from Grass Carp (Ctenopharyngodon idella)
LU Yaobin1,2, XIONG Guangquan1, LI Xin1, WU Wenjin1, QIAO Yu1, DING Anzi1, LIAO Li1, WANG Jun1, WANG Lan1,*
(1. Farm Products Processing Research Sub-Center, Hubei Innovation Center of Agriculture Science and Technology, Institute of Agricultural Products Processing and Nuclear-Agricultural Technology, Hubei Academy of Agricultural Sciences, Wuhan 430064, China; 2. College of Food Science and Engineering, Wuhan Polytechnic University, Wuhan 430023, China)
The present study investigated the cryoprotective effect of dextran with different molecular weights on denaturation of myofibrillar protein from grass carp (Ctenopharyngodon idella). The content of salt soluble protein, Ca2+-ATPase activity, surface hydrophobicity, total sulfhydryl group and active sulfhydryl group were evaluated. Results showed that the denaturation of grass carp myofi brillar protein was signifi cantly delayed by dextran during frozen storage, and the effect of dextran (0.5%) was better than that of commercial antifreeze (4% sucrose + 4% D-sorbitol). Low molecular weight dextran (T7) was better than high molecular weight dextran (T20) in protecting the Ca2+-ATPase activity and active sulfhydryl group and also in delaying the increase of surface hydrophobicity and the decrease of sulfhydryl group after 15 d frozen storage. Thus, the low molecular weight dextran is recommended to be used in the fishery industry as a promising cryoprotectant.
grass carp; myofi brillar protein; dextran; molecular weight; frozen denaturation
10.7506/spkx1002-6630-201610049
TS254.4
A
1002-6630(2016)10-0289-06
魯耀彬, 熊光權(quán), 李新, 等. 葡聚糖延緩草魚肌原纖維蛋白冷凍變性的機理分析[J]. 食品科學(xué), 2016, 37(10): 289-294. DOI:10.7506/spkx1002-6630-201610049. http://www.spkx.net.cn
LU Yaobin, XIONG Guangquan, LI Xin, et al. Cryoprotective effect and mechanism of dextran with different molecular weights on denaturation of myofi brillar protein from grass carp (Ctenopharyngodon idella)[J]. Food Science, 2016, 37(10): 289-294. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201610049. http://www.spkx.net.cn
2015-08-19
武漢市青年科技晨光計劃項目(2015070404010197);湖北省重大科技創(chuàng)新計劃項目(2015ABA038);
湖北省科技支撐計劃項目(2014BBA158);湖北省農(nóng)科院青年科學(xué)基金項目(2013NKYJJ16)
魯耀彬(1990—),男,碩士研究生,研究方向為肉禽深加工機理與技術(shù)。E-mail:394454689@qq.com
*通信作者:汪蘭(1981—),女,副研究員,博士,研究方向為農(nóng)產(chǎn)品加工和天然產(chǎn)物化學(xué)。E-mail:11060577@qq.com

