人血漿蛋白多烯紫杉醇納米粒子的自組裝及對腫瘤的靶向性
龔光明,陳美惠,王曙東
?
·論 著·
人血漿蛋白多烯紫杉醇納米粒子的自組裝及對腫瘤的靶向性
龔光明,陳美惠,王曙東
目的 提高多烯紫杉醇的溶解度,提高其靶向性能。方法 用二硫鍵斷裂法制備人血清白蛋白多烯紫杉醇納米粒子,并用電鏡進行觀察。對粒子載藥量、穩定性及粒子對腫瘤部位趨向性進行表征。結果 二硫鍵斷裂法成功組裝了白蛋白-多烯紫杉醇納米粒子。電鏡觀察該納米粒子外貌為80~100 nm左右的球形粒子,高效液相和蛋白質定量檢測多烯紫杉醇載藥量可達21.5%。結果 白蛋白多烯紫杉醇納米制劑可顯著提高多烯紫杉醇的溶解度,提高對腫瘤靶向性。結論 白蛋白-多烯紫杉醇納米粒子對腫瘤細胞具有良好的靶向作用,具有臨床運用的潛在價值。
血漿蛋白;多烯紫杉醇;納米粒子;自組裝;腫瘤靶向
腫瘤新生血管不遵循正常的血管結構而具有毛細血管的特征[1],其高通透性使得一些特殊大小的藥物載體容易通過腫瘤血管但不能通過正常血管,藥物體系在其中聚集且潴留時間延長,這就是滲透和滯留效應(enhanced permeability and retention, EPR)[2-4],是腫瘤被動靶向[5]。除分子靶向腫瘤藥物外[6-7],血清白蛋白可在快速生長的腫瘤中積蓄,具有主動靶向性[8-9],負載的藥物能被選擇性輸送到腫瘤組織,藥物毒副作用被降低[10]。多烯紫杉醇是一類合成的微管為靶點的抗腫瘤藥物,使用時需要吐溫80和乙醇增溶,具有顯著毒性。前期我們用巰基乙醇為變性劑制備了白蛋白納米粒子[11]。本研究中我們用工藝更簡便的三(2-羧乙基)膦(trichloroethyl phosphate, TCEP)為變性劑制備了白蛋白多烯紫杉醇納米粒子,并進行了相關表征。
1 材料與方法
1.1 材料
人血清白蛋白(human serum albumin, HSA),近紅外-797(NIR-797),購自Sigma(美國)。TCEP購自Pierce(美國)。三羥甲基氨基甲烷(Tris)購自國藥集團,多烯紫杉醇(Docetaxel)購自南京澤朗醫藥,等其余試劑均為國產試劑,現購現用。S180(小鼠肛門纖維肉瘤細胞,購自上海博谷生物公司),ICR小鼠雄性,20~22 g,10只,購自上海西普爾-必凱實驗動物有限公司〔合格證號:2008001640769,許可證號碼:SCXK(滬)2013-0016〕。JEM-2100電子顯微鏡(JEOL,日本)。
1.2 方法
1.2.1 白蛋白多烯紫杉醇粒子 (HSA docetaxel nanoparticles, NPs-Docetaxel)的制備、形態觀察 將HSA溶解于,5 mM Tris(pH 7.8),濃度為2 mg/mL,攪拌作用下,向HSA溶液中加入TCEP,10 min后加入Docetaxel(10 mg/mL)。Tris緩沖液對納米粒子溶液進行透析,時間為24 h。粒子溶液滴在200目鍍碳膜銅網上,用1%磷鎢酸染色。干燥后,用JEOL電子顯微鏡觀察粒子。
1.2.2 納米粒子中Docetaxel含量分析 HPLC色譜條件:色譜柱:Kromasil C18柱,5 μm, 250 mm×4.6 mm;流速:1.0 mL/min;流動相:乙腈∶水(76∶24,v/v);檢測波長:230 nm。
載藥量根據公式:載藥量=Docetaxel重量/(蛋白質重量+Docetaxel重量)×100%
取100 μL NPs-Docetaxel加入800 μL乙腈,震蕩,混勻后,10 000 rpm,離心10 min,取上清。Docetaxel標準品為對照,HPLC測定樣品中Docetaxel質量,考馬斯亮藍試劑盒測定樣品中白蛋白質量,計算納米粒子溶液中Docetaxel載藥量。
1.2.3 納米粒子在25 ℃ 5%葡萄糖水溶液中的穩定性 取NPs-Docetaxel凍干樣品,5%葡萄糖+蒸餾水溶解后,用激光粒度測定儀檢測粒徑起始粒子大小,將溶液靜置在25 ℃,分別在0、2、6、18、24、36、48 h檢測其粒子大小。
1.2.4 NPs-Docetaxel的大鼠血液毒性 不同組分別連續3次給予生理鹽水、Docetaxel (10 mg/kg)和NPs-Docetaxel (10、20 mg/kg)后,抗凝管采血,全血自動分析儀 (XS-800i, SYSMEX, Japan)分析白細胞和紅細胞的數量。
1.2.5 NIR-797-NPs-Docetaxel在小鼠體內的分布 用5 mg NIR-797(二甲亞砜溶解)與 50 mg HSA(5 mM Tris,pH 7.8, 10 mL)混合反應2 h制備NPs-Docetaxel,5 mM Tris緩沖液透析24 h,加入1%甘露醇后凍干,臨用前用水稀釋。
1.2.5.1 S180小鼠腫瘤模型 參照Wu等[12]方法,將所購S180細胞接種至ICR小鼠左腋皮下,構建荷瘤小鼠。1周后選腫瘤長徑、短徑在0.5~1 cm之間的成瘤小鼠6只,分成兩組,3只/組,分別用于NIR-797和NIR-797-NPs-Docetaxel成像,以脫毛膏脫去腫瘤部位毛發用于活體成像。
1.2.5.2 NIR-797-NPs-Docetaxel示蹤 NIR-797-NPs-Docetaxel溶液甘露醇凍干粉用水溶解后,取200 μL 尾靜脈注射腫瘤小鼠,間隔3、8、30、72、108 h在近紅外檢測儀下觀察熒光標記納米粒子在小鼠體內成像情況。
1.2.5.3 實時荷瘤小鼠NIR體內示蹤過程 小鼠麻醉后,放入紅外成像儀暗室,將暗室通麻醉氣體使小鼠處于麻醉狀態,明場調節視野,使小鼠全身在視野范圍之內,熒光激發波長調節至704 nm,發射波長700~950 nm,成像后保存圖象待處理。小鼠活體成像結束后,將小鼠取心、肝、脾、肺、腎、腫瘤、大腦、小腸、胃等臟器觀察紅外熒光,并拍片。拍片后,用活體成像儀上的軟件處理小鼠活體和解剖后各組織器官的熒光信號。
2 結 果
2.1 NPs-Docetaxel的制備 NPs-Docetaxel形成過程中,溶液逐漸變成淡藍色,透射電鏡觀察粒子大小為80~100 nm左右(圖1)。TCEP是一種廣泛運用的二硫鍵斷裂劑,無色無味、無毒性,后期易處理。制備的納米粒子溶液攪拌條件下透析24 h,中間發現溶液及容器壁上均有白色顆粒,可能在透析過程中,Docetaxel從粒子中逐步釋放出來,聚集成白色懸浮物,部分粒子分散開。

圖1 透射電鏡觀察白蛋白多西紫杉醇粒子外貌和形狀 (1%磷鎢酸染色×150萬)
2.2 NPs-Docetaxel載藥量和溶解度分析 高效液相檢測NPs-Docetaxel溶液中Docetaxel的含量為0.42 mg/mL,HSA含量為1.95 mg/mL, Docetaxel載藥量為21.5%。Docetaxel的溶解度提高了近100倍。
2.3 NPs-Docetaxel在25 ℃5%葡萄糖水溶液中的穩定性 NPs-Docetaxel的起始大小為124.7 nm,隨其在25 ℃葡萄糖水溶液中放置時間的延長,納米粒子逐漸變大,見圖2。樣品放置48 h以內,沒有明顯沉淀,粒子小于240 nm(DLS檢測)。
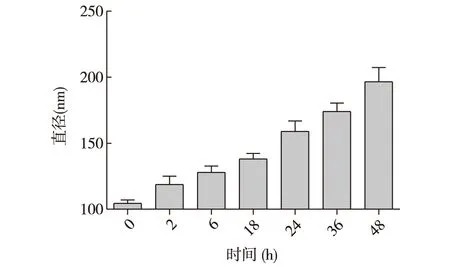
圖2 白蛋白多烯紫杉醇粒子與5%葡萄糖孵育48 h內粒徑的變化
2.4 Docetaxel及其制劑對大鼠血液毒性 大鼠分別連續3次給予生理鹽水、Docetaxel和NPs-Docetaxel制劑后,抗凝管采血,結果顯示,Docetaxel組與生理鹽水組相比,白細胞數目呈顯著性降低(P<0.05,圖3a),而NPs-Docetaxel組白細胞與對照組相比,無顯著下降(圖3a)。Docetaxel和NPs-Docetaxel注射劑與對照組相比,對大鼠紅細胞數量無顯著影響(圖3b)。NPs-Docetaxel所致的骨髓抑制較Docetaxel更低。
2.5 NIR-797-NPs-Docetaxel在荷瘤小鼠體內的分布 將1 h、24 h和72 h的NIRF數據信號提取后,獲取熒光信號如圖4。結果顯示:24 h內,NIR-797組小鼠(左)和NIR-797-NPs-Docetaxel組小鼠(右)熒光主要在腹腔和膀胱位置富集,可能NIR經過膽道沿著腸道排泄,另外沿泌尿系統移行至膀胱,而被排出體外。72 h后,NIR-797小鼠腹腔部位熒光難以檢測,主要集中于肝臟和腫瘤部位;NIR-797-NPs-Docetaxel組小鼠熒光在腸道和腫瘤部位均有聚集(圖4a)。72 h后,荷瘤小鼠各組織器官心臟、肝臟、肺臟、脾臟、腎臟、腫瘤、腦、小腸、胃被解剖剝離,近紅外檢測NIR熒光。結果表明,NPs-Docetaxel組腫瘤部位熒光最強,肝臟和腎臟相對弱,其他器官沒有檢測到納米粒子熒光,NIR-797組小鼠腫瘤部位熒光較弱(圖4b)。
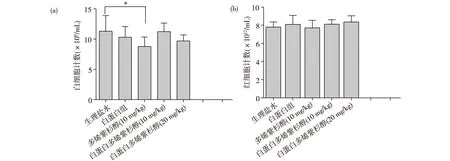
圖3 大鼠全血細胞計數分析[(a)白細胞計數;(b)紅細胞計數;*P<0.05]
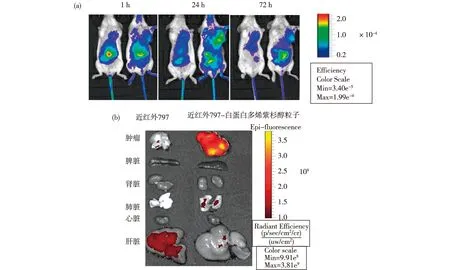
圖4 小鼠成像圖[(a)S180荷瘤小鼠靜脈注射近紅外-797、近紅外-797-白蛋白多烯紫杉醇后1 h、24 h和72 h成像圖; (b)72 h后,小鼠離體臟器成像]
3 討 論
TCEP變性法可用于制備80~100 nm大小的NPs-Docetaxel。二硫鍵的破壞可能導致了HSA疏水性區域的暴露[11],在Docetaxel的協同作用下形成了納米粒子。本文Docetaxel的載藥量達到21.5%,大大提高了Docetaxel溶解度。臨床上使用Docetaxel時,需要吐溫和乙醇作為增溶劑,而NPs-Docetaxel無需吐溫和乙醇增溶,避免了溶血反應的發生。納米粒子在5%葡萄糖溶液中穩定性可達30 h,粒徑仍然小于240 nm,表明NPs-Docetaxel非常穩定,符合注射劑的注射要求。NPs-Docetaxel對白細胞數量降低的影響小于Docetaxel組,骨髓抑制毒性顯著降低。由于NPs-Docetaxel對腫瘤組織具有較好被動或主動靶向作用,因此,本方法制備的NPs-Docetaxel是良好的Docetaxel遞送系統,具有較強的臨床開發價值。
[1] 符比煒,穆 毅,路逵陽.微血管密度和血管內皮生長因子在肝細胞癌中的表達及意義[J].東南國防醫藥,2009,7(1):23-25.
[2] Iyer AK, Greish K, Seki T, et al.Polymeric micelles of zinc protoporphyrin for tumor targeted delivery based on EPR effect and singlet oxygen generation[J]. J Drug Target, 2007,15(7-8): 496-506.
[3] Hobbs SK, Monsky WL, Yuan F, et al. Regulation of transport pathways in tumor vessels: role of tumor type and microenvironment[J]. Proc Natl Acad Sci USA, 1998, 95(8): 4607-4612.
[4] Maeda H, Wu J, Sawa T, et al.Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review[J]. J Contr Rel, 2000, 65(1-2):271-284.
[5] Duncan R. Drug polymer conjugates potential for improved chemotherapy[J]. Anti-Cancer Drug, 1992, 3(3): 175-210.
[6] 王曉萍,豐俊東.放射治療與分子靶向藥物在腫瘤治療中的聯合應用[J].東南國防醫藥,2008,10(4):277-280.
[7] 耿懷成,陳龍邦.抗體介導的抗腫瘤血管治療[J].醫學研究生學報,2001,14(6):535-537.
[8] Lshima Y, Chen D, Fang J, et al. S-nitrosated human serum albumin dimer is not only a novel anti-tumor drug but also a potentiator for anti-tumor drugs with augmented EPR effects[J]. Bioconjug Chem, 2012, 23 (2): 264-271.
[9] Kratz F, Muller-Driver R, Hofmann I, et al. A novel macromolecular prodrug concept exploiting endogenous serum albumin as a drug carrier for cancer chemotherapy[J]. J Med Chem, 2000, 43(7):1253-1256.
[10]Sparreboom A, Scripture CD, Trieu V, et al. Comparative preclinical and clinical pharmacokinetics of a cremophor-free, nanoparticle albumin-bound curcumin (ABI-007) and curcumin formulated in cremophor (Taxol)[J]. Clin Cancer Res, 2005, 11(11): 4136-4143.
[11]Gong G, Zhi F, Wang K, et al. Fabrication of a nanocarrier system through self-assembly of plasma protein and its tumor targeting[J]. Nanotechnology,2011, 22(29):295603-295611.
[12]Wu D, Gao Y, Chen L, et al. Anti-tumor effects of a novel chimeric peptide on S180 and H22 xenografts bearing nude mice[J]. Peptides,2010, 31(5):850-864.
(本文編輯:張仲書; 英文編輯:王建東)
Preparation and characterization of human serum albumin-docetaxel nanoparticles
GONG Guang-ming, CHEN Mei-hui, WANG Shu-dong.
DepartmentofPharmaceutics,NanjingGeneralHospitalofNanjingMilitaryCommand,PLA,Nanjing,Jiangsu210002,China
Objective To improve the solubility of docetaxel and reduce its toxic and side effects, and to improve the targeting capability of docetaxel. Methods The human serum albumin-docetaxel nanoparticles were prepared by the disulfide bond reduction method, and were observed by electron microscope. The drug loading efficiency, stability and targeting capability of nanoparticles were explored. Results Albumin-docetaxel nanoparticles were successfully fabricated through disulfide bond reduction. Albumin-docetaxel nanoparticles were about 80-100 nm in diameter, and the loading of docetaxel was up to 21.5%. The marrow depression toxicity of albumin-docetaxel nanoparticles, which could accumulate at the tumor site, was reduced. Conclusion Albumin-docetaxel nanoparticles have good targeting effect on tumor cells, which have potential value in clinical application.
human serum albumin; docetaxel; nanoparticles; self-assembly; tumor target
南京軍區南京總醫院院管課題(2013055)
210002江蘇南京,南京軍區南京總醫院制劑科
王曙東,E-mail: sdwangpharm@126.com
龔光明,陳美惠,王曙東.人血漿蛋白多西紫杉醇納米粒子的自組裝及對腫瘤的靶向性[J].東南國防醫藥,2016,18(5):468-471.
R945
A
10.3969/j.issn.1672-271X.2016.05.006
2016-05-05;
2016-05-17)

