寬體沙鰍精子超微結構及Na+、K+、Ca2+對其精子活力的影響
王永明, 陳瑜, 胡雨, 謝碧文*, 岳興建, 王芳, 齊澤民, 王淯
(1. 內江師范學院生命科學學院,長江上游魚類資源保護與利用四川省重點實驗室,四川內江641112;2. 西南大學,淡水魚類資源與生殖發育教育部重點實驗室,重慶400715)
?
寬體沙鰍精子超微結構及Na+、K+、Ca2+對其精子活力的影響
王永明1, 陳瑜1, 胡雨2, 謝碧文1*, 岳興建1, 王芳1, 齊澤民1, 王淯1
(1. 內江師范學院生命科學學院,長江上游魚類資源保護與利用四川省重點實驗室,四川內江641112;2. 西南大學,淡水魚類資源與生殖發育教育部重點實驗室,重慶400715)
選取健康的性成熟雄性寬體沙鰍,運用JSM 6510LV型掃描電鏡、H-7500型透射電鏡及Motic-BA210數碼顯微鏡分別觀察了寬體沙鰍精子的超微結構及不同濃度Na+、K+、Ca2+對其精子活力的影響。結果顯示,寬體沙鰍精子頭部圓球形,無頂體,細胞核后端有一植入窩凹陷,凹陷深度為細胞核長徑的1/6。中片由中心粒復合體和袖套組成。中心粒復合體分為近端中心粒和基體,兩者呈“L”型排列;袖套呈兩側不對稱分布,一側狹長,另一側肥厚。尾部主要由軸絲組成,為典型的“9+2”型雙聯微管結構,微管動力蛋白臂明顯。以NaCl、KCl和CaCl2濃度分別為75 mmol·L-1、0.5 mmol·L-1和5 mmol·L-1作為寬體沙鰍精子的激活介質,效果最佳。建議實際生產中選取合適的激活介質進行人工授精。
寬體沙鰍;精子;超微結構;精子活力
魚類精子的形態及活力是影響其繁殖效果的重要因素(Gagnon,1990)。魚類的精子活力是評價精子質量最重要的指標,與受精率成顯著正相關(Vladic & Jarvi,1997)。而魚類精子超微結構的研究不僅有助于揭示其受精機理及系統進化,而且在硬骨魚類分類學研究中具有重要的實踐意義(劉雪珠,楊萬喜,2002)。
寬體沙鰍Sinibotiareevesae隸屬鯉形目Cypriniformes鰍科Cobitidae沙鰍亞科Botiinae,為長江上游特有經濟魚類(丁瑞華,1994)。近年來,由于水利工程建設和采砂作業對其產卵場和索餌場的破壞,加之水體污染,其野生資源量急劇下降(岳興建等,2011)。目前,對寬體沙鰍的研究主要集中在胚胎發育(岳興建等,2011)、組織學(王芳等,2011)、個體生殖力(黃燕等,2011)、親魚脂肪酸組成(頡江等,2013)、繁殖生物學(王永明等,2014)及年齡與生長(王永明等,2015)等方面,尚無其精子超微結構及精子活力的研究。本文對寬體沙鰍精子超微結構及不同濃度Na+、K+、Ca2+溶液對其精子活力的影響進行了研究,旨在為該魚生殖生物學的研究和深入開展人工養殖提供基礎資料。
1 材料與方法
1.1 材料
2014年5月,于沱江(銀山段)收集性成熟寬體沙鰍,選取性腺發育良好的健康雄魚進行試驗,體質量12.42 g±0.58 g,體長88.33 mm±3.92 mm。
1.2 方法
1.2.1 掃描電鏡材料 活體解剖并切取大小為0.1 cm3的成熟精巢,用2.5%戊二醛固定,梯度乙醇脫水,叔丁醇置換,CO2臨界點干燥,JEOL JEC-3000FC噴金,JSM 6510LV掃描電鏡觀察拍照,觀察精子的外部形態。
1.2.2 透射電鏡材料 活體解剖并切取大小約0.1 cm3的成熟精巢,用2.5%戊二醛固定,24 h后用pH7.4的0.2 mol·L-1磷酸緩沖液沖洗3次,梯度乙醇脫水,丙酮置換,環氧樹脂650聚合包埋,LKB-5型超薄切片機切片,醋酸雙氧鈾和檸檬酸鉛雙染,H-7500透射電鏡觀察、拍照,觀察精子的超微結構。
1.2.3 活力觀察
精液采集 用吸水紙或干毛巾吸干雄魚生殖孔表面及周圍的水分并擦凈,由前往后輕壓魚腹兩側獲得精液。用干燥潔凈的載玻片接取精液,置于冰浴中備用。要求精液乳白色、粘稠、無水、無血、無尿、無糞便,遇水后能迅速散開。采集的精液樣品應至少每10 min更換一次,避免在空氣中長時間暴露導致精子失活影響實驗結果。
試驗液配制 配置3種不同陽離子試驗液,每種試驗液用曝氣去離子水配制6~7個濃度梯度:
NaCl溶液:0 mmol·L-1、10 mmol·L-1、25 mmol·L-1、50 mmol·L-1、75 mmol·L-1和100 mmol·L-1。
KCl溶液:0 mmol·L-1、0.1 mmol·L-1、0.3 mmol·L-1、0.5 mmol·L-1、0.7 mmol·L-1、0.9 mmol·L-1和1.0 mmol·L-1。
CaCl2溶液:0 mmol·L-1、1 mmol·L-1、3 mmol·L-1、5 mmol·L-1、10 mmol·L-1、15 mmol·L-1和20 mmol·L-1。
活力觀察 參照魯大椿(1989)的方法將寬體沙鰍精子的運動分為快速運動、中速運動、慢速運動和原地顫動4個階段。有效運動時間(effective movement time,ET)是快速運動時間與中速運動時間之和,為精子的有效受精時間。精子壽命(sperm life time,ST)指精子從激活開始,到約90%的精子停止原地顫動所需的時間。
活力測定 用干凈潤洗過的膠頭滴管滴半滴試驗液于干燥潔凈的載玻片上,置于Motic-BA210顯微鏡(40×)上,調節顯微鏡至視野清晰。用干凈牙簽蘸取少許新鮮寬體沙鰍精液于視野可見范圍內的試驗液調勻,同時按下秒表計時。觀察視野范圍中精子的運動狀況,記錄快速運動時間、中速運動時間、慢速運動時間和壽命。每個濃度連續觀察30次,結果用“平均數±標準差”表示。
統計分析 采用SPSS 19.0和Excel 2003對實驗所得數據進行統計分析。
2 結果
2.1 寬體沙鰍精子的外部形態
掃描電鏡觀察發現,寬體沙鰍精子充滿了整個精巢小葉腔(圖版Ⅰ:1)。精子由頭部、中片和尾部組成(圖版Ⅰ:2)。頭部圓球形,長徑2.525 μm±0.197 μm,短徑2.181 μm±0.148 μm;中片漏斗形,較短,長0.420 μm±0.033 μm;尾部為一細長的鞭毛。
2.2 寬體沙鰍精子的超微結構
頭部 透射電鏡觀察發現,寬體沙鰍精子頭部無頂體,外被質膜,質膜表面凹凸不平,呈現微小波浪狀,細胞質甚少(圖版Ⅰ:3,4)。整個精子頭部幾乎被細胞核占據,核內染色質致密,偶見零星分布的核空泡,核空泡大小0.37 μm,其內可見有電子致密狀顆粒分布,核膜緊貼質膜(圖版Ⅰ:3)。核后有一凹陷的植入窩且植入窩偏向一側,植入窩凹陷深度約為細胞核長徑的1/6(圖版Ⅰ:4)。
中片 寬體沙鰍精子中片較短,由中心粒復合體、袖套及少量線粒體組成。中心粒復合體由近端中心粒和基體組成(圖版Ⅰ:4)。近端中心粒與基體呈“L”形排列,基體起始端橫斷面可見“9+2”型雙聯微管結構且基體兩側底部分別有少量線粒體分布(圖版Ⅰ:4)。袖套緊接細胞核的后端,不對稱分布于鞭毛兩側,中央空隙為袖套腔(圖版Ⅰ:4)。袖套一側狹長,內含線粒體1~2個(圖版Ⅰ:3);另一側肥厚,內含數個線粒體和多個囊泡(圖版Ⅰ:3,4)。線粒體橢圓形,其內嵴清晰可見(圖版Ⅰ:3)。
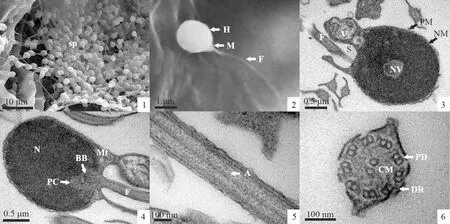
圖版Ⅰ 寬體沙鰍精子超微結構
Plate Ⅰ Ultrastructural of the sperm ofSinibotiareevesae
1. 精子(sp)充滿整個小葉腔; 2. 成熟精子, 示頭部(H), 中片(M)和鞭毛(F); 3. 精子頭部縱切, 示核膜(NM), 核空泡(NV), 精子細胞質膜(PM), 袖套腔(S), 囊泡(V)和鞭毛(F); 4. 精子頭部縱切, 示基體(BB), 線粒體(Mt), 近端中心粒(PC)和細胞核(N); 5. 鞭毛縱切,示軸絲(A); 6. 鞭毛橫切,示中央微管(CM),動力蛋白臂(DA)和外周二聯管(PD)。
1. Sperm (sp) in the lobules of the rip testis ofS.reevesae; 2. Mature sperm, showing head (H), mid-piece (M) and flagellum (F); 3. Logitudinal section of a mature sperm, showing nuclear membrance (NM), nuclear vacuole (NV), plasma membrance of the sperm (PM), central space of sleeve (S), vesicle (V) and flagellum (F); 4. Logitudinal section of a mature sperm, showing basal body (BB), mitochondrion (Mt), nucleus (N) and proximal centriole (PC); 5. Logitudinal section of a flagellum, showing axoneme (A); 6. Transverse section of a flagellum, showing central microtube (CM), dynein arm (DA) and peripheral doublet microtube (PD).
尾部 寬體沙鰍精子的尾部起始于袖套腔并由基體長出的軸絲外延形成,其主要結構為軸絲(圖版Ⅰ:5)。軸絲為典型的“9+2”型雙聯微管結構,微管膜結構及動力蛋白臂清晰可見(圖版 Ⅰ:6)。尾部外表面質膜向外突出形成側鰭,側鰭呈兩側對稱或等比例分為3支,尾部后段側鰭較前段發達(圖版 Ⅰ:3,6)。
2.3 NaCl對寬體沙鰍精子活力的影響
在Na+濃度0~100 mmol·L-1范圍內,精子均可存活,精子活力在75 mmol·L-1時達到最高,此時精子的有效運動時間和壽命分別為(37.45±4.43) s和(98.93±8.78) s。對照組中精子活力最低。單因素方差分析,Duncan多重檢驗顯示:精子有效運動時間在75 mmol·L-1與50 mmol·L-1之間差異有統計學意義(P<0.05),在75 mmol·L-1與其余各組之間差異有高度統計學意義(P<0.01);精子壽命在75 mmol·L-1與其他5種不同濃度的NaCl溶液之間差異有高度統計學意義(P<0.01)(圖1)。
2.4 KCl對寬體沙鰍精子活力的影響
精子在K+濃度0~1.0 mmol·L-1范圍內均具活力,在0.5 mmol·L-1時達到最高,此時精子的有效運動時間和壽命分別為(26.05±1.86) s和(52.78±2.96) s。有效運動時間和壽命分別在對照組和K+濃度1.0 mmol·L-1時最短。單因素方差分析,Duncan多重檢驗顯示:精子有效運動時間和壽命在0.5 mmol·L-1與在其他6種不同濃度的KCl溶液之間差異有高度統計學意義(P<0.01)(圖2)。
2.5 CaCl2對精子活力的影響
精子在Ca2+濃度為0~20 mmol·L-1范圍內均具活力,在5 mmol·L-1時有效運動時間達到最高,為(19.61±0.99) s;在10 mmol·L-1時壽命最高,為(61.30±7.14) s。精子活力的最低有效時間和最低壽命分別在20 mmol·L-1和0 mmol·L-1時。單因素方差分析,Duncan多重檢驗顯示:精子有效運動時間和壽命在5.0 mmol·L-1與其他6組不同濃度的CaCl2溶液之間差異有高度統計學意義(P<0.01)(圖3)。
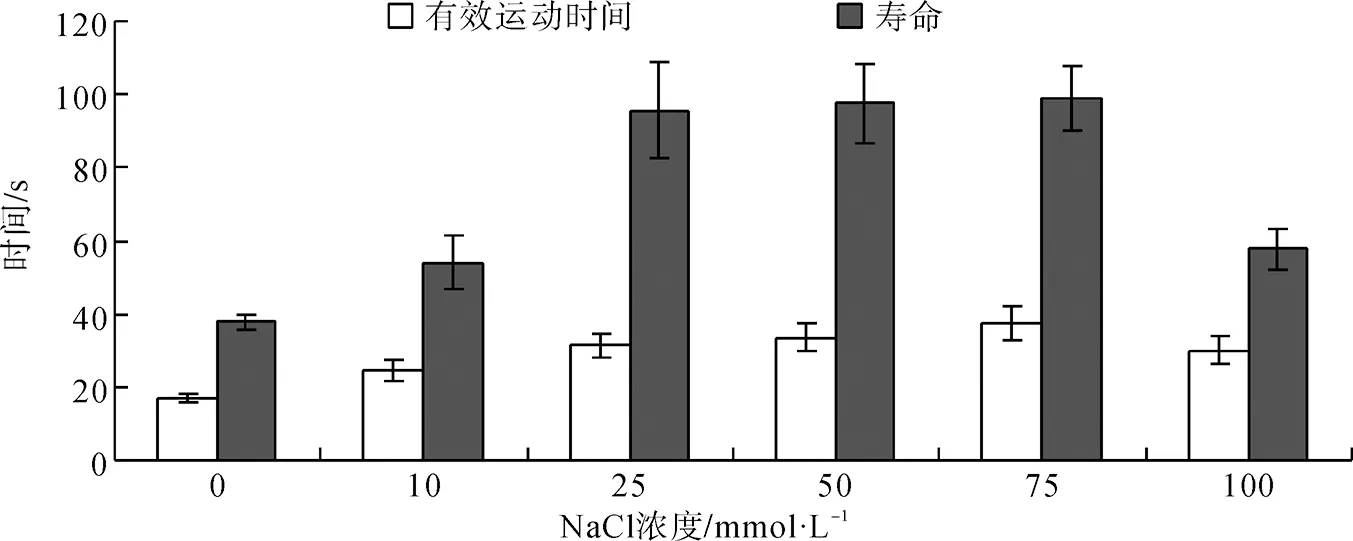
圖1 不同濃度NaCl對寬體沙鰍精子活力的影響
Fig. 1 The effect of diverse concentrations of NaCl onSinibotiareevesaesperm
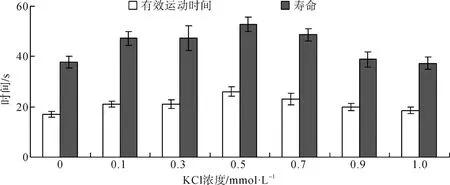
圖2 不同濃度KCl對寬體沙鰍精子活力的影響
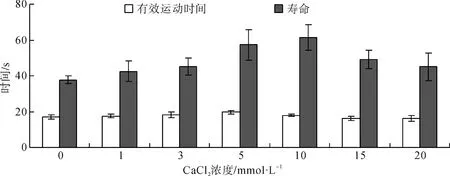
圖3 不同濃度CaCl2對寬體沙鰍精子活力的影響
3 討論
3.1 寬體沙鰍精子的超微結構
魚類精子的形態結構因物種的不同略有差異,其頭部形態及內部構造顯示出了種屬的差異及受精方式的相關性(劉雪珠,楊萬喜,2002)。精子按其頭部的形狀大致分為3類:螺旋形、柱塞形和圓形(劉雪珠,楊萬喜,2002)。寬體沙鰍精子頭部圓球形,為真骨魚類所特有(謝從新,2012)。頭部長徑(2.525±0.197) μm,短徑(2.181±0.148) μm,較泥鰍Misgurnusanguillicaudatus(長徑2.1 μm,短徑1.6 μm)(高令秋等,1995)、大鱗副泥鰍Paramisgurnusdabryanus(長度1.79 μm±0.28 μm)(李飛等,2011)和長薄鰍Leptobotiaelongata(直徑0.9~1.1 μm)(王志堅等,2009)精子頭部長。已有研究表明,絕大多數硬骨魚類精子頭部直徑與其卵膜表面的受精孔大小有關,這是魚類保證單精受精的重要因素(王永明,2011)。寬體沙鰍精子頭部前端無頂體,與長薄鰍和大多數鯉科魚類相同,為非頂體型(劉筠,1993)。頭部細胞核中偶見核空泡分布。透射電鏡觀察發現核空泡無生物膜包裹,為一種非泡狀結構,且空泡內有電子致密狀顆粒分布。該現象與黃顙魚Pelteobagrusfulvidraco(尤永隆,林丹軍,1996a)中的觀察結果一致。大多數硬骨魚類精子頭部細胞核的后端均存在植入窩,如黃顙魚精子的植入窩呈井狀(尤永隆,林丹軍,1996a),鯉Cyprinuscarpio精子的植入窩周圍有多余的核膜(尤永隆,林丹軍,1996b)。寬體沙鰍精子的植入窩凹陷,凹陷深度為細胞核長徑的1/6,不如長吻鮠精子植入窩發達(凹入深度約為長徑的5/6)(張耀光等,1993)。寬體沙鰍質膜與核膜緊貼,與鯉形目鰍科的長薄鰍(王志堅等,2009)和鯉科的鯉(尤永隆,林丹軍,1996b)結構相同,與鱸形目鮨科的斜帶石斑魚Epinepheluscoioides(趙會宏等,2003)質膜與核膜之間存在細胞質和少量囊泡不同。這種細胞質的多少及囊泡的存在有何生理意義尚待進一步研究。
硬骨魚類精子中片的有無尚存爭議,尤永隆和林丹軍(1997)認為硬骨魚類精子頭部與中片連接緊密,中性粒復合體與細胞核相并列,不應將之排斥在頭部之外。結合寬體沙鰍的掃描電鏡結果,寬體沙鰍精子中片是相對獨立的,其由中心粒復合體和袖套組成。中心粒復合體包含近端中心粒與基體,兩者呈“L”形排列。這與鯉(尤永隆,林丹軍,1996b)的研究結果相同,與斜帶石斑魚的“〉”形(趙會宏等,2003)較為類似,與硬骨魚類精子常見的“T”形(Billard,1986)不同。袖套大多存在于硬骨魚類精子中,為精子儲能倉庫,其形態和結構因硬骨魚類種屬關系略有差異(劉雪珠,楊萬喜,2002):西伯利亞鱘Acipenserbaerii精子未見袖套結構(章龍珍等,2003);尼羅羅非魚Tilapianilotica精子的袖套分為上段和下段兩部分,上段較厚,含有較多線粒體和囊泡,下段較薄,僅含有多余的核膜(尤永隆,林丹軍,1998);哲羅魚Huchotaimen精子的袖套兩側不對稱,線粒體不規則排列且存在部分線粒體融合現象(尹洪濱等,2008);鯉精子的袖套包括肥厚一側和狹窄一側,肥厚一側含較多的線粒體和囊泡,狹窄一側線粒體則較少(尤永隆,林丹軍,1996b)。寬體沙鰍的袖套結構與鯉相似。
魚類精子尾部的主要結構為軸絲,Jamieson等(2009)依據軸絲的位置,將精子分為Ⅰ型(鞭毛軸絲與細胞核底部垂直)和Ⅱ型(鞭毛軸絲與細胞核橫向平行)2種。寬體沙鰍精子屬于Ⅰ型,與鯉形目鰍科的長薄鰍(王志堅等,2009),鯉科的鯉(尤永隆,林丹軍,1996b)、銅魚Coreiusheterokon(鄭曙明,1997)、稀有鮈鯽Gobiocyprisrarus(王永明,2011),鲇形目鲿科的黃顙魚(尤永隆,林丹軍,1996a),鱸形目鮨科的斜帶石斑魚(趙會宏等,2003)相同;而與鱸形目石首魚科的黃姑魚Nibeaalbiflora和大黃魚Pseudosciaenacrocea(胡謀等,2014)不同。寬體沙鰍精子尾部軸絲為典型的“9+2”型雙聯微管結構,與大多數硬骨魚類相同(尤永隆,林丹軍,1996b;趙會宏等,2003;王永明,2011),與同屬于鰍科的長薄鰍“9+3”型(王志堅等,2009)不同。側鰭的形態及存在與否,不同的魚類表現不一。斜帶石斑魚尾部無側鰭(趙會宏等,2003);哲羅魚精子一側側鰭較另一側發達(尹洪濱等,2008);長薄鰍兩側側鰭均發達(王志堅等,2009)。與上述魚類不同,寬體沙鰍精子尾部側鰭發達且呈兩側對稱或等比例分為3支。有關側鰭的有無能否影響精子游泳速率,進而影響受精率,不同學者觀點不同。Stoss(1983)認為側鰭對于改善精子的游泳速率,提高卵子受精率有重要意義。而Afzelius(1978)則認為側鰭與精子游泳速率的提高關系不大。寬體沙鰍精子側鰭的特殊形態可能與其鞭毛的擺動方式有關,具兩側側鰭的精子鞭毛可能呈上下或左右擺動,具3個分支側鰭的精子鞭毛可能呈螺旋形擺動,有關側鰭是否能提高其精子的游泳速率有待進一步研究。
3.2 不同濃度Na+、K+、Ca2+對寬體沙鰍精子活力的影響
Na+、K+和Ca2+既是魚類血漿、精漿的重要組分,也是構成滲透壓和影響精子活力的主要離子(蘇德學等,2004)。已有研究表明,適當濃度的Na+可通過誘發精子細胞膜去極化產生動作電位,間接地激活精子運動(徐革鋒等,2005);精漿中高濃度的K+能抑制虹鱒Oncorhynchusmykiss和馬蘇大麻哈魚Oncorhynchusmasou精子的活動(Mosrisawaetal.,1983);精子細胞內的Ca2+也是激活精子的必需因素(Hadi Alavi,2004)。本實驗測得,寬體沙鰍精子的最適Na+、K+、Ca2+濃度分別為75 mmol·L-1(0.44% NaCl)、0.5 mmol·L-1(0.0037% KCl)和5 mmol·L-1(0.055% CaCl2)。最適Na+濃度與泥鰍(0.50%)(柴毅等,2009)相當,較寬口光唇魚Acrossocheilusmonticolus(0.51%)(羅芬,何學福,1999)、稀有鮈鯽(0.55%)(王永明等,2011)低。最適K+、Ca2+濃度均較泥鰍(阮國良等,2004)低。因此,魚類精子對各種激活介質的最適濃度因種而異,可能與其生存環境和精漿組成相關。本實驗發現,Na+、K+、Ca2+均對寬體沙鰍精子的激活具有促進作用,但較高濃度的Na+、K+、Ca2+皆能抑制寬體沙鰍精子的活力。建議人工授精時采用適當濃度的激活介質,對于硬度較高的水體,應適當降低硬度。有關Na+、K+、Ca2+在寬體沙鰍精子激活過程中的作用機理還有待進一步的研究。
柴毅, 黃棟才, 李羅新. 2009. 幾種化學因子對泥鰍精子活力的影響[J]. 安徽農業科學, 37(36): 17981-17982.
丁瑞華. 1994. 四川魚類志[M]. 成都: 四川科學技術出版社: 98-100.
高令秋, 高書堂, 岳朝霞, 等. 1995. 泥鰍精子入卵程序的掃描電鏡觀察[J]. 武漢大學學報 (自然科學版), 41(6): 740-744.
胡謀, 苗亮, 李明云, 等. 2014. 黃姑魚與大黃魚精子超微結構的觀察與比較[J]. 生物學雜志, 31(2): 1-4.
黃燕, 岳興建, 王芳, 等. 2011. 沱江寬體沙鰍個體生殖力的研究[J]. 四川動物, 30(6): 916-920.
李飛, 萬全, 黃鮮明. 2011. 大鱗副泥鰍精子結構研究[J]. 生物學雜志, 28(4): 26-30.
劉筠. 1993. 中國養殖魚類繁殖生理學[M]. 北京: 北京農業出版社: 20-29, 32-41, 73-73.
劉雪珠, 楊萬喜. 2002. 硬骨魚類精子超微結構及其研究前景[J]. 東海海洋, 20(3): 32-37.
魯大椿, 傅朝君, 劉憲亭, 等. 1989. 我國主要淡水養殖魚類精液的生物學特性[J]. 淡水漁業, 2: 34-37.
羅芬, 何學福. 1999. 氯化鈉濃度對寬口光唇魚精子活力的影響[J]. 四川動物, 18(2): 70-72.
阮國良, 馮家斌, 楊代琴. 2004. 滲透壓、pH和溫度對泥鰍精子活力及受精率的影響[J]. 湖北農學院學報, 24(1): 22-25.
蘇德學, 嚴安生, 田永勝, 等. 2004. 鈉、鉀、鈣和葡萄糖對白斑狗魚精子活力的影響[J]. 動物學雜志, 39(1): 16-20.
王芳, 岳興建, 謝碧文, 等. 2011. 寬體沙鰍消化系統的結構[J]. 四川動物, 30(4): 569-572.
王永明. 2011. 稀有鮈鯽受精生物學研究[D]. 重慶: 西南大學: 13-14.
王永明, 史晉絨, 蒲德永, 等. 2011. 稀有鮈鯽精子主要生物學特性及活力的觀察[J]. 淡水漁業, 41(1): 68-72.
王永明, 謝碧文, 王芳, 等. 2014. 沱江寬體華鰍繁殖特性[J]. 動物學雜志, 49(5): 699-706.
王永明, 謝碧文, 鄒遠超, 等. 2015. 沱江寬體華鰍的年齡與生長[J]. 動物學雜志, 50(2): 221-230.
王志堅, 殷江霞, 張耀光. 2009. 長薄鰍的精巢發育和精子發生[J]. 淡水漁業, 39(1): 3-9.
謝從新. 2012. 魚類學[M]. 北京: 中國農業出版社: 141.
頡江, 覃川杰, 侯平, 等. 2013. 沱江寬體沙鰍和中華沙鰍親魚脂肪酸組成分析[J]. 江蘇農業科學, 41(5): 290-292.
徐革鋒, 賈鐘賀, 楊雙英, 等. 2005. 尖吻和鈍吻細鱗魚(Brachmystaxlenok)精子活力的觀察[J]. 水產學雜志, 18(2): 16-21.
尹洪濱, 尹家勝, 孫中武, 等. 2008. 哲羅魚精子的超微結構[J]. 水產學報, 32(1): 27-31.
尤永隆, 林丹軍. 1996a. 黃顙魚精子的超微結構[J]. 實驗生物學報, 29(3): 235-245.
尤永隆, 林丹軍. 1996b. 鯉魚精子超微結構的研究[J]. 動物學研究, 17(4): 377-383.
尤永隆, 林丹軍. 1997. 大黃魚精子的超微結構[J]. 動物學報, 43(2): 119-126.
尤永隆, 林丹軍. 1998. 尼羅羅非魚精子形成中核內囊泡的釋放[J]. 動物學報, 44(3): 257-263.
岳興建, 王芳, 謝碧文, 等. 2011. 沱江流域寬體沙鰍的胚胎發育[J]. 四川動物, 30(3): 390-393.
張耀光, 羅泉笙, 鐘明超. 1993. 長吻魚危精巢及精子結構的研究[J]. 水生生物學報, 17(3): 246-257.
章龍珍, 劉鵬, 莊平, 等. 2008. 超低溫冷凍對西伯利亞鱘精子形態結構損傷的觀察[J]. 水產學報, 32(4): 558-565.
趙會宏, 劉曉春, 林浩然, 等. 2003. 斜帶石斑魚精子超微結構及鹽度、溫度、pH對精子活力及壽命的影響[J]. 中國水產科學, 10(4): 287-290.
鄭曙明. 1997. 銅魚精子發生中的超微結構研究[J]. 水利漁業, 6: 22-24.
Afzelius BA. 1978. Fine structure of the garfish spermatozoon[J]. Journal of Ultrastructure Research, 64(3): 309-324.
Billard R. 1986. Spermatogenesis and spermatology of some teleost fish species[J]. Reproduction Nutrition Development, 26(4): 877-892.
Gagnon C. 1990. Controls of sperm motility: biological and clinial aspects[M]. Boca Raton: CRC Press: 137-151.
Hadi Alavi SM, Cosson J, Kacrami M,etal. 2004. Chemical composition and osmolality of semina fluid ofAcipernserpersicus; their physiological relationship with sperm motility[J]. Aquaculture Research, 35(13): 1238-1243.
Jamieson BGM. 2009. Reproductive biology and phylogeny of fishes (agnathans and bony fishes)[M]. Enfield, NH: Science Publishers, US: 768.
Mosrisawa M, Suzuki K, Shimizu H,eta1. 1983. Effects of osmolality and potassium on motility of spermatozoa from freshwater cyprinid fishs[J]. Journal of Experimental Biology, 107: 95-103.
Stoss J. 1983. Fish gamete preservation and spermatozoon physiology[M]. New York: Academic Press: 307-308.
Vladic T, Jarvi T. 1997. Sperm motility and fertilization time span in Atlantic salmon and brown trout-the effect of water temperature[J]. Journal of Fish Biology, 50: 1088-1093.
Ultrastructural Observation of the Sperm ofSinibotiareevesaeand Effect of Na+, K+and Ca2+on its Motility
WANG Yongming1, CHEN Yu1, HU Yu2, XIE Biwen1*, YUE Xingjian1, WANG Fang1, QI Zemin1, WANG Yu1
(1. College of Life Sciences, Neijiang Normal University, Conservation and Utilization of Fishes Resources in the Upper Reaches of the Yangtze River Key Laboratory of Sichuan Province, Neijiang, Sichuan Province 641112, China;2. Southwest University, Key Laboratory of Aquatic Organism Reproduction and Developement, Chongqing 400715, China)
In order to study the ultrastructure of the sperm ofSinibotiareevesaeand the effect of Na+, K+and Ca2+on its motility, JSM 6510LV scanning electron microscope, H-7500 transmission electron microscope and Motic-BA210 digital microscope were used, respectively. The results showed that the head ofS.reevesaesperm was round without acrosome. There was an implantation fossa in the end of the nucleus and about 1/6 of the length of nuclei. The mid-piece consisted of centriolar complex and sleeves. The centriolar complex was divided into proximal centriole and matrix and arranged in an “L” type. Sleeves were found on both sides of axon, and one side was long and narrow, whereas the other side was hypertrophy. The tail was a typical “9+2” type consisting of axoneme. In conclusion, the best activation medium ofS.reevesaesperm should be made by deionized water with NaCl 75 mmol·L-1, KCl 0.5 mmol·L-1and CaCl25 mmol·L-1. It suggested that the optimal activation medium should be selected while using artificial insemination.
Sinibotiareevesae; sperm; ultrastructure; sperm motility
10.11984/j.issn.1000-7083.20150213
2015-06-18 接受日期:2015-10-29
四川省教育廳重大培育項目(09ZZ012); 四川省省屬高校科研創新團隊項目(KYTD201009); 四川省科技支撐項目(2011NZ0075)
王永明(1985—), 男, 講師, 研究方向為魚類形態及發育生物學
*通信作者Corresponding author, 教授, E-mail:xiebw6873@163.com
Q959.4
A
1000-7083(2016)01-0038-06

