細菌對重金屬吸附和解毒機制的研究進展
王澤煌王蒙蔡昆爭,2蔡一霞,2黃飛,2,3
(1. 華南農業大學資源環境學院,廣州 510642;2. 農業部華南熱帶農業環境重點實驗室,廣州 510642;3. 廣東省普通高等學校農業生態與農村環境重點實驗室,廣州 510642)
細菌對重金屬吸附和解毒機制的研究進展
王澤煌1王蒙1蔡昆爭1,2蔡一霞1,2黃飛1,2,3
(1. 華南農業大學資源環境學院,廣州 510642;2. 農業部華南熱帶農業環境重點實驗室,廣州 510642;3. 廣東省普通高等學校農業生態與農村環境重點實驗室,廣州 510642)
隨著采礦、冶煉和電鍍等工業的不斷發展,重金屬對環境造成的污染也日益嚴重。近年來提出的微生物修復法,因其成本低和無二次污染等優點而引起國內外學者的廣泛關注。目前,用來去除環境中重金屬的微生物主要有真菌、藻類、放線菌及細菌等,其中細菌對重金屬的微生物吸附和解毒機制研究較為廣泛。將從細胞結構的角度,即細菌細胞外部、細胞表面和細胞內部等三方面概述重金屬脅迫下細菌的吸附和解毒機制研究進展,主要內容包括細胞外部的沉淀機制、細胞表面的吸附機制以及細胞內部的解毒機制,并提出未來可能的發展方向,旨為重金屬污染的微生物修復技術提供理論依據和實踐參考。
重金屬;細菌;吸附機制;解毒機制
近年來,重金屬污染事件頻發,如血鉛事件、鉻渣污染事件及鎘大米事件等[1],對社會造成了巨大的經濟損失,同時給人類的健康帶來了潛在的危害。傳統的物理化學修復方法去除環境中的重金屬污染物花費的費用相對較高,容易造成二次污染等問題[2]。與之比較,微生物修復方法在治理重金屬污染方面展現出其菌種的來源豐富、低成本、無二次污染等方面的優勢,具有較大的應用前景[3]。其
中,針對細菌的吸附和解毒機制研究較多,Huang等[4]研究表明細菌B.cereus RC-1對Cd2+的吸附由細胞表面吸附和內部積累共同作用下完成的,表面吸附是被動,快速且不消耗能量;內部積累則是主動緩慢,需要能量且依賴于細菌的代謝調控系統[5]。
細菌對重金屬的吸附解毒過程和機制是非常復雜的,往往是通過多種機制來共同對抗重金屬的毒害作用。本文從細胞結構的角度,將整個吸附和解毒機制分三類:(1)細胞外部沉淀機制,通過分泌胞外物質改變環境條件等使重金屬發生沉淀作用;(2)細胞表面吸附機制,通過各種作用將重金屬離子吸附固定在細胞表面,減少細胞內部的吸收。這個過程涉及到絡合、配位、離子交換、無機微沉淀、氧化還原及靜電吸附等多種吸附機制[6];(3)細胞內部解毒機制,該過程較為復雜,涉及到重金屬的運輸和解毒機制等[7]。Chakraborty等[8]研究發現,細菌Pseudomonas aeruginosa JP-11對Cd進行細胞表面吸附的同時,細胞內部的Cd抗性基因czcABC表達水平也顯著提高。
目前,用來研究重金屬微生物修復機制的主要有真菌、藻類、放線菌、細菌等。本文針對細菌對重金屬的吸附和解毒機制,從細胞外部、細胞表面和細胞內部等三方面概述其相關研究的進展,并探討進一步可能發展的方向。
1 細胞外部沉淀機制
細胞外部沉淀機制,本文指微生物通過分泌某些物質釋放到環境中,通過改變環境的條件等使重金屬離子發生沉淀作用,從而減少重金屬離子對微生物的毒害作用。它與細胞表面吸附機制不同之處是發生在外界環境中。例如,環境中的某些細菌,如Bacillus brevis和Pseudomonas sp.,在重金屬脅迫下,通過釋放多糖、脂類、蛋白質等胞外分泌物來沉淀重金屬離子[9]。如硫酸鹽還原菌CL4通過釋放甘油使鋅發生沉淀,Acidithiobacillus ferrooxidans分泌硫化氫來沉淀銅[10]。有研究指出,胞外多糖被細菌分泌到溶液中后,可以與重金屬離子發生絡合作用[11]。如Pseudomonas fluorescens BM07分泌的生物高分子可以通過羥基、羧基等官能團使Hg、Cd、Zn等重金屬離子發生沉淀[12]。此外,一些細菌則是通過釋放胞外分泌物來提高環境的pH,從而促進重金屬離子形成氫氧化物沉淀[13]。如Streptococcus sp.通過分泌脂肪分解酵素來提高溶液pH,使重金屬離子發生絮凝沉淀,從而大大降低重金屬離子對它的毒害[14]。由此可見,細胞外部吸附機制是細菌去除環境中重金屬離子的常見機制之一。
2 細胞表面吸附機制
針對細菌對重金屬的吸附機制,大多數研究集中在細胞表面。重金屬離子通過與細菌表面某些物質發生作用,尤其是與細胞壁組分和胞外聚合物,最終被固定在細胞表面。該過程涉及到的機制主要包括離子交換、表面絡合、氧化還原、無機微沉淀和靜電作用等。
2.1 離子交換機制
離子交換機制指微生物細胞表面含有的一些離子與環境中重金屬離子發生交換作用,從而吸附固定重金屬離子[15]。李輝等[16]、劉瑞霞等[17]研究發現Bacillus cereus、Micrococcus luteus對Cd(II)和Cu(II)吸附過程中,伴隨著K+、Ca2+、Na+和Mg2+等陽離子的大量釋放,表明離子交換作用促進了這兩種細菌對Cd和Cu的吸附固定;Ye等[15]發現細菌Stenotrophomonas maltophilia對Cu(II)進行生物積累的同時,伴隨著K+、Mg2+和Ca2+的釋放。嗜麥芽窄食單胞菌在吸附Cu(II)和Cd(II)的同時,伴隨著Cl-、PO43-、SO42-、Na+、NH4+、K+和Ca2+等離子釋放[18]。以上這些研究表明,離子交換機制是細菌表面吸附主要機制之一(圖1),其中有些離子,如 K+、Na+、Mg2+、Ca2+、Cl-、PO3-、SO2-和 NH+444等在細菌吸附重金屬的過程中起到了一定的作用。
2.2 表面絡合機制
重金屬離子與微生物表面蛋白質、多糖、脂類等物質上的化學基團(如羧基、羥基、磷酰基、酰胺基、硫酸脂基、氨基和巰基等)相互作用,形成金屬絡合物,被吸附固定在細胞表面[19]。劉紅娟等[20]探討蠟狀芽孢桿菌RC積累Cd(II)前后細胞壁表面化學基團的變化情況發現,RC的細胞壁上參與絡合作用的化學官能團主要有-OH、-NH、-CO和-COOH。Bahari等[21]用蠟狀芽孢桿菌SZ2對As(III)進行吸附固定的實驗,則發現只有-OH和-NH
參與了As(III)的生物吸附過程。此外,不同的細菌吸附不同的重金屬參與絡合的官能團不盡相同。楊洲平等[22]在粗毛栓菌吸附Pb(II)過程中,發現起吸附作用的官能團主要是-OH、-COOH、-SH和-PO4。Joo等[23]發現綠膿假單胞菌ASU 6a參與Zn(II)的生物吸附的官能團主要是-OH、-NH、-CO和-COOH。而Bai等[24]則發現枯草芽孢桿菌DBM細胞表面的-OH、-NH、-CO、-COOH和-PO4與Pb(II)發生絡合作用。這些研究表明,-OH、-NH、-CO、-COOH、-SH和-PO4等細胞表面官能團在細菌吸附重金屬的過程中起到了重要作用。
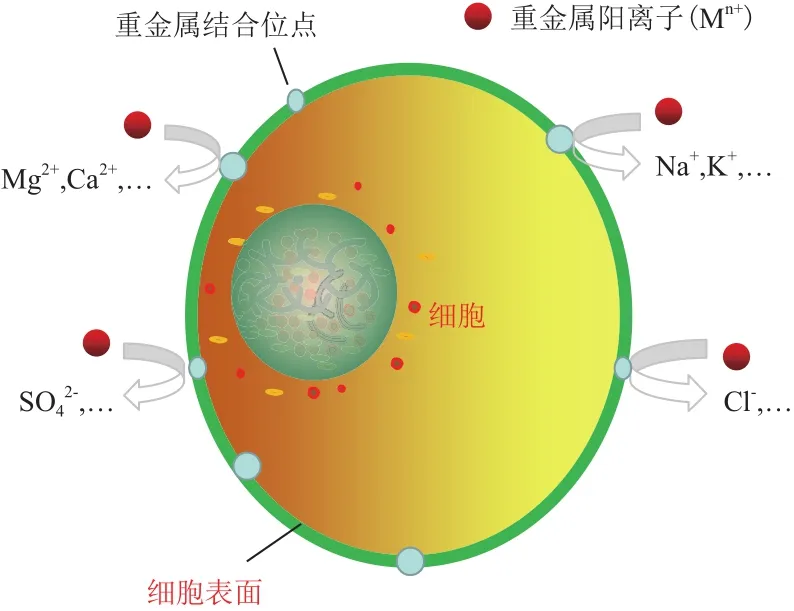
圖1 離子交換機制
2.3 氧化還原機制
氧化還原機制主要發生在一些多價態的重金屬離子上。重金屬脅迫下細菌對外界做出反應,如分泌一些氧化還原酶等,使重金屬離子從高毒轉化為低毒的價態并固定在細胞表面,從而保護自身,維持細胞正常的生理代謝[25]。如惡臭芽孢桿菌通過分泌Cr-還原酶到細胞表面,將細胞表面高毒性的Cr(VI)還原為低毒性的Cr(III)[26]。有研究指出錳還原細菌可以將Mn4+還原成為Mn3+等,并固定在細胞表面,從而降低重金屬對菌體的毒害。此外,Valenzuela等[25]和Fan等[27]從高砷污染河流的沉積物中分離出砷氧化菌,并發現這些菌株能將細胞表面的As(III)氧化為更加穩定的As(V)。以上研究表明,在面對Cr、Mn和As等多價態重金屬的脅迫下,細菌往往會通過氧化還原機制來緩解重金屬的毒害作用。
2.4 無機微沉淀機制
無機微沉淀機制主要指微生物使重金屬離子形成無機晶體沉淀,并積累在其細胞表面上,從而吸附固定重金屬[28]。劉瑞霞等[14]研究Micrococcus luteus吸附Cu(II)過程發現,當溶液pH值較高時,Cu2+會形成氫氧化物微沉淀沉積在細胞表面。Li等[28]發現Bacillus cereus細胞壁上的生物聚合物和銀離子發生復雜的化學作用,使重金屬以晶體微沉淀的方式存在于細胞表面。進一步來講,Bai等[24]通過X射線衍射分析確定了Bacillus subtilis DBM對Pb(II)的生物吸附過程中細胞表面形成了Pb5(PO4)3OH、Pb5(PO4)3Cl和Pb10(PO4)6(OH)2等晶體微沉淀。由此可見,無機微沉淀機制在細菌細胞表面吸附固定重金屬的過程中扮演著重要角色。
值得注意的是,靜電作用也是細胞表面吸附機制之一。李輝等[13]研究蠟狀芽孢桿菌SY對Cd的吸附過程中發現,靜電吸附對Cd的固定起到了一定的作用。同樣,Shan等[29]發現Bacillus subtilis通過靜電作用吸附Cu、La等重金屬。
3 細胞內部解毒機制
細菌表面在吸附固定重金屬的同時,有一部分重金屬通過離子轉運通道進入到細胞內,為了使自身不受重金屬離子的毒害,細菌需要能量和新陳代謝系統的調控。該過程主要分為兩部分,第一部分是重金屬離子的轉運,即排至細胞外;第二部分是內部固定轉化作用。目前認為的內部解毒機制主要有:促進重金屬離子外流即外排作用;阻止重金屬離子內流;重金屬的轉化作用;細胞內部的隔離作用(區域化作用)等[30-32]。這些機制的主要作用方式有外排泵、還原成低毒價態、結合金屬整合肽、金屬硫蛋白等沉積在內部特定位置等。另外,較之細胞外部和表面吸附機制,胞內機制尤為復雜,研究還不夠深入,需要進一步探討。
3.1 細菌對重金屬的轉運
細菌需要通過減少運輸、阻滲作用或外排機制來抵抗重金屬的毒害,最有效的方法之一就是將重金屬離子外排至細胞外。細菌中存在許多與金屬離子運輸有關的蛋白家族,它們大多位于細胞膜上,起著離子泵的作用[33]。如銅綠假單胞菌(Pseudo-
monas aerugionsa)就是通過外排泵系統RND超家族(MexAB-OprM、MexCD-OprJ和MexEF-OprN等)將Ni、Mn等重金屬離子轉運至細胞表面[34,35]。另外,某些細菌的鋅抗性基因編碼蛋白-ABC(ATP binding cassette)蛋白家族通過依賴能量的方式來實現對鋅的外排[30]。同樣,Antje等[36]研究發現有Zn(Ⅱ)存在時,菌體其中一個編碼外排泵的基因CzcCBA的表達水平顯著升高,并主動做出生理代謝反應,促使Zn的外排。而且,有的外排系統是ATP酶,如Mycobacterium的Cu抗性基因Ctp A編碼的P型ATP酶起到Cu2+通道的作用,將過高濃度的Cu2+排出細胞外[37]。此外,還有Proteus mirabilis strain V7編碼谷胱甘肽轉移酶的基因gstPm-4在Cd2+、Cu2+、Hg2+和 Pb2+存在的情況下表達水平上升[38],惡臭假單胞菌Zn(Ⅱ)抗性基因CD2 P型ATP酶基因CadA1在高濃度Zn2+下表達水平也上升,均參與重金屬離子的轉運[39]。
3.2 細菌對重金屬的轉化作用
在細胞內部,細菌可以通過氧化還原、甲基化等作用使某些多價態重金屬離子從高毒性轉化為低毒產物,從而達到解毒效果[40]。有研究表明,Staphylococcus和Bacillus cereus Pj1有Hg抗性基因merA,該基因編碼的汞抗性蛋白merA能將有毒性的Hg2+還原為Hg,再利用Hg本身的揮發性從細胞內部釋放到體外[31,41]。Enterobacter sp. DU17有Cr(VI)還原酶基因,在Cr(VI)的脅迫下能編碼產生Cr抗性蛋白,一種Cr(VI)還原酶,將高毒性的Cr(VI)還原為低毒性的Cr(III)[42]。此外,某些自養細菌,如硫鐵桿菌類,則通過氧化作用使Fe2+、As5+和Mo4+等重金屬離子活性降低[43]。有研究發現,Azospirillum sp.的砷抗性基因aioA能編碼砷氧化酶,將高毒性的As(III)氧化成低毒性的As(V)[44];銻氧化菌Comamonas sp. S44可以將細胞內高毒Sb(III)氧化成低毒Sb(V)[45]。另外,也有研究發現假單胞菌屬能使許多重金屬離子發生甲基化反應,從而將金屬離子毒性大大降低,如硒的甲基化產物毒性大大減弱[26]。以上研究表明,細菌能對一些重金屬離子,如Hg、As、Sb和Mo等,進行內部轉化作用,從而達到自身解毒作用。
3.3 細菌對重金屬的區域化作用
除了通過對重金屬的轉運及轉化作用,細菌還能通過代謝某些蛋白,如金屬硫蛋白和金屬整合肽等,直接與重金屬離子作用,并封存在細胞內部,即區域化作用,從而達到解毒作用[46]。有研究發現,細菌的金屬硫蛋白(metallothionein)富含半膚氨酸,能夠絡合銅、鋅等重金屬,并通過區域化作用將這些重金屬螯合物封存在細胞內的不同部位,從而使自身免受重金屬的毒害[47]。還有研究表明腸道菌S. enferica通過金屬整合肽(CopA、CueO和CueP)將胞質內過量的Cu2+封存起來[32]。E.coli受高濃度Cu2+脅迫時,細胞基質中過量的Cu2+主要是與大分子蛋白形成復合物CusCBA,被固定在細胞內[48]。可見,區域化作用是細菌內部重要的解毒機制之一。
4 展望
細菌作為一種生命體,因其細胞結構的復雜性,使得在研究它的重金屬生物吸附和解毒機制時需要從不同層次和角度來探討。雖然本文將細菌的吸附機制分為三類來概述,即細胞外部、細胞表面、細胞內部(圖2)。但是必須指出的是,這三類機制并非獨立的,而是相互聯系且共同作用于細胞生命體的。因此,開展相關研究時,需全面考慮,才能系統地揭示其機制。
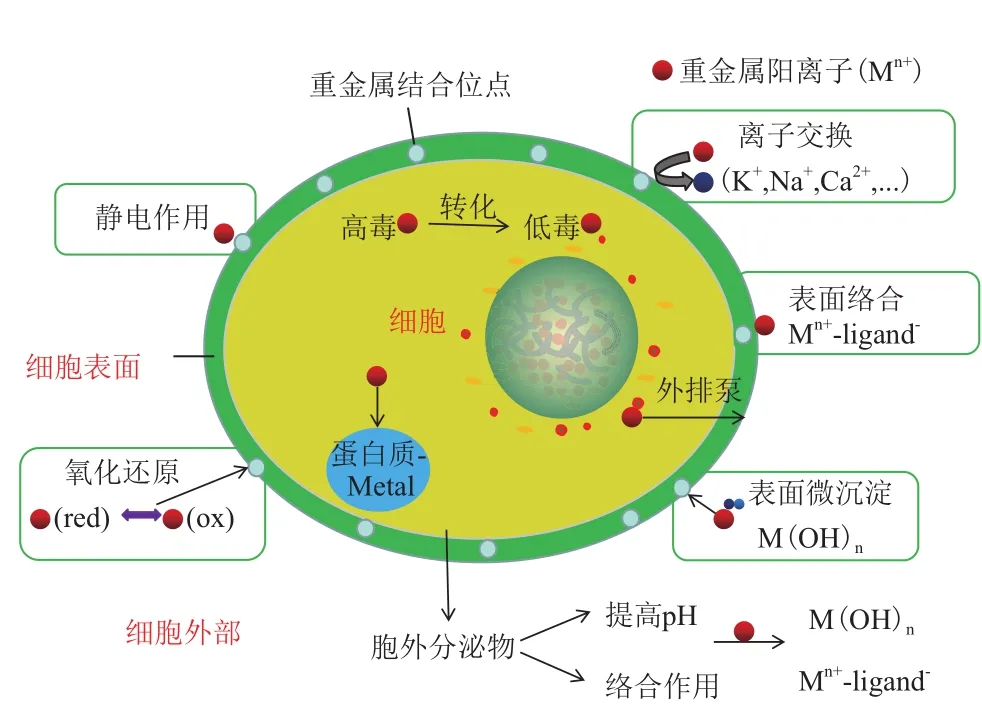
圖2 細菌對重金屬的吸附和解毒機制
人們對細胞外部沉淀和表面吸附機制研究較為廣泛,而對重金屬脅迫下細菌胞內生理生化反應及新陳代謝調控機制的研究尚不多見,了解還不夠深
入。另一方面,細菌種類繁多,不同菌種的內部解毒機制也不盡相同,還未形成一套完整的抗性機制體系。因此,需要進一步從分子的角度探討重金屬脅迫下細菌的生存策略,弄清楚細菌解毒過程中關鍵性的基因和蛋白質,以及它們的功能作用。
此外,微生物吸附和解毒機制的研究基本上都是基于單一重金屬離子存在下的情況,現實中往往是多種重金屬共存的環境,意味著需要進一步探討在多種重金屬離子共存的情況下,細菌對重金屬的吸附和解毒機制,以便更有效地指導實際環境中重金屬污染的修復應用。
[1] 李兆輝, 王光明, 徐云明, 等. 鎘、汞、鉛污染及其微生物修復研究進展[J]. 中國畜牧獸醫, 2010, 37(9):39-43.
[2] Suranjana AR, Manas KR. Bioremediation of heavy metal toxicity with special reference to chromium[J]. Al Ameen Journal of Medical Sciences, 2009, 2(2):57-63.
[3] 趙慶齡, 張乃弟, 路文如. 土壤重金屬污染研究回顧與展望Ⅱ——基于三大學科的研究熱點與前沿分析[J]. 環境科學與技術, 2010, 33(7):102-106.
[4] Huang F, Dang Z, Guo CL, et al. Biosorption of Cd(II)by live and dead cells of Bacillus cereus RC-1 isolated from cadmiumcontaminated soil[J]. Colloids Surf B Biointerface, 2013, 107:11-18.
[5] 王建龍, 陳燦. 生物吸附法去除重金屬離子的研究進展[J].環境科學學報, 2010, 30(4):673-701.
[6] Sud D, Mahajan G, Kaur MP. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solutions-a review[J]. Bioresour Technol, 2008, 99:6017-6027.
[7] Pavel K, Martina M, Tomas M. Microbial biosorption of metals[M]. Berlin:Springer Science, 2011:320.
[8] Chakraborty J, Das S. Characterization and cadmium-resistant gene expression of biofilm-forming marine bacterium Pseudomonas aeruginosa JP-11[J]. Environ Sci Pollut Res Int, 2014, 21(24):14188-14201.
[9] Singh VK, Kumar A. Production and purification of an extracellular cellulase from Bacillus brevis VS-1[J]. Biochem Mol Biol Int, 1998, 45(3):443-452.
[10] Donati ER, Viera MR, Tavani EL, et al. Sulfidogenesis at low pH by acidophilic bacteria and its potential for the selective recovery of transition metals from mine waters[J]. Advanced Materials Research, 2009, 71-73:693-696.
[11] Fayaz AM, Girilal M, Rahman M, et al. Biosynthesis of silver and gold nanoparticles using thermophilic bacterium Geobacillus stearothermophilus[J]. Process Biocheistry, 2011, 46(10):1958-1962.
[12] Kambiz AN, Hossein SZ, Sung CY, et al. The production of a coldinduced extracellular biopolymer by Pseudomonas fluorescens BM07 under various growth conditions and its role in heavy metals absorption[J]. Process Biochemistry, 2007, 42:847-855.
[13] Remacle J, Mugaruza I, Fransolet M. Cadmium removal by a strain of Alcaligenes denitrifieam isolated from a metal-polluted pond[J]. Water Resourses, 1992, 26(7):923-926.
[14] Tripathi MK, Roy U, Jinwal UK, et al. Cloning, sequencing and structural features of a novel Streptococcus lipase[J]. Enzyme and Microbial Technology, 2004, 34:437-445.
[15] Ye JS, Yin H, Peng H, et al. Copper biosorption and ions release by Stenotrophomonas maltophilia in the presence of benzo[a]pyrene[J]. Chemical Engineering Journal, 2013, 219:1-9.
[16] 李輝, 石璐, 張國芳, 等. 蠟狀芽孢桿菌SY對鎘的吸附機制[J]. 科技導報, 2010, 28(7):59-62.
[17] 劉瑞霞, 潘建華, 湯鴻霄, 等. Cu(Ⅱ)離子在Micrococcus luteus細菌上的吸附機理[J]. 環境化學, 2002, 1:50-55.
[18] 白潔瓊, 尹華, 葉錦紹, 等. 嗜麥芽窄食單胞菌對銅鎘的吸附特性與離子交換[J]. 環境科學, 2013(1):217-225.
[19] Pan XH, Chen Z, Chen YJ, et al. The analysis of the immobilization mechanism of Ni(II)on Bacillus cereus[J]. Journal of Nanoscience and Nanotechnology, 2011, 11(4):3597-3603.
[20] 劉紅娟, 張慧, 黨志, 等. 一株耐鎘細菌的分離及其富集Cd的機理[J]. 環境工程學報, 2009, 3(2):367-371.
[21] Bahari ZM, Altowayti W, Ibrahim Z, et al. Biosorption of As(III)by Non-living biomass of an arsenic-hypertolerant Bacillus cereus strain SZ2 isolated from a gold mining environment:equilibrium and kinetic study[J]. Appl Biochemi Biotechnol, 2013, 8:2247.
[22] 楊洲平, 陳平, 王振宇, 等. 粗毛栓菌和蠟狀芽孢桿菌及其共固定菌對Pb(Ⅱ)的吸附[J]. 應用生態學報, 2012, 23(8):2212-2218.
[23] Joo J, Hassan SHA, Oh S. Comparative study of biosorption of Zn2+
by Pseudomonas aeruginosa and Bacillus cereus[J]. International Biodeterioration and Biodegradation, 2010, 64(8):734-741.
[24] Bai J, Yang XH, Du RY, et al. Biosorption mechanisms involved in immobilization of soil Pb by Bacillus subtilis DBM in a multi-metalcontaminated soil[J]. J Eeviron Sci, 2014, 10:2056-2064.
[25] Valenzuela C, Campos V, Yanez J, et al. Isolation of arseniteoxidizing bacteria from arsenic-enriched sediments from Camarones River, Northern Chile[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(5):593-596.
[26] 陳亞剛, 陳雪梅, 張玉剛, 等. 微生物抗重金屬的生理機制[J]. 生物技術通報, 2009(10):60-65.
[27] Fan H, Su C, Wang Y, et al. Sedimentary arsenite-oxidizing and arsenate-reducing bacteria associated with high arsenic groundwater from Shanyin, Northwestern China[J]. Journal of Applied Microbiology, 2005, 105(2):529-539.
[28] Li L, Hu Q, Zeng JH, et al. Resistance and biosorption mechanism of silver ions by Bacillus cereus biomass[J]. Journal of Environmental Sciences, 2011, 23(1):108-111.
[29] Shan Q, Fang M, Huang X, et al . Study on the adsorption of bacteria in ceramsite and their synergetic effect on adsorption of heavy metals[J]. Water Sci Technol, 2014, 69(2):407-413.
[30] 劉義, 何鋼, 陳介南, 等. 細菌的鋅抗性基因及其在生物修復中的應用[J]. 生物技術通報, 2008, 2:35-38.
[31] Baldi F, Gallo M, et al. Seasonal mercury transformation and surficial sediment detoxification by bacteria of Marano and Grado lagoons[J]. Estuari Coast Shelf Sci, 2012, 113:105-115.
[32] Osman D, Waldron KJ, Denton H, et al. Copper homeostasis in Salmonella is atypical and copper-CueP is a major periplasmic metal complex[J]. J Biol Chem, 2010, 33:25259-25268.
[33] Wang XY, Chen MLi, et al. Genome sequence analysis of the naphthenic acid degrading and metal resistant bacterium Cupriavidus gilardii CR3[J]. PLoS One, 2015, 8:e0132881.
[34] 李樊, 劉義, 孫偉峰, 等, 銅綠假單胞菌czcCBA基因與生物修復[J]. 生物技術通報, 2010(11):44-47.
[35] Boutoille D, Jacqueline C, Le Mabecque V, et al. In vivo impact of the MexAB-OprM efflux system on beta-lactam efficacy in an experimental model of Pseudomonas aeruginosa infection[J]. Int J Antimicrob Agents, 2009, 33(5):417-420.
[36] Stahl A, Pletze D, Mehmood A, et al. Marinobacter adhaerens HP15 harbors two CzcCBA efflux pumps involved in zinc detoxification[J]. Antonie Van Leeuwenhoek, 2015, 108:649-658.
[37] Andres LT, Lorena NA, et al. CtpA, a putative Mycobacterium tuberculosis P-type ATPase, is stimulated by copper(I)in the mycobacterial plasma membrane[J]. Biometals, 2015, 28:713-724.
[38] Zhang WW, Yin K, Li BW, et al. A glutathione S-transferase from Proteus mirabilis involved in heavy metal resistance and its potential application in removal of Hg2+[J]. Journal of Hazardous Materials, 2013, 261:646-652.
[39] 王偉. 惡臭假單胞菌CD2 P型ATP酶基因cadA1抗Zn2+功能的確定[D]. 武漢:華中農業大學, 2008.
[40] Giovanella P, Costa AP, Schffer N, et al. Detoxification of mercury by bacteria using crude glycerol from biodiesel as a carbon source[J]. Water Air Soil Pollut, 2015, 226:224.
[41] Santos-Gandelman JF, Cruz K, Crane S, et al. Potential application in mercury bioremediation of a marine sponge-Isolated Bacillus cereus strain Pj1[J]. Curr Microbiol, 2014, 69(3):374-380.
[42] Rahman Z, Singh VP. Cr(VI)reduction by Enterobacter sp. DU17 isolated from the tannery waste dump site and characterization of the bacterium and the Cr(VI)reductase[J]. International Biodeterioration and Biodegradation, 2014, 91:97-103.
[43] Yamamura S, Amachi S. Microbiology of inorganic arsenic:From metabolism to bioremediation[J]. Journal of Bioscience and Bioengineering, 2014, 118(1):1-9.
[44] Bahar MM, Megharaj M, Naidu R. Oxidation of arsenite to arsenate in growth medium and groundwater using a novel arsenite-oxidizing diazotrophic bacterium isolated from soil[J]. International Biodeterioration and Biodegradation, 2016, 106:178-182.
[45] Li J, Wang Q, Zhang SZ, et al. Phylogenetic and genome analyses of antimony-oxidizing bacteria isolated from antimony mined soil[J]. Int Biodeterior Biodegradation, 2013, 76:76-80.
[46] Sinha A, Kumar S, Khare SK. Biochemical basis of mercury remediation and bioaccumulation by Enterobacter sp. EMB21[J]. Appl Biochem Biotechnol, 2013, 169(1):256-267.
[47] Vasak M. Advances in metallothionein structure and functions. [J]. J Trace Elem Med Biol, 2005, 19(1):13-17.
[48] Ward SK, Abomoelak B, Hoye EA, et al. CtpV:a putative copper exporter required for full virulence of Mycobacterium tuberculosis[J]. Mol Microbiol, 2010, 77(5):1096-1110.
(責任編輯 狄艷紅)
Research Advances on Biosorption and Detoxification Mechanisms of Heavy Metals by Bacteria
WANG Ze-huang1WANG Meng1CAI Kun-zheng1,2CAI Yi-xia1,2HUANG Fei1,2,3
(1. College of Natural Resources and Environment,South China Agricultural University,Guangzhou 510642;2. Key Laboratory of Tropical Agro-Environment,Ministry of Agriculture,South China Agricultural University,Guangzhou 510642;3. Key Laboratory of Agro-ecology and Rural Environment of Guangdong Regular Higher Education Institutions,South China Agricultural University,Guangzhou 510642)
With the continuous development of mining,smelting and electroplating industries,heavy metals pollutions to the environment are increasingly serious. In recent years,microbial remediation arouses the extensive attentions because of its advantages of low cost and no secondary pollution. The main microorganisms used to remove heavy metals include fungi,algae,actinomyces and bacteria;among them,the biosorption and detoxification mechanisms of bacteria are more widely studied. This paper summaries the research advances on biosorption and detoxification mechanisms of heavy metals by bacteria from the aspects of bacterial cell’s structure,i.e.,the extracellular part,the cell surface and intracellular part,which mainly includes extracellular precipitation mechanisms,biosorption mechanisms on cell surface and intracellular detoxification mechanisms. Furthermore,the paper puts forward the feasible direction of future research,and provides theoretical basis and practical
for the microbial remediation of heavy metals pollution.
heavy metals;bacteria;biosorption mechanisms;detoxification mechanisms
10.13560/j.cnki.biotech.bull.1985.2016.12.003
2016-04-11
國家自然科學基金項目(41501338),廣東省自然科學基金項目(2014A030310320),廣東省教育廳科研項目(2013CXZDA007)
王澤煌,男,碩士研究生,研究方向:重金屬微生物修復;E-mail:terrywzh2005@qq.com
黃飛,男,博士,研究方向:環境工程;E-mail:feihuang@scau.edu.cn

