一株在有氧條件下轉(zhuǎn)化丙酮醇為1,2-丙二醇的大腸桿菌菌株的研究
鄧靜靜 胡洪波 張雪洪
(上海交通大學(xué)生命科學(xué)技術(shù)學(xué)院 微生物代謝國家重點(diǎn)實(shí)驗(yàn)室,上海 200240)
一株在有氧條件下轉(zhuǎn)化丙酮醇為1,2-丙二醇的大腸桿菌菌株的研究
鄧靜靜 胡洪波 張雪洪
(上海交通大學(xué)生命科學(xué)技術(shù)學(xué)院 微生物代謝國家重點(diǎn)實(shí)驗(yàn)室,上海 200240)
本實(shí)驗(yàn)室在前期構(gòu)建了一株能高效利用甘油合成丙酮醇的大腸桿菌工程菌株,如果能在有氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇,則可以大幅提高1,2-丙二醇的合成速率。以大腸桿菌BW25113ΔglpK為出發(fā)菌株,篩選得到一株可以在有氧條件下代謝甘油的突變菌株P(guān)DO1。結(jié)果表明,該菌株可以在有氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇,1,2-丙二醇的產(chǎn)量達(dá)到0.73 g/L,轉(zhuǎn)化率達(dá)到0.493 g/g丙酮醇。突變株P(guān)DO1的甘油脫氫酶酶活和胞內(nèi)的NADH百分比分別是對照株的75.9倍和1.64倍,由此推測,甘油脫氫酶酶活的提高以及NADH的相對提高,使得突變株可以在有氧條件下通過甘油脫氫酶途徑代謝甘油,并轉(zhuǎn)化丙酮醇為1,2-丙酮醇。
大腸桿菌;1,2-丙二醇;甘油;丙酮醇;靜息細(xì)胞發(fā)酵
隨著生物柴油產(chǎn)業(yè)規(guī)模的不斷擴(kuò)大,其大量累積的副產(chǎn)物甘油正日益成為生物柴油生產(chǎn)企業(yè)的負(fù)擔(dān)。因此,利用微生物將甘油轉(zhuǎn)化為高附加值的產(chǎn)物成為熱門研究課題,例如,把甘油轉(zhuǎn)化為1,3-丙二醇、氫氣、乙醇、莽草酸、1,2-丙二醇等[1-3]。其中,1,2-丙二醇因具有低毒性和良好的溶劑特性等優(yōu)點(diǎn)被廣泛應(yīng)用于不飽和聚酯、食品、醫(yī)藥、化妝品、洗滌用品、增塑劑、防凍劑等領(lǐng)域[4,5]。利用微生物方法生產(chǎn)1,2-丙二醇因具有反應(yīng)條件溫和、對環(huán)境污染少等優(yōu)點(diǎn),日益受到人們
的關(guān)注。
已有的文獻(xiàn)報(bào)道中,大多數(shù)是利用大腸桿菌在厭氧條件下把甘油轉(zhuǎn)化為1,2-丙二醇,其合成途徑如圖1所示[6]。基因gldA編碼的甘油脫氫酶不僅是甘油厭氧代謝途徑的初始酶,也可在厭氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇,但是當(dāng)大腸桿菌以甘油為碳源進(jìn)行厭氧發(fā)酵時(shí),存在菌體生長緩慢和產(chǎn)物產(chǎn)率低等缺點(diǎn)[7]。本實(shí)驗(yàn)室在前期研究中構(gòu)建了一株在有氧條件下能利用甘油高效合成丙酮醇的大腸桿菌工程菌株[2],如果大腸桿菌能在有氧條件下通過甘油脫氫途徑代謝甘油,則該菌株也有可能在有氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇。
本研究以大腸桿菌PDO0為出發(fā)菌株,篩選得到一株可以在有氧條件下以甘油為唯一碳源生長的突變株P(guān)DO1。靜息細(xì)胞轉(zhuǎn)化實(shí)驗(yàn)證明該菌株可以在有氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇,并測定該菌株的甘油脫氫酶的酶活以及NADH水平,旨在為有氧條件下利用甘油合成1,2-丙酮醇研究奠定基礎(chǔ)。
1 材料與方法
1.1 材料
1.1.1 菌株、引物和質(zhì)粒 本實(shí)驗(yàn)所用菌株、引物和質(zhì)粒見表1。
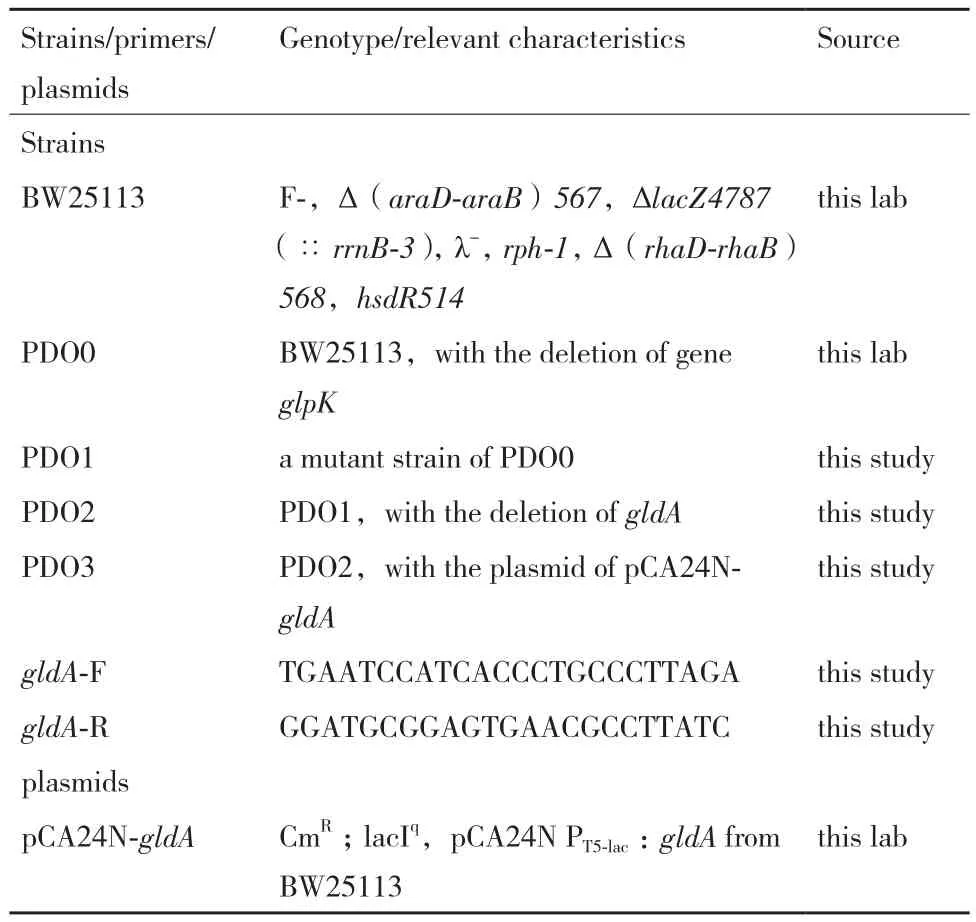
表1 菌株、質(zhì)粒和引物列表
1.1.2 培養(yǎng)基 無機(jī)鹽培養(yǎng)基:每1 L的溶液A含Na2HPO4·12H2O 17.19 g,KH2PO42.99 g,NaCl 0.58 g,(NH4)2·SO45.95 g。每1 L的溶液B含CaCl24.3 g,F(xiàn)eCl3·6H2O 16.7 g,MnCl2·4H2O 1 g,ZnCl21.7 g,CuCl2·2H2O 0.43 g,CoCl2·6H2O 0.6 g,H4MoNa2O60.6 g。另外配制120.18 g/L MgSO4和0.5 g/L thiamine。溶液A高壓滅菌以后,每1 L溶液A過濾滅菌加入1 mL溶液B、1 mL MgSO4溶液和1 mL thiamine溶液。甘油篩選平板:在無機(jī)鹽培養(yǎng)基中添加5 g/L甘油,1.5%瓊脂,50 mg/L卡那霉素。
1.1.3 試劑及儀器 丙酮醇(>98.0%)和1,2-丙二醇(>99.0%)購自梯希愛(上海)化成工業(yè)發(fā)展有限公司。GC-FID 7890氣相色譜儀,安捷倫公司。毛細(xì)管色譜柱CB-VAX(30 m×0.25 mm×0.33 μm),蘭州東立龍信息技術(shù)有限公司。全自動微生物生長曲線分析儀,Bioscreen公司。NAD+/NADH測試盒(編號ECNP-100),博世生物公司。
1.2 方法
1.2.1 突變菌株的篩選 以大腸桿菌菌株P(guān)DO0為出發(fā)菌株,菌體用PB緩沖液懸浮后涂布甘油篩選平板,37℃培養(yǎng)箱培養(yǎng)。
1.2.2 生長曲線的測定 野生型菌株BW25113、出發(fā)菌株P(guān)DO0和突變菌株P(guān)DO1接種于添加5 g/L甘油的無機(jī)鹽培養(yǎng)基,初始OD600為0.2,用全自動生長曲線測定儀檢測OD600,檢測72 h。
1.2.3 菌株有氧條件轉(zhuǎn)化丙酮醇為1,2-丙二醇的驗(yàn)證 突變菌株P(guān)DO1和BW25113在添加5 g/L甘油
的300 mL無機(jī)鹽培養(yǎng)基中有氧發(fā)酵,培養(yǎng)到OD600為1左右,將全部菌體離心收集,PB緩沖液洗滌2次后,轉(zhuǎn)接到添加5 g/L丙酮醇的20 mL PB緩沖液中,37℃,有氧發(fā)酵24 h。發(fā)酵液離心取上清,用甲醇稀釋10倍后過濾備用,丙酮醇和1,2-丙二醇的標(biāo)準(zhǔn)樣品用甲醇稀釋配制濃度梯度。氣相檢測方法:100℃保持1 min;以溫度上升速度20℃/min上升到230℃后,保持3 min。
1.2.4 基因gldA的敲除和回補(bǔ) 采用P1噬菌體轉(zhuǎn)導(dǎo)法敲除突變菌株P(guān)DO1的gldA基因,構(gòu)建得菌株P(guān)DO2[8-10];基因回補(bǔ)即以電轉(zhuǎn)法將質(zhì)粒pCA24N-gldA導(dǎo)入PDO2菌株,構(gòu)建得菌株P(guān)DO3。菌株構(gòu)建后,接種添加5 g/L甘油的20 mL無機(jī)鹽培養(yǎng)基,搖瓶發(fā)酵,檢測生長情況。
1.2.5 甘油脫氫酶酶活的測定 菌株P(guān)DO1和BW25113在甘油無機(jī)鹽培養(yǎng)基中培養(yǎng)到穩(wěn)定階段后,取菌液做酶活測定[11,12]。
1.2.6 輔酶NAD+/NADH量測定 突變菌株P(guān)DO1和BW25113在添加5 g/L甘油的無機(jī)鹽培養(yǎng)基中培養(yǎng)到穩(wěn)定生長期后,按照NAD+/NADH試劑盒說明書進(jìn)行操作。
2 結(jié)果
2.1 突變株的生長特性
菌株P(guān)DO0在甘油篩選平板上涂布多次以后,得到一個(gè)單菌落,命名為PDO1。檢測72 h的生長曲線如圖2所示。出發(fā)菌株P(guān)DO0由于敲除了在有氧條件下代謝甘油的必須基因glpK,幾乎不生長。野生型菌株BW25113在12 h即達(dá)到生長穩(wěn)定期,突變菌株P(guān)DO1在18 h開始生長,在48 h達(dá)到生長穩(wěn)定期,最終OD600和BW25113一樣。突變菌株P(guān)DO1雖然生長速度比野生型菌株BW25113緩慢,但是相對于不能在有氧條件下生長的出發(fā)菌株P(guān)DO0,生長特性有顯著改變。
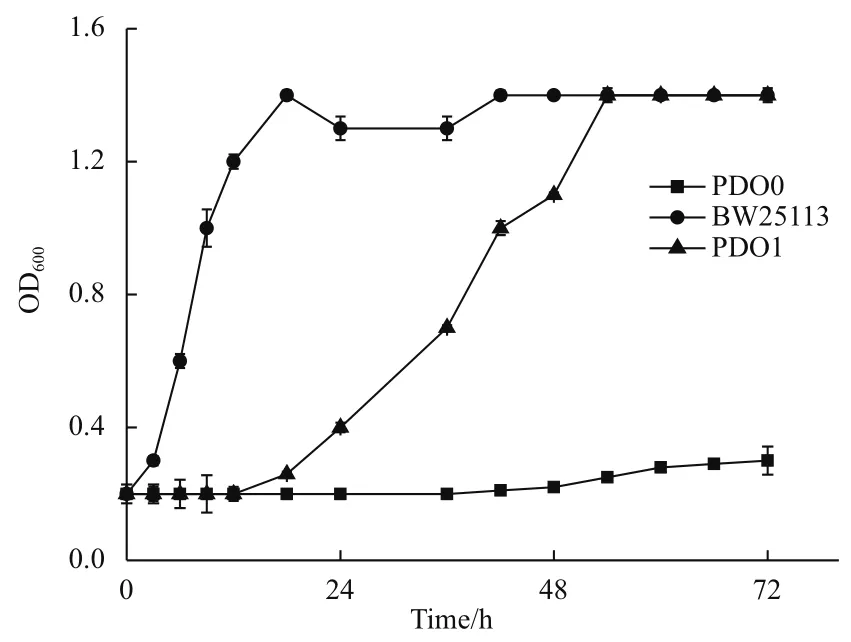
圖2 菌株P(guān)DO0,PDO1,BW25113在甘油無機(jī)鹽培養(yǎng)基中的生長曲線
2.2 突變株有氧條件下轉(zhuǎn)化丙酮醇為1, 2-丙二醇
經(jīng)GC-FID檢測,丙酮醇和1,2-丙二醇標(biāo)準(zhǔn)樣品出峰時(shí)間分別為4.1 min和7.2 min。靜息細(xì)胞轉(zhuǎn)化實(shí)驗(yàn)后,菌株P(guān)DO1的發(fā)酵液中可以檢測到1,2-丙二醇(圖3-A),而對照菌株BW25113的發(fā)酵液中未檢測到1,2-丙二醇(圖3-B)。如圖3-C所示,菌株BW25113消耗丙酮醇的量為0.72 g/L,菌株P(guān)DO1消耗丙酮醇的量為1.48 g/L,合成1,2-丙酮醇的量為0.73 g/L,轉(zhuǎn)化率達(dá)到0.493 g/g丙酮醇。
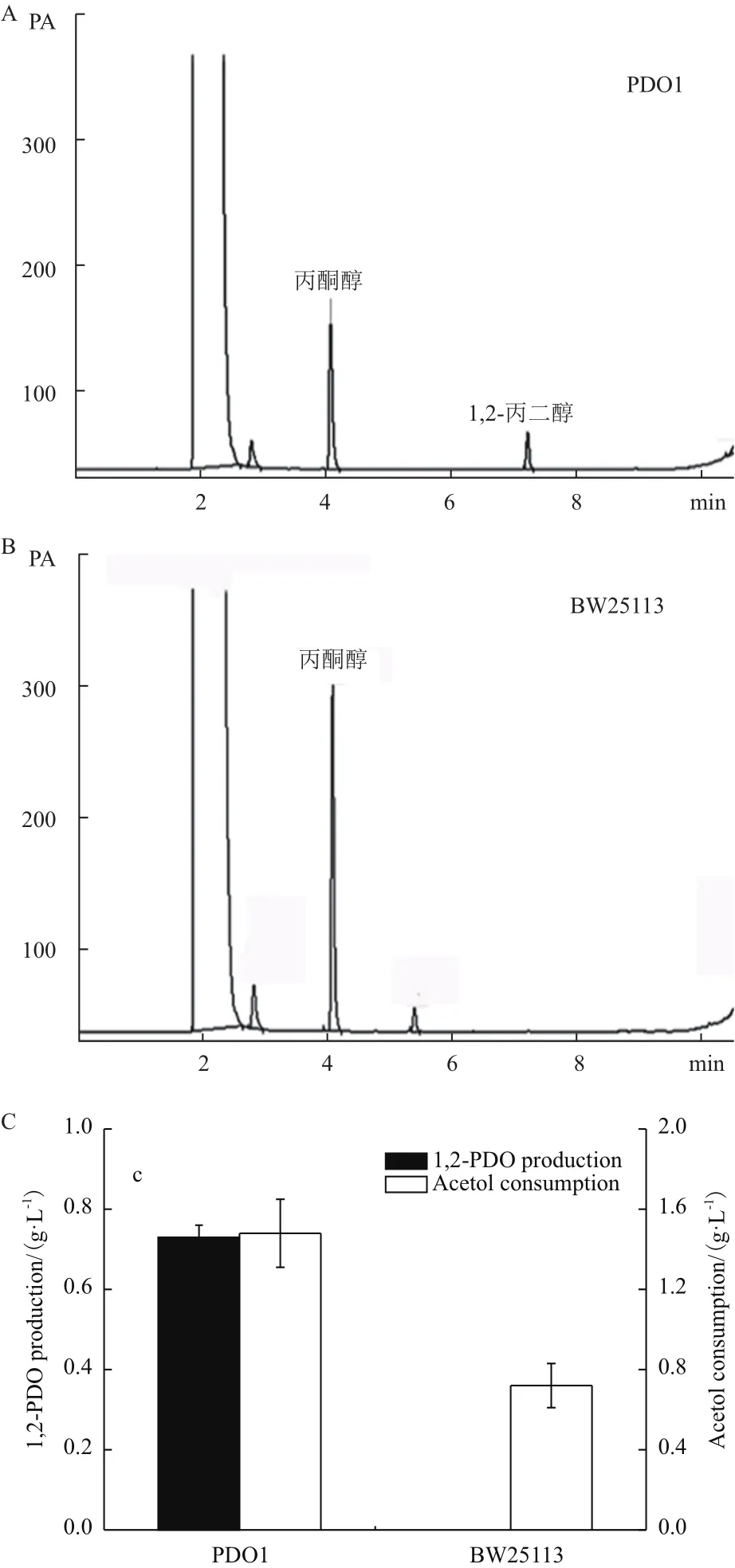
圖3 靜息細(xì)胞發(fā)酵菌液的檢測情況
2.3 基因gldA的作用
為了確認(rèn)是否因?yàn)榛騡ldA的突變導(dǎo)致突變株P(guān)DO1具有有氧條件下代謝甘油的特性,對突變株P(guān)DO1中的基因gldA進(jìn)行測序,測序結(jié)果證明基因gldA沒有突變。為了證實(shí)突變株P(guān)DO1中是否存在其他有氧代謝甘油的途徑,我們敲除了PDO1中的gldA基因,得到突變株P(guān)DO2,并將質(zhì)粒pCA24N-gldA導(dǎo)入菌株P(guān)DO2,得到回補(bǔ)菌株P(guān)DO3。圖4的生長曲線表明菌株P(guān)DO2不可以利用甘油生長,菌株P(guān)DO3可以利用甘油生長,表明基因gldA是菌株P(guān)DO1在有氧條件下代謝甘油的必需基因。
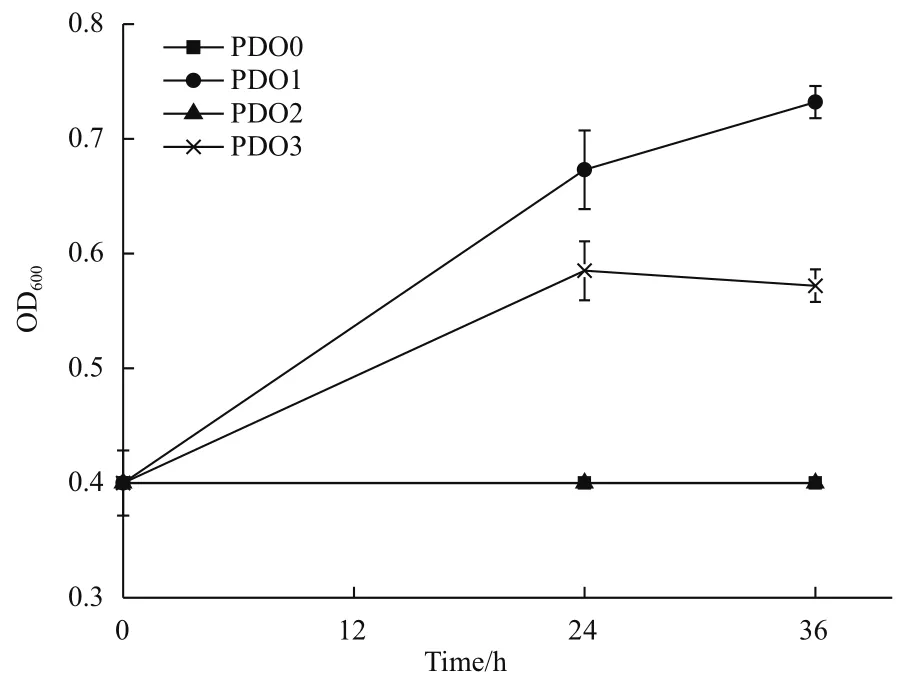
圖4 菌株P(guān)DO0,PDO1,PDO2,PDO3在甘油無機(jī)鹽培養(yǎng)基中的生長曲線
2.4 突變株甘油脫氫酶酶活水平提高
以上實(shí)驗(yàn)已經(jīng)證明gldA是突變株P(guān)DO1利用甘油生長的必需基因,此外,我們測定了PDO1中甘油脫氫酶的活性。如圖5所示,對照菌株的甘油脫氫酶酶活為37 U/mg蛋白總量,突變株P(guān)DO1的酶活為2 809 U/mg蛋白總量,是BW25113酶活的75.9倍。這表明突變株P(guān)DO1中甘油脫氫酶活性顯著的提高可能是其能利用甘油厭氧代謝途徑代謝甘油的原因。
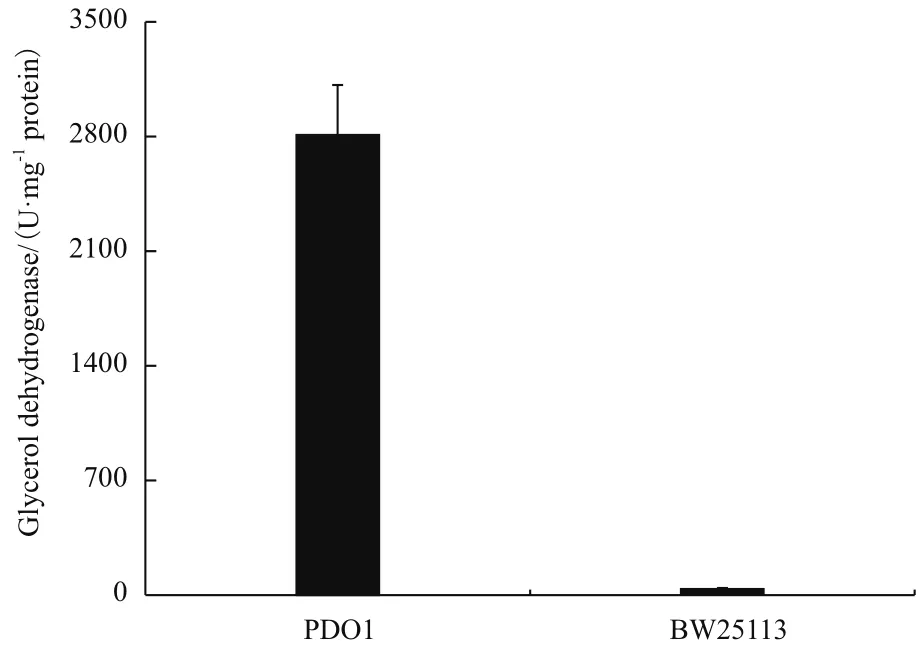
圖5 菌株BW25113和PDO1的甘油脫氫酶酶活
2.5 突變菌株的NADH相對增加
基因gldA編碼的甘油脫氫酶催化甘油脫氫時(shí)需要輔酶NAD+的參與,催化丙酮醇合成1,2-丙二
醇則需要輔酶NADH的參與。為了考察胞內(nèi)NADH和NAD+對菌株特性的影響,測定了突變菌株P(guān)DO1中NAD+和NADH的含量。結(jié)果如圖6所示,菌株P(guān)DO1的NAD+和NADH總量明顯比BW25113少,但是菌株P(guān)DO1的NADH占輔酶總量的百分比卻顯著比BW25113多,是后者的1.64倍,NADH水平的提高可能為丙酮醇轉(zhuǎn)化為1,2-丙二醇提供了必須的NADH。
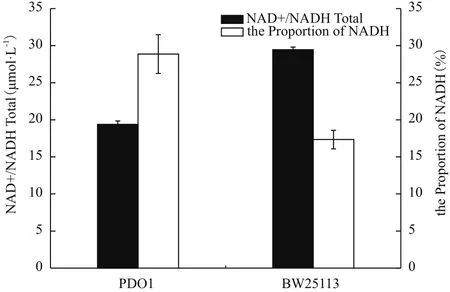
圖6 菌株在甘油無機(jī)鹽培養(yǎng)基中的NAD+和NADH總量及NADH百分比
3 討論
在本研究中,以甘油激酶基因缺失的菌株P(guān)DO0為出發(fā)菌株,篩選得到了一株有氧條件下以甘油為唯一碳源生長的菌株P(guān)DO1。另外,用靜息細(xì)胞發(fā)酵證實(shí)菌株可以在有氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇,而且轉(zhuǎn)化率達(dá)到0.493 g/g丙酮醇。
基因gldA是菌株P(guān)DO0甘油厭氧代謝途徑以及合成1,2-丙二醇的關(guān)鍵基因,測序結(jié)果表明突變株P(guān)DO1中該基因并沒有突變。基因gldA的敲除和回補(bǔ)實(shí)驗(yàn)表明基因gldA是突變菌株好氧條件下代謝甘油的必需基因。由此猜測可能是突變菌株中相關(guān)調(diào)控基機(jī)制改變增加了基因gldA的表達(dá)量,隨后的甘
油脫氫酶酶活檢測證實(shí)了這點(diǎn)。突變株P(guān)DO1中基因gldA表達(dá)的顯著提高可能是在有氧條件下代謝甘油的原因。
NAD+和NADH是細(xì)胞內(nèi)重要的電子載體,參與到多種氧化還原反應(yīng)[13]。大腸桿菌在厭氧條件下代謝甘油以及產(chǎn)1,2-丙二醇途徑中,甘油的脫氫以及1,2-丙二醇的合成都依賴于NAD+和NADH的相互轉(zhuǎn)化。Bekers等[13,14]的研究表明,NADH和NAD+的比例對代謝途徑的流向有至關(guān)重要的作用,而且Rachit和Huang等[15]敲除ubiC基因阻斷了NADH在微氧條件下的氧化,提高1,2-丙二醇的產(chǎn)量。在有氧條件下,胞內(nèi)NADH會被迅速氧化,細(xì)胞內(nèi)NADH相對少,在厭氧培養(yǎng)時(shí),NADH才能維持在一個(gè)相對較高的水平[16,17]。而突變株P(guān)DO1細(xì)胞內(nèi)的NADH在有氧培養(yǎng)時(shí)仍然維持在一個(gè)較高的水平,因此可能是菌株P(guān)DO1胞內(nèi)NADH的相對提高以及基因gldA表達(dá)水平的上升促使了突變菌株在有氧條件下轉(zhuǎn)化丙酮醇為1,2-丙酮醇。
以前的研究均在厭氧條件下發(fā)酵產(chǎn)1,2-丙二醇,但是大腸桿菌以甘油為唯一碳源時(shí),在厭氧條件下生長緩慢。本研究中得到的突變菌株可以在有氧條件下轉(zhuǎn)化丙酮醇為1,2-丙二醇,但是也存在生長緩慢的問題。因此,在后面的研究中,可以通過突變菌株在甘油培養(yǎng)基中的適應(yīng)性進(jìn)化,提高其在有氧條件下的生長速度,實(shí)現(xiàn)在有氧條件下的快速生長以及高產(chǎn)1,2-丙二醇。
4 結(jié)論
在本研究中,以大腸桿菌BW25113ΔglpK為出發(fā)菌株,通過篩選得到一株可以在有氧條件下代謝甘油的突變菌株P(guān)DO1。靜息細(xì)胞發(fā)酵表明菌株P(guān)DO1可以在有氧條件下將丙酮醇轉(zhuǎn)化為1,2-丙二醇,1,2-丙二醇的產(chǎn)量達(dá)到0.73 g/L,轉(zhuǎn)化率達(dá)到0.493 g/g丙酮醇。
隨后基因gldA的研究表明gldA是突變菌株必需,而且該基因表達(dá)水平顯著比對照株高,另外突變株胞內(nèi)NADH水平也比對照菌株高。因此,我們推測突變菌株基因gldA表達(dá)水平的提高以及NADH的相對提高使得菌株可以有氧條件下利用甘油生長且生產(chǎn)1,2-丙二醇。
[1] Clomburg JM, Gonzalez R. Anaerobic fermentation of glycerol:a platform for renewable fuels and chemicals[J]. Trends in Biotechnology, 2013, 31(1):21-28.
[2] Zhu HL, Yi XY, Liu Y, et al. Production of acetol from glycerol using engineered Escherichia coli[J]. Bioresource Technology, 2013, 149(4):238-243.
[3] Yang FX, Hanna MA, Sun RC. Value-added uses for crude glycerol-a byproduct of biodiesel production[J]. Biotechnology for Biofuels, 2012, 5(6):1-10.
[4] 鄭軍. 1, 2 丙二醇國內(nèi)外生產(chǎn)現(xiàn)狀及發(fā)展前景[J]. 熱固性樹脂, 2009, 24(1):58-62.
[5] Bennett GN, San KY. Microbial formation, bitechnological production and application of 1, 2-Propanediol[J]. Applied Microbiology & Biotechnology, 2001, 55(1):1-9.
[6] Ramon G, Abhishek M, Yandi D, et al. A new model for the anaerobic fermentation of glycerol in enteric bacteria:Trunk and auxiliary pathways in Escherichia coli[J]. Metabolic Engineering, 2008, 10(5):234-245.
[7] Liu Q, Xiong DW, Hu HB, et al. Hydrogen production from glycerol using a genetically engineered Escherichia coli HW2 strain[J]. Journal of Chemical Engineering of Chinese Universities, 2015, 29(5):1133-1137.
[8] 曲璟秋, 劉翠花. 應(yīng)用基因敲除快速構(gòu)建大腸桿菌突變體改造
脂肪酸代謝途徑[J]. 微生物學(xué)報(bào), 2013, 53(6):608-614.
[9] Madyagol M, Al AH, Levarski Z, et al. Gene replacement techniques for Escherichia coli genome modification[J]. Folia Microbiologica, 2011, 56(3):253-263.
[10] Tomoya B, Takeshi A, Miki H, et al. Construction of Escherichia coli K-12 in-frame, single gene knockout mutants:the keio collection[J]. Molecular Systems Biology, 2006, 2(1):8-11.
[11] Jin RZ, Tang J, Lin E, et al. Experimental evolution of a novel pathway for glycerol dissimilation in Escherichia coli[J]. Journal of Molecular Evolution, 1983, 19(6):429-436.
[12] Piattoni CV, Figueroa CM, Diez MDA, et al. Production and characterization of Escherichia coli glycerol dehydrogenase as a tool for glycerol recycling[J]. Process Biochemistry, 2013, 48(3):406-412.
[13] Bekers KM, Heijnen JJ, Gulik WM. Determination of the in vivo NAD:NADH ratio in Saccharomyces cerevisiae under anaerobic conditions, using alcohol dehydrogenase as sensor reaction[J]. Yeast, 2015, 32(8):541-557.
[14] Bakker BM, Overkamp KM, Van AJ, et al. Stoichiometry and compartmentation of NADH metabolism in Saccharomyces cerevisiae[J]. FEMS Microbiol, 2001, 25(1):15-37.
[15] Rachit J, Jin H, Yuan QP, et al. Engineering microaerobic metabolism of E. coli for 1, 2-propanediol production[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(3):1-7.
[16] Zhang YP, Huang ZH, Du C, et al. Introduction of an NADH regeneration system into Klebsiella oxytoca leads to an enhanced oxidative and reductive metabolism of glycerol[J]. Metabolic Engineering, 2008, 11(2):101-106.
[17] Sun FF, Dai CY, Xie J, et al. Biochemical issues in estimation of cytosolic free NAD/NADH Ratio[J]. PLoS One, 2012, 7(5):1-10.
(責(zé)任編輯 馬鑫)
Research on an Escherichia coli Strain Capable of Transferring Acetol to 1,2-Propanediol Aerobically
DENG Jing-jing HU Hong-bo ZHANG Xue-hong
(Key Laboratory of Microbial Metabolism,School of Life Sciences and Biotechnology,Shanghai Jiao Tong University,Shanghai 200240)
We constructed an engineered Escherichia coli strain that can efficiently convert glycerol to acetol in our lab,the productivity of 1,2- Propanediol(1,2-PDO)may increase significantly if the strain can convert acetol to 1,2-PDO under aerobic condition. A mutant strain named PDO1 was screened from original strain E. coli BW25113ΔglpK,which metabolized glycerol aerobically. The further experiments showed that the strain PDO1 converted acetol to 1,2-PDO with the yield of 0.73 g/L and conversion rate of 0.493 g/g acetol under aerobic condition. The activity of glycerol dehydrogenase and the proportion of NADH were 75.6 and 1.64 times higher than that of control respectively. It is inferred that the increase of glycerol dehydrogenase activity and NADH level resulted in the mutant strain PDO1 metabolizing glycerol by glycerol dehydrogenase under aerobic condition and the conversion of acetol to 1,2-PDO .
Escherichia coli;1,2-Propanediol(1,2-PDO);glycerol;acetol;resting cells fermentation
10.13560/j.cnki.biotech.bull.1985.2016.12.025
2016-03-01
“973”項(xiàng)目(2012CB721005),國家自然科學(xué)基金項(xiàng)目(J1210047)
鄧靜靜,女,碩士研究生,研究方向:大腸桿菌利用甘油生產(chǎn)高價(jià)值產(chǎn)物的研究;E-mail:977613938@qq.com
胡洪波,男,副教授,研究方向:微生物代謝工程;E-mail:hbhu@sjtu.edu.cn

