Lifitegrast的制備工藝及市場分析
劉賀欽陸曉菡賀玉林(.華北制藥新藥研究開發有限責任公司、微生物藥物國家工程中心, 河北省工業微生物代謝工程技術研究中心, 河北 石家莊 05005 ;.華北制藥華勝有限公司, 河北 石家莊 0560)
Lifitegrast的制備工藝及市場分析
劉賀欽1陸曉菡2賀玉林1(1.華北制藥新藥研究開發有限責任公司、微生物藥物國家工程中心, 河北省工業微生物代謝工程技術研究中心, 河北 石家莊 050015 ;2.華北制藥華勝有限公司, 河北 石家莊 052160)
本文對lifitegrast滴眼液進行了簡要概述,包括了原料與制劑基本信息、原料藥合成工藝、制劑處方組成、流行病學以及市場預測。
lifitegrast;工藝;干眼癥;市場
Lifitegrast 是XiidraTM(ZYE-druh)的活性成分,是美國Sunesis 公司開發的一種用于治療干眼病的小分子藥物。2016年7月11日美國FDA批準用于干眼病的LFA-1拮抗劑藥物中的首款藥物。由于Xiidra藥物是Shire眼科部門的一項重要成果,該公司在開發中已將Lifitegrast認定為一種重磅炸彈藥物。
1 lifitegrast滴眼液信息
1.1 原料藥信息
Lifitegrast的CAS登記號:1025967-78-5,化學名為(S)-2-[2-(苯 并 呋 喃-6-羰 基)-5,7-二 氯-1,2,3,4-四 氫異喹啉-6-甲酰胺基]-3-(3-甲磺酰基苯基)丙酸,分子量為615.5,lifitegrast(SAR118)存在一個手性中心,固體存在無定型及A、B、C、D、E五種晶型,其原料藥是白色至類白色粉末、密度為1.479g/cm3。
1.2 制劑信息
XiidraTM制劑[1]為無菌、澄清、無色至淺棕黃色、pH值7.0~8.0等滲溶液,滲透壓力范圍在200~330mOsmol/kg。保存條件:室溫20℃~25℃,鋁箔袋避光保存。用法用量為每日兩次,每次每只眼睛一滴。不良反應有刺激眼睛、眼部不適、視力模糊、味覺障礙。由于兒童不經常發生干眼病,17歲以下的兒童患者的安全性和有效性還沒有研究。
2 制備工藝
2.1 原料藥的制備工藝
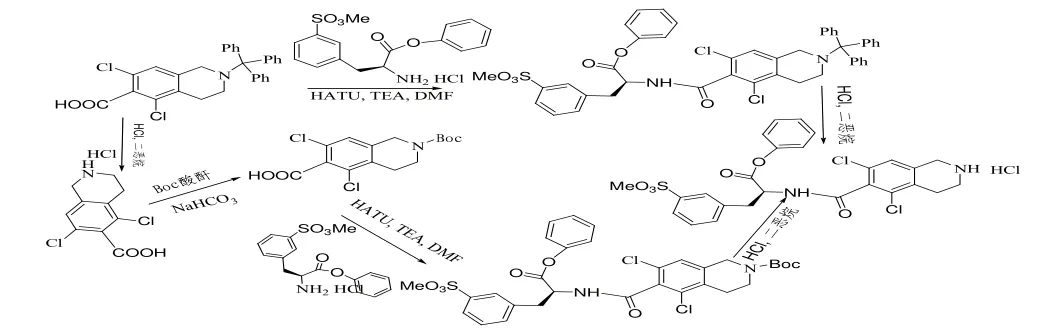
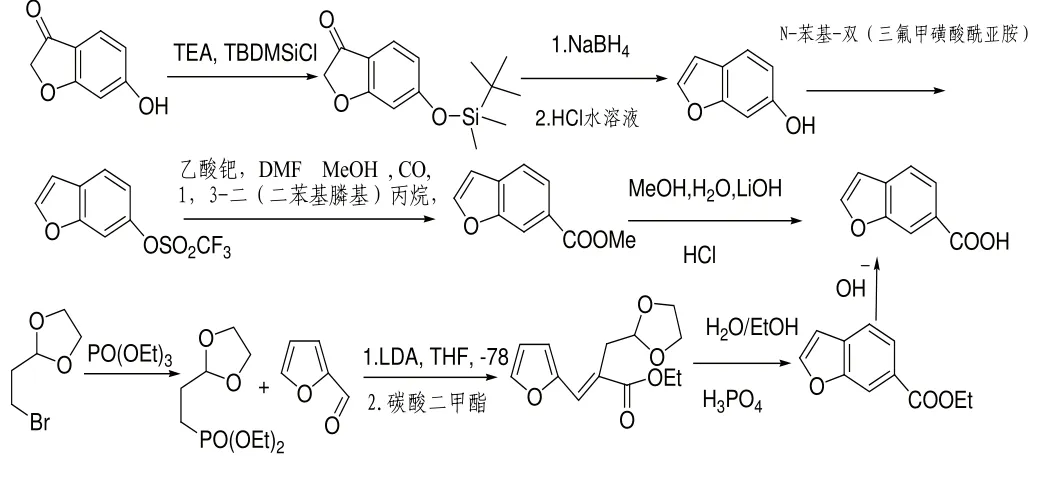
目前該藥物研究文獻較少,工藝方面主要以原研公司專利為主[2],該專利以化合物10、化合物12和化合物18為關鍵中間體進行合成,路線如下圖:

化合物12的合成路線:
化合物18的合成路線:
2.2 制劑處方組成
XiidraTM處方[1]組成:lifitegrast、氯化鈉、無水磷酸二氫鈉、五水硫代硫酸鈉、氫氧化鈉或鹽酸(調pH值)、注射用水。其中,lifitegrast含量為5%,濃度為50mg/ml。
3 流行病學與市場預測
3.1 干眼癥流行病學
干眼癥已成為全球流行性疾病,國外干眼癥流行病學表明[4],隨年齡增長患病風險增高,年齡在30~40歲人群中患病率大于20%,年齡超過70歲人群中患病率達道36.1%,而男性患者發病率為14.9%,女患者發病率為22.8%。研究表明[5]中國人40歲以上人群患病率較高,70歲以上患病率明顯增多,可能與淚液分泌功能減弱有關。
3.2 市場預測
根據流行病學研究數據,全球患干眼癥的人數眾多,且不斷增多,因此,Lifitegrast作為該領域治療中里程碑式藥物將會發揮巨大作用。2013年,Shire花費1.6億美元從SARcode Bioscience團隊收購了lifitegrast,并且前景一直為業內人士看好,有望超過10億美元銷售額。該藥物在中國的專利為CN104797574A,尚未獲得授權。藥智網顯示該藥物并未有申報企業,所以在中國也比較具有發展前景。
[1]FDA網站Lable文件.
[2]J.R.澤勒,S.伊耶,等.LFA-抑制劑及其多晶型物:CN104797574A[P].2015-07-22.
[3]SahaiA,MALIKP.Dryeyeprevalenceandattribu tableriskfactorsinahospital-basedpopulation[J]. IndianJOphthalmol,2005,(6).
[4]高春玲,等.眼科門診干眼癥的流行病學特征分析[J]山西醫科大學學報,2011,(8).

