小麥BNS雄性不育中國春恢復基因的連鎖群檢測和QTL初步定位
孫慧慧,楊 靖,2,衛 笑,付慶云,曹銀萍,茹振鋼,李友勇
(1.河南科技學院/河南省高等學校作物分子育種重點學科開放實驗室/現代生物育種河南省協同創新中心,河南新鄉 453003; 2.四川農業大學農學院,四川成都 611130)
?
小麥BNS雄性不育中國春恢復基因的連鎖群檢測和QTL初步定位
孫慧慧1,楊 靖1,2,衛 笑1,付慶云1,曹銀萍1,茹振鋼1,李友勇1
(1.河南科技學院/河南省高等學校作物分子育種重點學科開放實驗室/現代生物育種河南省協同創新中心,河南新鄉 453003; 2.四川農業大學農學院,四川成都 611130)
BNS是一個新發現的溫敏小麥雄性不育系,有良好的不育性和自身轉換性,在雜交小麥利用和不育資源研究中有重要價值。為定位BNS的恢復基因,首先以BNS的高恢復系中國春為材料,創建BNS×中國春F2作圖群體,建立自交結實率和花粉可育率兩個表型BSA池;然后用中國春缺體-四體系檢測恢復相關連鎖群;最后用這些連鎖群上的SSR分子標記篩選BSA池,用檢測的連鎖標記篩選F2作圖群體,進一步定位恢復基因的QTL位點。結果表明,用BNS與中國春缺四體雜交,根據F1不育性檢測到4個相關連鎖群,分別是1A、1B、2B和7B;利用4個相關連鎖群和4個非相關連鎖群共8個染色體上的222對SSR分子標記篩選2對共4個BSA池,結果在3個相關連鎖群上檢測到8對連鎖標記;用這8對連鎖標記篩選F2群體210個個體植株,檢測到5個QTL位點,位于1A、1B和2B染色體上。這些位點中,1個與自交結實率相關,2個與兩個表型均相關,是主效QTL位點,另2個與花粉可育率相關,是微效QTL位點。這些結果為BNS恢復基因分子標記選擇和精細定位奠定了基礎。
小麥;BNS雄性不育;恢復基因;SSR分子標記;QTL位點
BNS是一個新發現的小麥雄性不育系。多年觀察發現,當該不育系小孢子發育處于較低溫度時,花粉發育敗育,當小孢子發育時溫度升高,花粉發育逐步恢復,因此,BNS是一個對溫度敏感的二型雄性不育系[1-3]。觀察還發現,BNS在生產上不育度高,不育期長,且年度間穩定,一些特殊品種可對BNS有完全恢復性[3-7]。因此,BNS既是一個可應用于雜交小麥的優良材料,也是一個有重要研究價值的小麥雄性不育種質資源。
近些年來,圍繞BNS的生物學特性和遺傳機理,人們在不育性和自身轉換性方面做了大量的研究,并取得了重要進展[1-7],但在不育和恢復的遺傳機理以及基因定位方面報道較少。該方面的進展緩慢,主要原因是BNS的不育也是多基因遺傳[1,8-9],恢復規律不明確,加上小麥基礎研究薄弱,基因組測序未進入應用階段,因此全基因組測序定位缺乏參考基因組。關于BNS的遺傳機理,目前報道的有兩種推測模式,一種是隱性核不育模式,認為有1~3個隱性核不育基因控制BNS的雄性不育[1,8],另一種是顯性核不育和非等位恢復模式,認為BNS的不育有顯性特征,因為多數品種不能恢復BNS的育性,因此F1的恢復應是不育基因的非等位基因的作用[10]。關于BNS雄性不育和恢復相關基因的定位,Xing等[11]2003年曾將BNS的早期材料BNY-S的不育隱性核基因定位在2B染色體上,王茂婷[12]以BNS×山農055525組合的F2群體為材料,采用QTL方法檢測到與BNS恢復性相關的14個QTL位點,分布在5個染色體上。這些研究在BNS的不育和恢復基因定位方面做了開拓性工作,但他們均認為BNS的不育是隱性核不育,因此恢復基因是不育基因的顯性等位基因。
本實驗室通過大量的觀察認為BNS的恢復應是非等位恢復機制,并檢測到中國春是一個高恢復系[10]。中國春是一個小麥研究的經典材料,有一套完整的缺體-四體系,能在形態水平檢驗基因所屬連鎖群,并且目前報道的SSR分子標記工具也多是在中國春組合中開發的,因此,本研究在BNS非等位恢復模式下,選用中國春為恢復親本,用中國春及缺體-四體系檢測中國春中BNS恢復基因的所屬連鎖群,然后用SSR分子標記方法篩選與恢復基因連鎖的分子標記,最后用這些連鎖標記在BNS×中國春的F2作圖群體中檢測QTL位點,旨在初步檢測中國春恢復BNS育性的基因位點和特性。
1 材料與方法
1.1 材 料
BNS不育系是本實驗室保存材料。恢復系中國春(Chinase Spring,CS)以及中國春缺四體由中國農業大學劉志勇教授惠贈,這些缺四體均經SSR分子標記鑒定,部分重要材料經SSR熒光原位標記鑒定。
1.2 材料種植和表型調查
試驗材料在河南輝縣小麥育種基地種植。自2008年以來BNS于歷年10月1日開始播種,8 d一個播期。本試驗中中國春、中國春缺四體、BNS×中國春缺四體的F1和BNS×中國春的F1及F2均在2013-2014年10月9日播種,該播種期在研究地區是小麥正季播種期,也是BNS的不育播期[1-3]。田間種植方式為:行長2 m,行寬0.23 m,種植2行隔1空行。BNS、中國春及其缺四體和F1種植株距12~15 cm,F2株距18~20 cm。
抽穗后取主莖和高位分蘗穗套羊皮紙帶,每行植株依次套袋,每株套2穗,單穗套,父本每品種套袋20株以上,F1每個組合套袋30株以上,BNS不育系各播期套袋50株以上,F2全部套袋。成熟后收取套袋穗,統計每穗小穗數和結實粒數,每株取2穗的平均數。采用第1、第2小花結實粒數計算法[1-3,6-9](國內法)計算自交結實率,即自交結實率=第1、第2小花結實粒數/(2×總小穗數)×100%。
開花當天取單株的主莖穗上、中、下3個部位小穗各1個,隨即固定,后在室內取每個小穗第一小花的3枚花藥,擠出花粉粒,I2-KI染色,參照水稻和小麥的計數方法[3,13]統計完全黑色的可育花粉粒數和花粉粒總數,每個片子取3個視野,共9個觀察值,得出平均數,然后計算花粉可育率。花粉可育率=可育花粉粒數目/花粉粒總數×100%。
不育度和恢復度是雜交組合后代的套袋不育率或可育率與親本套袋的不育率或可育率的比率。
1.3 基因組DNA的提取及不育、可育池建立
田間依次標記BNS×CS的F2單株240個,于雌雄蕊分化期取各單株幼穗,采用CTAB法提取基因組DNA[10-11,14],1%瓊脂糖凝膠電泳和紫外分光光度計檢測DNA純度和濃度。群體集團分離法(Bulked segregant analysis,BSA)池[15]的建立用2個表型性狀,即自交結實率和花粉可育率,方法是在F2群體中取表型最低株系和最高株系各10株,各自DNA等量混合,形成自交結實率不育池(A1)和可育池(B1),花粉可育率不育池(A2)和可育池(B2)。
1.4 SSR引物的選擇及合成
SSR分子標記在Daryl的SSR圖譜上選擇[16-17],從染色體的短臂端開始,按順序每3~5 cM選1個標記位點,首先選單擴增產物標記,若長距離無單擴增產物標記,選二產物擴增標記。在總數222對引物中,其中184對是單擴增產物標記,38對是二產物擴增標記。引物序列在小麥網站(http://wheat.pw.usda.gov/cgi-bin/graingenes/browse.cgi?class=marker/)上獲得,由上海生工生物技術有限公司合成。
1.5 引物的多態性檢測
以P1(BNS)、P2(中國春)、F1及由F2建立的兩套不育和可育池DNA(見1.3)為模板,參考Somers等[11,17-18]的方法進行PCR擴增。反應體系(25 μL):ddH2O 18.2 μL,10×Buffer(Mg2+)2.5 μL,dNTP Mix(2.5 mmol·L-1)2 μL,TaqDNA Polymerase(5 U· μL-1)0.3 μL,模板DNA(50 ng· μL-1)1 μL,引物(10 μmol·L-1)1 μL。引物Xgwm、Xwmc和Xbarc的反應程序:94 ℃預變性3 min;94 ℃變性1 min,55 ℃退火1 min,72 ℃延伸2 min,45個循環;72 ℃延伸10 min;12 ℃保存。引物Cfd的反應程序:94 ℃預變性5 min;94 ℃變性30 s,60 ℃退火30 s;72 ℃延伸30 s,30個循環;72 ℃延伸10 min,12 ℃保存。擴增產物用2.5%的瓊脂糖凝膠電泳檢測,恒壓100 V,電泳50 min。電泳結束后,UVItec-FireReader凝膠成像分析儀觀察并記錄圖像。
1.6 遺傳圖譜的構建
以F2作圖群體各單株總DNA為模板,利用BSA池篩選得到的多態性引物進行PCR擴增,方法同1.5。用Mapmaker/Exp 3.0b[19]軟件處理標記的F2群體中的基因型,計算標記遺傳距離;用WinQTLCart 2.5[20]軟件檢測QTL位點;用Mapdraw繪制連鎖標記和QTL位點合并連鎖圖[21]。
2 結果與分析
2.1 BNS和中國春的自交結實率
從表1可以看出,中國春自交結實為59.33%~78.09%,BNS的套袋自交結實率為0.7%~3.54%,該結果也用作同年同期播種的F1、F2代不育和可育的劃分界限。
2.2 BNS與中國春缺四體雜交F1的自交結實率和恢復基因所屬連鎖群
2013年和2014年共做32個BNS與中國春缺四體雜交組合,包含小麥21個連鎖群,2015年是部分相關連鎖群的重復驗證,3年調查的BNS與中國春及其缺四體雜交F1的自交結實率見表2。從表2可以看出,2013年和2014年BNS×中國春F1套袋自交結實率分別為48.24%和60.68%,而中國春本身套袋自交結實率分別為59.33%和70.43%,與父本相比較,F1可恢復的程度達81.31%和86.16%,但32個BNS與中國春缺四體雜交組合的F1自交結實率均下降,部分組合下降顯著,甚至達到BNS的高不育程度,如N1B-T1A和N2B-T2D與中國春缺四體雜交組合的F1,這應是缺失了恢復基因的緣故。根據F1自交結實率及其連續3年不育性的穩定性,可知N1A-T1D、N1B-T1A、N1B-T1D、N2B-T2D、N7B-T7A和N7B-T7D為BNS與中國春缺四體雜交高不育組合的父本,說明BNS恢復基因位于1A、1B、2B和7B染色體上。以2A缺四體為父本的組合有兩個,但兩個組合表現不同,即以N2A-T2D為父本的F1表現不育,以N2A-T2B為父本的F1表現可育,雖然3年結果一致,但不能確定是恢復相關連鎖群。還有一些組合,也有高不育現象出現,但年份間表現不穩定,因此也不認為是恢復相關連鎖群。
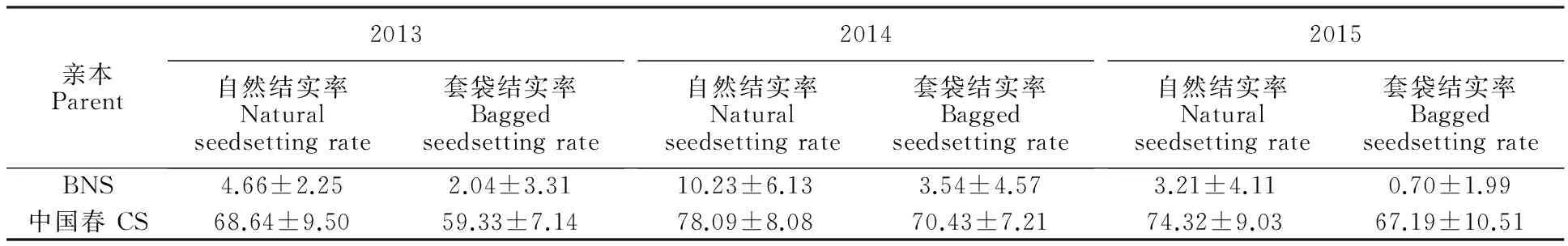
表1 不育期(10月9日)播種的BNS和中國春套袋與自然結實率
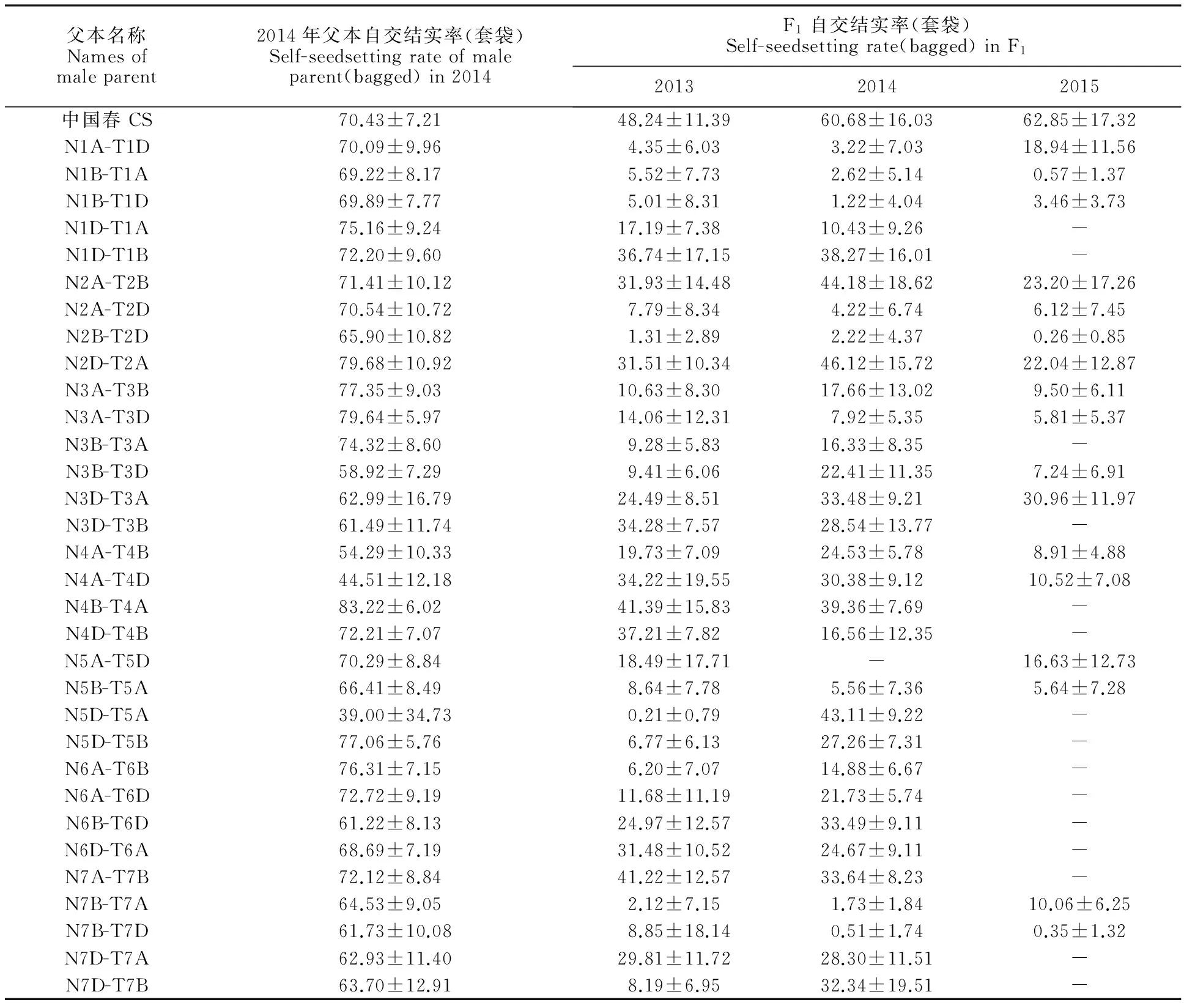
表2 BNS與中國春缺四體雜交F1及其父本缺四體的自交結實率
“-”代表無調查數據。
“-” represents missing data.
2.3 BNS×中國春F2作圖群體特征、BSA池建立和基因對數估計
為了檢測恢復基因位點,本研究構建了F2作圖群體。田間標記和取樣樣本數240,到分子標記篩選后數據完整的有效樣本數210,該210個樣本的表型(花粉可育率和自交結實率)分布見表3。表3的第一和第二區間設為0~3.54%和3.55%~9.89%,其中,3.54%和9.89%分別是BNS不育系10月9日播期的自交結實率和花粉可育率。從表3可以看出,自交結實率在不育性水平3.54%及以下是一個多數組,3.54%到99.99%呈連續分布,平均數為52.34%,眾數在50%~80%區間;從花粉可育率表型看,完全不育株較少,但高花粉可育率個體較多,平均數為59.29%,眾數在60%~90%區間。這些結果說明,一是花粉可育率大于自交結實率,二是兩個表型分布區間0~95%,適宜作定位群體。利用兩個表型的極端個體建BSA池,樣品均為10株,育性分組中3.54%和9.89%是指與F2同年同期播種的BNS的自交結實率和花粉可育率。
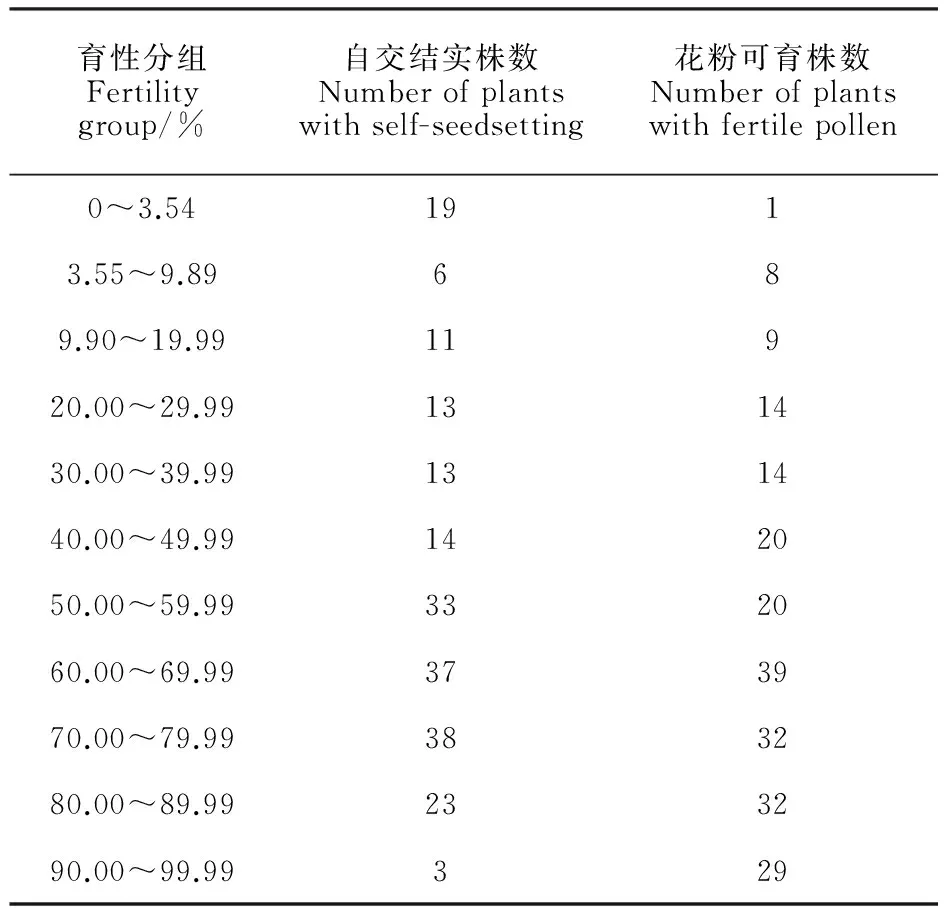
表3 BNS×中國春F2代自交結實率和花粉可育率分布(2014年)
Both 3.54% and 9.89% in fertility group represent the self-seedsetting rate and fertile pollen rate of BNS that were sown at the same time as F2.
自交結實率不育池結實率為0,可育池結實率為84.89%~92.9%;花粉可育率不育池可育率平均數<10%,且3個小花中有2個<2%,可育池花粉可育率>88%。
從F2群體分布可以看出,兩個表型的遺傳方式均是多基因遺傳。以同年BNS不育系表型值為臨界值,2014年自交結實率為3.54%,花粉可育率為9.89%,F2群體中自交結實率和花粉可育率不育個體數分別是19個和9個,分別占F2群體的1/11.05和1/23.3,該比值的數量遺傳學含義是,從自交結實率角度,恢復不育性有2個主效基因,從花粉可育率角度,涉及到3個基因。
2.4 BSA池篩選出8對多態性SSR分子標記
中國春缺四體檢測到恢復基因與4個染色體相關,因此,理論上在相關染色體上篩選連鎖標記即可。但為了提高可靠性,除了用1B、2B、1A和7B染色體外,還增加了4個對照染色體,其中,2個是F1組合育性表現不穩定的染色體2A和5D,另2個是隨機選取的非相關染色體3A和7D。沿著該8個染色體,在Somers的SSR圖譜上[17]順序選取SSR位點222個,引物在P1、P2、F1、自交結實率BSA池和花粉可育率BSA池總DNA中做多態性檢測,最后擴增的有效引物218對,篩選出親本間有明顯差異的引物58對,在該58對引物中,同時在不育池和可育池之間也存在相同多態性的引物8對,該8對引物的編號及所在染色體信息見表4。從表4可看出,檢測到的多態性SSR標記所在的染色體正是缺四體方法檢測的連鎖群,用作對照的非連鎖染色體,沒有檢測到連鎖標記,5D染色體也沒有篩選到連鎖標記,2A染色體上在花粉可育率池中檢測到1對連鎖標記。還有一個例外是7B染色體,缺四體檢測是連鎖染色體,但該染色體上用33對引物擴增,結果沒有檢測到連鎖標記。
8對多態性標記的擴增帶型清晰,區分明顯(圖1),擴增產物分子量在100~300 bp之間,其中序號1~7號(表4)標記是共顯性標記,8號是顯父顯性標記。這些多態性標記中,Xwmc619是在自交結實率BSA池中檢測到的,Xgwm311在兩個表型池中均檢測出多態性,其余6對均是在花粉可育率BSA池中檢測到的。
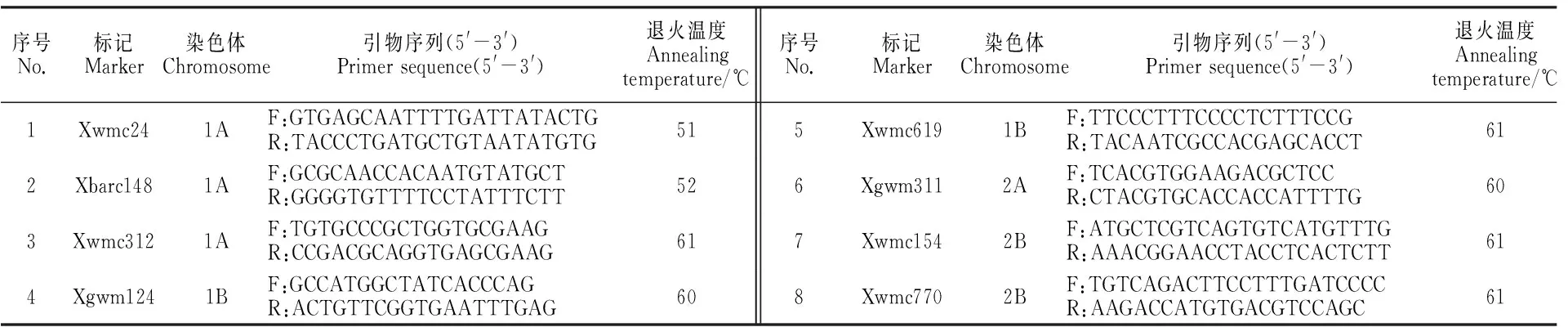
表4 親本和BSA池DNA中檢測的共分離SSR分子標記
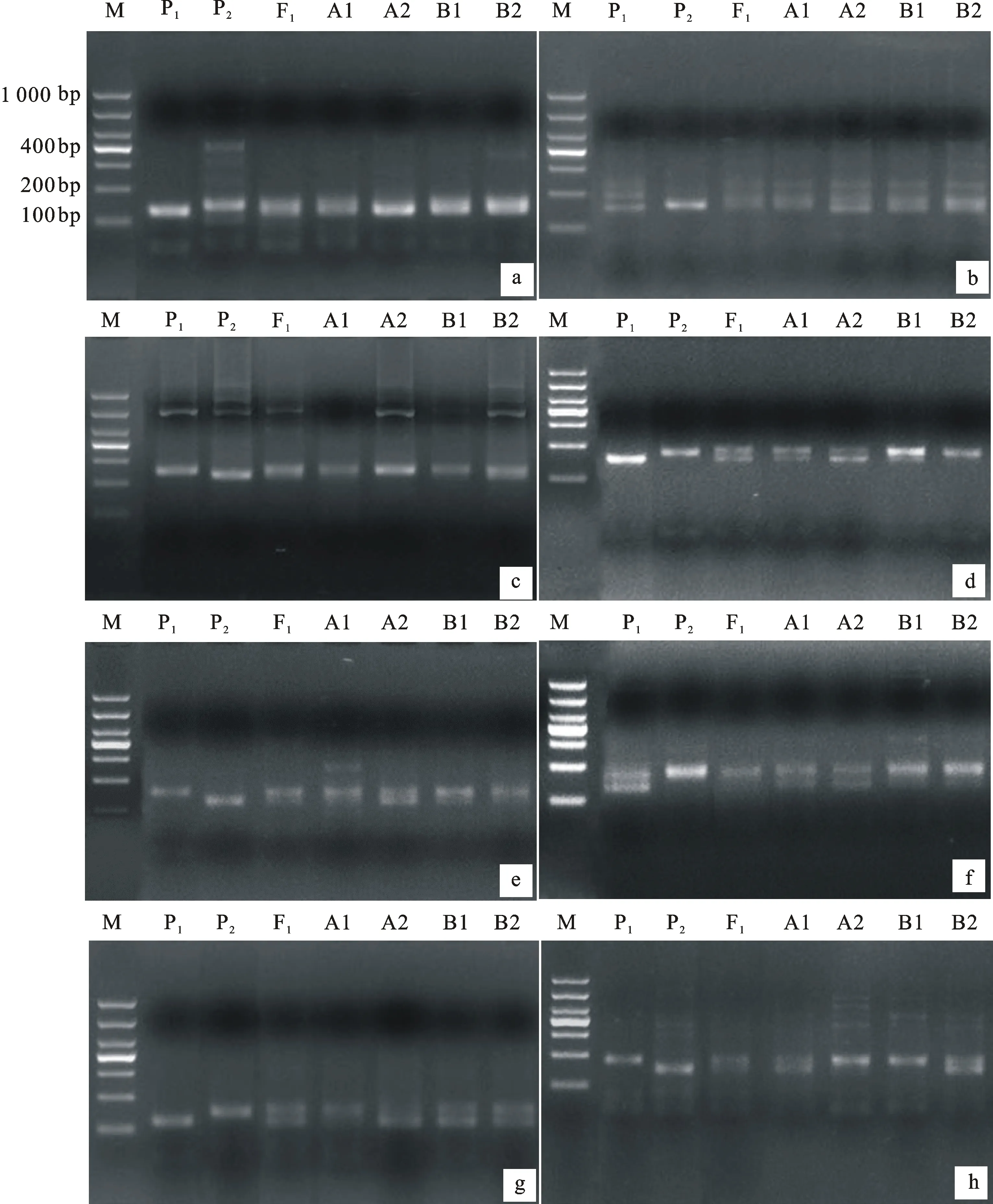
a~h分別表示分子標記引物Xwmc24、Xbarc14、Xwmc312、Xgwm124、Xwmc619、Xgwm311、Xwmc154和Xwmc770的擴增結果;M:DL1000;P1:BNS;P2:中國春;F1:BNS與中國春雜交F1代;A1:自交結實率不育池;B1:自交結實率可育池;A2:花粉可育率不育池;B2:花粉可育率可育池。
a-h indicate the amplication results of molecular marker Xwmc24,Xbarc14,Xwmc312,Xgwm124,Xwmc619,Xgwm311,Xwmc154 and Xwmc770,respectively;M:DL1000; P1:BNS; P2:Chinese Spring; F1:F1generation of BNS×CS; A1:Sterile pool of self seedsetting rate; B1:Fertile pool of self seedsetting rate; A2:Sterile pool of pollen fertility rate; B2:Fertile pool of pollen fertility rate.
圖1 8對多態性SSR標記引物在親本與BSA池中擴增的瓊脂糖凝膠電泳圖
Fig.1 Eight agarose gel electrophoresis of screening SSR molecular marker among BNS,Chinese Spring and BSA pools
2.5 恢復基因QTL檢測和初步定位
用具有多態性的8對SSR標記對F2群體總DNA擴增,結果顯示,標記的帶型保持清晰,產物分子量與BSA池篩選時保持一致,部分帶型圖譜見圖2。從圖譜上讀出的多態性標記基因型在Mapmaker/Exp 3.0b軟件上運行,結果是,1A染色體上Xwmc24和Xwmc312連鎖,2B染色體上Xwmc154和Xwmc770連鎖,與Somers的SSR圖譜連鎖關系[17]一致,但Xbarc148未檢測到與1A連鎖,1B上兩個標記Xgwm124和Xgwm311也未檢測到連鎖,這可能是標記間相距較遠的緣故。按照Somers的SSR圖譜連鎖關系,將Xbarc148添加到1A染色體上,Xgwm124與Xgwm311添加在1B染色體上,計算出相互間的遺傳距離,結果見表5。然后用WinQTLChart 2.5軟件處理表5遺傳距離數據,采用區間分析法檢測QTL位點,結果共發現5個QTL位點,1A染色體上2個,標記為 QTL1和 QTL2;1B染色體上2個,標記為 QTL3和 QTL4;2B染色體上1個,標記為 QTL5,其中, QTL1僅與自交結實率相關, QTL2和 QTL3僅與花粉可育率相關, QTL4和 QTL5與兩個表型性狀均相關,說明 QTL1是與授粉相關的位點, QTL2和 QTL3是與花粉發育相關的位點, QTL4和 QTL5與花粉發育和授粉均相關。這些QTL位點的遺傳特性參數見表6,從表6可看出,LOD值最小也為3.8, QTL1和 QTL4達10以上, QTL5是9.9,說明QTL的真實性很高。 QTL1、3、4、5均是加性和顯性效應,與張寶雷[8]測定的效應一致。根據這些位點的LOD值和遺傳效應,分析認為, QTL1、 QTL4和 QTL5應是主效QTL, QTL2和 QTL3是微效QTL。5個QTL位點和8個連鎖標記的連鎖圖見圖3。2A染色體上的連鎖標記Xgwm311沒有檢測到QTL位點。
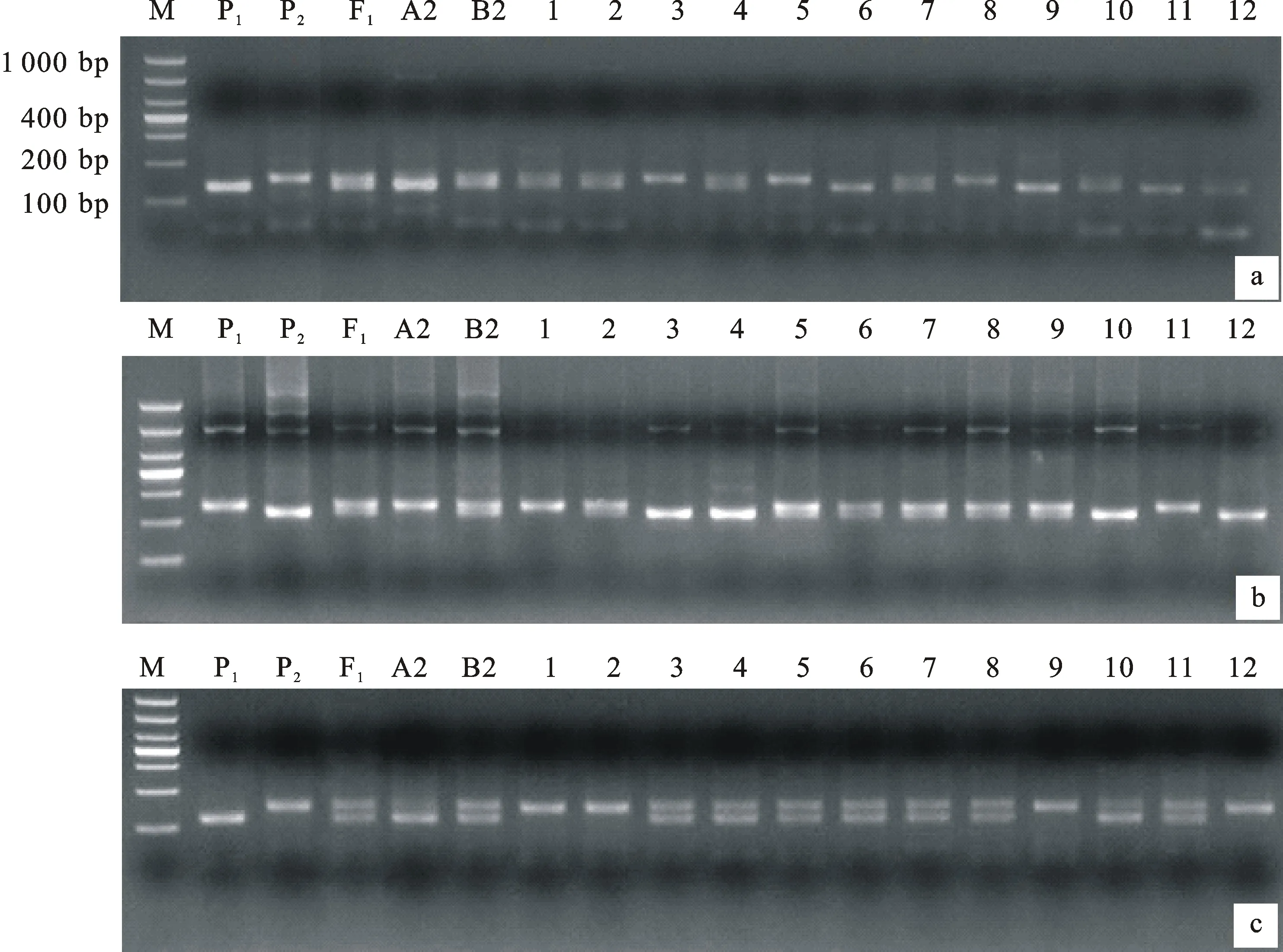
a~c分別表示標記Xwmc24、Xwmc312和Xwmc154的擴增結果; M:DL1000;P1:BNS;P2:中國春;F1:BNS與中國春雜交F1代;A1:自交結實率不育池;B1:自交結實率可育池;A2:花粉可育率不育池;B2:花粉可育率可育池;1~12:F2群體部分單株。
a-c indicate the amplication results of molecular marker Xwmc24,Xwmc312 and Xwmc154,respectively; M:DL1000; P1:BNS; P2:Chinese Spring; F1:F1generation of BNS×CS; A1:Sterile pool of self seedsetting rate; B1:Fertile pool of self seedsetting rate; A2:Sterile pool of pollen fertility rate; B2:Fertile pool of pollen fertility rate; 1-12:Part plants in F2population.
圖2 部分多態性標記在部分F2群體中的擴增結果
Fig.2 Amplication results of part polymorphic markers in part F2population
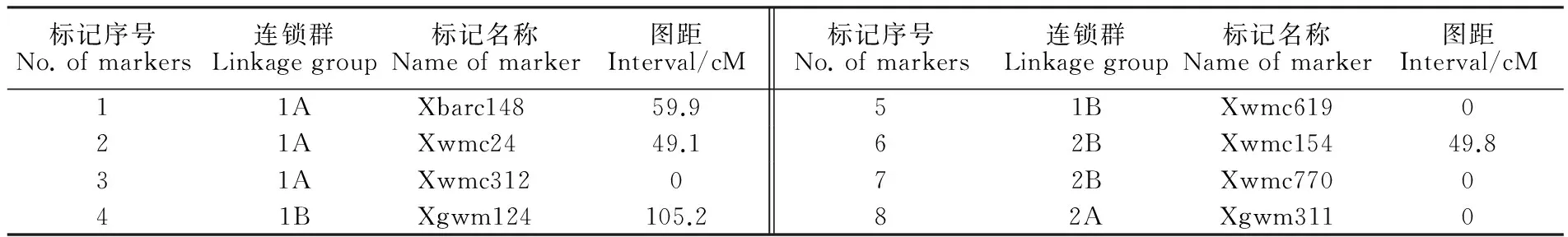
表5 8個連鎖標記的Mapmaker/EXP 3.0b連鎖圖距
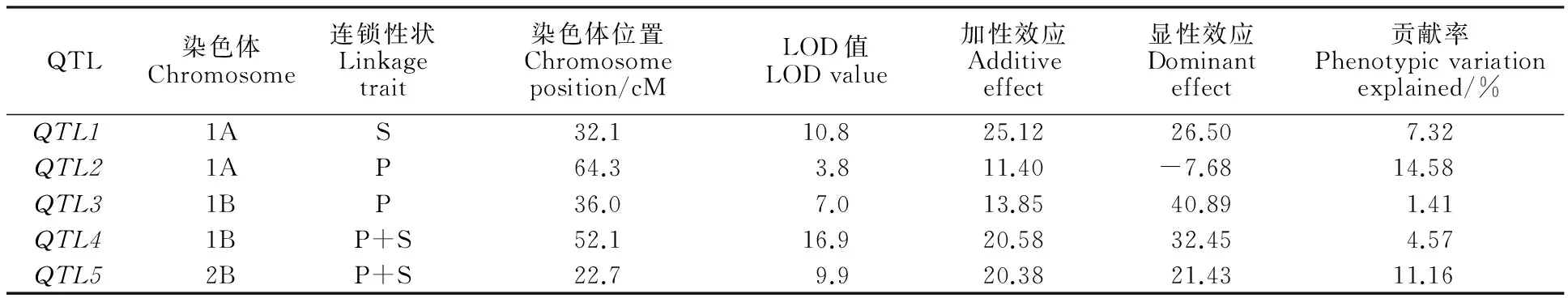
表6 WinQTLCart 2.5檢測的5個QTL及遺傳特性參數
連鎖性狀列中,P指花粉可育率,S指自交結實率。
In the column of linkage character,P refers to the pollen fertility rate,and S refers to the self seedsetting rate.

圖3 中國春恢復BNS育性基因的QTL位點和連鎖標記位點遺傳圖譜
3 討 論
3.1 關于在中國春缺四體檢測到的4個與恢復相關的連鎖群
關于BNS的不育和恢復機制,如果看作是隱性核不育,那么恢復基因應是不育的等位基因,但大多數可育的小麥品種不能恢復BNS的育性,因此非等位恢復的推斷更加合理[10]。中國春是BNS的高恢復系,應具有恢復BNS育性的主效基因,因此中國春的缺四體能夠檢測出恢復基因所在的染色體。從本研究結果可以看出,中國春的缺四體本身自交結實率,除N5D-T5A、N4A-T4B和N4A-T4D較低,分別為39.00%、54.29%和44.51%外,其余缺四體均在60.00%以上,但F1的組合自交結實率顯著下降,一些如以N1B-T1A、N2B-T2D為父本的組合,不育性達到BNS的水平,顯然結實率的下降是由于缺失染色體引起的,因此可以推測,缺失的染色體上攜帶有恢復的相關基因。根據結果,從該途徑檢測的4個染色體1B、2B、1A和7B缺四體與BNS雜交F1自交結實率低,3年表現穩定,因此認為這些染色體上載荷有BNS的恢復基因或重要相關基因。
3.2 關于BSA池篩選出的8對連鎖分子標記
為了進一步定位恢復基因,檢測和發現連鎖標記是有效途徑。用該4個相關連鎖群染色體,加上育性不穩定的2個連鎖群染色體,以及2個對照染色體共8個染色體,222對SSR引物,在2對共4個BSA池篩選,結果在3個相關的連鎖群上篩選到8對連鎖標記,這些標記,既是進一步檢測QTL的連鎖標記位點,也是恢復性選擇時可利用的連鎖標記。
篩選到的8對連鎖標記,其中7對位于3個相關連鎖群上,1對位于育性不穩定的2A染色體上,其余染色體,包括育性不穩定的5D染色體和非相關染色體,均未篩選到連鎖標記,這一方面說明缺四體檢測的可信性,另一方面也說明表型不穩定的材料也有遺傳基礎,但該遺傳基礎是否是真正的恢復基因,需要F2群體分離來證實。另外,缺四體檢測的相關染色體7B上沒有檢測到連鎖標記,該現象的出現有些意外,該現象是由于檢測的SSR分子標記密度不夠,還是缺四體檢測環節出現假陽性,需后續進一步研究。
在篩選連鎖標記時,建立了兩種類型BSA池,這是因為在表型調查時,發現群體中部分個體自交結實率和花粉可育率兩個表型不一致。自交結實率和花粉可育率不是同一概念[22],但都是雄性不育的重要指標。從結果也可看出,在兩種類型BSA池中分別篩選到不同連鎖標記,在自交結實率池中檢測到Xwmc619/1B和Xgwm311/2A 2對連鎖標記,在花粉可育率池中,除Xwmc619/1B標記外,7對標記均被檢測出來,這說明花粉可育率池靈敏度更高,但也有重大缺陷,它沒有檢測出重要的Xwmc619/1B標記,因此,對恢復基因分子標記的篩選來說,兩種類型BSA池都是必需的。
3.3 關于F2作圖群體檢測到的5個QTL位點
8對連鎖SSR標記在F2群體中檢測到5個QTL位點,其中, QTL1、 QTL4和 QTL5與自交結實率相關,認為是主效恢復基因位點,4個與花粉可育率相關的位點,除2個與自交結實率重疊,是主效位點外,另2個 QTL2和 QTL3屬微效位點。需要指出的是,這些位點的重要性是根據LOD值確定的,但它們連鎖的基因的確切作用需要進一步檢測之后才能確定。在QTL的數目上,由于中國春是BNS的高恢復系,F1相對中國春恢復度在85.0%左右,因此,理論上,具有多數位點,但不具備全部位點,因此BNS的完全恢復,除上述位點外,還應有一些微效恢復位點存在。王茂婷[12]用BNS×山農555025的F2為作圖群體,檢測到14個QTL,分布在1A、1B、4A、4B和7B染色體上,而中國春中并沒有檢測到4A、4B染色體上有恢復位點,而檢測到2B染色體上的恢復位點。2B染色體缺四體組合F1不育性很低,3年結果一致,因此,2B染色體是恢復的一個主效位點染色體。這些相同和不同,還需今后更多的檢測來證實。
另外,檢測的QTL數目的結果和作圖群體估計的基因數目基本一致。結果中顯示利用F2分離數據估計恢復基因數目,與自交結實率相關是2個主效基因,與花粉可育率相關是3個基因,檢測的QTL位點,分別是3個和4個。由于表型是基因綜合作用的結果,因此,基因數目估計值一般偏小。
檢測的恢復多位點還有一個重要意義,就是可解釋BNS的完全恢復系較少的原因。目前報道的正常可育的小麥品種,能完全恢復BNS的育性的品種較少[5,9-10]。分析認為這是由于對BNS不育性的完全恢復,上述位點以及未檢測到的位點都必須是顯性狀態,或者說對恢復的有效狀態才能實現,因此在此之前沒有進行過恢復性選擇的小麥品種中,恢復位點全部是顯性狀態的基因型,理論概率比較小,各種恢復性能力品種的比率應是恢復位點數的隨機組合概率。
根據以上討論,本研究從連鎖群檢測,到SSR連鎖標記篩選,到QTL定位,3個環節相互聯系,相互支撐,得到的結果相互印證,與數量遺傳的基因對數估計的結果也吻合,因此認為檢測的連鎖群和定位的QTL有較高可靠性。但還有一些問題需深入研究和回答,如中國春是高恢復系,但不是完全恢復系,因此定位的位點不是全部位點,今后需用恢復度更高的恢復系與BNS雜交建立作圖群體,整合定位位點;7B染色體是否是恢復相關連鎖群需進一步檢測;還有如BNS與中國春F1中的一些組合,缺少1對染色體即幾乎完全不育,表現出重疊基因的性質;檢測的QTLs與分子標記之間的距離還較大等,這些現象,可能存在實驗假陽性或假隱性,也可能存在恢復基因靶基因的干擾,這些疑問需通過優化實驗方案和技術路線等方法來解決,如選用透氣性更好的紙袋減少套袋對授粉的影響,提高SSR分子標記篩選密度來提高QTLs與分子標記之間的連鎖強度等,準確檢測和定位BNS的恢復基因及位點。
[1]李羅江,茹振剛,高慶榮,等.BNS小麥的雄性不育性及其溫光特性 [J].中國農業科學,2009,42(9):3019-3027.
LI L J,RU Z G,GAO Q R,etal.Male sterility and thermo-photo sensitivity charaterisitics of BNS in wheat [J].ScientiaAgriculturaSinica,2009,42(9):3019-3027.
[2]張自陽,胡鐵柱,馮素偉,等.溫敏核雄性不育小麥BNS的育性轉換規律初探 [J].河南農業科學,2010(7):5-9.
ZHANG Z Y,HU T Z,FENG S W,etal.A preliminary study on fertility alteration of thermo-sensitive genic male sterile wheat line BNS [J].HenanAgriculturalSciences,2010(7):5-9.
[3]周美蘭,茹振鋼,駱葉青,等.兩系小麥不育系BNS雄性育性的轉換 [J].核農學報,2010,24(5):887-894.
ZHOU M L,RU Z G,LUO Y Q,etal.Male fertility transformation of two-line wheat sterile lines BNS [J].JournalofNuclearAgriculturalSciences,2010,24(5):887-894.
[4]李羅江,茹振鋼,高慶榮,等.小麥雄性不育系BNS及其雜種F1的育性分析 [J].麥類作物學報,2009,29(4):583-587.
LI L J,RU Z G,GAO Q R,etal.Analysis the fertility of male-sterile line BNS and its F1hybrids in wheat [J].JournalofTriticeaeCrops,2009,29(4):583-587.
[5]寧江權,茹振鋼,鄭煒君,等.BNS小麥雄性不育性及其恢復性的研究 [J].麥類作物學報,2011,31(4):642-647.
NING J Q,RU Z G,ZHENG W J,etal.Male sterility and restoration of thermo-photo-sensitive male sterile line BNS of common wheat [J].JournalofTriticeaeCrops,2011,31(4):642-647.
[6]范曉靜,馬小飛,王 震,等.小麥溫敏雄性不育系BNS的遺傳穩定性及恢復性 [J].西北農林科技大學學報(自然科學版),2015,43(4):53-58.
FAN X J,MA X F,WANG Z,etal.Hereditary stability and restoration of thermo-photo-sensitive male sterile line BNS of wheat(TriticumaestivumL.) [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition),2015,43(4):53-58.
[7]秦志英,楊 靖,馬亞朝,等.BNS小麥雄性不育系育性的穩定性和波動性 [J].西北農業學報,2013,22(4):39-43.
QIN Z Y,YANG J,MA Y C,etal.Stability and variability of male infertility of wheat BNS line [J].ActaAgriculturaeBoreali-occidentalisSinica,2013,22(4):39-43.
[8]張保雷,張衛東,高慶榮,等.溫光敏雄性不育小麥BNS育性的遺傳效應分析 [J].中國農業科學,2013,46(8):1533-1542.
ZHANG B L,ZHANG W D,GAO Q R,etal.Genetic analysis on male sterility of thermo-photo-sensitive male sterile line BNS in wheat [J].ScientiaAgriculturaSinica,2013,46(8):1533-1542.
[9]馬小飛,王 震,李雪垠,等.小麥溫光敏雄性不育系BNS育性恢復性測定及雜種優勢 [J].西北農業學報,2013,22(7):90-94. MA X F,WANG Z,LI X Y,etal.Restoring ability test and heterosis analysis of wheat thermo-photo-sensitive genic male sterile line BNS [J].ActaAgriculturaeBoteali-occidentalisSinica,2013,22(7):90-94.
[10]曹銀萍,楊 靖,茹振鋼,等.小麥溫敏雄性不育BNS的顯性不育和非等位顯性恢復特性觀察[R/OL].中國科技論文在線(http://www.paper.edu.cn/releasepaper/content/),2015:3-15. CAO Y P,YANG J,RU Z G,etal.Observation of the characteristics of dominant infertility and non-allelic dominant recovery on male sterile wheat BNS [R/OL].Sciencepaper Online(http://www.paper.edu.cn/releasepaper/content/),2015:3-15.
[11]XING Q H,RU Z G,ZHOU C J,etal.Molecular tagging and mapping of the thermo-sensitive genic male-sterile gene( wtms1) in wheat [J].TheoreticalandAppliedGenetics,2003,107(8):1500-1504.
[12]王茂婷.BNS小麥雄性不育性恢復基因遺傳特性和QTL初步定位 [D].山東:山東農業大學,2011:41.
WANG M T.Genetic analysis and QTL priliminary mapping for fertility of BNS [D].Shandong:Shandong Agricultural University,2011:41.
[13]王風平,梅明華,徐才國,等.光敏核不育水稻農墾58S與正常品種“農墾58”在 pms1區段無育性基因分離 [J].植物學報,1997,39(10):922-925.
WANG F P,MEI M H,XU C G,etal. Pms1 is not the locus relevant to fertility difference between the photoperiod-sensitive male sterile rice Nongken 58S and normal rice “Nongken 58” [J].ChineseBulletinofBotany,1997,39(10):922-925.
[14]CHEN D H,RONALD P C.A rapid DNA minipreparation method suitable for AFLP and other PCR applications [J].PlantMolecularBiologyReporter,1999,17(1):53-57.
[15]MICHELMORE R W,PARAN I,KESSELI R V.Identification of markers linked to disease-resistance genes by bulked segregant analysis:a rapid method to detect markers in specific genomic regions by using segregating populations [J].ProceedingsoftheNationalAcademyofSciences,1991,88(21):9828-9832.
[16]R?DER M S,KORZUN V,WENDEHAKE K,etal.A microsatellite map of wheat [J].GeneticsSocietyofAmerica,1998,149(14):2007-2023.
[17]SOMERS D J,ISAAC P,EDWARDS K.A high-density microsatellite consensus map for bread wheat(TriticumaestivumL.) [J].TheoreticalandAppliedGenetics,2004,109(16):1105-1114.
[18]何蓓如,董普輝,宋喜悅,等.小麥溫度敏感不育系A3314溫敏特性研究 [J].麥類作物學報,2003,23(1):1-6.
HE B R,DONG P H,SONG X Y,etal.Study on the thermo-sensitivity male sterile wheat line A3314 [J].JournalofTriticeaeCrops,2003,23(1):1-6.
[19]王竹林,楊 睿,楊興圣,等.Mapmaker 3.0和作圖軟件使用 [J].實驗室研究與探索,2012,31(11):62-65.
WANG Z L,YANG R,YANG X S,etal.The use of mapmaker 3.0 and mapping software [J].ResearchandExplorationinLaborator,2012,31(11):62-65.
[20]WANG S,BASTEN C J,ZENG Z B.Windows QTL Cartographer 2.5 [EB/OL].Department of Statistics,North Carolina State University,Raleigh,NC.[2015-10-16]http://statgen.ncsu.edu/qtlcart/WQTLCart.htm.
[21]劉仁虎,孟金陵.MapDraw,在Excel中繪制遺傳連鎖圖的宏 [J].遺傳,2003,25(3):317-321.
LIU R H,MENG J L.MapDraw:a microsoft excel macro for drawing genetic linkage maps based on given genetic linkage data [J].Hereditas,2003,25(3):317-321.
[22]姚克敏,劉 梅,袁潛華.水稻不育系育性觀察指標套袋自交結實率和花粉可育度的比較分析 [J].雜交水稻,1998,13(4):23-25.
YAO K M,LIU M,YUAN Q H.Comparison of bagged seed set with pollen fertility in observing the fertility of male sterile rice [J].HybridRice,1998,13(4):23-25.
Detection of Linkage Groups and Location of QTLs in Chinese Spring for Restorer Wheat BNS Male Sterility SUN Huihui1,YANG Jing1,2,WEI Xiao1,FU Qingyun1,
CAO Yinping1,RU Zhengang1,LI Youyong1
(1.Henan Institute of Science and Technology/Key Discipline Opening Laboratory of Crop Molecular Breeding of Henan Province/Collaborative Innovation Center of Modern Biological Breeding,Xinxiang,Henan 453003,China; 2.College of Agronomy,Sichuan Agricultural University,Chengdu,Sichuan 611130,China)
BNS is a new type of thermo-sensitive wheat male-sterile line,and has excellent sterility and convertibility by itself. It is of important value for the utilization of hybrid wheat and the research of genetic resources. In order to locate the restorer gene of BNS,wheat Chinese Spring(CS),a high restorer line for BNS,was selected as parent material to reform an F2population by crossing over BNS. In the detection,two bulked segregant analysis(BSA) pools of phenotypes,the self-seedsetting rate and pollen fertility rate were established. First,the linkage groups related to restorer gene(s) were detected by Chinese Spring nulli-tetrasomes. Then,SSR molecular markers on these linkage groups were used to screen two BSA pools,and the linked markers obtained in screening were used to screen F2population to detect QTL loci of restorer gene(s). The results showed that when CS nulli-tetrasomes was crossed over BNS,there were four recombinations in F1to be pulled into low self-seedsetting rate,meaning that the four linkage groups on chromosomes 1B,2B,1A and 7B were relative to the recovery of BNS. When 222 pairs of SSR primers from 8 chromosomes were used to screen two phenotypes BSA pools,it was found that there were eight SSR markers on three linkage groups on chromosomes 1B,2B and 1A,which are linked with the restoration of BNS. These eight linkage markers then were used for screening 210 individual plants of F2population,and five QTL loci were found. Of them,one QTL was relative to self seedsetting rate only,and two major QTLs were relative to two phenotypes,and two minor QTLs were relative to fertile pollen rate only,which were located on chromosomes 1A,1B and 2B,respectively. These results laid a value foundation for MAS(marker-assisted selection) and fine mapping of BNS restorer genes.
Wheat; BNS male sterility; Restorer gene; SSR molecular marker; QTL locus
時間:2016-07-07
2015-12-03
2016-03-30
河南省基礎與前沿計劃重點項目(122300410011,162300410136)
E-mail:vip.sunhui@qq.com(孫慧慧);yangjing228@foxmail.com(楊 靖,與第一作者同等貢獻)
李友勇(E-mail:liyouyong@163.com)
S512.1;S330
A
1009-1041(2016)07-0856-10
網絡出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20160707.1530.010.html

