茶黃素與EGCG抑制體內外β-淀粉樣蛋白1-42水平及其誘導的神經細胞氧化損傷
張靜,黃建安,2,3,蔡淑嫻,易曉芹,劉建軍,王英姿,田麗麗,劉仲華,2,3*
1. 湖南農業大學茶學教育部重點實驗室,湖南 長沙 410128;2. 國家植物功能成分利用工程技術研究中心,湖南 長沙 410128;3. 植物功能成分利用協同創新中心,湖南 長沙 410128
茶黃素與EGCG抑制體內外β-淀粉樣蛋白1-42水平及其誘導的神經細胞氧化損傷
張靜1,黃建安1,2,3,蔡淑嫻1,易曉芹1,劉建軍1,王英姿1,田麗麗1,劉仲華1,2,3*
1. 湖南農業大學茶學教育部重點實驗室,湖南 長沙 410128;2. 國家植物功能成分利用工程技術研究中心,湖南 長沙 410128;3. 植物功能成分利用協同創新中心,湖南 長沙 410128
通過模擬生理條件體外實驗,將β-淀粉樣蛋白1-42(Aβ42)與EGCG和4種茶黃素單體分別按照1∶1和1∶5比例進行孵育,采用硫黃素T熒光檢測β-折疊結構的生成量,結果表明,EGCG與茶黃素均能明顯降低β-折疊結構生成,從而抑制Aβ42聚集;此外,通過建立20μmol·L-1Aβ42誘導人神經母細胞瘤SH-SY5Y細胞損傷模型,將不同濃度的EGCG或茶黃素(10、50、100μmol·L-1)處理后,MTT法檢測細胞存活率,同時,檢測細胞內活性氧(ROS)、谷胱甘肽過氧化物酶(GSH-Px)及丙二醛(MDA)等抗氧化指標,結果表明,EGCG與茶黃素可抑制因Aβ42誘導SH-SY5Y細胞活力下降及氧化損傷。體內實驗中,通過10mg·kg-1·d-1的EGCG或茶黃素處理快速老化模型小鼠(SAMP8),10周后檢測小鼠血清Aβ42及晚期糖基化終末產物(AGEs)含量,結果表明,EGCG和茶黃素可顯著降低SAMP8小鼠血清中Aβ42及AGEs含量。本研究表明了茶黃素和EGCG可抑制Aβ42聚集纖維化及Aβ42導致的神經氧化損傷,從而對阿爾茨海默病具有一定保護作用。
EGCG;茶黃素;β-淀粉樣蛋白1-42;晚期糖基化終末端產物;SH-SY5Y細胞;SAMP8小鼠
阿爾茨海默病(Alzheimer’s desease,AD)作為最常見的老年癡呆病,早在一個世紀前已被歸為神經退行性疾病,AD的發病率僅次于心血管疾病及癌癥,成為第三大流行病[1]。AD致病因子的作用機制較為復雜,因此有不同假說解釋其發病機制,如基因假說、淀粉樣蛋白假說、氧化應激假說、炎癥機制學說、膽堿能學說等;雖然有關AD的細胞分子機制未完全明確,但大量基因、生物化學及分子生物學研究支持淀粉樣蛋白假說,淀粉樣蛋白假說認為,β-淀粉樣蛋白(Amyloid-β,Aβ)才是造成AD的罪魁禍首,腦內Aβ生成與清除之間失去平衡將使Aβ大量積累,這將是AD最主要的發病機理[2]。Aβ聚集將導致一系列問題,如炎癥、突觸損傷、tau蛋白聚集、氧化應激及細胞凋亡等[3]。Aβ聚集過程中將產生具有毒性的寡聚體和淀粉樣纖維,其富含穩定的β折疊(β-sheet)結構。同時,有研究表明糖基化終末產物(Advancedglycation end products,AGEs)可促進Aβ聚集并增強其穩定性[4],從而加劇AD的主要病理特征。
表沒食子兒茶素沒食子酸酯(Epigallocatechingallate,EGCG)和茶黃素(Theaflavins,TFs)分別是綠茶和紅茶中的主要功能成分。兒茶素占茶葉干重12%~24%,EGCG是兒茶素的主要成分之一,占兒茶素總量的50%~80%[5-6];紅茶中茶黃素一般以茶黃素(Theaflavin,TF)、茶黃素-3-沒食子酸酯(Theaflavin-3-gallate,TF-3-G),茶黃素-3'-沒食子酸酯(Theaflavin-3'-gallate,TF-3′-G)和茶黃素雙沒食子酸酯(Theaflavin-3, 3'-digallate,TF-DG)4種為主體成分,紅茶中茶黃素含量通常不超過2%,甚至低至0.3%[7]。較多研究表明[8-11],以EGCG為主的綠茶多酚類化合物以及紅茶提取物能直接與松散無折疊的淀粉樣蛋白相結合,從而促進其形成無毒性單體結構,而不是形成具有毒性的β-sheet結構;同時,茶多酚等功能活性成分對AD的神經細胞具有保護作用[12],表明了EGCG和茶黃素具有防治AD的潛能[13]。茶黃素和EGCG含有較多酚羥基結構,眾多研究已證實茶黃素及EGCG具有清除超氧陰離子、抑制脂質過氧化損傷等抗氧化功能[14-16];同時,有研究表明茶黃素與綠茶中EGCG抗氧化能力相當[17]。
本研究通過體外實驗構建Aβ42聚集化模型以及Aβ42誘導SH-SY5Y神經細胞氧化損傷模型,探討EGCG及茶黃素單體抑制蛋白聚集過程中毒性β-sheet結構生成,以及拮抗Aβ42神經毒性的作用。以茶黃素和EGCG干預快速老化模型小鼠(Senescence accelerated mouse-prone 8,SAMP8),進一步探究這些茶葉功能成分對AD模型小鼠體內Aβ42及AGEs抑制作用,以期為將茶葉開發成有效防治AD相關神經退行性疾病的藥物奠定基礎。
1 材料與方法
1.1儀器與材料
SH-SY5Y神經細胞購自上海生命科學研究院,SAMR1和SAMP8小鼠購自北京大學醫學部,茶黃素單體(TF、TF-3-G、TF-3′-G、TF-DG,含量>98%,北京工商大學提供,EGCG(純度≥98%)購自長沙飛拓植物制品公司,茶黃素混合物(>68%)由湖南農業大學茶學重點實驗室提供,Aβ42蛋白(純度≥95%)購自上海吉爾生化,胎牛血清、DMEM高糖培養基購自Hyclone,MTT、DMSO、硫磺素-T(Thioflavin T,ThT)、六氟異丙醇(Hexafluoroisopropanol,HFIP)購自Sigma,DCFH-DA活性氧(ROS)探針、谷胱甘肽過氧化物酶(GSH-Px)、丙二醛(MDA)檢測試劑盒、BCA法蛋白質檢測試劑盒購自南京建成科技有限公司,小鼠Aβ42檢測試劑盒購自北京樂博生物科技有限公司。
SKY-200B搖床、水浴鍋、Christ ALPHA 1-2 LD冷凍干燥機、Thermo Scientific Varioskan Flash光譜掃描多功能酶標儀,LDZX-50KB立式壓力蒸汽滅菌器、Nuaire CO2培養箱、SW-CJ-2FD型雙人單面凈化工作臺、MIKRO-22R型冷凍離心機。
1.2實驗方法
1.2.1ThT熒光檢測EGCG和茶黃素抑制Aβ42聚集
ThT與含β-sheet結構的分子相結合后可發出熒光,發射光譜呈現紅移特點,通過ThT檢測的熒光強度可得知被測分子中β-sheet結構的相對含量,ThT熒光探針法是檢測蛋白質聚集纖維化過程中產生的β-sheet結構較為理想的方法[18]。
每0.5 mg Aβ42加入250μL HFIP溶解過夜后預凍2~3 h,冷凍干燥,Aβ42干粉用少量DMSO溶解。本試驗各組Aβ42終濃度為30μmol·L-1,藥物干預組分別加入濃度為30μmol·L-1(1×)和150μmol·L-1(5×)的EGCG、TF、TF-3-G、TF-3′-G、TF-DG,各組由PBS(pH7.2)配成1.5mL總體系,置于180 r·min-1,37℃搖床進行孵育;于0、2、4、8、12、24、48、72 h不同時間點取樣檢測,96孔板中每孔40μL樣品+160μL 40μmol·L-1ThT(用50mmol·L-1甘氨酸溶解配制,pH8.5),激發波長440nm(band pass 5nm),發射波長485nm于全自動酶標儀檢測熒光值[19]。
1.2.2細胞培養
SH-SY5Y細胞用含10%胎牛血清的DMEM高糖(4.5mmol·L-1)培養基培養于CO2培養箱中,CO2濃度5%,溫度37℃;兩天換液1次,當融合度達到80%~90%,用0.25%胰酶消化后吹散成1×106mL-1細胞懸液,接種于細胞培養板。
1.2.3藥物濃度選擇及細胞模型的建立
Aβ42蛋白溶解于DMSO中,配制成濃度為1mmol·L-1母液,加入前用培養基稀釋成20μmol·L-1的Aβ42工作液。
將SHSY-5Y細胞以密度為104個/孔種于96孔板,待細胞融合率為50%~60%,加藥組先加入不同濃度EGCG、TF、TF-3-G、TF-3′-G、TF-DG(10、50、100μmol·L-1),6 h后去培養基加入20μmol·L-1Aβ42培養48 h;Aβ42模型組加入20μmol·L-1Aβ42以及Control對照組加入培養基同時培養48 h;各組均設4~5個復孔。
MTT檢測細胞活力,每孔加入5 mg·mL-1的MTT 20μL,37℃孵育4 h,吸棄MTT后加入100μL DMSO,置37℃搖床中數分鐘,待紫色結晶溶解后,于全自動酶標儀檢測OD值,檢測波長為570nm。
1.2.4細胞內活性氧ROS檢測
參考步驟1.2.3將SH-SY5Y細胞經Aβ42或藥物處理后,經PBS洗滌3次,加入原培養基稀釋的10μmol·L-1DCFH-DA,37℃孵育40min,細胞經原培養基洗3次后用0.25%胰酶消化并收集;PBS洗滌細胞2次(1 000 r·min-1,10min),細胞重懸于PBS中,于全自動酶標儀上檢測熒光強度(激發波長為488nm,發射波長為525nm)。
1.2.5細胞內MDA、GSH-PX活性檢測
將SH-SY5Y細胞用PBS洗滌2~3次,胰酶消化收集后置于冰上超聲裂解(重復3次,每次5 s),將細胞懸液按照試劑盒操作說明,分別檢測細胞中MDA、GSH-PX含量。
1.2.6快速老化模型小鼠分組給藥
快速老化模型小鼠SAMP8,對照小鼠SAMR1,雄性,12周齡。小鼠自由飲食普通飼料,在安靜、通風、清潔環境下,飼養環境溫度22~25℃,相對濕度40%~60%。采用每只小鼠單籠飼養的方式,飼養1周后,將小鼠隨機分為4組(每組6只):正常對照組(SAMR1,R1)、模型組(SAMP8,P8),EGCG組(P8+EGCG)及茶黃素組(P8+TFs),加藥組劑量為10mg·kg-1·d-1,SAMR1組和SAMP8組灌胃等量的蒸餾水,連續灌胃10周。
1.2.7實驗取材及相關指標檢測
實驗中,定期記錄各組小鼠的體質量、飲水量和進食量。實驗結束時,各組小鼠禁食12 h,摘眼球取血,全血離心(3 500 r·min-1,4℃,10min)并收集血清。試劑盒檢測血清中Aβ42含量;于全自動酶標儀(激發波長為370nm,發射波長為440nm)檢測血清中AGEs含量[20-21]。
1.3數據分析
實驗重復次數至少3次,所有數值以平均值±標準誤表示;實驗數據用SPSS 18.0統計軟件進行統計分析,采用ANOVA進行單因素方差分析。
2 結果與分析
2.1EGCG和茶黃素對Aβ42聚集過程中β-sheet生成的影響
通過構建不同濃度茶黃素、EGCG與Aβ42共同孵育的反應體系,孵育過程中于不同時間點取樣進行ThT熒光檢測。因ThT檢測的熒光強度反映了Aβ42聚集水平,因此,從結果(圖1-A)可知,在72 h內,Aβ42模型組ThT熒光值一直處于上升趨勢,表明Aβ42中β-sheet結構在不斷生成,聚集化水平不斷增加;然而,在0~24 h之間,各加藥組聚集化水平呈加速上升趨勢,直至24 h,聚集化水平開始進入平穩期。取48 h時間點作為代表,將各組ThT熒光值作柱形圖(圖1-B),綜合圖1-A分析可知,與Aβ42模型組相比,各加藥組均顯著降低了β-sheet結構的生成,從而抑制Aβ42聚集纖維化;同時,5×加藥組抑制效果比1×加藥組更加明顯,其ThT熒光值約為1×加藥組的一半(圖1-B)。各個單體成分之間比較分析,可大致得出不同成分之間存在的差異,整體而言,EGCG與同濃度的TFs相比,對Aβ42聚集過程中β-sheet結構生成的抑制效果更為顯著,甚至1×EGCG與5×TF效果相當。4種主要茶黃素單體成分之間相比,抑制Aβ42聚集化及β-sheet結構生成的作用大小排序大致為TF-DG>TF-3′-G>TF-3-G>TF。
2.2EGCG和茶黃素對Aβ42誘導SH-SY5Y細胞活力的影響
由圖2中MTT檢測結果可知,20μmol·L-1Aβ42處理48 h能顯著降低SH-SY5Y細胞的存活率,將細胞活力下降至58.87%。用不同濃度的EGCG或TFs處理6 h后,其神經細胞活力均存在不同程度提高。當EGCG和TFs濃度為10μmol·L-1或50μmol·L-1時,對Aβ42誘導細胞損傷具有一定緩解作用,提高SH-SY5Y細胞活力的效果較為顯著,且差異具有統計學意義(P<0.05或P<0.01);而當藥物濃度高達100μmol·L-1時,其對細胞活力提升作用并不顯著,差異無統計學意義,由此推測100μmol·L-1或較高濃度的EGCG或茶黃素可能超出藥物有效濃度范圍。綜合以上結果表明,在10~50μmol·L-1這一有效濃度范圍內,EGCG和TFs對Aβ42產生的神經毒性具有一定程度的拮抗作用,從而保護神經細胞。
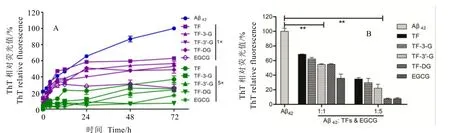
圖1 EGCG和TFs對Aβ42聚集化β-sheet生成的抑制作用Fig. 1 EGCG and TFs inhibit thegeneration of β-sheet in the aggregation of Aβ42
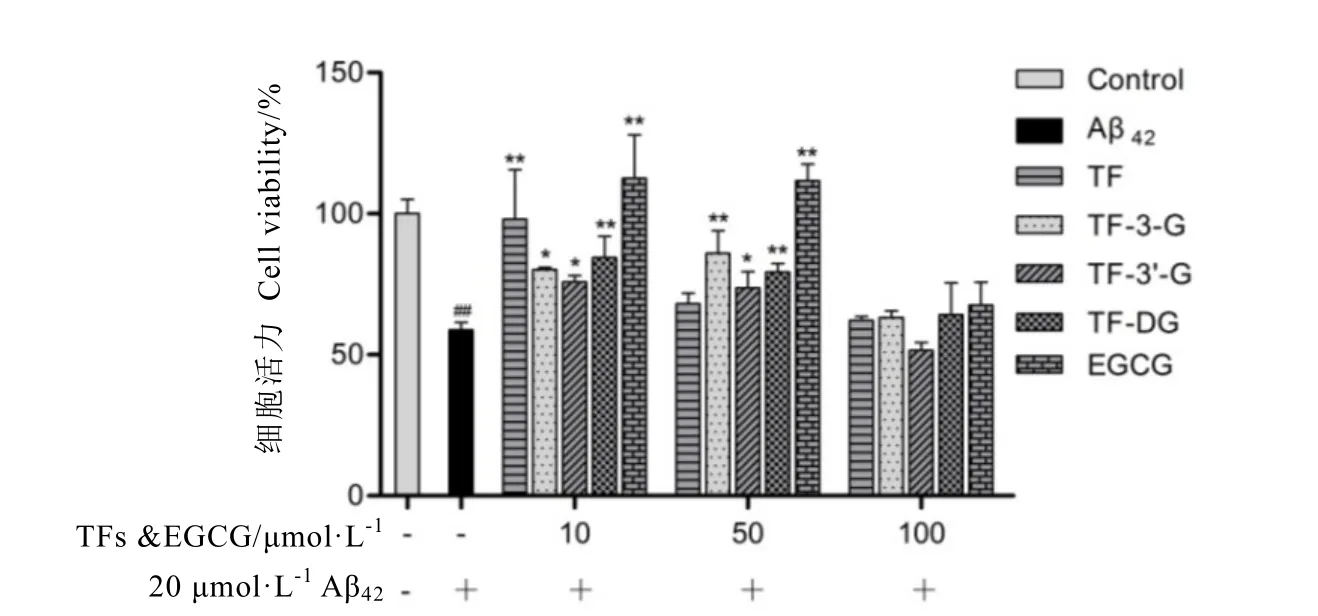
圖2 EGCG和TFs對Aβ42誘導損傷的SH-SY5Y細胞活力的影響Fig. 2 The effects of EGCG and TFs on the viability of SH-SY5Y cells injured by Aβ42
2.3EGCG和茶黃素保護Aβ42致SH-SY5Y細胞氧化損傷
當機體或細胞內遭受氧化應激損傷時,ROS和抗氧化系統將失去平衡。從圖3-A可知,Aβ42誘導的SH-SY5Y神經細胞內ROS熒光值顯著增加(與Control組相比,P<0.01);經EGCG和TFs處理后,ROS熒光值不同程度降低(與Aβ42誘導組相比,P<0.01),整體而言,EGCG抑制ROS產生或清除ROS能力強于TFs,EGCG組ROS熒光值甚至低于Control組。綜上結果表明,Aβ42處理SH-SY5Y細胞將增加細胞內ROS含量,10μmol·L-1EGCG或TFs能顯著抑制神經細胞內ROS的生成或清除細胞內過量的ROS。
GSH-Px為廣泛存在于機體內分解H2O2的主要氧化還原相關酶,其活性在一定程度上反映了機體內抗氧化水平。本實驗檢測了各組細胞內GSH-Px活性,圖3-B表明,Aβ42損傷組細胞內GSH-Px活性顯著下降(與Control組相比,P<0.01);而經10μmol·L-1EGCG或TFs處理后均能有效抑制GSH-Px活性下降(與Aβ42模型組相比,P<0.01);其中,TF和TF-3-G提高GSH-Px活性效果優于其他加藥組。MDA為脂質過氧化中產物之一,由圖3-C表明,各加藥組不同程度降低了因Aβ42誘導細胞產生的過量的MDA。
總之,EGCG和TFs可不同程度抑制Aβ42誘導SH-SY5Y細胞氧化應激。由結果可推測EGCG和TFs可能通過降低細胞內ROS和MDA含量,提高GSH-Px活性,從而對Aβ42誘導神經細胞氧化損傷產生保護作用,為細胞維持平衡的抗氧化系統并提供較為良好的氧化還原環境。
2.4EGCG和茶黃素對小鼠血清Aβ42及AGEs的影響
SAMP8小鼠是目前國內外用來研究AD機理方面應用較廣泛、較理想的模型小鼠,此模型小鼠具有明顯的AD病理特征。由圖4-A可知,SAMP8小鼠血清中Aβ42含量明顯高于SAMR1對照組(P<0.01),而灌胃茶黃素或EGCG后,小鼠血清中Aβ42呈明顯下降趨勢,且差異具有統計學意義(P<0.01)。
現大量研究已證實,體內AGEs不斷積累在AD發生與發展過程中起到至關重要的作用[22-23]。圖4-B表明EGCG和茶黃素均能顯著降低SAMP8小鼠血清中AGEs含量,兩者效果相當。
3 討論
本文通過體內外實驗,綜合驗證了茶葉中典型的功能成分EGCG和茶黃素4種主要單體控制Aβ42大量聚集纖維化和沉積,以及抑制Aβ42誘導神經細胞造成氧化損傷,為進一步證實茶葉功能成分具有緩解AD發病的效果提供理論依據。
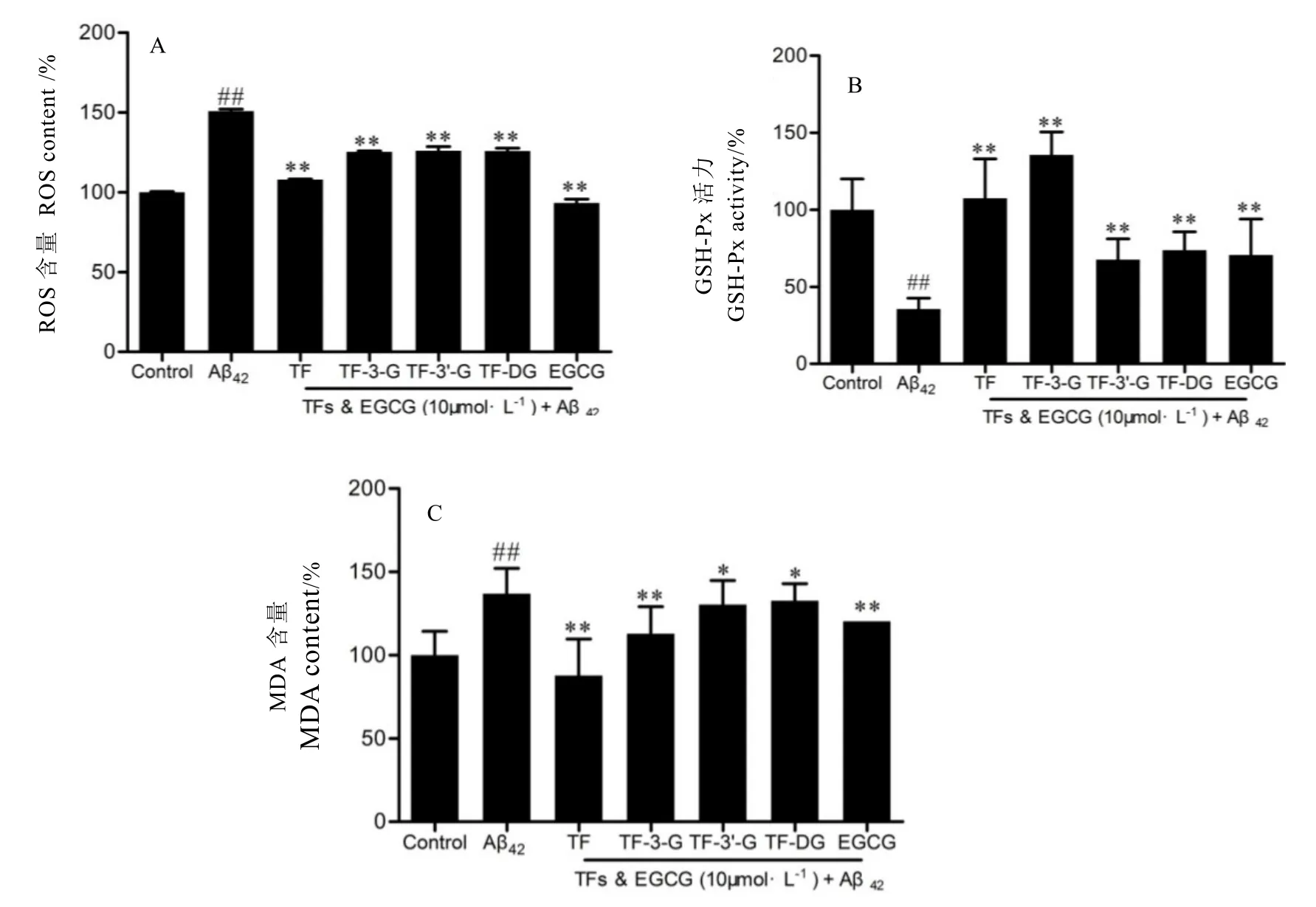
圖3 EGCG和TFs對Aβ42處理的SH-SY5Y細胞內ROS、GSH-Px和MDA含量的影響Fig. 3 The effects of EGCG and TFs on the contents of ROS, GSH-Px and MDA in SH-SY5Y cells injured by Aβ42
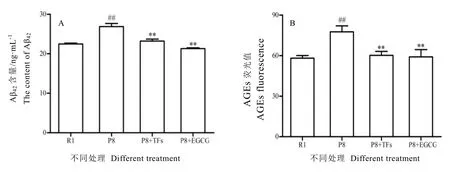
圖4 EGCG和TFs對SAMP8小鼠血清中Aβ42和AGEs含量的影響Fig. 4 The effects of EGCG and TFs on the contents of Aβ42and AGEs in SAMP8 serum
體外實驗通過30μmol·L-1Aβ42與不同濃度EGCG和茶黃素4種單體(TF、TF-3-G、TF-3′-G和TF-DG)分別以1∶1和1∶5的比例于模擬生理條件下共同孵育3 d,結果表明,幾種不同茶葉功能成分能不同程度阻抑蛋白聚集纖維化過程中β-sheet結構的生成,富含β-sheet結構的毒性寡聚體明顯減少,Aβ42聚集化水平也相應降低;EGCG和茶黃素對Aβ42聚集纖維化的抑制效果存在劑量依賴關系,其抑制效果從強到弱大致排序為EGCG>TF-DG>TF-3′-G>TF-3-G>TF。此外,本實驗構建體外細胞模型,將20μmol·L-1Aβ42誘導SH-SY5Y神經細胞48 h后,細胞活力下降至58.87%,從而成功建立Aβ42誘導SH-SY5Y神經細胞損傷模型;10μmol·L-1或50μmol·L-1EGCG和茶黃素對神經細胞預處理6 h后,不同程度提高了細胞活力,從而有效拮抗Aβ42導致神經毒性。同時,Aβ42可導致神經細胞氧化損傷,顯著提高ROS及MDA含量,并降低GSH-Px酶活力,EGCG和茶黃素能提高抗氧化酶GSH-Px活力并降低破壞氧化還原系統的ROS和脂質過氧化終末產物MDA,從而暗示著EGCG和茶黃素拮抗Aβ42導致的神經細胞損傷與其維護細胞內氧化還原系統平衡存在一定關系。整體而言,EGCG緩解Aβ42致神經細胞活力下降及氧化損傷的水平高于茶黃素4種主要單體,這與體外ThT熒光檢測EGCG及茶黃素抑制Aβ42聚集化的相關結果相符合。
有報道稱AD患者體內AGEs水平與同齡正常人相比升高了3倍[4],且AGEs積累可加速Aβ聚集從而加劇AD病癥。本實驗運用快速老化模型小鼠SAMP8作為AD動物模型,SAMR1作為對照組,SAMP8小鼠連續灌胃劑量為10mg·kg-1·d-1的EGCG和茶黃素混合物10周后,發現藥物干預組小鼠血清中Aβ42及AGEs水平均有所降低。因Aβ聚集為AD發病機制中較為典型的病理特征,且Aβ與AGEs在AD患者機體內具有協同作用,因此,由此推斷EGCG和茶黃素可能通過調控Aβ42和AGEs處于正常水平,從而緩解AD的發生與發展。
近年來,AD等神經退行性疾病嚴重影響著人們的健康生活,日益受到科研及醫學界的關注。Aβ作為AD的主要致病因子之一,成為國內外研究AD的焦點。茶葉作為最受歡迎的飲料之一,因其含有多酚類化合物而具有較多藥理功效;且茶多酚類化合物不僅具備抑制蛋白質聚集或寡聚體解聚等功能;還具有與AD發病機制相關聯的如抗氧化、清除自由基、神經保護等功能[24-25];因此,茶葉被開發為防治AD的藥物具有一定的潛力,并可能成為醫學研究的熱點。
[1] Schmaier A H. Alzheimer disease is in part a thrombohemorrhagic disorder [J]. Journal of Thrombosis and Haemostasis, 2016, 14(5): 991-994.
[2] Hardy J, Selkoe D J. The amyloid hypothesis of Alzheimer'sdisease: progress and problems on the road to therapeutics [J]. Science, 2002, 297(5580): 353-356.
[3] Fernandez-Echevarria C, Diaz M, Ferrer I, et al. Aβ promotes VDAC1 channel dephosphorylation in neuronal lipid rafts. Relevance to the mechanisms of neurotoxicity in Alzheimer’s disease [J]. Neuroscience, 2014, 278: 354-366.
[4] Vitek M P, Bhattacharya K, Glendening J M, et al. Advancedglycation end products contribute to amyloidosis in Alzheimer disease [J]. Proceedings of the National Academy of Sciences, 1994, 91(11): 4766-4770.
[5] da Silva Pinto M. Tea: A new perspective on health benefits [J]. Food Research International, 2013, 53(2): 558-567.
[6] Frei B, Higdon J V. Antioxidant activity of tea polyphenols in vivo: evidence from animal studies [J]. Journal of Nutrition, 2003, 133(10): 3275S-3284S.
[7] Balentine D A, Wiseman S A, Bouwens L C, et al. The chemistry of tea flavonoids [J]. Critical Reviews in Food Science & Nutrition, 1997, 37(8): 693-704.
[8] Bastianetto S, Yao Z X, Papadopoulos V, et al. Neuroprotective effects ofgreen and black teas and their catechingallate esters against β-amyloid-induced toxicity [J]. European Journal of Neuroscience, 2006, 23(1): 55-64.
[9] Grelle G, Otto A, Lorenz M, et al. Black tea theaflavins inhibit formation of toxic amyloid-β and α-synuclein fibrils [J]. Biochemistry, 2011, 50(49): 10624-10636.
[10] Bieschke J, Russ J, Friedirich R P, et al. EGCG remodels mature α-synuclein and amyloid-β fibrils and reduces cellular toxicity [J]. Proceedings of the National Academy of Sciences, 2010, 107(17): 7710-7715.
[11] Ehrnhoefer D E, Bieschke J, Boeddrich A, et al. EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers [J]. Nature structural & molecular biology, 2008, 15(6): 558-566.
[12] 高雄, 陳忠正, 張媛媛, 等. 茶葉活性成分對阿爾茨海默癥的神經保護作用研究進展[J]. 現代食品科技, 2015, 31(12): 416-425.
[13] 魏然, 徐平, 應樂, 等. 茶多酚對阿爾茨海默病的防治功能與機理研究進展[J]. 茶葉科學, 2016, 36(1): 1-10.
[14] Yang Z, Jie G, Dong F, et al. Radical-scavenging abilities and antioxidant properties of theaflavins and theirgallate esters in H2O2-mediated oxidative damage system in the HPF-1 cells [J]. Toxicology in Vitro, 2008, 22(5): 1250-1256.
[15] Halder J and Bhaduri A N. Protective role of black tea against oxidative damage of human red blood cells [J]. Biochemical and Biophysical Research Communications, 1998, 244(3): 903-907.
[16] 劉曉慧, 揭國良, 林康, 等. EGCG和茶氨酸對細胞氧化損傷的協同保護和修復作用研究[J]. 茶葉科學, 2014, 34(3): 239-247.
[17] Leung L K, Su Y, Chen R, et al. Theaflavins in black tea and catechins ingreen tea are equally effective antioxidants [J]. The Journal of Nutrition, 2001, 131(9): 2248-2251.
[18] 李松, 劉夫鋒, 余林玲, 等. 硫黃素T對淀粉樣β-蛋白質40聚集成核動力學的雙重影響[J]. 物理化學學報, 2016, 32(6): 1391-1395.
[19] 張靜, 蔡淑嫻, 黃建安, 等. 茶黃素對BSA/MDA羰-氨交聯反應體系中的蛋白質羰基化及其聚集化抑制作用研究[J]. 茶葉科學, 2016, 36(4): 363-371.
[20] Lee S J, Lee K W. Protective effect of (-)-epigallocatechingallate against advancedglycation endproducts-induced injury in neuronal cells [J]. Biological & Pharmaceutical Bulletin, 2007, 30(8): 1369-1373.
[21] Mustata G T, Rosca M, Biemel K M, et al. Paradoxical effects ofgreen tea (Camellia sinensis) and antioxidant vitamins in diabetic rats: improved retinopathy and renal mitochondrial defects but deterioration of collagen matrixglycoxidation and cross-linking [J]. Diabetes, 2005, 54(2): 517-526.
[22] Shuvaev V V, Laffont I, Serot JM, et al. Increased proteinglycation in cerebrospinal fluid of Alzheimer’s disease [J]. Neurobiology of aging, 2001, 22(3): 397-402.
[23] Loske C, Gerdemann A, Schepl W, et al. Transition metal-mediatedglycoxidation accelerates cross-linking of β-amyloid peptide [J]. European Journal of Biochemistry, 2000, 267(13): 4171-4178.
[24] 李大祥, 鮮殊, 楊衛, 等. 茶葉的神經保護作用研究進展[J]. 茶葉科學, 2011, 31(2): 79-86.
[25] 劉春芳. 表沒食子兒茶素沒食子酸酯抗氧化及神經元保護作用的研究進展[J]. 蚌埠醫學院學報, 2011, 36(10): 1163-1164.
Theaflavins and EGCG Protect SH-SY5Y Cells from Oxidative Damage Induced by Amyloid-β 1-42 and Inhibit the Level of Aβ42in vivo and in vitro
ZHANG Jing1, HUANG Jian'an1,2,3, CAI Shuxian1, YI Xiaoqin1, LIU Jianjun1, WANG Yingzi1, TIAN Lili1, LIU Zhonghua1,2,3*
1. Key Laboratory of Ministry of Education for Tea Science, Hunan Agricultural University, Changsha 410128, China; 2. National Research Center of Engineering Technology for Utilization of Botanical Functional Ingredients, Changsha 410128, China; 3. Collaborative Innovation Center of Utilization of Functional Ingredients from Botanicals, Changsha 410128, China
In this study, amyloid β-protein Aβ42was incubated with EGCG, TF, TF-3-G, TF-3'-G, TF-DG at the ratio of 1∶1 and 1∶5 under simulated physiological condition. The contents of β-sheets after incubation were tested by thioflavin T fluorometric assay. It was found that EGCG and theaflavins could suppress the formation of β-sheet structure, therebyinhibiting aggregations of Aβ42. In addition, an SH-SY5Y cell damage model was established and MTT assay was used to examine cell viabilities when 20μmol·L-1Aβ42was incubated with different concentrations of EGCG and theaflavins (10, 50, 100μmol·L-1). Intracellular reactive oxygen species (ROS) levels, antioxidant enzyme activities (GSH-Px) and MDA levels were also measured. The results showed EGCG and theaflavins treatments could alleviate the Aβ42induced oxidative damage to neural cells by reducing ROS and increasing the activity of GSH-Px. To study the in vivo protective effects of EGCG and theaflavins, SAMP8 mice were treated with 10mg·kg-1·d-1EGCG or theaflavins respectively bygavage for 10 weeks, and the contents of Aβ42and AGEs in mouse serum were determined. The results showed that EGCG and theaflavins significantly decreased the contents of Aβ42and AGEs in SAMP8 serum. In summary, EGCG and theaflavins could inhibit the aggregations of Aβ42and reduce oxidative injury induced by Aβ42in neural cells, thereby exerting protective effects on AD.
EGCG, theaflavins, amyloid-β 1-42, advancedglycation end products, SH-SY5Y cells, SAMP8 mice
TS272;Q946.8
A
1000-369X(2016)06-655-08
2016-08-08
2016-10-13
國家茶葉產業技術體系項目(CARS-23-11B)、湖南省植物功能成分利用協同創新項目(HNCR-2014003)、國家自然科學基金項目(31471590)、湖南省研究生科研創新項目(CX2015B245)。
張靜,女,博士,主要從事茶葉功能成分藥理研究。*通訊作者:larkin-liu@163.com

