果膠-殼聚糖多層修飾脂質體的制備及配方優化
白春清,鄭景霞,袁 璐,崔丹丹,陳麗麗,袁美蘭,趙 利,*
(1.江西科技師范大學生命科學學院國家大宗淡水魚加工技術研發分中心,江西南昌 330013;2.南昌大學食品科學與技術國家重點實驗室,江西南昌 330047)
?
果膠-殼聚糖多層修飾脂質體的制備及配方優化
白春清1,鄭景霞2,袁 璐1,崔丹丹1,陳麗麗1,袁美蘭1,趙 利1,*
(1.江西科技師范大學生命科學學院國家大宗淡水魚加工技術研發分中心,江西南昌 330013;2.南昌大學食品科學與技術國家重點實驗室,江西南昌 330047)
本研究利用殼聚糖、果膠對常規脂質體進行先后修飾構建果膠-殼聚糖多層修飾脂質體(pectin-chitosan coated liposomes,Pe-Ch-Liposomes),以番茄紅素為模型藥物,系統研究了主要因素對多層修飾脂質體包封率和濁度的影響,并以包封率為指標優化配方。結果表明果膠溶液與殼聚糖溶液的體積及濃度配比均對多層修飾脂質的包封率及濁度有一定的影響,且多層修飾過程可降低由卵磷脂與膽固醇質量比引起的包封率及濁度的差異。正交實驗結合單因素分析確定最佳配方為果膠殼聚糖體積比為2∶1,果膠-殼聚糖總濃度為0.2%∶0.2%,卵磷脂與膽固醇質量比為5∶1,番茄紅素添加量為2.5 mg。在此條件下制備的多層修飾脂質體的包封率(97.8%)顯著高于常規脂質體的包封率(85.4%);粒度分布較為集中,平均粒徑為1870.4 nm,多分散系數為0.231。
多層修飾脂質體,番茄紅素,果膠,殼聚糖
番茄紅素是植物中所含的一種天然色素,多存在于茄科植物西紅柿的成熟果實中。它是目前在自然界的植物中被發現的最強抗氧化劑之一,其淬滅單線態氧速率常數是維生素E的100倍,可以有效防治因衰老,免疫力下降引起的各種疾病,如炎癥、腫瘤等[1-2]。然而,番茄紅素對外界環境極為敏感,易發生降解及異構化,喪失生理活性;水溶性差,直接口服,生物利用度低。因此,開發高效包埋系統是拓展番茄紅素應用的關鍵。
常規脂質體是由磷脂等兩親性分子分散在水中形成的具有類似細胞膜脂質雙分子層結構的封閉囊泡。因結構的特殊性可包埋親水、親油及兩親性成分。且粒徑小、可控釋釋放、具有提高包埋物穩定性等特點,已被廣泛應用于生物醫藥、化工、食品加工等領域[2-5]。但常規脂質體穩定性差,長期放置易出現聚集、分層、包埋物滲漏等問題[6]。研究表明采用水溶性聚合物對其進行表面修飾可提高其穩定性,目前已有聚乙二醇、殼聚糖等單一聚合物修飾脂質體的大量報道。但由于修飾過程中脂質體與修飾層間的結合力較弱,修飾層結構松散,這種簡單修飾所形成的聚合物單層修飾脂質體的貯藏穩定性并不理想[7-9]。因此需要與其它材料復配,進行雙層或多層包埋以提高其穩定性。殼聚糖、果膠分別作為天然聚陽、陰離子多糖,因具有良好的乳化性、凝膠性等特性,備受研究者關注,是緩釋性載體的常用原料,多用于活性成分的包埋保護[10-15]。本研究擬以帶負電荷的脂質體為核心,利用果膠分子中的羧基(-COO-)與殼聚糖分子中的氨基(-NH3+)間靜電相互作用及復合作用,在常規脂質體表面進行雙層修飾制備殼聚糖、果膠多層修飾構建核殼結構脂質體[10,16]。據文獻[15-16]介紹包埋率、粒徑分布是衡量載體體系的重要指標,也是影響產品貯藏穩定性的重要因素。而前期預實驗發現包埋物的添加量、修飾材料的濃度及配比等因素不僅會影響修飾層的結構,進而影響其對包埋物的包埋效果及貯藏穩定性。
綜上,本研究擬利用殼聚糖、果膠二者正、負電荷靜電作用層層交替對采用乙醚注入法制備的常規脂質體進行先后修飾構建多層修飾脂質體。并以番茄紅素為包埋物研究層層包埋過程對其包埋效果的影響,研究配方中主要因素的影響,優化配方,為多層修飾脂質體開發為功能性成分載體提供參考依據。
1 材料與方法
1.1 材料與儀器
卵磷脂、膽固醇 上海藍季科技發展有限公司;殼聚糖、果膠、番茄紅素 上海阿拉丁生化科技股份有限公司;磷酸氫二鈉、磷酸二氫鈉、醋酸、無水乙醚 國藥集團化學試劑有限公司。以上試劑皆為分析純。
DF-101S集熱式磁力加熱攪拌器 鞏義市予華儀器有限責任公司;TGL-16G臺式離心機 上海菲恰爾分析儀器有限公司;TU-1810紫外可見分光光度計 北京普析通用儀器有限責任公司;HYL-1080激光納米粒度分析儀 丹東市皓宇科技有限公司;SKF-6超聲波發生器 上海科導超聲儀器有限公司。
1.2 實驗方法
1.2.1 Pe-Ch-Liposomes的制備 首先采用乙醚注入法制備常規脂質體(Liposomes),即以磷脂、膽固醇為膜材(質量比3∶1,總量40 mg)與番茄紅素完全溶于20 mL無水乙醚后,將其加入到40 mL pH7.0的磷酸緩沖液中,45 ℃下水合20 min(避光或用錫箔紙包裹)后,超聲30 min后,加水定容至40 mL得常規脂質體。然后取10 mL常規脂質體慢慢注入到殼聚糖醋酸溶液中,得殼聚糖修飾脂質體(chitosan-Liposomes,Ch-Liposomes),再將其緩慢注入到果膠溶液中得總體積為40 mL的Pe-Ch-Liposomes。
1.2.2 Pe-Ch-Liposomes的配方優化 首先采用單因素實驗分別考察果膠溶液與殼聚糖溶液體積比、果膠溶液與殼聚糖溶液濃度配比、卵磷脂與膽固醇質量比、番茄紅素添加量對Pe-Ch-Liposomes包封率和濁度的影響,并在此基礎上,選取影響較大的三個因素,以包封率為指標,采用正交實驗優化配方,并測定最優配方下樣品的包封率及粒徑。
1.2.3 果膠溶液與殼聚糖溶液體積比對Pe-Ch-Liposomes包封率及濁度的影響 設定果膠溶液與殼聚糖溶液體積比分別為1∶2、1∶1、3∶2、2∶1、3∶1、4∶1,在果膠溶液濃度與殼聚糖溶液濃度配比為0.2%~0.1%,卵磷脂與膽固醇質量比為3∶1,番茄紅素添加量為5 mg(每100 mL Pe-Ch-Liposomes)條件下制備Pe-Ch-Liposomes,分別測定樣品的包封率及濁度。
1.2.4 果膠溶液與殼聚糖溶液濃度配比對Pe-Ch-Liposomes包封率及濁度的影響 設定果膠溶液濃度與殼聚糖溶液濃度配比分別為0.3%∶0.2%、0.3%∶0.1%、0.2%∶0.2%、0.2%∶0.1%、0.1%∶0.05%、0.05%∶0.05%、0.05%∶0.01%,在卵磷脂與膽固醇質量比為3∶1,番茄紅素添加量為5 mg(每100 mL Pe-Ch-Liposomes)及1.2.3選定的果膠溶液與殼聚糖溶液體積比條件下制備Pe-Ch-Liposomes,分別測定樣品的包封率及濁度。
1.2.5 卵磷脂與膽固醇質量比對Pe-Ch-Liposomes包封率及濁度的影響 設定卵磷脂與膽固醇質量比分別為:1∶1、3∶1、5∶1、7∶1、9∶1,在番茄紅素添加量為5 mg(每100 mL Pe-Ch-Liposomes),1.2.3選定的果膠溶液與殼聚糖溶液體積比,1.2.4選定的果膠溶液濃度與殼聚糖溶液濃度配比條件下制備Pe-Ch-Liposomes,分別測定樣品的包封率及濁度。
1.2.6 番茄紅素添加量對Pe-Ch-Liposomes包封率及濁度的影響 設定每100 mL Pe-Ch-Liposomes中番茄紅素的添加量分別為:0.5、1.0、1.5、2.5、5、7.5、10 mg,在1.2.3選定的果膠溶液與殼聚糖溶液體積比,1.2.4選定的果膠溶液濃度與殼聚糖溶液濃度配比,1.2.5選定的卵磷脂與膽固醇質量比條件下制備Pe-Ch-Liposomes,分別測定樣品的包封率及濁度。
1.2.7 配方優化 根據單因素實驗的結果,選取影響較大的三個因素(A卵磷脂與膽固醇質量比、B果膠溶液與殼聚糖溶液體積比、C果膠溶液與殼聚糖溶液濃度配比),以包封率為指標按照表1進行正交實驗,優化配方,并測定最佳配方下樣品的包封率及粒徑分布。

表1 L9(33)工藝正交設計因素水平表Table 1 L9(33)orthogonal design factor level table
1.2.8 包封率的測定 準確移取2 mL番茄紅素脂質體,加入 2 mL正己烷,在3000 r/min下離心40 s,移取上清液;再次加入2 mL正己烷,于3000 r/min下離心40 s。如此重復2次,合并上清液于10 mL容量瓶中,以正己烷定容,于471 nm下檢測吸光度A0,對照標準曲線方程C=0.4375A0,計算游離番茄紅素質量C[17-18]。然后根據以下公式,計算番茄紅素脂質體的包封率,其中體系中番茄紅素總量為樣品中含有的番茄紅素總量來計算:
包封率(%)=[1-(游離番茄紅素/體系中番茄紅素總量)]×100
1.2.9 濁度的測定 取適量脂質體于比色皿中,以蒸餾水為空白測定樣品在500 nm處的吸光度,吸光度越大表示粒度越小。
1.2.10 粒徑的測定 取適量脂質體于比色皿中,采用HYL-1080激光納米粒度分析儀測定脂質體的粒徑大小和粒度分布。
1.3 數據的統計處理
實驗數據采用origin 8.0軟件進行繪圖,數值以3次實驗的均值±標準偏差表示。
2 結果與討論
2.1 果膠溶液與殼聚糖溶液體積比對Pe-Ch-Liposomes包封率及濁度的影響

圖1 果膠溶液與殼聚糖溶液體積比 對Pe-Ch-Liposomes包封率及濁度的影響Fig.1 The effects of pectin solution to chitosan solution volume ratio on the encapsulation efficiency and turbidity of Pe-Ch-Liposomes
圖1顯示不同果膠溶液與殼聚糖溶液體積比所制備的Pe-Ch-Liposomes的包封率在78.8%~85.4%之間,且當二者體積比低于2∶1時,隨著果膠溶液體積的增大包封率逐漸提高,之后果膠溶液體積的增加反而導致包封率降低,在二者體積比為2∶1時包封率出現最大值。樣品的濁度測定值越大,表示粒徑越小,從圖1也可發現改變果膠溶液與殼聚糖溶液體積比對濁度的影響較小,但其對濁度的影響與體積比對包封率的影響呈現相似的趨勢,即在體積比為2∶1時出現最大的濁度值,即此時樣品粒徑最小。前期(<2∶1)包封率的提高及粒徑的減小,說明殼聚糖修飾的脂質體雖能提高脂質體包封率,但所形成的修飾層較為松散,加入果膠,通過二者的靜電相互作用,發生交聯,使修飾層致密的同時將游離的番茄紅素包埋,提高了包埋率。而隨著果膠溶液添加量的提高,殼聚糖層裸露-NH3+被大量中和,果膠與殼聚糖間的靜電相互作用減弱,修飾層結構松散,從而引起粒徑變大。而過多果膠溶液的加入可能會導致修飾層脫落,其影響一方面會產生部分未修飾脂質體,降低體系粒徑;另一方面修飾層脫落的同時可能會連帶破壞脂質體雙分子層結構,引起被脂質雙分子層包埋的部分番茄紅素釋放,體系包埋率下降。
2.2 果膠溶液與殼聚糖溶液濃度配比對Pe-Ch-Liposomes包封率及濁度的影響
由于每次制備出的Pe-Ch-Liposomes總體積為40 mL,且果膠溶液與殼聚糖溶液體積比為2∶1,則果膠溶液-殼聚糖溶液濃度配比為0.05%∶0.01%,0.05%∶0.05%,0.1%∶0.05%,0.2%∶0.1%,0.2%∶0.2%,0.3%∶0.1%,0.3%∶0.2%分別對應最終制備出的Pe-Ch-Liposomes修飾層總質量濃度分別為:0.0275%,0.0375%,0.0625%,0.125%,0.15%,0.175%,0.2%。從圖2可以看出隨著修飾層總質量濃度的增加,包封率及濁度值均呈現先增大后降低的趨勢。即在一定濃度范圍內,修飾層濃度的增加有利于將游離的番茄紅素進行包埋,也促進修飾材料在脂質體表面形成更為致密的修飾層,導致包封率提高,粒徑變小。但修飾層增大到一定程度后,包封率和粒徑分別有所降低和升高,但包封率仍高于未修飾脂質體。這可能是源于果膠與殼聚糖間的相互連接更為緊密的同時,降低了殼聚糖與脂質體間的相互作用,致使在脂質體與殼聚糖層間包埋的番茄紅素有所滲漏,而殼聚糖與脂質體間作用力的降低,使二者之間的連接減弱,間距加大導致粒徑變大。
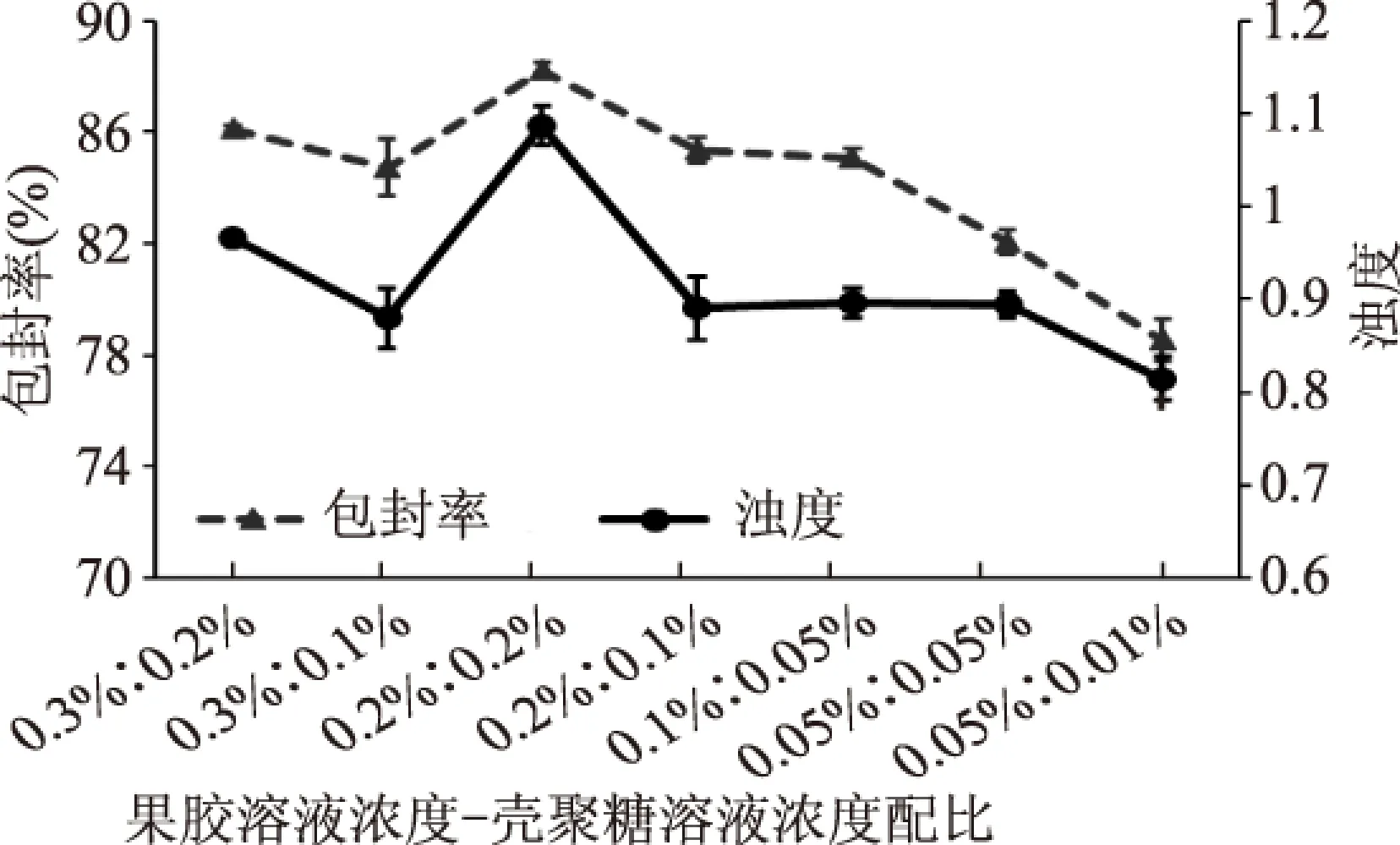
圖2 果膠溶液與殼聚糖溶液濃度 對Pe-Ch-Liposomes包封率及濁度的影響Fig.2 The effects of pectin solution and chitosan solution concentrations on the encapsulation efficiency and turbidity of Pe-Ch-Liposomes
從圖2也可看出,在果膠-殼聚糖濃度比例相同的條件下,提高果膠和殼聚糖濃度有利于提高包封率,同時降低粒徑大小。如當果膠與殼聚糖濃度比為1∶1時,果膠-殼聚糖濃度0.05%~0.05%和0.2%~0.2%制備的脂質體包封率分別為82.06%,88.23%。同時也說明當殼聚糖濃度一定時,在一定范圍內提高果膠的濃度,有利于提高包封率,而果膠濃度過大反而使包埋率降低:當殼聚糖溶液濃度為0.05%時,果膠溶液濃度為0.05%樣品的包封率小于果膠溶液濃度為0.1%樣品的包封率;當殼聚糖濃度增大至0.1%時,果膠溶液濃度為0.3%樣品的包封率略大于果膠溶液濃度為0.2%樣品的包封率;而殼聚糖溶液濃度為0.2%時,果膠溶液濃度為0.3%樣品的包封率小于果膠濃度為0.2%樣品的包封率;即殼聚糖溶液與果膠溶液的濃度及其配比是否合理大大影響保證脂質體的包封率。
2.3 卵磷脂與膽固醇質量比對Pe-Ch-Liposomes包封率及濁度的影響
圖3為不同的卵磷脂與膽固醇質量比制備的常規脂質體、殼聚糖修飾脂質體及Pe-Ch-Liposomes包封率數據分析圖。從圖3可得知,卵磷脂與膽固醇質量比對三種脂質體的包封率都有一定的影響,且其對常規脂質體的影響最大,當質量比為7∶1時常規脂質體包封率僅為28.2%,而質量比為5∶1時為86%。研究表明膽固醇具有加固脂質雙分子層膜,減弱膜的流動性,進而降低滲漏率的作用,前者(7∶1)較低的包封率,可能是因為膽固醇含量太低,導致脂質雙分子流動性大,容易受外界沖擊(超聲處理)降低包封率。同時也可發現脂質體表面修飾有利于提高包封率,雖然不同質量比制備的同一類脂質體間存在一定的差異,但隨著修飾層的增多都呈增大的趨勢,且由于卵磷脂膽固醇質量比導致的包封率差異隨著修飾層的增多逐漸變小。如經過果膠、殼聚糖共同修飾后的Pe-Ch-Liposomes包封率間沒有顯著性差異。這種現象說明在修飾過程可將游離的番茄的紅素包埋在各修飾層間及修飾層與脂質體間[6]。
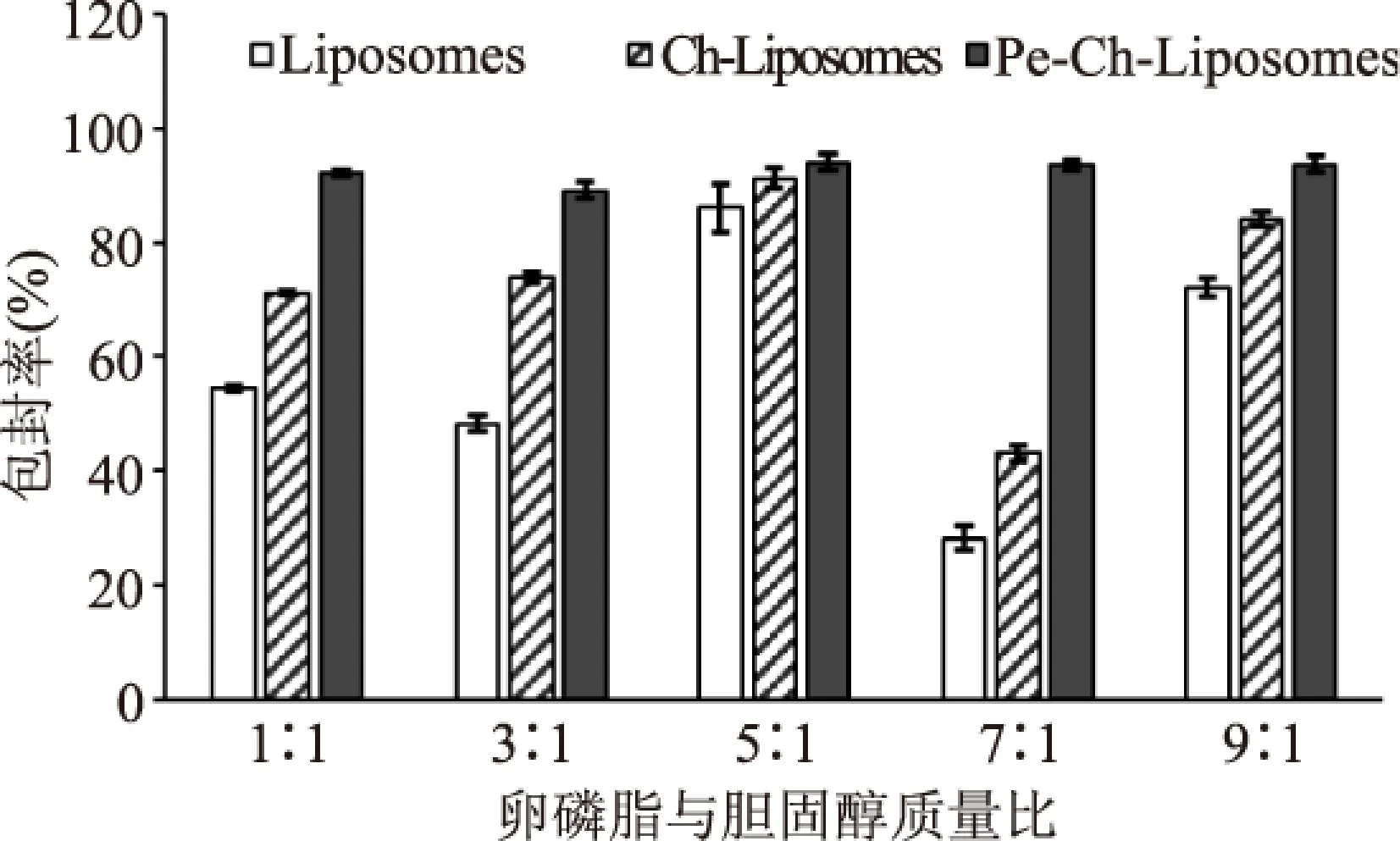
圖3 卵磷脂與膽固醇質量比 對Pe-Ch-Liposomes包封率及濁度的影響Fig.3 The effects of lecithin to cholesterol mass ratio on the encapsulation efficiency of Pe-Ch-Liposomes
圖4為不同卵磷脂膽固醇質量比制備的三種脂質體濁度值。卵磷脂與膽固醇質量比與濁度值并沒有呈現明顯的依賴性增多或減少的規律,但同一卵磷脂與膽固醇質量比下制備的脂質體的濁度值都呈現Pe-Ch-Liposome
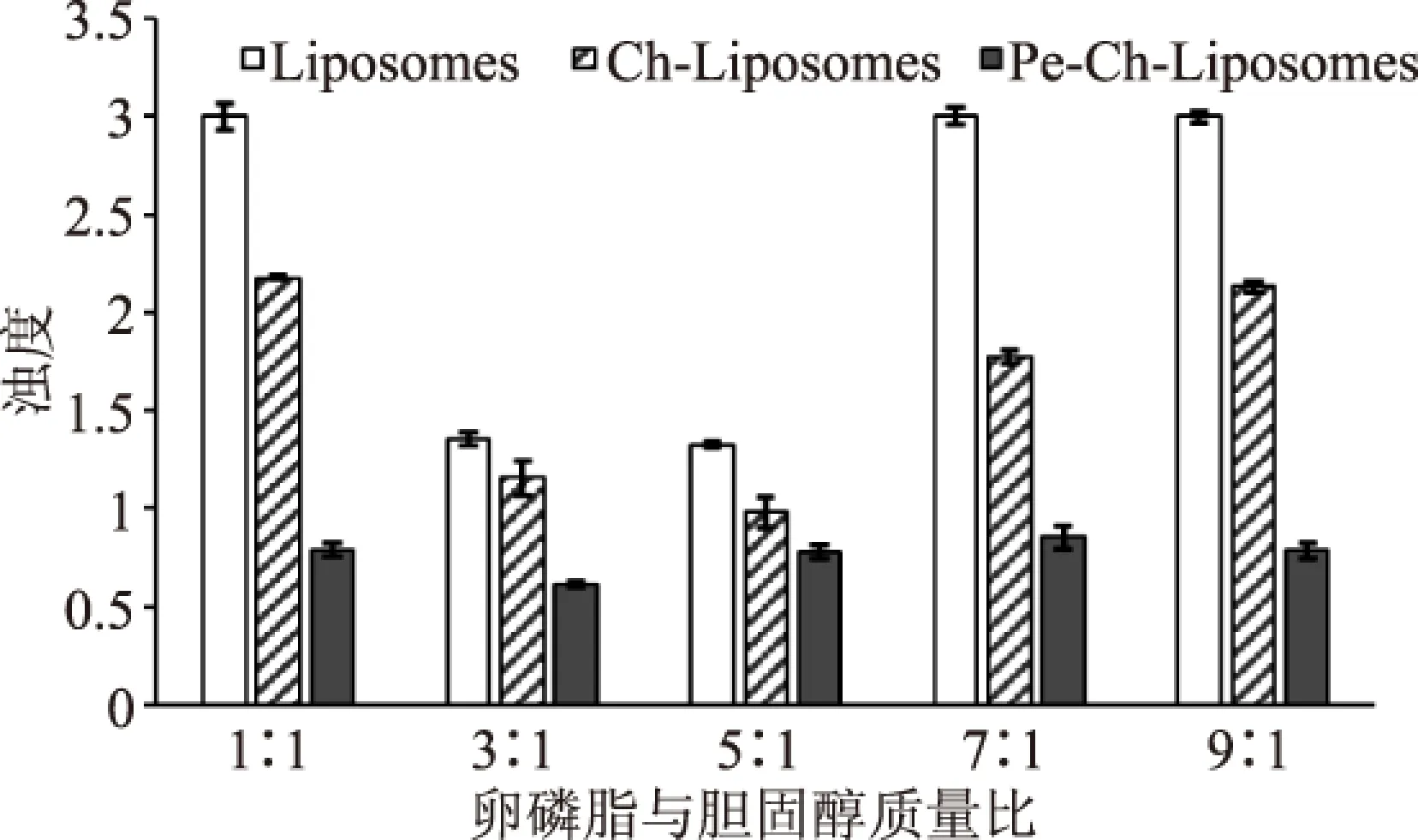
圖4 卵磷脂與膽固醇質量比 對Pe-Ch-Liposomes濁度的影響Fig.4 The effects of lecithin to cholesterol mass ratio on the turbidity of Pe-Ch-Liposomes
常規脂質體包封率較高組,因大量番茄紅素受到脂質體、殼聚糖及果膠的緩釋作用,在貯藏過程中可能具有較高的保留率;雖其對應的粒徑較大,但單囊脂質體相對多囊脂質體更為穩定,即綜合考慮選取質量比為3∶1、5∶1和7∶1進行后期實驗。
2.4 番茄紅素添加量對Pe-Ch-Liposomes包封率及濁度的影響
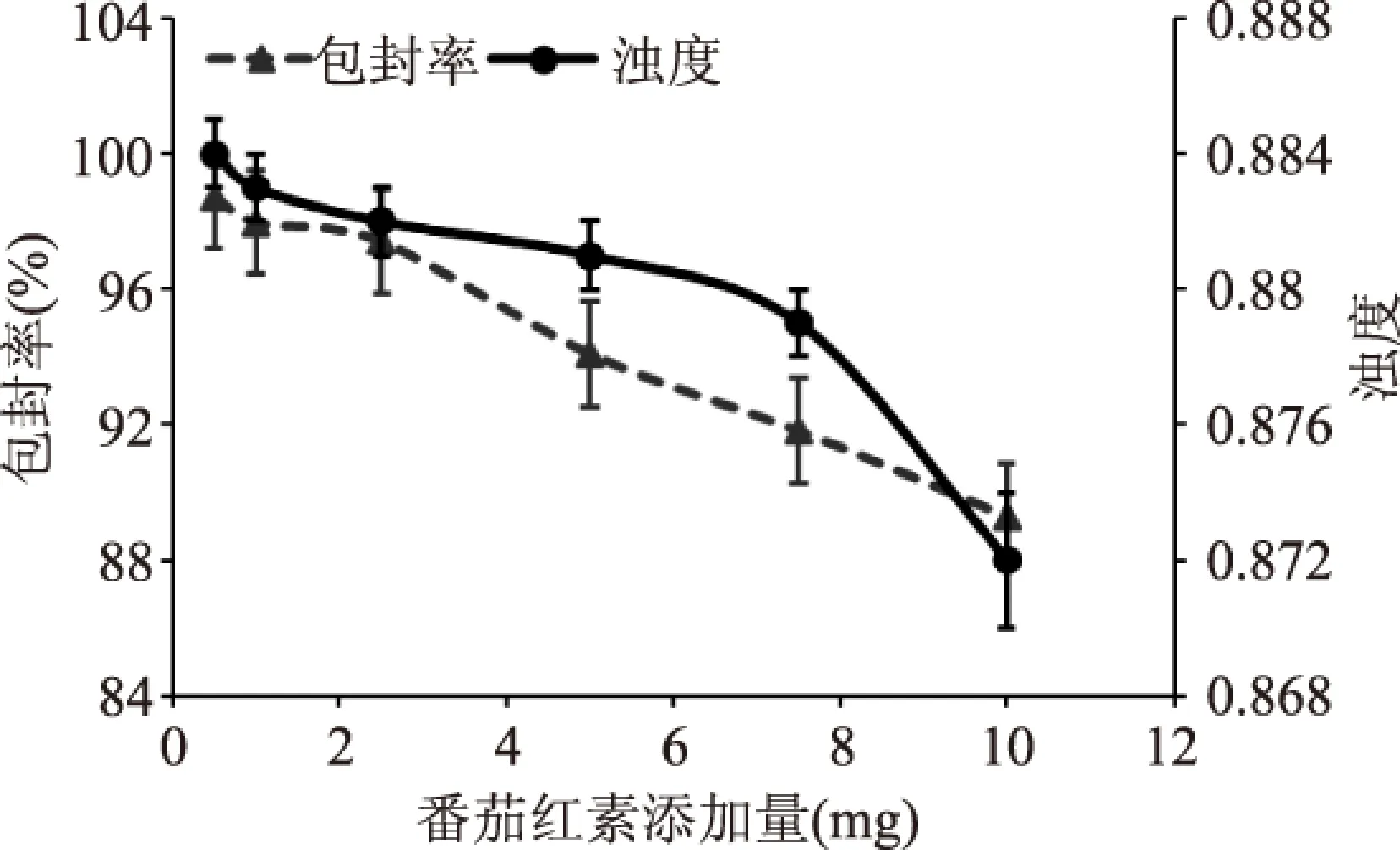
圖5 番茄紅素添加量 對Pe-Ch-Liposomes包封率及濁度的影響Fig.5 The effects of lycopene addition on the encapsulation efficiency and turbidity of Pe-Ch-Liposomes
由圖5可知,隨著番茄紅素添加量的增多所制備的Pe-Ch-Liposomes包封率呈整體下降趨勢,在添加量為0.5~2.5 mg范圍內降低幅度較小,數值之間差異不大,當添加量>5 mg時包封率與番茄紅素添加量呈明顯的負相關關系。在添加量為0.5~7.5 mg范圍內,濁度變化不大,數值之間沒有顯著性差異,當添加量為10 mg時濁度有所降低。因此,為了保證高包埋率的條件下,載量較高,選取添加量為2.5 mg進行配方優化。
2.5 工藝優化的結果及討論
由表2可知A、B、C三個因素對Pe-Ch-Liposomes包封率影響順序為B>C>A,最佳組合為A2B2C2,即經正交實驗優化后的最佳工藝條件為:果膠溶液與殼聚糖溶液體積比為2∶1;果膠溶液與殼聚糖溶液濃度配比為0.2%∶0.2%,卵磷脂與膽固醇質量比為5∶1,番茄紅素添加量2.5 mg。
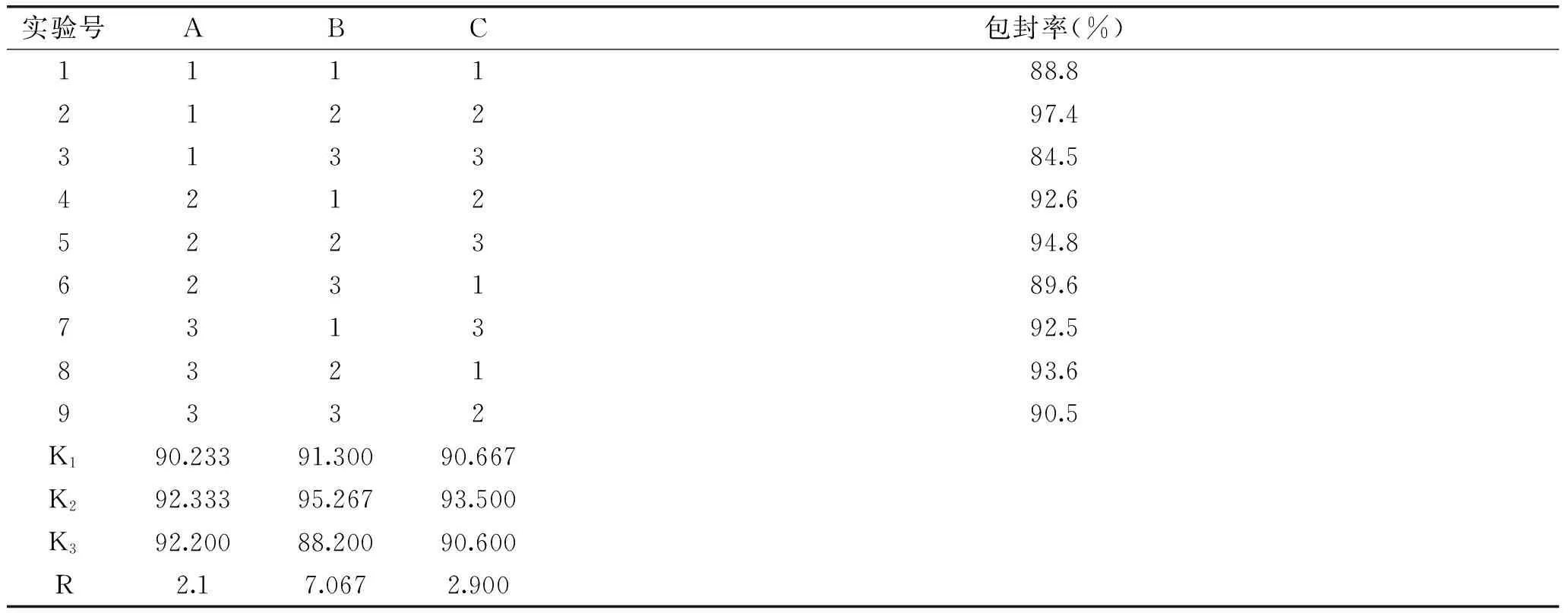
表2 L9(33)正交實驗結果Table 2 Results of L9(33)orthogonal experiment
按照該配方制備常規脂質體(未修飾脂質體)、殼聚糖修飾脂質體和殼聚糖果膠修飾脂質體,然后根據番茄紅素標準曲線和包封率公式分別求得各自的包封率如圖6所示。由圖6可以直觀地看出經過殼聚糖修飾后的脂質體較常規脂質體包封率更好,且包封率有顯著的提高,包封率由85.4%提升到了93.7%;在殼聚糖修飾脂質體的基礎上再用果膠修飾后包封率也相對提高(97.8%),由此可以說明殼聚糖和果膠能夠使脂質體的穩定性有所改善,提高其包封率。

圖6 番茄紅素脂質體的包封率Fig.6 The encapsulation efficiency of liposomes containing lycopene
圖7為按照最佳配方所制備的Pe-Ch-Liposomes粒度分布圖,從圖7可發現其粒度分布為雙峰分布,平均粒徑為1870.4 nm,多分散系數為0.231即分布較為集中。
3 小結
多層修飾過程可提高脂質體體系的包埋率,即可將游離的番茄紅素包裹在修飾層間及修飾層與脂質體間,多層修飾過程可減少由于卵磷脂與膽固醇質量比引起的包封率及濁度差異。
果膠、殼聚糖間要滿足適宜的比例、濃度才能制備粒徑小,且包封率高的多層修飾脂質體。
正交實驗表明主要因素對包封率的影響大小順序為果膠殼聚糖體積比>果膠殼聚糖濃度配比>卵磷脂與膽固醇質量比,正交實驗優化后的最佳配方為果膠殼聚糖體積比為2∶1;果膠殼聚糖總濃度為0.2%~0.2%,卵磷脂與膽固醇質量比為5∶1。在此條件下制備的修飾脂質體包封率為97.8%,平均粒徑為 1870.4 nm。
[1]Lila A A,Nawata K,Shimizu K,et al. Use of polyglycerol(PG),instead of polyethylene glycol(PEG)prevents induction of the accelerated blood clearance phenomenonagainst long-circulating liposomes upon repeated administration[J]. International Journal of Pharmaceutics,2013,456(1):235-242.
[2]Carine S,Alia J,Hatem F,et al. Preparation and characterization of clove essential oil-loaded liposomes[J]. Food Chemistry,2015,178(3):52-62.
[3]Bai C Q,Liu Y Z,Luo G W,et al. Preparation of coix seed oil liposomes by five different methods and their properties comparison investigation[J]. Journal of Dispersion Science and Technology,2015,36(1):136-145.
[4]Nahar K,Absar S,Gupta N,et al. Peptide-coated liposomal fasudil enhances site specific vasodilation in pulmonary arterial hypertension[J]. Molecular Pharmaceutics,2014,11(12):4374-4384.
[5]Mota L D,de Barros A L B,Fuscaldi L L,et al. Long-Circulating and pH-Sensitive Liposome Preparation Trapping a Radiotracer for Inflammation Site Detection[J]. Journal of Nanoscience and Nanotechnology,2015(6):4149-4158.
[6]Liu W L,Liu J H,Liu W,et al. Improved physical andinvitrodigestion stability of a polyelectrolyte delivery system based on layer-by-layer self-assembly alginate-chitosan coatednanoliposomes[J]. Journal of Agricultural and Food Chemistry,2013,61(17):4133-4144.
[7]Chen M X,Li B K,Yin D K,et al. Layer-by-layer assembly of chitosan stabilized multilayered liposomes for paclitaxel delivery[J]. Carbohydrate Polymers,2014,111(20):298-304.
[8]白春清. 羧甲基殼聚糖包覆薏苡仁油前體脂質體的制備穩定性及體外釋放研究[D]. 南昌:南昌大學,2011.
[9]Bigucci F,Luppi B,Cerchiara T,et al. Chitosan/pectin polyelectrolyte complexes:selection of suitable preparative conditions for colon-specific delivery of vancomycin[J]. European Journal of Pharmaceutical Sciences,2008,35(1):435-441.
[10]Ciobanu B C,Cadinoiu A N,Popa M,et al. Modulated release from liposomes entrapped in chitosan/gelatin hydrogels[J]. Materials Science and Engineering,2014,43(1):383-391.
[11]Nahar K,Absar S,Gupta N,et al. Peptide-coated liposomal fasudil enhances site specific vasodilation in pulmonary arterial hypertension[J]. Molecular Pharmaceutics,2014,11(1):4374-4384.
[12]劉珍,鄒立強,劉偉,等. 層層自組裝法制備雙重修飾脂質體及其體外消化穩定性[J]. 食品科學,2014,15(1):5-10.
[13]Xin L,Cao J Q,Liu C,et al. Evaluation of rMETase-loaded stealth PLGA/liposomes modified with Anti-CAGE scFV for treatment of gastric carcinoma[J]. Journal of Biomedical Nanotechnology,2015,11(1):1153-1161.
[14]Supper S,Anton N,Boisclair J,et al. Chitosan/glucose 1-phosphate as new stable in situ forming depot system for controlled drug delivery[J]. European Journal of Pharmaceutics and Biopharmaceutics,2014,88(1):361-373.
[15]Kavianinia I,Plieger P G,Kandile N G,et al.Invitroevaluation of spray-dried chitosan microspheres crosslinked with pyromellitic dianhydride for oral colon-specific delivery of protein drugs[J]. Journal of Applied Polymer Science,2014,131(15):4401-4404.
[16]Butnariu M V,Giuchici C V. The use of some nanoemulsions based on aqueous propol is and lycopene extract in the skin’s protective mechanisms against UVA radiation[J]. Journal of Nanobiotechnology,2014,9(1):3-11.
[17]Choksi P M,Joshi V Y. A Review on lycopene-extraction,purification,stability and applications[J]. International Journal of Food Properties,2007,10(1):289-298.
[18]孔祥輝.番茄紅素脂質體的制備及其生物利用率的研究[D]. 無錫:江南大學,2009.
Preparation of pectin-chitosan layer by layer modified liposomes and the formula optimization
BAI Chun-qing1,ZHENG Jing-xia2,YUAN Lu1,CUI Dan-dan1,CHEN Li-li1,YUAN Mei-lan1,ZHAO Li1,*
(1.College of Life Science,Jiangxi Science and Technology Normal University,Nanchang 330013,China;2.Nanchang University,State Key Laboratory of Food Science and Technology,Nanchang University,Nanchang 330047,China)
Inthisresearchpectin-chitosanlayerbylayermodifiedliposomesweresuccessfullyprepared.Theeffectsofmainfactorsontheencapsulationefficiencyandturbiditywereevaluated,andoptimalformulawasobtainedbyorthogonalexperimentsusingencapsulationefficiencyasthemainindex.Theresultsindicatedthatthevolumeratioandconcentrationratioofpectinsolutiontochitosansolutionhadsignificanteffectsontheencapsulationefficiencyandturbidityofpectin-chitosanlayerbylayermodifiedliposomes.Theprocessofmodificationcoulddiminishthepropertiesdifferencesaffectedbythemassratiooflecithintocholesterol.Theoptimalformulawasthevolumeratioofpectinsolutiontochitosansolution2∶1,concentrationsofpectinsolutionandchitosansolution0.2%∶0.2%,themassratiooflecithintocholesterol5∶1,additionamountoflycopene2.5mg.Theencapsulationefficiencyoftheoptimizedpectin-chitosanmodifiedliposomeswassignificantlyhigherthanthatofconventionalliposomes,whichwas97.8%and85.4%forthem,respectively,theparticlesizedistributionoftheobtainedpectin-chitosanmodifiedliposomeswasnarrowwiththemeanparticlesizeof1870.4nmandpolydispersityindexof0.231.
layerbylayermodifiedliposome;lycopene;pectin;chitosan
2016-05-16
白春清(1984-),女,博士,講師,研究方向:新型脂質體開發與特性研究,E-mail:chunqingbai01@aliyun.com。
*通訊作者:趙利(1967-),女,博士,教授,研究方向:食品化學,E-mail:lizhao618@hotmail.com。
國家自然科學基金地區項目(31560465);江西省自然科學基金資助項目 (20151BAB214023,20161BAB204190) ;江西省大宗淡水魚產業技術體系項目(JXARS-04-贛中片);江西省教育廳青年項目(GJJ150803)。
TS218
A
1002-0306(2016)21-0049-06
10.13386/j.issn1002-0306.2016.21.001

