菲律賓蛤仔血細胞透射電鏡樣品制備固定液的篩選
劉 靜,袁玉清
( 1.青島農業大學 中心實驗室,山東 青島 266109; 2.溫州醫科大學 環境與公共衛生學院,浙江 溫州 325035 )
菲律賓蛤仔血細胞透射電鏡樣品制備固定液的篩選
劉 靜1,2,袁玉清1
( 1.青島農業大學 中心實驗室,山東 青島 266109; 2.溫州醫科大學 環境與公共衛生學院,浙江 溫州 325035 )
對樣品的固定是透射電鏡樣品制備的關鍵環節,通過在透射電鏡下觀察和比較不同固定液固定菲律賓蛤仔血細胞后血細胞超微結構的變化,初步篩選出適合菲律賓蛤仔血細胞透射電鏡制樣的固定液。試驗結果表明,固定液可直接影響到透射電鏡制樣品質的高低,2.5%、5%戊二醛低滲固定液引起了血細胞細胞器的腫脹,其中線粒體腫脹尤為嚴重,腫脹程度2.5%戊二醛組大于5%戊二醛組;等滲固定液固定的血細胞細胞器不腫脹,但等滲5%戊二醛與4%多聚甲醛-2.5%戊二醛固定液對血細胞的精細結構保存不佳,而2%多聚甲醛-2.5%戊二醛固定液對血細胞超微結構保存較好,表現為細胞外膜結構清晰,細胞質基質豐富且分布均勻,細胞內線粒體、內質網、高爾基體、細胞核等細胞器固定效果較好。試驗得出,低滲固定液會導致細胞腫脹,線粒體對滲透壓的要求較其他細胞器更加敏感;提高固定液含量會減輕因低滲引起的細胞腫脹程度,但高含量固定液會損壞細胞內精細結構,故適合的樣品固定液是細胞精細結構較好保存的基礎。
菲律賓蛤仔;血細胞;透射電鏡;制樣固定液
菲律賓蛤仔(Ruditapesphilippinarum)是我國南北沿海廣泛分布,且較為重要的海水經濟貝類,其免疫系統屬非特異性免疫,主要有血細胞免疫和體液免疫兩部分組成,其中血細胞通過吞噬、凝集和包囊等作用清除異物和自身損傷、死亡的細胞,還能夠通過產生各種非特異性體液因子來參與宿主的免疫防御系統,在貝類的免疫防御過程中起著重要的作用[1-2]。目前關于菲律賓蛤仔血細胞形態、免疫功能的研究還較少[3-7]。利用透射電鏡可以揭示生物細胞中各種細胞器的超微結構,而且可以對生物大分子,特別是核酸、蛋白質、酶、抗原等在超微結構中準確定位、定性,但是目前國內外尚無菲律賓蛤仔血細胞透射電鏡樣品制備的研究。
超薄切片技術是最常用的透射電鏡樣品制備技術,樣品制備過程包括取材、樣品固定、脫水、滲透、包埋、超薄切片、染色等環節,其中樣品固定的好壞可直接影響到透射電鏡制樣的成敗和品質的高低,甚至會造成試驗假象,影響試驗結果,因此對樣品固定液的選擇是獲得理想透射電鏡觀察結果的關鍵條件之一。本文選取5種不同樣品固定液對菲律賓蛤仔血細胞進行固定,將制好的血細胞超薄切片在透射電鏡下進行超微結構的觀察和比較,從而篩選出適合菲律賓蛤仔血細胞透射電鏡制樣的固定液,為今后利用透射電鏡研究菲律賓蛤仔及其他海產雙殼貝類的血細胞分類、免疫學功能、病理學等方面提供可靠的技術支持。
1 材料與方法
1.1 試驗材料
菲律賓蛤仔購自青島城陽水產品批發市場,殼長(3.52±1.97) cm,體質量(8.23±0.197) g。試驗用蛤仔暫養于塑料水箱中,水溫約16 ℃,每日早晚各換新鮮海水1次,暫養3 d后進行試驗。
1.2 試驗方法
1.2.1 不同固定液配方
中貝類血細胞透射電鏡制樣固定液,并有所改進,從制樣固定液的組成、含量和滲透壓方面考慮,選取了5種制樣固定液,其配方見表1。
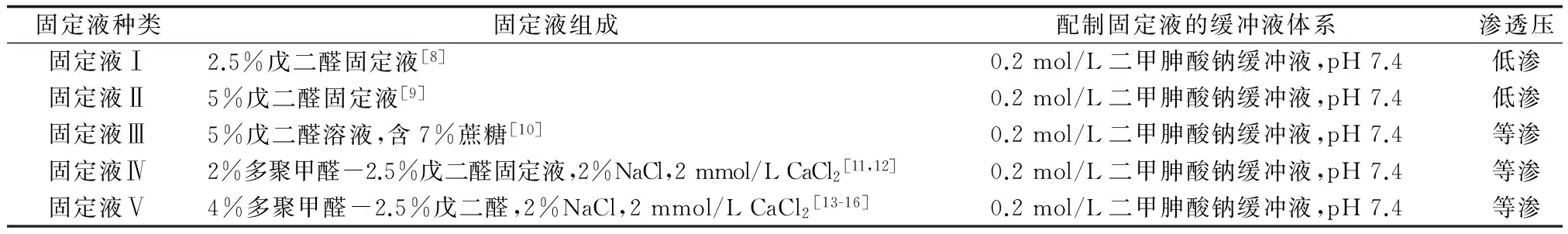
表1 5種不同貝類血細胞透射電鏡制樣用的固定液配方
1.2.2 血淋巴的抽取與制備
選取健康有活力的菲律賓蛤仔,無菌海水沖洗后,用1 mL的無菌注射器預先吸入一定量預冷固定液, 再從菲律賓蛤仔閉殼肌處1∶1抽取血淋巴,每個試驗組抽取3枚菲律賓蛤仔的血淋巴,迅速混勻,冰上保存。抽取的血淋巴4 ℃,3000 r/min 離心10 min,去掉上清液,血細胞沉淀立即加入4 ℃新鮮固定液固定。每種固定液重復制樣3次。
1.2.3 透射電鏡樣品制備
血細胞在各自固定液中4 ℃固定過夜,3000 r/min離心10 min,血細胞沉淀用2.5%的瓊脂預包埋后,0.1 mol/L二甲胂酸鈉緩沖液清洗血細胞,再用1%鋨酸后固定血細胞2 h,0.1 mol/L二甲胂酸鈉緩沖液清洗血細胞后,進行丙酮梯度脫水,Spi-pon812環氧樹脂樹脂浸透包埋以及聚合,Leica UC7超薄切片機切片,切片厚度70 nm,超薄切片經醋酸鈾和檸檬酸鉛染液雙染色,日立HT7700型透射電鏡觀察并拍照,加速電壓80 kV。
1.2.4 試驗結果的評價方法和標準
透射電鏡下觀察和比較不同制樣固定液固定菲律賓蛤仔血細胞后其超微結構的變化時,主要觀察細胞的細胞質膜、細胞質基質、粗面內質網、線粒體、細胞核等細胞器超微結構保存是否良好。其固定良好的細胞超微結構的形態特征參照表2。

表2 固定良好的細胞超微結構的形態特征
2 結 果
2.1 低滲2.5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響
經2.5%戊二醛固定液處理的細胞整體完整,但細胞質基質分布不均勻,部分區域呈現空白(圖1a);線粒體腫脹,基質淺,線粒體嵴變少;腫脹嚴重的線粒體基質顆粒消失,基質中出現多個亮區,線粒體嵴亦消失,部分線粒體外膜出現破裂(圖1b);大部分高爾基體保存完好,少數高爾基體囊膜膨脹模糊不清(圖1c);粗面內質網核糖體顆粒散落,顯示不清,部分內質網膜不完整(圖1d),細胞內部分顆粒腫脹,膜破裂(圖1e);細胞核異染色質保存較好,部分常染色質部位出現空白區域(圖1d);細胞核核周隙寬度不均勻,外膜呈波浪狀,局部腫脹呈山丘狀(圖1f)。
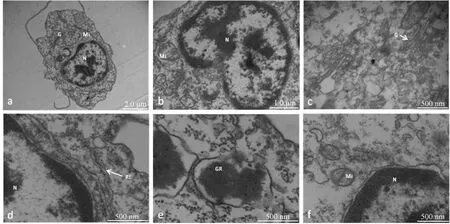
圖1 2.5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響N:細胞核;Mi:線粒體;G:高爾基體;RE:粗面內質網;GR:顆粒.
2.2 低滲與等滲5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響
兩種固定液固定的血細胞細胞質、線粒體基質和核基質豐富。低滲5%戊二醛固定液組中細胞大部分線粒體嵴顯示不清,部分線粒體腫脹、外膜發生破裂(圖2a),粗面內質網上核糖體部分散落,部分核膜膨脹(圖2b),腫脹程度低于2.5%戊二醛固定液;等滲5%戊二醛固定液固定后細胞無腫脹現象,但細胞內膜系統的膜性精細結構保存不佳,表現為大部分高爾基體膜、核膜顯示不清(圖2c),線粒體外膜、線粒體嵴、粗面內質網膜不清晰,但粗面內質網上負載的核糖體豐富,清晰可見(圖2d)。
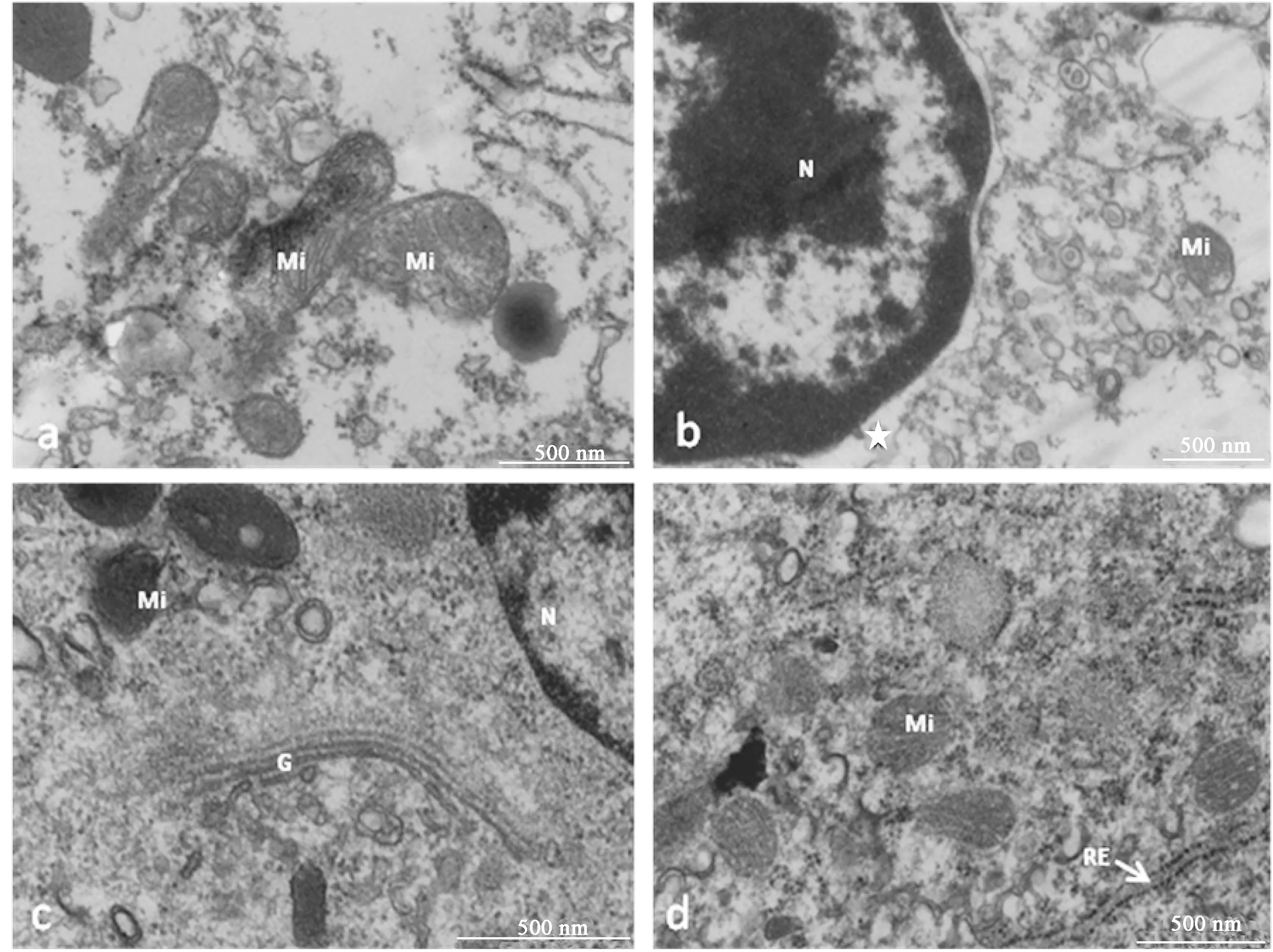
圖2 低滲與等滲5%戊二醛固定液對血細胞超微結構的影響N:細胞核;Mi:線粒體;RE:粗面內質網;★:細胞核膨脹部位.
2.3 2%多聚甲醛-2.5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響
2%多聚甲醛-2.5%戊二醛固定液固定血細胞后,細胞基質均勻豐富,各細胞器精細結構保存較好,無腫脹現象(圖3a)。細胞質膜三層結構顯示清晰,線粒體基質豐富,線粒體嵴清晰可見(圖3b);粗面內質網保存較完整,負載的核糖體清晰(圖3c);高爾基體保存較好(圖3d);細胞中花瓣狀的顆粒外膜和基質緊密貼合(圖3e);核膜清晰,核基質豐富(圖3f)。
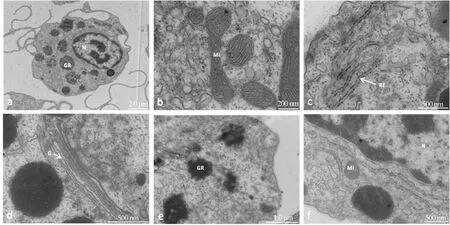
圖3 2%多聚甲醛-2.5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響N:細胞核;Mi:線粒體;RE:粗面內質網;G:高爾基體;GR:顆粒.
2.4 4%多聚甲醛-2.5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響
4%多聚甲醛-2.5%戊二醛固定液固定的血細胞細胞質基質不均勻,胞質中部分基質明顯變淺,但線粒體基質和核基質保存較好(圖4a)。細胞外膜及胞質內膜精細結構保存不佳,表現為大部分線粒體外膜和線粒體嵴顯示不清(圖4b),高爾基體大部分保存不完整,核膜雙層膜結構顯示不清(圖4c),粗面內質網膜顯示不清晰,但內質網上核糖體顯示清晰(圖4d)。

圖4 4%多聚甲醛-2.5%戊二醛固定液對菲律賓蛤仔血細胞超微結構的影響N:細胞核;Mi:線粒體;G:高爾基體;RE:粗面內質網.
3 討 論
利用透射電鏡可觀察細胞的超微結構,探明細胞的功能以及生理調節機制,隨著透射電鏡分辨率的不斷提高,其清晰度已不完全取決于顯微鏡的分辨率,而是很大程度上取決于樣品制備的好壞。在貝類血細胞的超微結構研究中,多數學者應用了超薄切片技術,但制樣細節不盡相同,主要表現為固定方式、樣品固定液種類、固定時間、固定溫度、緩沖液種類及包埋樹脂等方面存在差異[10-11,13-20]。本試驗在其他條件一致的前提下,主要研究了固定液種類對菲律賓蛤仔血細胞超微結構的影響。
透射電鏡制樣過程中,對樣品固定的目的是盡可能使細胞中的各種細胞器以及大分子結構保持生活狀態,并且牢固地固定在其原來所在的位置上,避免在以后的清洗和脫水時溶解和流失,使結構更加清晰。樣品固定是一種復雜的化學過程,固定液的組成、含量、滲透壓、pH等都會對樣品的固定效果產生影響。
在超薄切片制樣中,固定方式一般采用雙固定,即醛類固定液前固定,鋨酸后固定,醛類固定液一般選用戊二醛和多聚甲醛,兩者混合使用效果更佳[21]。本試驗結果表明,2%多聚甲醛-2.5%戊二醛固定液效果最佳,證實了這一觀點,但同時本文研究結果亦發現兩者混合使用時,必須要求多聚甲醛和戊二醛的含量配比合適才能得到較好的固定效果。相同的固定時間,較低含量的固定液對樣品固定可能不徹底,而較高含量的固定液容易毀壞酶的活性和細胞的精細結構[21],比較本試驗中2%多聚甲醛-2.5%戊二醛固定液與4%多聚甲醛-2.5%戊二醛固定液的組成,除了多聚甲醛含量不同,其余條件均一致,但是2%多聚甲醛-2.5%戊二醛固定液的效果遠好于4%多聚甲醛-2.5%戊二醛固定液,筆者認為可能由于4%多聚甲醛-2.5%戊二醛固定液中多聚甲醛含量高引起的;試驗結果亦顯示5%戊二醛含量的固定液試驗組血細胞的精細結構保存亦不佳。由此筆者推測4%多聚甲醛-2.5%戊二醛、5%戊二醛固定液對于菲律賓蛤仔血細胞而言固定劑的含量太高,破壞了血細胞的精細結構。
一般來說,低滲固定液容易引起組織腫脹,而高滲固定液容易造成組織收縮,但也有學者提出調解滲透壓平衡是不必要的,因為滲透壓平衡只存在于活細胞中,細胞一旦和固定液接觸,即被固定并死亡,因此失去了滲透壓平衡調節的能力[21]。在已發表的貝類血細胞透射電鏡制樣的文獻中,有學者在固定液和緩沖液中通過添加蔗糖[10]、氯化鈉[11]或者海水[17-18]來調節固定液的滲透壓平衡,而有學者則沒考慮固定液滲透壓[9]。菲律賓蛤仔屬于海水貝類,其體內滲透壓要比淡水生物的滲透壓要高,本文選取的低滲2.5%、5%戊二醛固定液沒有考慮到固定液滲透壓,細胞器發生腫脹,尤其是線粒體腫脹明顯,提高戊二醛的含量,線粒體的腫脹程度會降低,而等滲固定液通過添加蔗糖或NaCl調節了固定液的滲透壓,細胞沒有發生腫脹。這充分說明了在選擇菲律賓蛤仔血細胞固定液時一定要考慮固定液和緩沖體系的滲透壓,調節固定液的滲透壓和固定樣品滲透壓一致,同時試驗表明細胞內線粒體相比其他細胞器對固定液滲透壓變化敏感。
通過本研究,筆者發現,固定液滲透壓、含量對菲律賓蛤仔血細胞超微結構影響較大,低滲固定液使細胞內的細胞器腫脹,尤其是線粒體較其他細胞器更加敏感,提高固定液的含量能部分緩解細胞器的腫脹,但是高含量的固定液對細胞內精細結構保存不佳。所以合適的固定液含量以及離子組成是細胞超微結構較好保存的關鍵。
參考文獻:
[1] Brulle F, Jeffroy F, Madec S, et al. Transcriptomic analysis ofRuditapesphilippinarumhemocytes reveals cytoskeleton disruption after in vitroVibriotapetischallenge[J]. Developmental & Comparative Immunology, 2012, 38(2):368-376.
[2] Donaghy L, Lambert C, Choi K S, et al. Hemocytes of the carpet shell clam (Ruditapesdecussatus) and the Manila clam (Ruditapesphilippinarum): current knowledge and future prospects[J]. Aquaculture, 2009, 297(1/4):10-24.
[3] Marisa I, Marin M G, Caicci F, et al. In vitro exposure of haemocytes of the clamRuditapesphilippinarumto titanium dioxide (TiO2) nanoparticles: nanoparticle characterisation, effects on phagocytic activity and internalisation of nanoparticles into haemocytes[J]. Marine Environment Research, 2015(103):11-17.
[4] Ford S E,Paillard C. Repeated sampling of individual bivalve mollusks I: intraindividual variability and consequences for haemolymph constituents of the Manila clam,Ruditapesphilippinarum[J]. Fish and Shellfish Immunology, 2007, 23(2):280-291.
[5] Jeffroy F,Paillard C. Involvement of nitric oxide in the in vitro interaction between Manila clam,Ruditapesphilippinarum, hemocytes and the bacteriumVibriotapetis[J]. Fish and Shellfish Immunology, 2011, 31(6):1137-1141.
[6] 王文琪,徐申波,張玉娜,等. 菲律賓蛤仔(Ruditapesphilippinarum)血細胞分類及其功能初探[J]. 萊陽農學院學報:自然科學版, 2006, 23(3):165-169.
[7] 劉東武,王宜艷,孫虎山. 菲律賓蛤仔、中國蛤蜊、文蛤和紫石房蛤血細胞的分類研究[J]. 水產科學, 2005, 24(10):5-7.
[8] Xie Y H, Hu B C, Wen C G, et al. Morphology and phagocytic ability of hemocytes fromCristariaplicata[J]. Aquaculture, 2011, 310(3):245-251.
[9] 宋微微, 王春琳,勵迪平,等. 4種常見頭足類動物的血細胞分類及比較[J]. 海洋與湖沼, 2013, 44(3):775-781.
[10] Lopez C, Carballal M J, Azevedo C, et al. Morphological characterization of the hemocytes of the clam,Ruditapesdecussatus(Mollusca: Bivalvia)[J]. Journal of Invertebrate Pathology, 1997, 69(1):51-57.
[11] Zhang W Z, Wu X Z, Wang M. Morphological, structural, and functional characterization of the haemocytes of the scallop,Argopectenirradians[J]. Aquaculture, 2006, 251(1):19-32.
[12] Wootton E C, Dyrynda E A, Ratcliffe N A. Bivalve immunity:comarison between the marine mussel (Mytilusedulis), the edible cockle (Cerastodermaedule) and the razor shell (Ensissiliqua)[J]. Fish and Shellfish Immunology, 2003, 15(3):195-210.
[13] Aladaileh S, Nair S V, Birch D, et al. Sydney rock oyster (Saccostreaglomerata) hemocytes: morphology and function[J]. Journal of Invertebrate Pathology, 2007, 96(1):48-63.
[14] Aladaileh S, Mohammad M G, Ferrari B, et al. In vitro effects of noradrenaline on Sydney rock oyster (Saccostreaglomerata) hemocytes[J]. Comparative Biochemistry and Physiology, Part A, Molecular & Integrative Physiology, 2008, 151(4):691-697.
[15] Wang Y, Hu M, Chiang M W, et al. Characterization of subpopulations and immune-related parameters of hemocytes in the green-lipped musselPernaviridis[J]. Fish and Shellfish Immunology, 2012, 32(3):381-390.
[16] Kuchel R P,Raftos D A. In vitro effects of noradrenaline on Akoya pearl oyster (Pinctadaimbricata) haemocytes[J]. Fish and Shellfish Immunology, 2011, 31(3):365-372.
[17] Balbi T R,Fabbri K,Cortese A,et al.Interactions betweenMytilusgalloprovincialishemocytes and the bivalve pathogensVibrioaestuarianus01/032 andVibriosplendidusLGP32[J]. Fish and Shellfish Immunology, 2013, 35(6):1906-1915.
[18] Barmo C,Ciacci C,Canonico B,et al.In vivo effects of n-TiO2on digestive gland and immune function of the marine bivalveMytilusgalloprovincialis[J]. Aquatic Toxicology, 2013, 132/133(2):9-18.
[19] Marie-Agne`s T,Patricia M,Silva N,et al.Morphologic, cytometric and functional characterisation of abalone (Haliotistuberculata) haemocytes[J]. Fish and Shellfish Immunology, 2008, 24(4):400-411.
[20] Kuchel R P, Raftos D A, Birch D, et al.Haemocyte morphology and function in the Akoya pearl oyster,Pinctadaimbricata[J]. Journal of Invertebrate Pathology, 2010, 105(1):36-48.
[21] 楊勇驥, 湯瑩,葉煦亭,等. 醫學生物電子顯微鏡技術[M]. 上海:第二軍醫大學出版社,2012:78-83.
ScreeningofSpecimenPreparationandFixativesofManilaClamRuditapesphilippinarumHaemocytesforTransmissionElectronMicroscopy
LIU Jing1,2, YUAN Yuqing1
( 1.Central Laboratory, Qingdao Agriculture University, Qingdao 266109,China;2.School of Environmental Science and Public Health,Wenzhou Medical University,Wenzhou 325035,China )
Fixation is the key step of the specimen preparation for transmission electron microscopy. The aim of this paper is to investigate and compare the influence of 5 different fixatives on the ultrastructure alterations of haemocytes in Manila clamRuditapesphilippinarumusing transmission electron microscope in order to find the proper fixative for Manila clam. The results showed that fixative affected the haemocyte ultrastructure directly. The haemocytes were swelled in 2.5% and 5% glutaraldehyde groups, the higher in 2.5% glutaraldehyde groups than in 5% glutaraldehyde fixative treatments, and higher swollen in the haemocytes mitochondria than in the other organelles. No organelles swelling was found in isotonic fixative treatments, while the inner structures of the haemocytes were not preserved very well in 5% glutaraldehyde fixative with 7% saccharose groups and 4% paraformaldehyde-2.5% glutaraldehyde fixative treatments, especially the endomembrane system. In 2% paraformaldehyde-2.5% glutaraldehyde fixative treatments, the haemocytes had better ultrastructure than in other groups, with clear outer membrane structure of haemocytes. The cytoplasmic matrix was rich and evenly distributed, as well the ultrastructure of the organelles such as mitochondria, endoplasmic reticulum, Golgi apparatus and the nucleus were better preserved. From this study we can concluded that the hypotonic fixative could cause haemocytes swelling and that the mitochondria are more sensitive to the fixative osmotic pressure than other organelles. Raised fixative concentration reduces the cell swelling degree, but the high fixative concentration is not benefit to the haemocytes ultrastructure. Thus the suitable fixative is the foundation of the cell ultrastructure preservation.
Ruditapesphilippinarum; haemocyte; transmission electron microscope; sample fixative
10.16378/j.cnki.1003-1111.2016.05.013
S917.4
A
1003-1111(2016)05-0535-06
2016-03-01;
2016-05-06.
國家自然科學基金資助項目(31302166);浙江省近岸水域生物資源開發與保護重點實驗室開放基金資助項目(J2013004).
劉靜(1982—),女,助理研究員,博士研究生;研究方向:貝類免疫學. E-mail:liujingandlele@163.com.

