雞β-防御素-13(Gal-13)成熟肽序列的克隆及表達
周堯許國洋潘康成王承旭張鈞利
(1.四川農業大學動物微生態研究中心,四川成都611130)(2.廣州市中添生物科技有限公司,廣東廣州510470)(3.江蘇無錫阿爾寶爾生物工程股份有限公司,江蘇無錫214046)(4.重慶市畜牧科學研究院獸醫研究所,重慶榮昌402460)
雞β-防御素-13(Gal-13)成熟肽序列的克隆及表達
周堯1,2許國洋1,3潘康成1王承旭2張鈞利2
(1.四川農業大學動物微生態研究中心,四川成都611130)
(2.廣州市中添生物科技有限公司,廣東廣州510470)
(3.江蘇無錫阿爾寶爾生物工程股份有限公司,江蘇無錫214046)
(4.重慶市畜牧科學研究院獸醫研究所,重慶榮昌402460)
本研究旨在克隆雞成熟肽cDNA序列并構建原核和真核表達載體,研究其在大腸桿菌和畢赤酵母中誘導后融合蛋白的表達情況。利用PCR技術從pDM19-T-Gal-13質粒中擴增得到成熟肽cDNA序列,將其亞克隆到pGEX-4T-1和pPICZαA質粒中,構建重組原核表達質粒pGEX-4T-1-Gal-13和真核表達載體pPICZαA-Gal-13,轉化大腸桿菌BL21(DE3)和畢赤酵母X-33,挑取陽性轉化子用進行鑒定和誘導表達,(Tricine)SDS-PAGE檢測產物的表達情況,以及真核誘導表達上清液對雞白痢沙門氏菌和金黃色葡萄球菌。結果顯示,成功克隆得到的成熟肽序列長為128bp,包含ATG片段和酶切位點與保護堿共20bp,共編碼36個氨基酸;構建獲得重組原核表達質粒pGEX-4T-1-Gal-13和真核表達載體pPICZα-A-Gal-13,并將重組質粒轉化到大腸桿菌BL21和酵母X-33,進行誘導表達產物經電泳分析后結果顯示,Gal-13融合蛋白在大腸桿菌和酵母中得到大量表達,原核表達分子量是31ku并以包涵體的形式存在,真核表達的分子量5.9 ku并分泌到發酵液中;抑菌試驗表明,發現真核表達的發酵無菌上清對雞白痢沙門氏菌和金黃色葡萄球菌具有抑菌活性。
雞;防御素Gal-13;成熟肽;克隆;表達
防御素是一類富含半胱氨酸的陽離子抗菌肽,廣泛分布于動物、植物、昆蟲等體內,是機體先天免疫系統的重要組成部分,因其具有高效的抗菌活性和免疫增強作用,以及不會引起病原菌的耐藥性的問題等優勢而成為目前生物醫學的一個研究熱點(袁波等,2009;sugiano等,2004)。依據防御素的空間結構特點,可將其分為植物防御素、昆蟲防御素、α-防御素、β-防御素和θ-防御素(王新衛等,2006)。1994年,Harrwing等(1994)最先從雞的嗜中性粒細胞中分離提取到了β-防御素,并將其分別命名為Gal-1,Gal-1α,Gal-2。隨著研究技術方法的不斷成熟,其他種類的防御素也被相繼發現(E-vans等,1994;Lynn等,2004),張輝華等(2008)研究了雞的Gal-1~Gal-13序列信息及在組織中的分布情況,目前,在NCBI中已注冊的雞防御素共有14種,且均為β-防御素,國內報道的雞的防御素主要是從絲羽烏骨雞和三黃雞的組織器官中獲得(張祥斌等,2008;冀君等,2008),Gal-13是近年來剛發現的新種類,其被楊玉榮等(2008;2006)用乙酸提取的方法從雞的腸道中分離得到,并證實了它的抑菌活性和對雛雞免疫功能的影響,但提取工藝繁瑣耗時,且提取量有限。而關于Gal-13在基因工程方面的研究相對較少,其在大腸桿菌和真核中的表達情況未見報道(王璟等,2007),本研究擬構建Gal-13成熟肽基因表達載體,以期望其在大腸桿菌和酵母中大量表達,彌補Gal-13在基因工程方面的空白,為進一步研究其活性奠定基礎,也為其今后在畜牧業中的生產應用奠定一定的理論依據。
1 材料與方法
1.1菌株和載體
大腸桿菌DH5α和BL21(DE3)、攜帶雞β-防御素-13基因質粒pMD18-T-Gal-13、表達載體pGEX-4T-1、分泌表達載體pPICZaA、畢赤酵母X-33,雞白痢沙門氏菌(CVCC534)和金黃色葡萄球菌(ATCC25923),由本實驗室提供。
1.2酶和試劑
T4DNA連接酶和RNA提取Trizol試劑盒均為Gibco公司產品;Prime Script RT-PCR Kit、2×Taq MasterMix(含染料)購自北京康為世紀生物科技有限公司;EcoR1和BamH1限制性內切酶均購于寶生物(大連)工程有限公司;Gel DNA Recovery Kit購自PUEX公司;Mini PlasmidKit、酵母基因組提取試劑盒購自TIANGEN公司;D-山梨醇、生物素和YNB均購自Solarbio公司;博萊霉素(ZeocinTM)為Invitrogen公司產品。
1.3 PCR引物設計與合成
參照張輝華等(2008)報道的Gal-13cDNA序列設計引物P1/P2,擴增Gal-13成熟肽基因序列。并依據載體pPICZaA序列合成一對檢測重組菌株表型的引物5,AOX/3,AOX,引物由上海基康公司合成。
1.4原核表達載體pGEX-4T-1-Gal-13的構建及鑒定
以pMD18-T-Gal-13為模板,P1/P2為引物,擴增Gal-13成熟肽序列(擴增體系為2×TaqMaster-Mix12.5μL,DNA 2μL,ddH2O10.5μL;反應條件為94℃5min;94℃45s,55℃45s,72℃45s,共30個循環;72℃延伸10min)。PCR產物用1%的凝膠電泳鑒定,回收純化產物,送上海生工公司測序。將pGEX-4T-1質粒與鑒定正確的成熟肽序列,分別用EcoR1和Kpn1雙酶切,酶切產物經電泳后回收純化,連接過夜,構建原核重組表達質粒,將擴增出成熟肽序列和pGEX-4T-1表達質粒進行雙酶切,連接過夜,轉化感受態DH5a,篩選陽性轉化子,提取重組質粒進行PCR鑒定,并將PCR產物送上海生工公司測序,測序正確的陽性質粒命名為pGEX-4T-1-Gal-13。
1.5原核重組子的誘導表達與表達產物的鑒定
鑒定正確的重組質粒轉化感受態BL21,涂布于LB瓊脂培養基(含Amp+)上,篩選出的陽性轉化子,進行PCR鑒定,將鑒定正確的重組菌株(命名為大腸桿菌BL-Gal-13),接種于200ml含氨芐青霉素的LB培養液中,在OD值達到0.3~0.5時加入終濃度為1.0mmol/L的誘導劑IPTG,37℃誘導表達4h后,取1mL菌液離心收集菌體,加入100μl電泳緩沖液水煮10min,進行SDS-PAGE和Westernblot凝膠電泳分析。
將誘導表達后的菌液4℃下12000r/min離心10min,收集沉淀,離心后用PBS懸浮菌體沉淀,冰水浴中超聲裂解菌懸液(超聲功率為300W,工作4s間歇5s,超聲裂解15min)。取1ml裂解液4℃下12000r/min離心 10min,沉淀和上清分別做SDS-PAGE分析。
1.6真核pPICZαA-Gal-13重組質粒的構建及鑒定
方法1.4回收鑒定正確的PCR產物與pPICZaA質粒用EcoR1與Kpn1酶切消化處理,T4 DNA連接酶進行連接,連接產物直接轉化DH5a感受態細胞,在含有Zeocin(25μg/μl)的LB平板上進行篩選,挑取單個菌落接種于LB液體培養基(含Zeocin)中37℃培養過夜,提取重組質粒,進行PCR和雙酶切鑒定,構建成功的質粒送往上海博亞生物公司測序,重組質粒命名為pPICZαA-Gal-13。

表1 引物序列信息
1.7重組表達質粒pPICZαA-Gal-13的電擊轉化
提取重組質粒pPICZαA-Gal-13,用Sac1內切酶線性化處理,取100μl制備好的畢赤酵母X-33感受態細胞,與5~20μg線性化的目的片段混合,轉移至一冰預冷無菌0.2cm電轉杯中,冰水浴15min,放入電轉儀中電擊轉化,然后取出電轉化皿,立即加入1ml冰預冷的1mol/L Sorbitol,混勻后轉到1.5ml無菌離心管,取600μl電轉化菌體涂布于YPDS平板(含Zeocin),30℃培養3d左右,篩選轉化子。
1.8真核重組菌株的誘導表達與鑒定
將陽性轉化子(命名為重組酵母X-33-Gal-13)接種于3ml YPD液體培養基中,30℃,250r/min搖床培養至OD600=2~6,2500r/min離心2min,棄上清收集菌體,菌體用BMMY重懸,其中甲醇含量為1%,連續誘導表達培養4d,每24h取樣并補充甲醇,使其終濃度為0.5%。對樣品進行離心收集上清,并用上清進行Tricine-SDS-PAGE電泳。
1.9 Gal-13的抑菌活性試驗
收集重組畢赤酵母X-33甲醇誘導72h后表達的上清液,以牛津杯法,分析真核表達的重組蛋白雞白痢沙門氏菌和金黃色葡萄球菌的抑菌活性。
1.10耐熱性分析
取誘導表達72h的重組酵母X-33-Gal-13菌株表達上清12mL,分為6管,分別在50℃,60℃,70℃,80℃,90℃,100℃的溫度下水浴處理15min,參照方法1.9做抑菌試驗。
2 結果
2.1重組表達質粒的構建與鑒定
以P1/P2為引物擴增出其成熟肽序列,經測序共128bp,包括引入ATG片段和酶切位點與保護堿基。對構建篩選的重組表達質粒進行菌落PCR鑒定和測序,所擴增的序列信息與目的基因一致,結果表明目的基因成功插入到表達質粒中(圖1)。
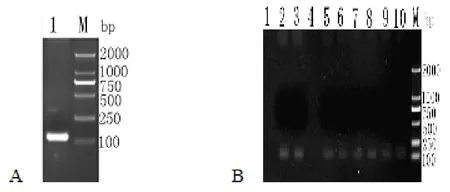
圖1 Gal-13成熟肽cDNA序列的擴增及菌落PCR鑒定
2.2重組大腸桿菌BL-Gal-13表達產物的鑒定分析
誘導表達4h的菌液樣品經SDS-PAGE和westernblot凝膠電泳分析顯示,GST標簽的分子量大小約為26ku,融合蛋白的分子量大小約為31KD,與預期結果一致,電泳結果如圖2所示。對融合蛋白的經過表達形式分析后發現菌體經超聲裂解后,只有在沉淀中檢測到了目的蛋白。
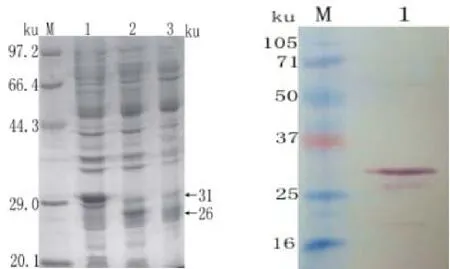
圖2 表達產物的SDS-PAGE及western blot分析
2.3真核pPICZαA-Gal-13表達載體的構建與鑒定
成熟肽序列經PCR擴增的產物與pPICZaA質粒用EcoR1與Kpn1酶切,連接酶連接轉化DH5a感受態細胞,隨機挑取5個轉化后的DH5a單菌落,進行菌落PCR鑒定,發現均在約120bp的位置出現預期條帶,電泳結果如圖3A所示,提取重組質粒后,進行雙酶切鑒定,在圖3B中出現了兩個條帶,結果表明成功構建了Gal-13成熟肽的真核分泌pPICZaA-Gal-13質粒。
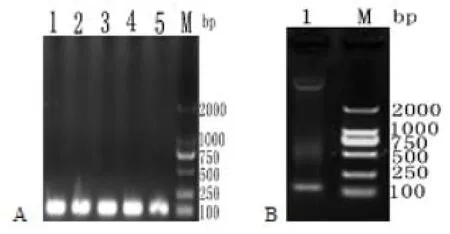
圖3 pPICZαA-Gal-13陽性菌落PCR和重組質粒的雙酶切鑒定
2.4高抗性菌株的篩選鑒定
對含有Zeocin的抗性平板中長出的轉化子擴大培養,提取酵母基因組進行PCR鑒定,產物電泳結果如圖4所示。由圖可以看出,以P1/P2為引物擴增出了大小約為120bp的條帶;重組菌株基因組用5’AOX1/3’AOX1擴增出約700bp和2200bp的條帶,所獲得的菌株,為陽性轉化子,且表型為甲醇利用野生型Mut+,酵母基因組擴增出一條2200bp條帶,結果表明,所獲得的高抗性菌株,為陽性轉化子,且表型為甲醇利用野生型。
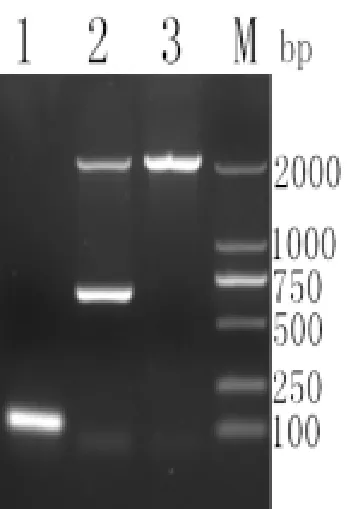
圖4 高抗性菌株鑒定
2.5重組酵母X-33-Gal-13的誘導表達
利用甲醇對重組酵母X-33-Gal-13進行誘導表達,重組菌株在誘導表達24h,Tricine-SDS-PAGE電泳后在約5.9 ku的位置出現目的條帶,該條帶的蛋白中含有His標簽,大小與預期結果一致(圖5)。凝膠薄層灰度掃描結果顯示,24~72h目的蛋白占菌體自身分泌總蛋白的百分比分別約為18.2%、20.0%、27.2%,誘導表達72h目的蛋白所占比例明顯升高。

圖5 畢赤酵母X-33-Gal-13誘導表達上清Tricine-SDS-PAGE
2.6表達產物的抑菌活性
重組酵母X-33-Gal-13誘導表達72h的表達產物對雞白痢沙門菌的抑菌圈直徑平均值為11.78mm,對金黃色葡萄球菌的抑菌圈直徑平均值為12.56mm,比前者抑菌效果更加明顯,結果如圖6A,B所示。
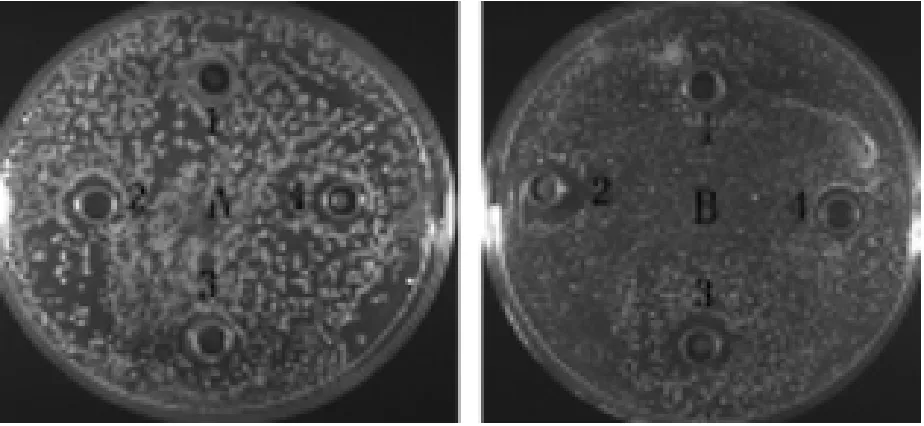
圖6 Gal-13抑菌活性分析結果
2.7耐熱性分析
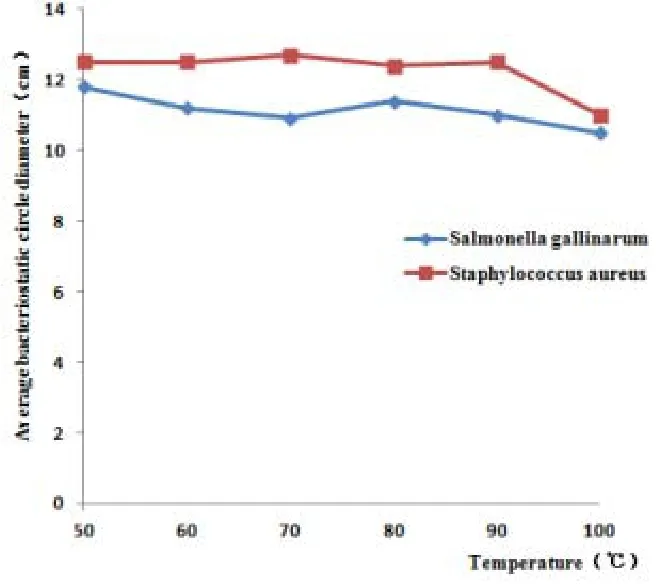
圖7 耐熱性分析
通過對不同溫度處理重組酵母X-33-Gal-13誘導表達的上清液,處理Gal-13抑菌活性的分析,發現溫度對Gal-13的抑菌效果無明顯影響。圖7表明Gal-13在100℃的條件下,處理15min后,對雞白痢沙門氏菌和金黃色葡萄球菌依然具有抑菌活性,雖然均有所下降,但幅度較小,表現出較好耐熱性。
3 討論
防御素作為一種新型的生物活性肽,其抗菌譜廣泛,與抗生素阻斷大分子生物合成的作用機制完全不同,防御素能夠快速殺滅廣譜病原微生物,而且作為機體本身的一種活性物質,相對不具有免疫原性,對其具有抵抗性的細菌較少,病原菌也不易對其產生耐藥性,因此可以替代抗生素發揮廣譜高效的抗菌作用(Risso等,2000)。但防御素天然產量低,合成或從機體中提取步驟復雜、產量低,價格相當昂貴,利用基因工程技術生產防御素具有現實意義(馮興軍等,2006)。
從實驗室構建的雞pDM-19-T-Gal-13的質粒,通過對引物的設計,去掉其序列中的信號肽、前導肽序列,成功獲得成熟肽序列,將其亞克隆到Gal-13的原核表達質粒中,首次實現了Gal-13大腸桿菌中得到高效表達,表達產物以包涵體形式存在,有利于避免其被宿主菌蛋白酶的降解,同時避免防御素對表達菌株的損傷。另外,Gal-13含有GST標簽,便于目的蛋白的篩選、鑒定和純化(吳靜等,2013;王海英,2008)。同時,通過分離純化目標蛋白并對雞源大腸桿菌和金色葡萄球菌進行抑菌活性試驗,結果純化的目標蛋白對兩株病原菌具有一定的抑制作用(另文報道)。結果為進一步研究重組蛋白Gal-13的生物學特性和其作為一種新型抗菌肽藥物制劑在畜牧業中的應用奠定一定的基礎。
畢赤酵母表達系統具有易于操作,發酵密度高,表達量高等優勢,被越來越多的應用于外源基因蛋白的表達,并且已經成功表達了多種外源蛋白(Gil de Los Santos等,2012)。本試驗以畢赤酵母X-33為宿主菌,用分泌表達載體pPICZαA構建了重組表達系統,目的蛋白以分泌形式表達于培養基中,這樣不僅避免了產物被細胞內蛋白酶降解和因產物在細胞內堆積所造成的毒性作用而影響細胞代謝,而且大大簡化了產物的分離純化過程,為工業化大規模生產提供了便利條件。該成熟肽的抑菌活性試驗表明,其對雞白痢沙門氏菌和金黃色葡萄球菌菌具有一定的抑制作用,抑菌活性雖然較弱,但其對溫度有較好的耐受性。本研究初步證實了其具有生物活性,彌補了Gal-13在真核表達系統方面的空缺,為防御素Gal-13生產工藝的建立提供了依據,也為進一步研究Gal-13的作用機制以及在生物體內的生物學功能奠定了理論基礎。
4 結論
本研究成功構建獲得重組原核表達質粒pGEX-4T-1-Gal-13和真核表達載體 pPICZα-A-Gal-13及重組質粒轉化到大腸桿菌BL21和酵母X-33,Gal-13融合蛋白在大腸桿菌和酵母中得到大量表達,原核表達分子量是31ku并以包涵體的形式存在,真核表達的分子量5.9 ku并分泌到發酵液中,表達產物對病原菌具有抑菌活性和具有較好的耐熱性。
[1]馮興軍,王建華,單安山,等.抗菌肽基因工程研究及其表達策略[J].中國生物工程雜志,2006,26(3):63-67.
[2]冀君,陳燕珊,張祥斌,等.廣西黃雞β-防御素基因的克隆、序列分析與組織分布[J].華南農業大學學報,2008,29( 3):61-65.
[3]王海英.雞β-防御素2(Gal-2)基因在大腸桿菌中的融合表達與純化[J].家禽科學,2008,12:7-10.
[4]吳靜,史玉穎,等.雞β-防御御素-1基因在大腸桿菌中的融合表達及其初步純化與抗菌活性測定[J].家禽科學, 2013,(1):6-11.
[5]王璟,楊玉榮,梁紅德等.禽類防御素作用機理及基因工程研究進展[J].動物醫學進展,2007,28(10):82-84.
[6]王新衛,康相濤.禽類防御素研究進展[J].動物醫學進展,2006,27(12)35-37.
[7]楊玉榮,等.雞抗茵肽Gal-13的分離提取及其對雛雞免疫的影響和作用機理研究[D].北京:中國農業大學,2006.
[8]楊玉榮,佘銳萍,彭開松.雞腸道抗菌肽Gal-13的乙醇提取及其工藝優化 [J].西北農林科技大學學報,2008,36,(9): 22-25.
[9]袁雪波,郭榮富,陳恒燦等.β-防御素的研究進展及其應用前景[J].獸藥與飼料添加劑2009,14(2)23-25.
[10]張輝華,畢英佐,曹永長,等.胡須雞防御素Gal-1-Gal-13基因克隆、序列分析與組織分布[J].農業生物技術學報,2008,16(4):597-603.
[11]張祥斌,謝青梅,馬靜云,等.絲羽烏骨雞β-防御素的克隆與序列分析[J].廣東畜牧獸醫科技,2008,33(4):22-25.
[12]Evans E w,Beach G G,wunderlich J,et al.Isolation of antimicrobial peptides fromavian heterophils[J].J Leukoc Biol, 1994,56(5):66l-665.
S916.7
A
1005-8613(2016)11-0038-05
2016-9-6

