Ca(ClO)2消毒劑對高羊茅種子的消毒效果
尚 丹,文昭竹,龔梨霞,穆 麟,張志飛,2*
(1 湖南農業大學農學院,長沙 410128; 2 湖南農業大學草業科學研究所,長沙 410128)
?
Ca(ClO)2消毒劑對高羊茅種子的消毒效果
尚 丹1,文昭竹1,龔梨霞1,穆 麟1,張志飛1,2*
(1 湖南農業大學農學院,長沙 410128; 2 湖南農業大學草業科學研究所,長沙 410128)
為研究Ca(ClO)2對高羊茅種子作為外植體誘導培養愈傷組織時的消毒效果,以3種不同的前處理方式配合Ca(ClO)2溶液不同濃度(3%、20%)和不同消毒時間(15、30、45、60 min)進行高羊茅種子消毒處理,以升汞消毒劑處理的高羊茅種子為對照。愈傷組織誘導培養結果表明:僅用Ca(ClO)2攪拌的前處理的感菌率顯著高于其余兩種前處理;Ca(ClO)2高濃度處理比低濃度處理的出愈率低;Ca(ClO)2處理的出愈率和愈傷總數均優于升汞處理;最佳的消毒組合是無菌環境下用Ca(ClO)2攪拌+3% Ca(ClO)2浸泡60 min,該消毒處理方式可降低種子感菌率、縮短出愈時間、提高出愈系數,為建立高羊茅高效再生體系奠定實驗基礎。
高羊茅;組織培養;消毒;次氯酸鈣
高羊茅(FestucaarundinaceaSchreb)是多年生禾本科羊茅屬(Festuca)草本植物,在我國廣泛用于低成本的水土保持及草坪綠化[1]。基因工程是高羊茅遺傳改良的重要方向,再生體系的建立是基因工程研究的基礎。高羊茅莖尖培養[2],愈傷組織[3]、原生質體[4]、胚性懸浮培養細胞獲得再生植株[5]和直接用高羊茅花藥進行培養獲得再生植株的研究已初具成效[6,7]。目前以種子為外植體誘導愈傷組織構建再生體系是高羊茅組織培養的主要方法。愈傷組織培養體系中防止污染是首要克服的問題,在保證熟練操作和提高培養室潔凈度的前提下,外植體消毒方法成為影響愈傷組織誘導成功的關鍵因素[8]。
升汞(HgCl2)是較常用的外植體消毒劑,常用的組合是75%乙醇加0.1%升汞[9,10],但處理完的Hg2+難以徹底清除,對種子發育相關酶產生毒害,導致出愈率低下、出愈時間延長[11]。Ca(ClO)2常溫下保存較穩定,遇水生成具有強氧化性的次氯酸,處理后容易清除且殘留消毒液易揮發,是一種較好的消毒劑。本實驗設計3種不同前處理方式結合后期Ca(ClO)2溶液不同的消毒時間和濃度,以升汞處理為對照,探討最佳Ca(ClO)2消毒組合,為快速高效構建高羊茅再生體系提供技術支持。
1 材料與方法
1.1 實驗材料
4個高羊茅品種:獵狗5號(Houndog 5)、水城(Shuicheng)、斗牛Ⅱ(Endeavor Ⅱ)、埃斯卡拉迪(Easycare)。水城為貴州省草業研究所提供,其他為百綠公司提供。
采用MS培養基(Murashige and Skoog,1962)為基本培養基,并添加10 mg/L 2,4-D。
1.2 實驗方法
1.2.1 消毒處理方法
(1)種子消毒處理方式
A處理(僅用Ca(ClO)2攪拌):完整的高羊茅‘獵狗5號’種子用3%Ca(ClO)2溶液室溫磁力攪拌3 h(78HW-1數顯恒溫磁力攪拌器,1800 rpm,下同),無菌水沖洗,4℃過夜;用無菌水搓種至無外稃脫落。次日在無菌環境下將前處理完的種子分成3份進行消毒處理。1)3%Ca(ClO)2處理:用3%Ca(ClO)2浸泡種子進行表面消毒,時間分別為15、30、45、60 min;2)20%Ca(ClO)2處理:用20%Ca(ClO)2(飽和次氯酸鈣)浸泡,時間分別為15、30、45、60 min;3)對照:75%乙醇浸泡5 min,0.1%升汞浸泡15 min。
B處理(溫水浸泡加Ca(ClO)2攪拌):完整的高羊茅‘獵狗5號’種子在50℃溫水中浸泡4 h,無菌水沖洗,再用3%Ca(ClO)2溶液室溫磁力攪拌3 h,無菌水沖洗,4℃過夜;用無菌水搓種至無外稃脫落。次日在無菌環境下將前處理完的種子分成3份進行消毒處理。1)3%Ca(ClO)2處理:用3%Ca(ClO)2浸泡,時間分別為15、30、45、60 min;2)20%Ca(ClO)2處理:用20%Ca(ClO)2浸泡,時間分別為15、30、45、60 min;3)對照:75%乙醇浸泡5 min,0.1%升汞浸泡15 min。
C處理(無菌環境下Ca(ClO)2攪拌):完整的高羊茅‘獵狗5號’種子用3%Ca(ClO)2溶液在室溫無菌環境下磁力攪拌3 h,無菌水沖洗,4℃過夜。次日在無菌環境下將前處理完的種子分成3份進行消毒處理。1)3%Ca(ClO)2處理:分別用3%Ca(ClO)2溶液室溫無菌環境下磁力攪拌15、30、45、60 min;2)20%Ca(ClO)2處理:分別用20%Ca(ClO)2溶液室溫無菌環境下磁力攪拌15、30、45、60 min;3)對照:75%乙醇浸泡5 min,0.1%升汞浸泡15 min。
(2)愈傷組織培養
消毒處理后的種子分別接種于愈傷誘導培養基(MS+10 mg/L 2,4-D)中,每個處理接種20個培養皿,每個培養皿30粒種子,25±1℃,24 h暗培養。20 d后統計感菌率、出愈率、發芽率Ⅰ和愈傷總數。
1.2.2 不同品種高羊茅驗證最優消毒處理方式
(1)不同品種高羊茅種子發芽實驗。4個高羊茅品種種子進行濾紙發芽實驗,每個處理4次重復,每個重復30粒種子,于人工氣候箱中(25℃,16 h光照/18℃,8 h黑暗)培養,逐日觀察記錄發芽種子數,期間濾紙保持濕潤狀態。9 d后統計發芽率Ⅱ、發芽勢、發芽指數。
(2)最優消毒處理方式的驗證。根據上面的消毒實驗結果選擇最優組合,選取4個品種的高羊茅種子,每品種接種20個培養皿,每個培養皿30粒種子,25±1℃,24 h暗培養。20 d后統計感菌率、出愈率、發芽率Ⅰ和愈傷總數。
1.3 測定指標
感菌率=[接種20 d后感菌的培養皿數/接種的培養皿數]×100%
發芽率Ⅰ=[接種后20 d發芽的高羊茅種子數/接種的高羊茅種子數]×100%
出愈率=[20 d后產生的愈傷組織的高羊茅種子數/接種的高羊茅種子數]×100%
發芽率Ⅱ=[發芽實驗第9天的發芽種子數/總種子數]×100%
發芽勢=[發芽實驗第5天的發芽種子數/總種子數]×100%
發芽指數=ΣGt/Dt
式中:Gt為不同時間(d)的發芽量;Dt為相應的發芽實驗天數。
所有數據均采用SPSS19.0統計分析軟件進行處理。對3種不同前處理方式,4個品種種子的發芽率Ⅰ、出愈率分別進行最小顯著差數法多重比較(LSD);以降序排列各發芽率Ⅰ、出愈率和愈傷總數,以升序排列感菌率來對不同處理的消毒效果進行秩和比(RSR)排序。
2 結果與分析
2.1 不同前處理方式的種子消毒效果
2.1.1 A前處理方式的消毒效果
最小顯著差數法多重比較結果表明:Ca(ClO)2溶液在不同的濃度和處理時間下的發芽率Ⅰ和出愈率均有顯著差異(p<0.05)。A1、A3、A4的發芽率Ⅰ顯著高于A2,也顯著高于A5~A8及A-CK。A1~A4處理間的出愈率無顯著差異,但顯著高于A5~A8處理的出愈率;A5~A8處理和A-CK的出愈率無顯著差異。A+3%Ca(ClO)2處理的種子感菌率普遍高于A+20%Ca(ClO)2處理和A對照(表1)。
綜合評價(RSR)表明,A+Ca(ClO)2處理的綜合效果均優于A-CK;A處理最佳組合是A7,即A +20%Ca(ClO)2浸泡45 min。
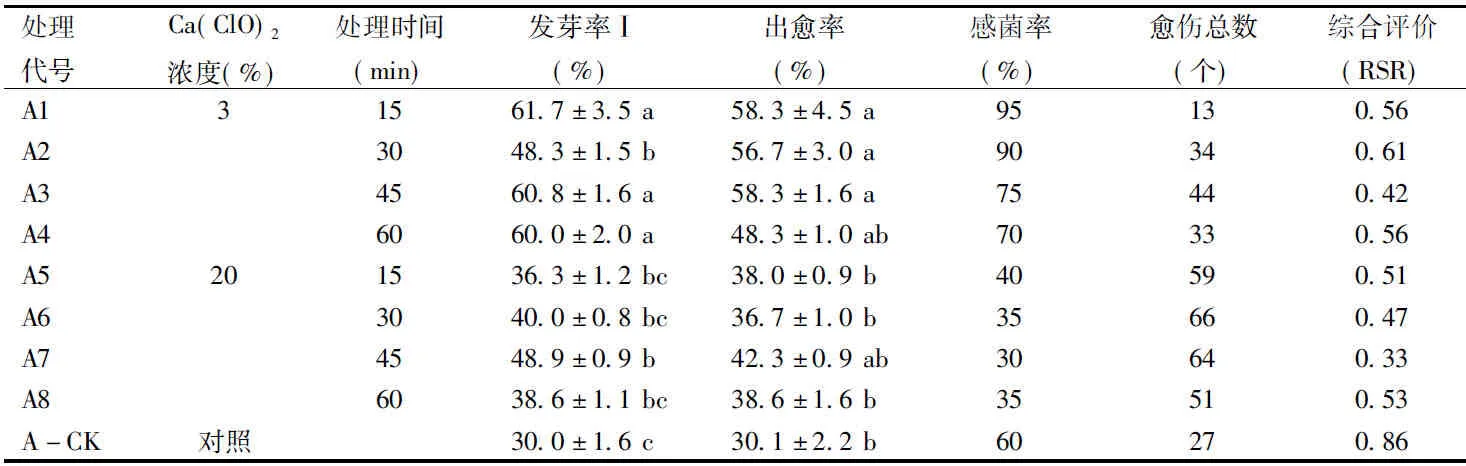
表1 A前處理的消毒效果Table 1 Disinfection effect of A pre-treatments
2.1.2 B前處理方式的消毒效果
由表2可知,B前處理下各組的發芽率Ⅰ和出愈率間均存在顯著差異(p<0.05)。B1~B4處理的種子發芽率Ⅰ間無顯著差異,但都顯著高于B7、B8和B-CK的發芽率Ⅰ。B+3%Ca(ClO)2浸泡處理的出愈率顯著高于B+20%Ca(ClO)2浸泡處理和B對照。B前處理下的感菌率得到了穩定控制,除B2、B7、B-CK外,其余處理的感菌率均小于或等于20%。B+3%Ca(ClO)2浸泡處理的愈傷總數明顯高于B前處理下其他兩種處理。
綜合評價結果,B+Ca(ClO)2處理的消毒方法明顯優于B對照,且低濃度Ca(ClO)2處理優于高濃度處理;B前處理最佳組合是B1,即B+3%Ca(ClO)2浸泡15 min。
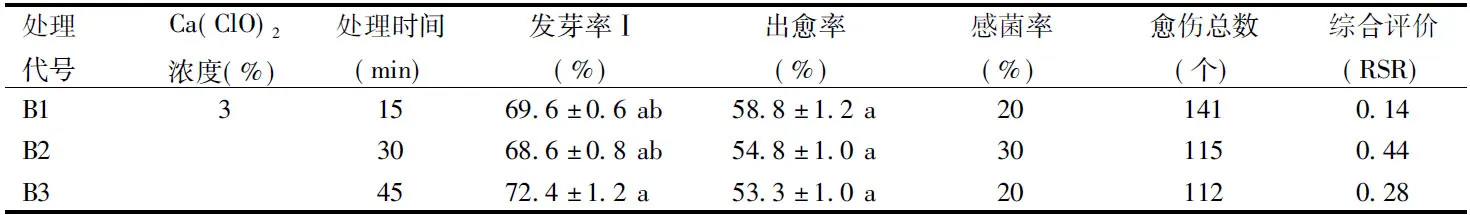
表2 B前處理的消毒效果Table 2 Disinfection effect of B pre-treatments
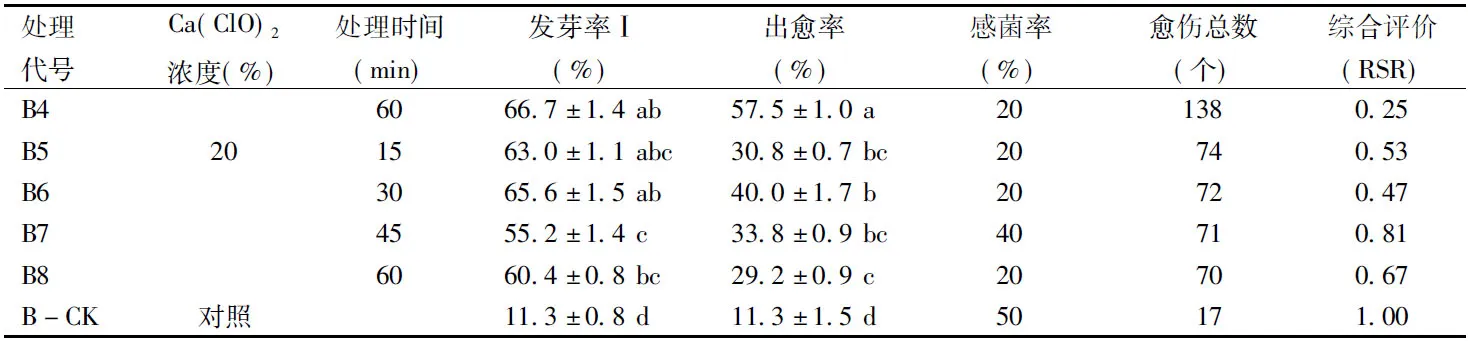
(續表2)
2.1.3 C前處理的消毒效果
由表3可知,C5、C6處理的發芽率Ⅰ顯著高于其他處理(p<0.05);C1、C2、C4處理的出愈率顯著高于其他處理(p<0.05),其中C4處理的愈傷總數最多;C-CK的發芽率Ⅰ和出愈率都顯著低于C+Ca(ClO)2處理;C+3%Ca(ClO)2處理和C-CK的感菌率略高于C+20%Ca(ClO)2處理,但總體都優于A、B兩種前處理,維持在25%以下。
綜合評價結果,C+Ca(ClO)2處理的消毒方法明顯優于C對照的消毒方法,且Ca(ClO)2低濃度處理獲得的愈傷總數高于高濃度處理;C處理最佳組合是C4,即C+3%Ca(ClO)2浸泡60 min。
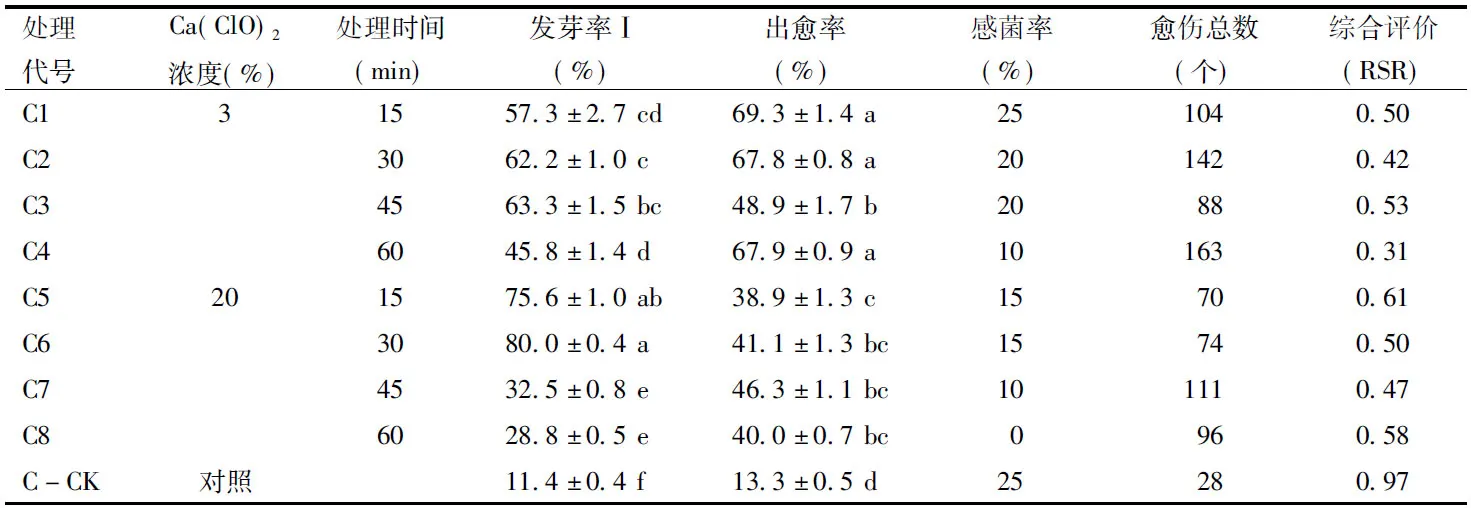
表3 C前處理的消毒效果Table 3 Disinfection effect of C pre-treatments
2.1.4 三種不同前處理方式對高羊茅種子消毒效果的綜合評價
根據以上3種不同前處理方式的消毒結果發現,3種前處理+Ca(ClO)2處理的綜合評價都優于各自對照處理。A前處理方式的感菌率明顯高于B、C前處理方式,而C前處理方式在出愈率、愈傷總數和感菌率上整體優于A、B前處理方式。根據組織培養實驗的基本要求:操作簡便、藥品毒性小、處理時間短、可快速獲得愈傷并建立高效的再生體系等,最終選擇C+3%Ca(ClO)2浸泡60 min為最佳處理方式。
2.2 不同品種高羊茅種子的發芽實驗
隨機選擇實驗室保存的4個高羊茅品種用于消毒處理方法的驗證。如表4所示,獵狗5號和斗牛Ⅱ種子的發芽率Ⅱ高于80%,發芽勢超過60%,發芽指數超過15。而埃斯卡拉迪和水城的發芽率Ⅱ、發芽勢、活力指數顯著低于獵狗5號和斗牛Ⅱ(p<0.05)。發芽實驗結果表明,4個品種的種子在相同實驗條件下活力差異較大,可以保證種子選擇的多樣性。
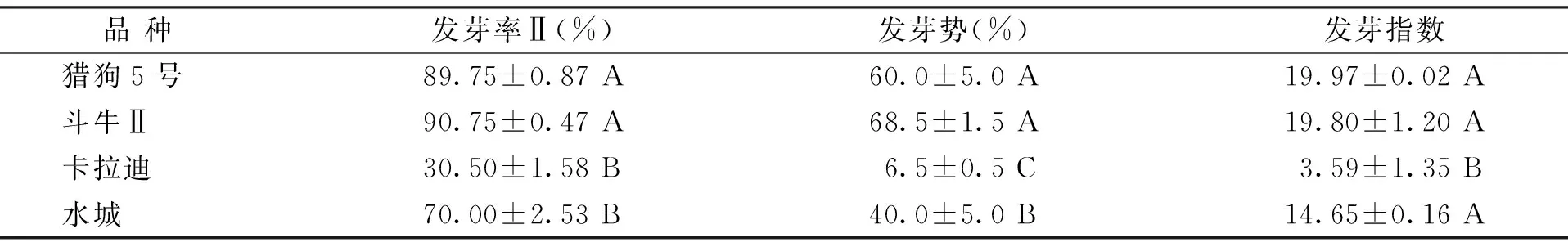
表4 不同品種高羊茅種子的發芽率、發芽勢和發芽指數Table 4 Seed germination percentage,germination potential and germination index of different tall fescue varieties
2.3 最優消毒處理下不同品種高羊茅種子的表現
4種高羊茅種子在C+3%Ca(ClO)2浸泡60 min消毒后接種,進行愈傷組織誘導培養,結果表明:不同品種種子間感菌率都維持在30%以下(表5),整體的消毒效果較好。因為基因型差異,消毒處理后的4種高羊茅種子間的發芽率Ⅰ和出愈率差異顯著(p<0.05),造成出愈總數有較大的差異。
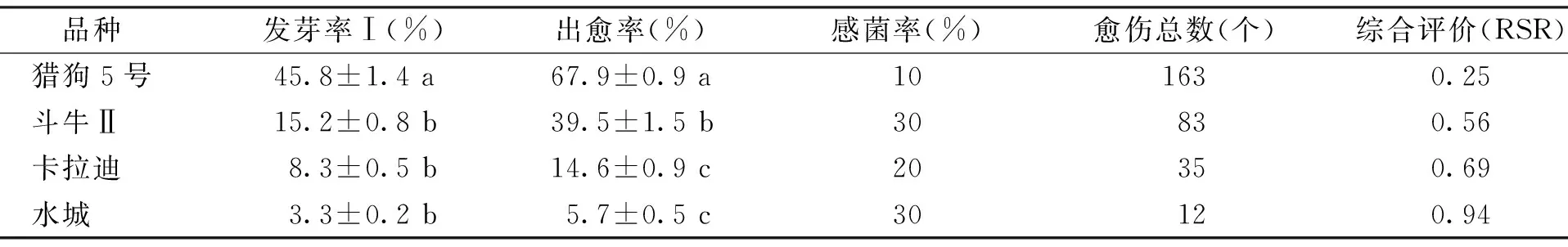
表5 C+3%Ca(ClO)2浸泡60 min下不同品種的高羊茅種子消毒效果比較Table 4 Comparison about the disinfection effect of different tall fescue variety seeds under C+3% Ca(ClO)2 60 min
3 討論與結論
在愈傷組織培養中外植體消毒是為了獲得無菌外植體用于誘導愈傷,感菌率是種子消毒效果最直接的反映[12,13]。種子消毒中常用的消毒劑有次氯酸鈣、次氯酸鈉、升汞、溴水、過氧化氫、抗生素等[14~16],其中75%乙醇加0.1%升汞被廣泛使用。張付遠等[17]研究表明,0.1%升汞在消毒野生鳳仙花時感菌率僅為10%;張瑞越等[18]、郭麗等[19]也證明在油菜和雞冠花種子中升汞的消毒效果最好。乙醇具有殺菌力和穿透力,有利于其他消毒劑的滲入,但殘留的汞離子滲入種子不僅難洗凈而且會抑制愈傷生長,廢液還會給環境造成較大污染[20]。次氯酸鈣和次氯酸鈉的消毒原理相同,都是用產生的氯氣消毒,殘留消毒液易揮發,毒性小,對環境的污染也比較小。但根據本實驗室前期的實驗結果發現,次氯酸鈉消毒后的高羊茅愈傷容易產生毛狀根,導致繼代時操作困難,甚至無法繼代。另外,由于次氯酸鈉屬于揮發性液體,貯存過程中濃度變化較大,開封后不能久置,較難保證消毒效果的穩定。因此,本實驗選擇用次氯酸鈣來代替升汞和次氯酸鈉,對其消毒濃度和時間進行調整,以摸索出最適的條件,同時根據發芽實驗下測得不同品種高羊茅的發芽率Ⅱ、發芽勢、發芽指數與最適宜處理下測得發芽率Ⅰ、感菌率、出愈率、愈傷總數等7個指標,進行兩兩相關性分析發現:感菌率與其他指標間沒有相關關系,僅與消毒方法密切相關,因此不同的高羊茅品種可以通用一種較好的消毒處理方式。
高羊茅種子較小且具有外稃,消毒過程中容易漂浮于消毒液的表面,導致消毒不徹底,而且高羊茅種子共生著枝頂孢霉屬真菌(Acremoniumspp.),不易被殺滅[21],誘導愈傷組織時容易感菌。本實驗在選擇適宜消毒劑的情況下,利用磁力攪拌方法將種子完全浸泡于消毒液中,使種子與消毒液完全接觸,并配合搓去種皮,將感菌率控制到最低。
本實驗結果表明,滅菌環境下Ca(ClO)2打種+3%Ca(ClO)2浸泡60 min的消毒方法可以將感菌率控制在30%以下,誘導獲得的健康愈傷組織可用于再生體系構建的進一步研究。
[1] 支大英,韓曉光,趙軍勝,等.8種基因型的高羊茅的組織培養與植株再生[J].山東大學學報(理學版),2004(4):109-114.
[2] Kasperbauer MJ,Buckner RC,Springer WD.Haploid plants by Anther-panicle culture of tall fescue[J].Crop Science,1980,20:103-107.
[3] Lowe KW,Conger BV.Root and shoot formation from callus cultures of tall fescue[J].Crop Science,1979,19:397-400.
[4] Dalton SJ.Plant regeneration from cell suspension protoplasts ofFestucaarundinaceaSchreb.(tall fescue) andLoliumperenneL.(perennial ryegrass)[J].Journal of Plant Physiology,1988,132(2):170-175.
[5] Takamizo T,Suginobu KI,Ohsugi R.Plant regeneration from suspension culture derived protoplasts of tall fescue (FestucaarundinaceaSchreb.) of a single genotype[J].Plant Science,1990,72:125-131.
[6] 唐小艷,易自力,蔣建雄,等.高羊茅愈傷組織再生體系研究進展[J].四川草原,2006(5):8-11.
[7] 張志飛,饒力群,陳信波,等.高羊茅再生體系構建的基因型比較研究[J].中國草地學報,2009(5):102-106.
[8] 易自力,陳智勇,蔣建雄,等.三種冷季型草坪草愈傷組織再生體系的建立[J].中南林學院學報,2005(1):25-28.
[9] 劉衛東,刑偉一,文冬才,等.高羊茅組織培養基的選擇[J].中南林學院學報,2005(6):116-119.
[10]欒博宇,耿 慧,王志鋒,等.公農1號紫花苜蓿離體培養中最佳消毒方式和外植體種類的篩選研究[J].山東農業科學,2011(12):35-37.
[11]楊云貴,王紅俊,楊雪嬌,等.消毒處理對高羊茅種子發芽的影響[J].草地學報,2014,22(2):380-385.
[12]劉明稀,郭振飛.不同消毒方式對假儉草種子愈傷誘導的影響[J].草地學報,2012,20(2):383-388.
[13]董文科,馬暉玲,陳春艷.不同消毒劑對甘肅紅豆草種子消毒效果及萌發的影響[J].草原與草坪,2015(4):80-83.
[14]王維飛,韓烈保,曾會明.高羊茅愈傷組織誘導及植株再生的研究[J].草業科學,2006,23(6):99-103.
[15]金忠民,沙 偉,張艷馥,等.羊茅種子愈傷組織誘導及再生體系的建立[J].草業科學,2010,27(10):60-63.
[16]魯黎明,安 影.不同消毒劑對煙草種子消毒效果及萌發的影響[J].種子,2012,31(4):93-95.
[17]張付遠,李丹丹,廖忠明,等.不同消毒劑及激素對江西省野生白花鳳仙花組培誘導的影響[J].現代農業科技,2015(15):164-165.
[18]張瑞越,季 勤,朱陽陽.不同消毒劑對油菜種子消毒效果的比較[J].淮陰師范學院學報(自然科學版),2011,10(2):127-129.
[19]郭 麗,徐 榮.不同消毒方式對接種雞冠花種子影響的研究[J].現代農業,2015(4):62-63.
[20]黃作喜,邱 超,曾楨迦,等.植物組織培養中消毒劑的應用研究進展[J].內江師范學院學報,2013(6):26-30.
[21]梁蕊芳,黃叢林,于 榮,等.高羊茅植株再生體系的研究與建立[J].生物技術通報,2005(3):37-40.
[22]代 亮.草地早熟禾組織培養體系構建及轉化探究[D].北京:北京林業大學碩士學位論文,2012.
Disinfectant Effect of Ca(ClO)2on Tall Fescue Seeds
SHANG Dan1,WEN Zhaozhu1,GONG Lixia1,MU Lin1,ZHANG Zhifei1,2*
(1 College of Agronomy,Hunan Agricultural University,Changsha,Hunan 410128,China;2 Grassland Science Institute,Hunan Agricultural University,Changsha,Hunan 410128,China)
To study the disinfection effect of Ca(ClO)2on tall fescue seeds as explant for callus induction,three different kinds of pre-treatments combined with Ca(ClO)2in different concentrations (3% and 20%) and different times (15,30,45,60 min) were performed in this experiment,with 0.1% HgCl2as control.The results of callus culture showed that infection rate of only Ca(ClO)2was significantly higher than that of other treatments.The callus rate of the treatment with high concentration of Ca(ClO)2was lower than that of low concentration Ca(ClO)2.The callus formation rate and total callus of Ca(ClO)2treatments was higher than that of 0.1% HgCl2treatment.The optimization disinfection treatment was that the tall fescue seeds was stirred in solution of Ca(ClO)2in sterile environment and soaking in the solution of 3% Ca(ClO)260 min,it will reduce seed infection rate,shorten the time and improve the callus numbers,also offer experimental basis for the construction of tall fescue regeneration system.
tall fescue (FestucaarundinaceaSchreb.);ttissue culture;disinfection;calcium hypochlorite
2016-04-19
尚 丹(1991-),女,回族,碩士研究生,Email:563167080@qq.com。*通信作者:張志飛,副教授,博士,研究方向為牧草及草坪草遺傳改良,Email:zzf0917@aliyun.com。
中國博士后科學基金項目(2014M560643);湖南省教育廳優秀青年基金(14B083)。
Q943.1
A
1001-5280(2016)05-0563-06
10.16848/j.cnki.issn.1001-5280.2016.05.19

