紫變青霉生物轉化根皮苷制備根皮素的研究
梅建鳳,李 靚,易 喻,陳建澍,張彥璐,應國清
(浙江工業大學 藥學院,浙江 杭州 310014)
?
紫變青霉生物轉化根皮苷制備根皮素的研究
梅建鳳,李 靚,易 喻,陳建澍,張彥璐,應國清
(浙江工業大學 藥學院,浙江 杭州 310014)
為了開發一種生物轉化根皮苷生成根皮素的工藝,首先從蘋果皮富集培養物中分離篩選微生物菌株,進而優化產酶培養基主要組成、pH和轉化條件,提高根皮素的轉化得率.結果從富集培養物中篩選到一株紫變青霉(Penicilliumpurpurescens)QL-9204菌株,經產酶培養制備的粗酶液能轉化根皮苷為根皮素;在產酶培養基組成為蔗糖2 g/L,(NH4)2SO46 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO41 g/L,pH=6時,QL-9204菌株經種子擴培后接種產酶培養基,于30 ℃,200 r/min條件下培養5 d,濾除菌體的粗酶液中加入80 mg/L的根皮苷,于30 ℃,250 r/min轉化14 h后,根皮素的轉化得率可達90.3%.利用紫變青霉菌QL-9204發酵制備的粗酶液轉化根皮苷制備根皮素,具有方法簡單、轉化得率高和成本低的優勢,有潛在的工業化應用價值.
根皮素;根皮苷;生物轉化;紫變青霉
根皮素(phloretin),又名三羥苯酚丙酮,化學名3-(4-羥基苯基)-1-(2,4,6-三羥基苯基)-1-丙酮,屬于二氫查爾酮化合物.根皮素廣泛存在于荔枝、蘋果、梨等水果以及多種蔬菜中,因在這些植物的根莖或根皮中含量較為集中而得名[1].根皮素具有較好的抗氧化、抗自由基作用,能抑制黑色素細胞活性,對色斑有很好的淡化作用[2];不僅如此,根皮素還具有很好的抗炎和免疫抑制作用[3-4];最新研究表明根皮素還具有抗腫瘤及抗癌活性[5-7].從天然植物中提取根皮素,收率往往較低,得到的多是其糖苷形式,即根皮苷(phlorizin)[8-9].根皮苷可以經酸堿水解得到根皮素.采用酸堿水解法雖然具有成本低的優勢[10-11],但存在轉化專一性差、產品需脫色和易造成環境污染等不足,應用有一定的限制;采用生物法轉化天然產物,往往具有轉化專一性高、條件溫和及產品純度高等優點[12-13].采用生物轉化根皮苷制備根皮素,使用純化的糖苷酶[14],因酶不能回收重復利用,必然導致生產成本較高.如果利用微生物發酵制備含糖苷酶的粗酶液來轉化天然糖苷,只要避免雜酶對苷元結構的水解,就能夠實現轉化目標,則省去酶的分離和純化步驟,可以突破酶制劑成本較高的瓶頸[15].
筆者篩選出轉化專一性較好的微生物菌株,發酵制備含糖苷酶的粗酶液,在粗酶液中加入根皮苷,就能轉化為根皮素,且根皮素不會被水解,可以獲得較高的轉化得率,可以克服酸堿水解和純酶水解法的不足,具有反應條件溫和、專一性強、生產成本低和環境友好的優點.
1 材料和方法
1.1 儀器與試劑
安捷倫1200型高效液相色譜儀(安捷倫科技有限公司),色譜柱為Phenomenex Luna C18鍵合硅膠柱(5 μm,250 mm×4.6 mm);YXQ-LS-70A高壓蒸汽滅菌鍋(上海博迅實業有限公司);SW-CJ-1BU超凈工作臺(蘇州安泰空氣技術有限公司);DHP-9402恒溫培養箱(上海一恒科學儀器有限公司);HZ-9311K恒溫振蕩培養箱(太倉華利達實驗設備有限公司)以及其他常規實驗儀器.
根皮苷和根皮素標準品(西安開來生物工程有限公司,批號分別K141013和K141101,純度98%),以及各類常用的市售色譜純或分析純商品試劑.
1.2 培養基
平板和斜面培養基采用馬鈴薯瓊脂培養基(PDA),種子培養基采用馬鈴薯培養基(PDB)[16];初始產酶培養基的組成:蔗糖5 g/L,蛋白胨5 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO41 g/L,pH=6.所有培養基經121 ℃高壓蒸汽滅菌20 min.
1.3 方 法
1.3.1 菌種的富集與分離
250 mL三角瓶中加入約50 g經粉碎的新鮮蘋果皮,置于28 ℃的恒溫箱培養5 d.用無菌水將長滿霉菌的富集物稀釋106~107倍后,涂布于PDA上,于28 ℃培養2 d,挑取顏色和形態不同的霉菌菌落轉接PDA斜面培養基,置于28 ℃恒溫培養2 d,得孢子豐富的純種菌株斜面.
1.3.2 產酶培養
菌種篩選時,用接種環挑取分離得到的菌株孢子直接接種100 mL產酶培養基;產酶條件優化時,挑取菌種斜面孢子接種PDB種子培養基,于30 ℃,200 r/min振蕩培養2 d,再移取種子液5 mL接種100 mL產酶培養基.接種后的產酶培養基于30 ℃,200 r/min振蕩培養5 d.
1.3.3 根皮苷的生物轉化
微生物產酶培養物用4層紗布過濾,濾液即為粗酶液.取50 mL粗酶液于250 mL三角瓶中,根皮苷用甲醇配制成10 g/L的溶液加入粗酶液中,于30 ℃,250 r/min振蕩轉化8~15 h.
1.3.4 根皮素和根皮苷的質量濃度分析
轉化結束后,取轉化液10 mL用同等體積的乙酸乙酯萃取2 次,合并乙酸乙酯,45 ℃下減壓蒸干,用1 mL甲醇溶解殘留物,經0.45 μm微孔濾膜過濾.用HPLC分析甲醇溶液中根皮苷和根皮素的質量濃度.色譜檢測條件:流動相為V(甲醇)∶V(水)=7∶3,流速0.8 mL/min,柱溫25 ℃,檢測波長280 nm,進樣量10 μL,由相同分析條件下的根皮苷和根皮素質量濃度—峰面積標準曲線計算樣品中的兩者的質量濃度.
2 結果與討論
2.1 轉化菌株的篩選
蘋果皮中根皮苷含量較高,且天然蘋果皮中本身帶有大量的微生物,其中可能會有可以轉化根皮苷的微生物存在,所以用蘋果皮作為微生物分離源,篩選能轉化根皮苷為根皮素的微生物菌株.從蘋果皮富集物中分離到11 個霉菌菌株,利用這些菌株發酵制備的粗酶液轉化根皮苷,在底物質量濃度為20 mg/L時,不同菌株轉化根皮苷生成根皮素得率見表1.
表1 不同分離菌株轉化根皮苷生成根皮素的得率
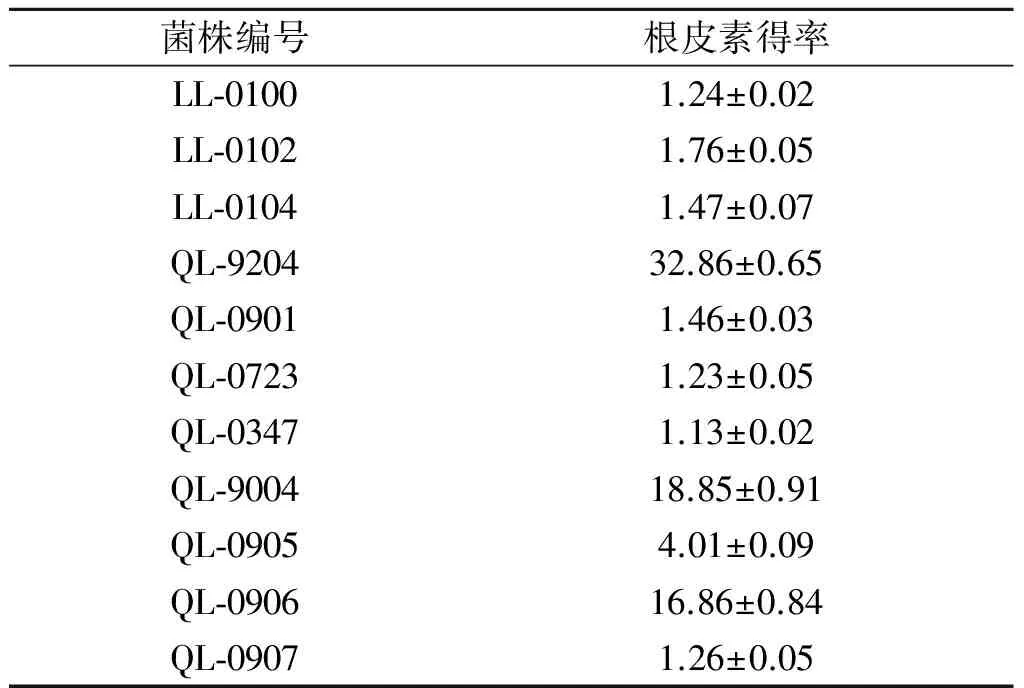
Table 1 The yield of phloretin from phlorizin after bioconversion by different isolated strains %
由表1可知:大部分菌株轉化能力較弱,僅有QL-9204,QL-9004,QL-0906菌株轉化能力較好,其中QL-9204菌株最佳,根皮素的轉化得率達到32.7%.雖然根皮素轉化得率不高,但轉化體系中還有大量根皮苷存在(HPLC分析圖譜見圖1),根皮苷和根皮素的總摩數未降低,說明兩者未被水解,進一步優化產酶培養條件和轉化條件,轉化得率能夠得以提高.
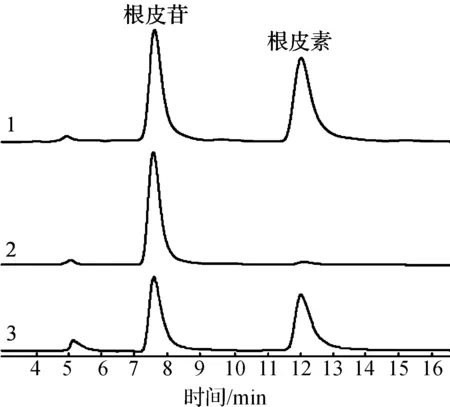
1—根皮苷和根皮素標準品;2—轉化0 h對照;3—QL-9204菌株轉化樣品圖1 根皮苷生物轉化為根皮素HPLC分析圖譜Fig.1 HPLC chromatograms of phlorizin and phloretin after bioconversion
2.2 QL-9204菌株的鑒定
QL-9204菌株接種在PDA平板培養基上,28 ℃培養2 d后,平板表面長出白色絮狀的菌絲體,氣生菌絲長度在1~2 mm,菌落邊緣呈鋸齒狀不整齊,繼續培養3 d后,菌落正面逐漸變灰綠色,背面逐漸變為紫紅色.顯微鏡下觀察菌絲孢子絲呈掃帚狀,1~2 層小梗,分生孢子串呈不分枝的鏈狀,橢圓形,淡黃色,表面粗糙.符合青霉屬(Penicillium)菌株的形態特征.該菌株交由生工生物工程(上海)有限公司進行18S rDNA測序,測得序列長度為1 318 bp.將該序列在GenBank(http://www.ncbi.nlm.nih.gov)上進行BLAST比對,與30 株以上的紫變青霉菌株的18S rDNA序列有99%以上的相似度.綜合QL-9204菌株的形態特征和18S rDNA的序列分析,可以確定QL-9204菌株為一株紫變青霉(Penicilliumpurpurogenum),該菌株提交中國典型培養物保藏中心保藏,保藏編號CCTCC No: M 2015781.
2.3 產酶培養基優化
2.3.1 培養基碳源種類及質量濃度
考察了產酶培養基中碳源種類對根皮素得率的影響,將初始產酶培養基中的蔗糖分別替換為5 g/L的葡萄糖、可溶性淀粉、乳糖和果糖.QL-9204菌株產酶培養制備的粗酶液轉化根皮苷,在底物質量濃度為20 mg/L時,根皮素的轉化得率見圖2.
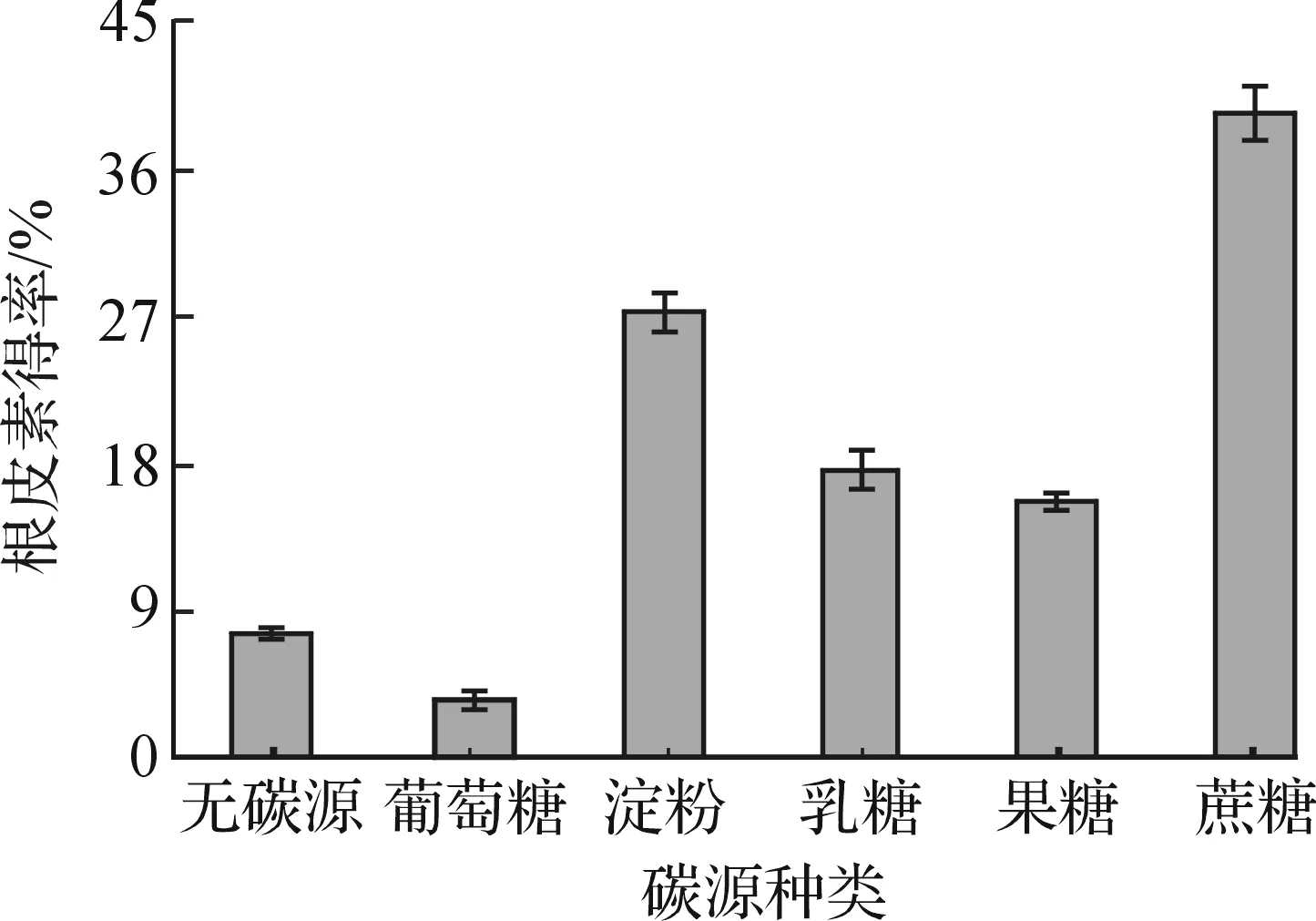
圖2 培養基碳源種類對根皮素轉化得率的影響Fig.2 Effects of different carbon source on the yield of phloretin
由圖2可知:在產酶培養基碳源為單糖葡萄糖時,QL-9204菌株產酶轉化根皮苷生成根皮素的得率最低,甚至低于不加碳源時的得率;而碳源為二糖或多糖時,根皮素得率則顯著提高,說明轉化根皮苷為根皮素的糖苷酶需要含糖苷鍵的糖類誘導生成.在碳源為蔗糖時,根皮素得率最高,達到39.3%,進而考察了蔗糖質量濃度對根皮素轉化得率的影響,結果見圖3.
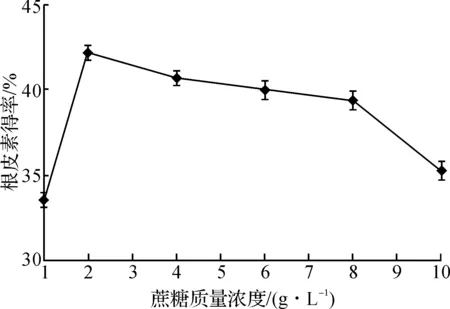
圖3 蔗糖質量濃度對根皮素轉化得率的影響Fig.3 Effects of sucrose concentration on the yield of phloretin
由圖3可知:當蔗糖質量濃度為2 g/L時,根皮素的轉化得率最高,達到了42.2%.當蔗糖質量濃度提高時,菌體生物量雖然有明顯增加,但根皮素的轉化得率反而降低,這可能是因為菌體生長過旺,產生的水解酶對根皮素的降解作用增強.
2.3.2 培養基氮源種類與質量濃度
考察了不同種類的氮源對根皮素轉化得率的影響.選取蛋白胨、酵母浸出粉、牛肉膏、(NH4)2SO4和NaNO3作為培養基中的氮源,不同氮源的培養基含氮質量濃度均配制為1 g/L.QL-9204菌株產酶培養制備的粗酶液轉化根皮苷,在底物質量濃度為20 mg/L時,根皮素的轉化得率見圖4.
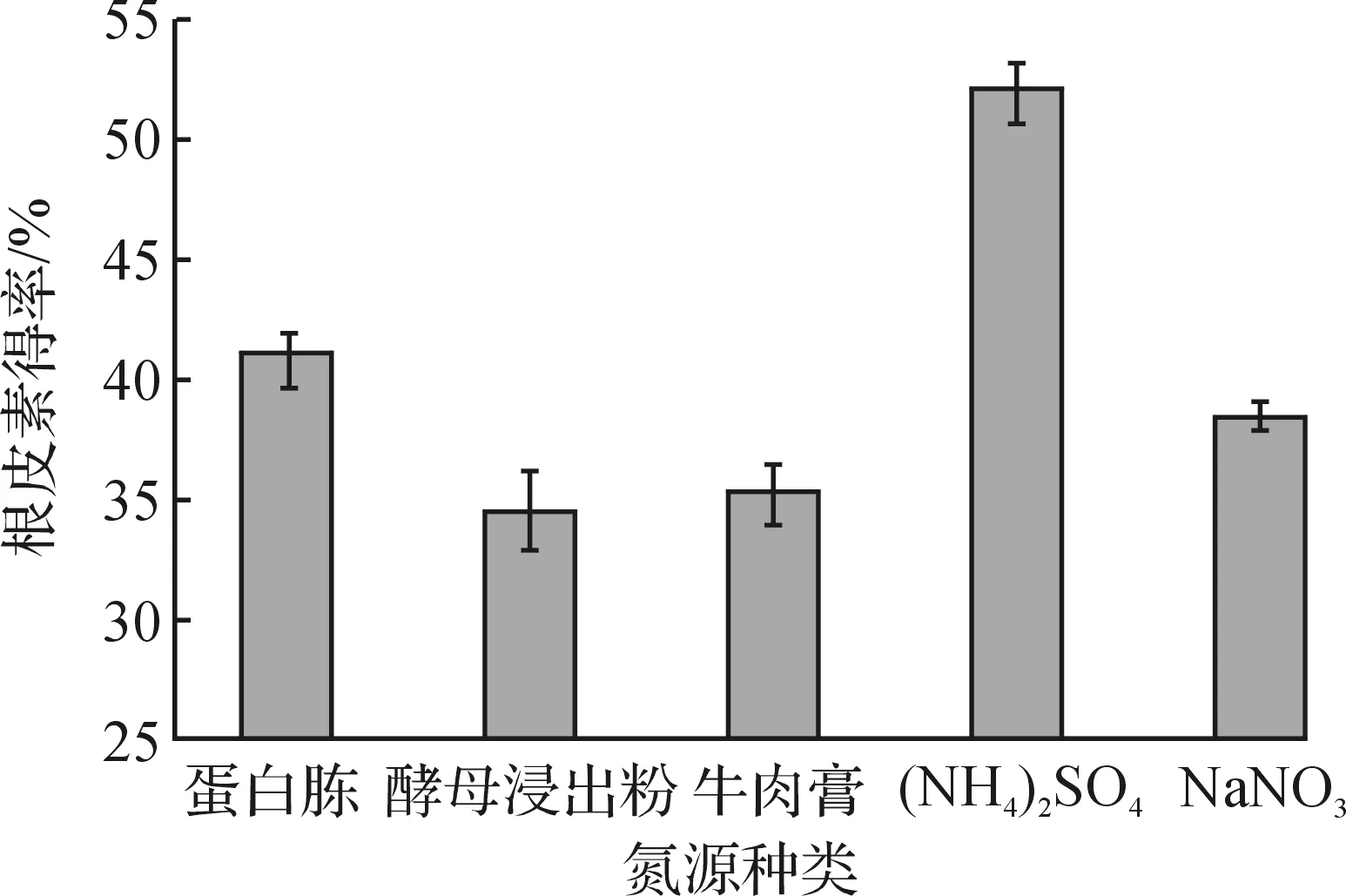
圖4 培養基氮源種類對根皮素轉化得率的影響Fig.4 Effects of different nitrogen source on the yield of phloretin
由圖4可知:產酶培養基氮源為(NH4)2SO4時(質量濃度為4.72 g/L),根皮素的轉化得率最高,達到51.9%.進而考察了產酶培養基中的(NH4)2SO4質量濃度對根皮素轉化得率的影響,結果見圖5.
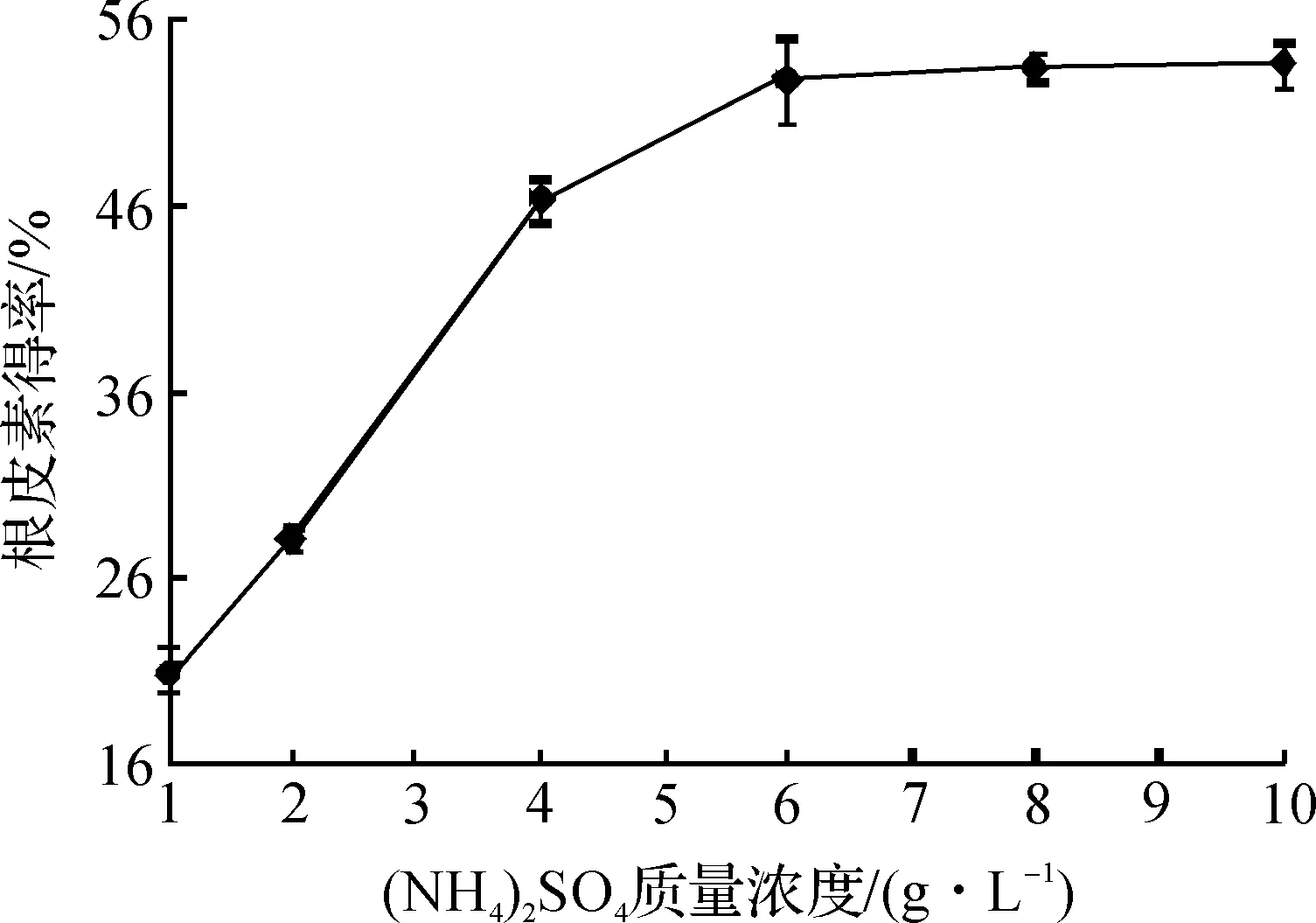
圖5 (NH4)2SO4的質量濃度對根皮素轉化得率的影響Fig.5 Effects of (NH4)2SO4 concentration on the yield of phloretin
由圖5可知:在(NH4)2SO4質量濃度從1 g/L增加到6 g/L時,根皮素的轉化得率隨(NH4)2SO4質量濃度增加而提高,之后便不再增加,所以最佳的(NH4)2SO4質量濃度為6 g/L,此時根皮素的轉化得率為52.7%.
2.3.3 培養基初始pH
不同初始pH對微生物的生長和產酶活性有很大的影響,便考察了產酶培養基初始pH對根皮素得率的影響.在產酶培養基組成為蔗糖2 g/L,(NH4)2SO46 g/L,NaCl 5 g/L,KH2PO45 g/L,MgSO41 g/L,MnSO41 g/L時,用濃度為2 mol/L的HCl或NaOH將培養基初始pH調成4~7.QL-9204菌株產酶培養制備的粗酶液轉化根皮苷,在底物質量濃度為20 mg/L時,根皮素的轉化得率見圖6.

圖6 培養基初始pH對根皮素轉化得率的影響Fig.6 Effects of initial medium pH on the yield of phloretin
由圖6可知:在培養基初始pH對QL-9204菌株產酶轉化根皮苷為根皮素的得率有顯著影響,在初始pH低于6時,隨初始pH的升高,根皮素轉化得率顯著提高;初始pH為6時,得率最高;初始pH高于6之后,轉化得率便顯著下降.
2.4 轉化條件的優化
2.4.1 底物的質量濃度
為了提高轉化率和產率,首先對底物根皮苷質量濃度進行優化,底物的添加質量濃度分別為20,40,60,80,100,120 mg/L.QL-9204菌株產酶培養制備的粗酶液轉化根皮苷,根皮素的轉化得率見圖7.
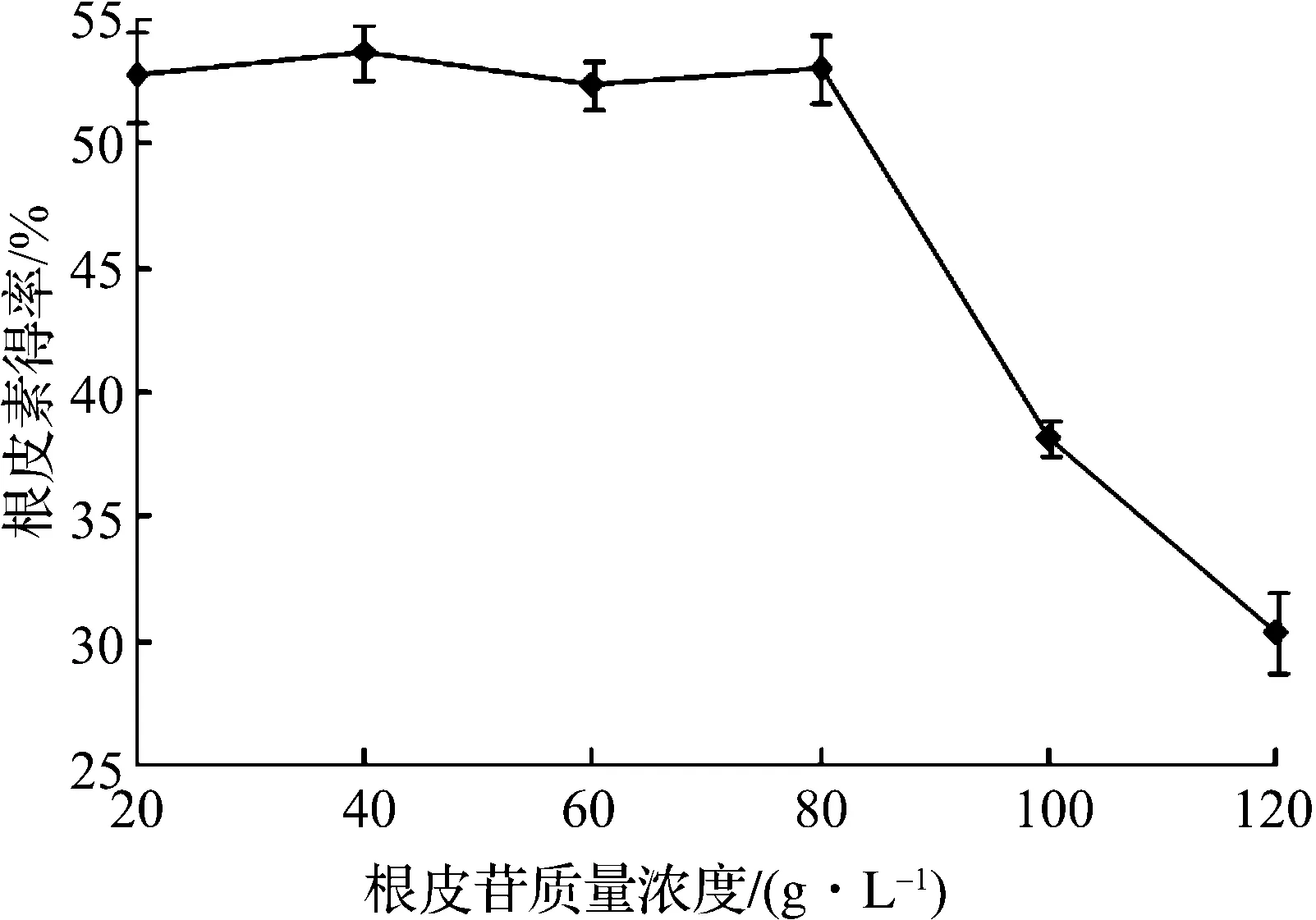
圖7 根皮苷的質量濃度對根皮素轉化的影響Fig.7 Effects of phlorizin concentration on the yield of phloretin
由圖7可知:在根皮苷的質量濃度達到80 mg/L之前,根皮素的轉化得率均能達到50%以上,之后便迅速下降,所以底物根皮苷的質量濃度需在80 mg/L以下.
2.4.2 轉化時間
考察了轉化時間對根皮素轉化得率的影響,QL-9204菌株產酶培養制備的粗酶液轉化根皮苷,在底物質量濃度為80 mg/L時,根皮素的轉化得率見圖8.
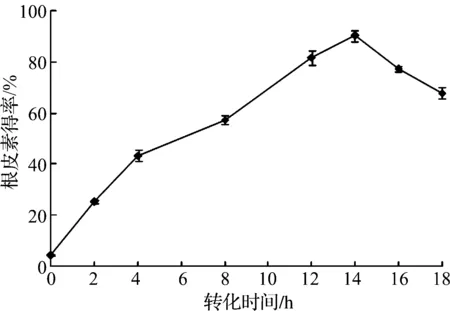
圖8 轉化時間對根皮素轉化得率的影響Fig.8 Effects of bioconversion time on the yield of phloretin
由圖8可知:隨著轉化時間的延長,根皮素的得率逐漸提高,轉化14 h時,根皮素的得率達到最高,達90.3%;之后在顯著下降,說明QL-9204菌株的粗酶液中存在根皮素的水解酶,轉化時間過長則導致根皮素的水解.
考察轉化溫度和振蕩轉速對根皮素得率的影響,結果表明最佳轉化溫度仍然為30 ℃,振蕩速度對轉化得率無顯著影響.重復批次實驗結果表明:在底物根皮苷質量濃度為80 mg/L,30 ℃,250 r/min條件下轉化14 h,根皮素的得率均能在90%以上.
3 結 論
近些年來,生物轉化技術在天然產物化學中的應用,取得了豐碩的研究成果.將生物轉化技術運用于中藥成分的結構修飾,可以提高一些中藥成分的生物活性或降低毒性和副作用,是實現中藥現代化的重要途徑之一.糖苷類化合物是許多中藥的主要有效成分,但糖苷類化合物分子具有極性大、脂溶性差和分子量大的特點,不易透過腸壁粘膜被吸收.去除糖基的苷元產物極性小、脂溶性增加,更容易透過腸壁進入血液循環,進而發揮更好的藥效.根皮苷大量存在于一些植物中,但生物活性遠遠不如根皮素,所以采用生物轉化法將根皮苷轉化為根皮素,是生產根皮素的有效途徑之一.本研究從蘋果皮微生物富集物中篩選到一株紫變青霉菌QL-9204菌株,該菌株能專一性的轉化根皮苷生成根皮素,但幾乎不產生水解苷元結果的酶,經產酶培養基和轉化條件優化后,在底物根皮苷濃度為80 mg/L,根皮素的轉化得率可達90.3%,顯著高于已有的報道的59.01%轉化率[17](底物質量濃度60 mg/L),所以本工藝具有方法簡單、轉化得高和成本低的優勢,進一步研究可以增加底物質量濃度,提高產量,便具有一定的工業化應用價值.
[1] 李秉擘.具有生物活性的天然產物根皮素的合成與純化的相關研究[D].杭州:浙江大學,2012.
[2] 王建新,周忠,王建國.根皮素抑酪氨酸酶活性研究[J].香料香精化妝品,2002(2):4-5.
[3] 陸曉宇,曾耀英,葉燕霞,等.根皮素的抗炎和免疫抑制作用(英文)[J].藥學學報,2009(5):480-485.
[4] REZK B M, HAENEN, GRMM, et al. The antioxidant activity of phloretin: the disclosure of a new antioxidant pharmacophore in flavonoids[J]. Biochemical and biophysical research communications,2002,295(1):9-13.
[5] ABKIN S V, OSTROUMOVA O S, KOMAROVA E Y, et al. Phloretin increases the anti-tumor efficacy of intratumorally delivered heat-shock protein 70 kDa (HSP70) in a murine model of melanoma[J]. Cancer immunology immunotherapy,2015,65(1):1-10.
[6] LU M, KONG Q, XU X, et al. Evaluation of apoptotic and growth inhibitory activity of phloretin in BGC823 gastric cancer cell[J]. Tropical journal of pharmaceutical research,2015,14(1):27-31.
[7] 王會,劉政,吳漢東.根皮素對肝癌細胞HepG-2增殖和凋亡的影響[J].中國生化藥物雜志,2015(7):39-42.
[8] 徐凱,呂海濤.蘋果皮中根皮素的提取工藝研究[J].食品研究與開發,2009,30(12):109-112.
[9] 趙艷敏,王皎,宋光明,等.蘋果樹枝和葉中根皮苷及根皮素含量變化研究[J].食品研究與開發,2013(7):95-98.
[10] 彭學東,張梅,趙金召,等.一種天然根皮苷半合成制備根皮素工藝:中國,ZL201310238175.1[P].2013-06-17.
[11] 周金林,黃寶華,盧宇靖.一種根皮素的制備方法:中國,ZL 201310152063.4[P].2013-04-27.
[12] 王鴻,周峰,吳祺豪,等.甾體類化合物生物轉化的研究進展[J].浙江工業大學學報,2015,43(5):556-561.
[13] 歐志敏,嚴琴英,楊根生.生物轉化法水解牛蒡子苷制備苷元[J].浙江工業大學學報,2009,37(6):629-632.
[14] 於洪建,劉丹,孫華庚,等.酶解法生產根皮素的方法:中國,ZL200910228671.2[P].2009-11-23.
[15] 梅建鳳,金航,李靚,等.生物轉化法提高積雪草中積雪草酸的質量分數[J].浙江工業大學學報,2015,43(5):573-577.
[16] 沈萍,陳向東.微生物學實驗[M].北京:高等教育出版社,2007:241.
[17] 馬衛俊,延慧君,宋新波,等.根皮苷的微生物轉化篩選及消耗率的測定[J].食品研究與開發,2014(8):107-110.
(責任編輯:陳石平)
Bioconversion of phlorizin to phloretin by a selectedPenicilliumpurpurescensstrain QL-9204
MEI Jianfeng, LI Liang, YI Yu, CHEN Jianshu, ZHANG Yanlu, YING Guoqing
(College of Pharmaceutical Science, Zhejiang University of Technology, Hangzhou 310014, China)
A bioconversion process was developed for the production of phloretin from phlorizin. First, microbial strains were isolated and screened from the enrichment of apple peel, and then the main composition and initial pH of the medium for producing enzyme, and bioconversion conditions were optimized for improving the bioconversion yield of phloretin. Some desired results were achieved. A strain ofPenicilliumpurpurescensdesignated as QL-9204 was selected from 11 fungus strains, which can specifically produce enzyme for bioconversion of phlorizin to phloretin. The optimum medium for producing enzyme was composed of 2 g/L sucrose, 6 g/L (NH4)2SO4, 5 g/L NaCl, 5 g/L KH2PO4,1 g/L MgSO4and 1 g/L MnSO4with the initial pH of 6. The strain QL-9204 after seed cultivation was inoculated in the medium and cultured for 5 d. The filtrate of the culture was collected and 80 mg/L of phlorizin was added in. The bioconversion was performed at 30 ℃, 250 r/min for 14 h. The molar of phlorizin could reach 90.3%. The developed process shown in this paper has advantages of simple operations, high productivity and low cost, which may be an effective way for the production of phloretin in the pharmaceuticals industry.
phloretin; phlorizin ; bioconversion;Penicilliumpurpurescens
2016-03-05
梅建鳳(1973—),男,安徽天長人,副教授,博士,主要從事生物制藥方向的研究,E-mail:mrion@zjut.edu.cn.
Q814.9
A
1006-4303(2016)06-0660-05

