miR-34a通過靶向調控Notch1表達影響乳腺癌細胞的增殖
高硯春
(川北醫學院附屬醫院甲狀腺乳腺外科,四川 南充 637000)
?
研究報告
miR-34a通過靶向調控Notch1表達影響乳腺癌細胞的增殖
高硯春
(川北醫學院附屬醫院甲狀腺乳腺外科,四川 南充 637000)
目的探討miR-34a通過靶向調控Notch1表達影響乳腺癌細胞的增殖。方法乳腺癌細胞MCF-7轉染miR-34a mimics及miR-34a NC,RT-PCR法檢測細胞中miR-34a表達,MTT,克隆形成實驗,Hoechst染色及流式細胞術分別檢測miR-34a mimics對乳腺癌MCF-7細胞活力、克隆能力、凋亡情況及細胞周期的影響;通過雙熒光素酶報告基因實驗,western blot及RT-PCR檢測Notch1是否是miR-34a的下游靶基因。結果與miR-34a NC比較,miR-34 mimics組中miR-34a表達量上調,細胞活力降低(P<0.01),細胞凋亡率顯著提高(P<0.01),細胞克隆數目減少(P<0.01),細胞周期阻滯在G1期(P<0.01),Notch1蛋白及mRNA表達量都顯著降低(P<0.01),同時熒光素酶報告基因實驗也證實miR-34a mimics能與報告基因結合。結論miR-34a mimics能通過負性調控Notch1表達,從而顯著的抑制MCF-7乳腺癌細胞增值,并誘導細胞凋亡。
miR-34a;Notch1;乳腺癌細胞MCF-7;增殖
乳腺癌是女性較容易患的惡性腫瘤之一,是導致女性癌癥死亡的第二大原因,在我國及全世界范圍內發病率都呈上升趨勢。盡管近年來放療、化療以及生物治療技術的不斷發展,使得乳腺癌患者的預后及生存期獲得了很大改善,但是乳腺癌復發率及難治率仍居高不下[1]。因此尋找有效的診斷及治療方法是乳腺癌研究一直以來的關注點。Notch是1917年美國著名遺傳學家Thomas在果蠅缺口翅膀中發現并命名的,并于1980年克隆成功。Notch包括配體,受體及下游效應分子。其中受體包括4種,分別為Notch1,Notch2,Notch3,Notch4。研究顯示Notch信號通路在包括乳腺癌在內的多種惡性腫瘤中高表達,特別是Notch1[2-3]。Notch1在乳腺癌中高表達[4],沉默Notch1表達能顯著的抑制MCF-7細胞增殖,并誘導細胞凋亡[5]。同時研究也表明Notch1的高表達與miRNA的異常表達密切相關[6-8],從而提示miRNA可能通過調控Notch1表達從而影響腫瘤的增殖與凋亡等生物學行為。
miRNA是一類高度保守的非編碼內源性RNA分子,長度大約為19-23 nt,能通過結合于其下游靶基因3′端非編碼區,從而調控靶基因的轉錄,進而影響細胞的生物學行為。研究表明miR-34a能與Notch1報告基因結合,從而影響結腸癌SW480細胞,膀胱癌細胞T24細胞的增殖作用[7-8]。但對于在乳腺癌中miR-34a是否能夠通過靶向Notch1表達從而影響MCF-7細胞的增殖還未見報道,所以本研究將對此展開研究。
1 材料和方法
1.1 材料
1.1.1 細胞株
人乳腺癌細胞MCF-7購于中國科學院上海細胞庫。
1.1.2 試劑
兔抗Notch1多克隆抗體(美國Abcam公司);四甲基偶氮唑鹽(美國Gibco公司);胎牛血清(美國Hyclone公司);小鼠抗GAPDH單克隆抗體,辣根過氧化物酶標記山羊抗兔IgG(H+L),BCA試劑盒,Hoechst 33258染色試劑盒,細胞周期檢測試劑盒(碧云天生物技術有限公司);LipofectamineTM2000,trizol試劑盒,一步法RT-PCR試劑盒(大連寶生生物有限公司);野生型載體pmir-RB-ReportTM Notch1 3’UTR-Wt,突變型載體pmir-RB-ReportTM 3’UTR-Mut,miR-34a mimics及miR-34a NC(廣州市銳博生物科技有限公司)。
1.1.3 儀器
迷你雙垂直電泳儀,迷你轉印電泳儀(北京六一儀器廠);ChemiDocTM XRS凝膠成像系統(美國Bio-Rad公司);TS100倒置顯微鏡(日本Nikon公司);FACS Calibur流式細胞儀(美國BD公司);SMA2000型微量紫外分光光度計(美國Thermo公司)。
1.2 方法
1.2.1 細胞轉染
當MCF-7細胞匯合度達到50%左右時候,利用LipofectamineTM2000脂質體轉染試劑盒分別轉染miR34a NC、miR-34a mimics,6 h以后換成含10%血清的DMEM培養基;37℃,CO2培養箱培養48 h。應用RT-PCR檢測細胞中miR-34a的表達。
12.2 MTT法檢測細胞活力
將MCF-7細胞接種于96孔板,按“1.2.1”進行轉染。48 h后,加入20 μL終濃度為5 mg/mL的MTT,繼續培養4 h后,將上清液舍棄,并每孔加入150 μL的二甲基亞砜,震蕩使結晶物充分溶解,于酶標儀560 nm處測OD值,OD值即代表細胞活力。
1.2.3 集落形成實驗
將MCF-7細胞接種于96孔板,按“1.2.1”進行轉染,48 h后,用含10%甲醛和0.1%結晶紫染液固定染色,室溫中放置30 min。輕輕甩去染色液,用蒸餾水洗滌各孔,將培養板倒置于吸水紙上吸干水分,然后拍照分析。
1.2.4 Hoechst染色檢測細胞凋亡
將MCF-7細胞接種于6孔板,按“1.2.1”進行轉染。48 h后用不含EDTA的胰蛋白酶消化收集細胞,后按照Hoechst 33258染色試劑盒說明書進行操作,4%多聚甲醛固定15 min,PBS洗滌3次,加入Hoechst 33258染色液避光染色15 min,PBS洗滌3次,在熒光顯微鏡下觀察并拍照。
1.2.5 流式細胞術檢測細胞周期
將MCF-7細胞接種于6孔板,按“1.2.1”進行轉染。48 h后,按細胞周期檢測試劑盒說明書進行檢測:用不含EDTA的胰蛋白酶消化細胞,離心,并重懸,接著加入5 μL終濃度為10 mg/mL 的Rnase,37℃孵育1 h,再加入 碘化丙啶染液,室溫下避光染色 30 min,用流式細胞儀進行細胞周期檢測分析。
1.2.6 RT-PCR檢測細胞中miR-34a及Notch1 mRNA表達
參考Trizol試劑盒使用說明書提取總RNA,并用微量紫外分光光度計檢測RNA的純度,通過一步法RT-PCR試劑盒將逆轉錄RNA,并進行PCR擴增,最后將擴增產物用于2%的瓊脂糖膠電泳。引物如下,Notch1上游引物:5′-GTCAACGCCGTAGA TGACCT-3′,下游引物:5′-TCTCCTCCCTGTTGTTC TGC-3′;GADPH上游引物:5′-AGCCACATCGCTC AGACA-3′,下游引物:5′-TGGACTCCACGACGTACT-3′。引物分別加入25 μL PCR反應體系中,反應條件為94℃變性45 s,59℃復性45 s,72℃延伸60 s,共35個循環。
1.2.7 Western blot檢測細胞中Notch1蛋白表達
將MCF-7細胞接種于6孔板,按“1.2.1”進行轉染,48 h收集細胞,加入細胞裂解液,裂解30 min后,4℃,10000 r/min離心10 min,吸取上清,即可獲得總蛋白。采用BCA試劑盒檢測蛋白濃度。蛋白變性,上樣,進行十二烷基苯磺酸鈉凝膠電泳,后濕法轉膜30 min。將膜浸入一抗溶液(兔抗Notch1多克隆抗體,小鼠抗GAPDH單克隆抗體,稀釋比例:1:100)孵育,4℃過夜;次日二抗(辣根過氧化物酶標記山羊抗兔IgG(H+L),稀釋比例:1:200)室溫孵育1 h。并在膜上滴加ECL曝光液,于凝膠成像系統中曝光。用“Quantity one”軟件分析各抗體條帶灰度值。
1.2.8 熒光素酶報告基因表達分析
miR-34a及Notch1重組載體共轉染到MCF-7細胞中。分組如下:miR-34a mimics+Wt Notch1,miR-34a NC+ Wt Notch1,miR-34a mimics+Mut Notch1,miR-34a NC+ Mut Notch1。應用雙熒光素酶檢測系統檢測轉染好的熒光素酶活性,計算公式:相對熒光值=螢火蟲熒光素梅熒光值/海腎熒光素梅熒光值。
1.2.9 統計學分析

2 結果
2.1 miR-34a轉染效果的檢測
如圖1所示,與miR-34a組比較,miR-34a mimics組中miR-34a表達量顯著提高,差異具有統計學意義(P<0.01)。

注:與miR-34a NC組比較,**P<0.01。
2.2 miR-34a mimics對MCF-7細胞活力及克隆數目的影響

注:與miR-34a NC組比較,**P<0.01。

注:與miR-34a NC組比較,**P<0.01。
如圖2 MTT結果所示,與miR-34a NC組比較,miR-34a mimics組中細胞活力顯著降低,差異具有統計學意義(P<0.01)。如圖3細胞克隆實驗結果所示,與miR-34a NC組(128.57±10.69)比較,miR-34a mimics組(34.59±3.46)中細胞克隆數目顯著降低,差異具有統計學意義(P<0.01)。
2.3 miR-34a mimics對MCF-7細胞周期的影響
如圖4 流式細胞術結果所示,與miR-34a NC組比較,miR-34a mimics組中細胞周期G1期顯著延長,S及G2期縮短,差異具有統計學意義(P<0.01),說明miR-34a mimics能使細胞周期顯著阻滯在G1期。

圖4 miR-34a mimics對MCF-7細胞周期的影響Fig.4 Effect of miR-34a mimics on MCF-7 cell viability
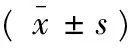
表1 miR-34a mimics對MCF-7細胞周期的影響Tab.1 Effect of miR-34a mimics on MCF-7 cell viability
2.4 miR-34a mimics對MCF-7細胞凋亡情況的影響
如圖5 Hoecsht染色結果所示,與miR-34a NC組(3.56±0.36)比較,miR-34a mimics組(36.48±3.65)細胞凋亡率顯著提高,差異具統計學意義(P<0.01)。

圖5 miR-34a mimics對MCF-7細胞凋亡情況的影響(×20)Fig.5 Effect of miR-34a mimics on MCF-7cell apoptosis (×20)
2.4 熒光素酶報告基因表達分析
將miR-34a mimics、miR-34a NC及野生型載體pmir-RB-ReportTM Notch1 3’UTR-Wt、及突變型載體pmir-RB-ReportTM Notch1 3’UTR-Mut轉入MCF-7細胞中,結果發現,miR-34a mimics與野生型載體pmir-RB-ReportTM Notch1 3’UTR-Wt共轉染組的熒光信號強度明顯弱于其它轉染組,差異具有統計學意義(P<0.01)。而對于突變型載體pmir-RB-ReportTM Notch1 3’UTR-Mut來說,各組間熒光強度無任何差別(P>0.05),說明Notch1是miR-34a下游靶基因(圖6)。

注:與miR-34a NC組比較,**P<0.01。
2.5 miR-34a mimics對MCF-7細胞中Notch1蛋白及mRNA表達量的影響
如圖7所示,與miR-34a NC組比較,miR-34a mimics組中Notch1蛋白及mRNA表達量顯著降低(P<0.05)。

注:與miR-34a NC組比較,**P<0.01。
3 討論
miRNA具有癌基因或抑癌基因的作用,能夠結合于靶基因mRNA的3’-UTR區域,阻遏靶基因的翻譯,從而抑制靶基因表達,并與腫瘤的發生發展密切相關,在腫瘤的增殖,凋亡,侵襲轉移中起重要作用[9-10]。miR-34家族是一類高度保守的miRNA,廣泛存在于節肢動物及哺乳動物中,包括三個同源基因,即miR-34a,miR-34b,miR-34c。其中miR-34a是miR-34基因突變的結果,染色體定位于1p36.23,且能夠廣泛存在肺以外的所有正常組織中,而miR-34b及miR-34c是miR-34串聯形成的,在肺以外的正常組織中表達量有限[11]。研究認為miR-34家族是具有抑癌作用的miRNA,miR-34家族在包括乳腺癌在內的大多數腫瘤組織中低表達,特別是miR-34a,miR-34a的異常表達可作為乳腺癌患者患瘤風險,診斷,預后的標志[11]。而且miR-34a表達量上調后對膀胱癌細胞,結腸癌細胞的增殖具有顯著的影響[7-8]。因此我們推測miR-34a對乳腺癌細胞的增殖凋亡等生物學行為也具有顯著的影響作用,所以本研究在此推論上,首先通過脂質體轉染miR-34a mimics及miR-34a NC,RT-PCR檢測轉染后MCF-7細胞中miR-34a的表達,結果表明miR-34 mimics轉染成功,接著通過MTT法及克隆實驗證實了miR-34a mimics能顯著的降低MCF-7細胞活力及細胞克隆數目,說明miR-34a mimics對MCF細胞增殖具有顯著的抑制作用。Hoechst染色結果也證實了結論,也與Nie等[12],Zhao等[13]研究miR-34a mimics在食管鱗狀細胞癌細胞,骨肉瘤細胞中的作用一致。另外腫瘤細胞的惡性增殖,說明了腫瘤細胞周期的紊亂及不可控,且大多數抗癌藥物也通過調控細胞周期的變化來發揮其療效的,所以本研究接著采用流式細胞術檢測miR-34a mimics對MCF-7細胞周期的影響,結果表明miR-34a mimics能延長MCF-7細胞周期,使細胞周期阻滯在G1期,并縮短G2和M期,從而阻斷了細胞的有絲分裂及DNA復制,進一步的說明了miR-34a mimics對MCF細胞增殖的抑制作用,與Ghawanmeh等[14]研究觀點一致。
miRNA對細胞生物學行為的調控作用基本都是基于其對下游靶基因的調控作用,miR-34a也不例外。有學者通過生物軟件預測發現Notch1可能是miR-34a的下游靶基因之一,且此基因與細胞增殖密切相關[7, 8]。Notch1是1991年在人類T淋巴細胞白血病中被鑒定出來,并被證實與腫瘤的發生發展密切相關。Norch1是由RAM結構區,6個與細胞周期相關的重復區,2個細胞核定位信號,富含谷氨酸區及PEST序列構成的。研究顯示Notch1與腫瘤的生長,分化,凋亡密切相關[15]。而且本研究的雙熒光素酶報告基因實驗證實了miR-34a mimics能顯著的與Notch1的3’端結合,接著western blot及RT-PCR也證實了較miR-34a NC比較,miR-34a mimics組中Notch1蛋白及mRNA表達量均顯著下調,從而說明了Notch1是miR-34a的下游靶基因,而且干擾Notch1表達能顯著的抑制MCF-7增殖[5],進而得出miR-34a mimics通過靶向下調Notch1表達,從而抑制MCF細胞的增殖。
綜上所述,miR-34a mimics能通過靶向負調控Notch1表達,誘導乳腺癌細胞MCF-7凋亡,并抑制細胞增殖,使細胞周期阻滯在G1期。此外研究還證實p53基因能與miR-34a啟動子結合,從而激活miR-34a的轉錄,而在腫瘤組織中p53發生突變,導致miR-34a的轉錄受到抑制,呈低表達狀態[16]。而且另有大量研究表明p53與Notch1之間也存在著直接的聯系[17]。從而提示了MCF-7細胞中miR-34a對于Notch1的調控作用可能與p53信號通路有關,將是本課題組將來的研究方向。
[1] Dubey A K, Gupta U, Jain S. Breast cancer statistics and prediction methodology: a systematic review and analysis[J]. Asian Pac J Cancer Prev, 2015,16(10):4237-4245.
[2] Yun J, Espinoza I, Pannuti A,etal. p53 Modulates Notch Signaling in MCF-7 Breast Cancer Cells by Associating With the Notch Transcriptional Complex Via MAML1[J]. J Cell Physiol, 2015,230(12):3115-3127.
[3] D’Angelo R C, Ouzounova M, Davis A,etal. Notch reporter activity in breast cancer cell lines identifies a subset of cells with stem cell activity[J]. Mol Cancer Ther, 2015,14(3):779-787.
[4] Yuan X, Zhang M, Wu H,etal. Expression of Notch1 Correlates with Breast Cancer Progression and Prognosis[J]. PLoS One, 2015,10(6):e131689.
[5] 毛俊, 牟秋菊, 李連宏, 等. RNA干擾Notch1基因對乳腺癌MCF-7細胞增殖及凋亡的影響[J]. 臨床與實驗病理學雜志, 2012,28(1):11-14.
[6] Zhang H D, Sun D W, Mao L,etal. MiR-139-5p inhibits the biological function of breast cancer cells by targeting Notch1 and mediates chemosensitivity to docetaxel[J]. Biochem Biophys Res Commun, 2015,465(4):702-713.
[7] 張超, 姚志勇, 朱鳴陽, 等. MicroRNA-34a通過Notch1對膀胱腫瘤細胞株T24增殖的影響[J]. 解放軍醫學雜志, 2012,37(5):426-430.
[8] 邵新宏, 于游, 張才全. miR-34a靶向調控NOTCH1基因對SW480細胞增殖的影響[J]. 第三軍醫大學學報, 2012,34(22):2297-2301.
[9] Kaboli P J, Rahmat A, Ismail P,etal. MicroRNA-based therapy and breast cancer: A comprehensive review of novel therapeutic strategies from diagnosis to treatment[J]. Pharmacol Res, 2015,97:104-121.
[10] Rothschild S I. microRNA therapies in cancer[J]. Mol Cell Ther, 2014,2(1):1-8.
[11] 鞏雅寧, 劉為青, 董堅. miR-34a對腫瘤發生發展調控作用的最近研究進展[J]. 醫學研究雜志, 2013,42(6):6-9.
[12] Nie J, Ge X, Geng Y,etal. miR-34a inhibits the migration and invasion of esophageal squamous cell carcinoma by targeting Yin Yang-1[J]. Oncol Rep, 2015,34(1):311-317.
[13] Zhao H, Ma B, Wang Y,etal. miR-34a inhibits the metastasis of osteosarcoma cells by repressing the expression of CD44[J]. Oncol Rep, 2013,29(3):1027-1036.
[14] Ghawanmeh T, Thunberg U, Castro J,etal. miR-34a expression, cell cycle arrest and cell death of malignant mesothelioma cells upon treatment with radiation, docetaxel or combination treatment[J]. Oncology, 2011,81(5-6):330-335.
[15] Mansoori B, Mohammadi A, Shirjang S,etal. Micro RNA 34a and Let-7a Expression in Human Breast Cancers is Associated with Apoptotic Expression Genes[J]. Asian Pac J Cancer Prev, 2016,17(4):1887-1890.
[16] Javeri A, Ghaffarpour M, Taha M F,etal. Downregulation of miR-34a in breast tumors is not associated with either p53 mutations or promoter hypermethylation while it correlates with metastasis[J]. Med Oncol, 2013,30(1):413.
[17] Yun J, Espinoza I, Pannuti A,etal. p53 Modulates Notch Signaling in MCF-7 Breast Cancer Cells by Associating With the Notch Transcriptional Complex Via MAML1[J]. J Cell Physiol, 2015,230(12):3115-3127.
Inhibitory effect of miR-34a on the proliferation of breast cancer cell by targeting Notch1
GAO Yan-chun
(Department of thyroid and breast surgery of the Affiliated Hospital of Chuanbei Medical College,Sichuan Nanchong, 637000, China)
Objective To explore inhibitory effect of miR-34a on the proliferation of breast cancer cell MCF-7 by targeting Notch1. Methods MCF-7 cells were transferred with miR-34a mimics and miR-34a NC. The expression of miR-34a in MCF-7 cell was examed by RT-PCR. The cell viability was detected by MTT. The cell apoptosis was examed by Hoechst staining. Cell cycle was detected by flow cytometry. Western blot, RT-PCR and dual luciferase reporter gene assay was to detect whether Notch1 was a downstream target gene of miR-34a. Results Compared with miR-34a NC group, the expression of miR-34a was up-regulated, the cell viability was decreased, cell apoptotic rate was increased, cell cycle was arrested in the G1 phase, the expression of Notch1 protein and mRNA was down-regulated (P<0.01). Conclusion miR-34a mimics inhibited MCF-7 cell proliferation and induced cell apoptosis via targeting regulation expression of Notch1.
miR-34a; Notch1; breast cancer cell MCF-7; proliferation
高硯春(1976-),女,碩士,副主任醫師,研究方向:乳腺癌綜合治療。E-mail: 164771624@qq.com。
R-332
A
1671-7856(2016)11-0055-06
10.3969.j.issn.1671-7856. 2016.11.010
2016-07-28

