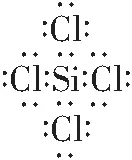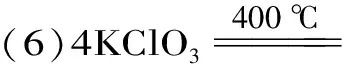化學鍵與分子間作用力考點精析
■廣東省佛山市高明區紀念中學
雷范軍
■四川省眉山市眉山中學校
銀代智
?
化學鍵與分子間作用力考點精析
■廣東省佛山市高明區紀念中學
雷范軍
■四川省眉山市眉山中學校
銀代智
化學鍵和分子間作用力既是高中化學的基本概念和重要規律,也包含電子式等化學用語書寫的基本技能,還與元素周期律(表)、原子結構、離子結構、分子結構、元素化合物的性質和制備等具有緊密的聯系。下面根據課程標準和考試大綱及其說明的要求,提煉該部分常見的重要考點,闡釋各考點在高考中的考查方式和類型,并命制典型試題予以說明。
一、化學鍵的分類及共價鍵、離子鍵的辨別
該考點通常涉及構成物質的微粒(原子、離子、分子)之間是否存在化學鍵,化學鍵常按什么標準進行分類,離子鍵和共價鍵的成鍵微粒、成鍵元素、成鍵原因分別是什么,共價鍵可按什么標準進行分類等問題。活潑金屬和活潑非金屬元素易結合成含有離子鍵的離子化合物(還有NH4Cl、NH4H等鹽,但AlCl3等例外),非金屬元素與非金屬元素一般結合為含有共價鍵的共價單質或化合物(還有AlCl3等,但銨鹽除外)。
例1 下列說法正確的是( )。
A.金屬元素和非金屬元素形成的化學鍵一定是離子鍵,非金屬元素組成的化合物中只含共價鍵
C.KClO4是助氧化劑,KClO4含有化學鍵的類型是離子鍵和共價鍵
D.氣態單質分子中一定含有非極性共價鍵

答案:C
點評:物質所含化學鍵的類型主要有五種情況,具體如下:(1)只含共價鍵的物質有:①同種非金屬元素組成的單質,如I2、N2、P4、金剛石、晶體硅等;②不同非金屬元素組成的共價化合物,如HX、H2O、NH3、SiO2、CS2、大多數有機物等。(2)只含有離子鍵的物質有:活潑非金屬元素與活潑金屬元素形成的化合物,如Na2O、K2S、NaH等。(3)既含離子鍵又含有共價鍵的物質有:NaOH、Na2O2、NH4Cl、(NH4)3PO4、NaClO等。(4)金屬鍵只存在于金屬單質或合金中。(5)無化學鍵的物質有稀有氣體,如氬氣、氦氣等。
二、電子式的書寫或正誤判斷
該考點主要涉及常見物質或具有重要用途的物質的電子式,且逐漸由常見物質向聯系生活、生產、高科技的陌生物質過渡,不僅僅局限于知識與技能,還逐漸向過程與方法的考查過渡,要求考生應用有關規則去書寫陌生物質的電子式,如N2、H2O2、C2H2、(CN)2、NaCN、NaBH4、(CN)2、KSCN、HCN等。
例2 下列敘述正確的是( )。
A.N2的電子式為N??N

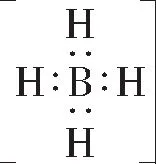

答案:D

三、化學鍵與化合物類型的關系
該考點一般包括離子化合物和共價化合物的判斷方法、物質所含化學鍵類型的判斷等。離子化合物與共價化合物的根本區別是看熔化狀態下能否導電。離子鍵只存在于離子化合物中;共價鍵不僅存在于非金屬單質和共價化合物中,還可存在于離子化合物中,但惰性氣體和金屬單質中沒有共價鍵。
例3 下列說法正確的是( )。
A.HCl溶液和NaCl溶液均通過離子導電,所以HCl和NaCl均是離子化合物
B.由不同元素組成的多原子分子里,一定只存在極性共價鍵
C.含共價鍵的化合物一定是共價化合物
D.Na在Cl2中燃燒的生成物含離子鍵

答案:D
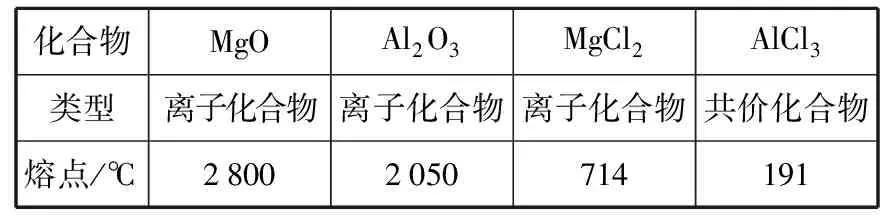
點評:離子化合物和共價化合物的判斷方法主要有三類:(1)根據構成化合物的粒子間作用力是離子鍵還是共價鍵判斷,活潑金屬原子和活潑非金屬原子之間形成離子鍵,同種或不同非金屬原子之間形成共價鍵。(2)根據化合物的類型判斷,大多數堿性氧化物、Al2O3、強堿和鹽是離子化合物;非金屬氫化物、非金屬氧化物、含氧酸一般是共價化合物。(3)根據化合物的性質判斷,溶于水后不能發生電離的化合物是共價化合物;熔化狀態下能導電的化合物是離子化合物,不能導電的化合物是共價化合物。
四、化學鍵、分子間作用力對物質沸點等性質的影響
該考點主要涉及物質熔化、溶解、沸騰等過程能不能導致化學鍵和分子間作用力變化,化學鍵和分子間作用力的強弱及其重要應用(規律及使用范圍),范德華力和氫鍵對物質沸點高低的影響規律及應用等。
例4 下列敘述正確的是( )。
A.共價化合物溶于水,分子內共價鍵被破壞,單質溶于水,分子內共價鍵不被破壞
B.分子之間一定存在分子間作用力,分子中不一定存在共價鍵
C.所有的物質中均含化學鍵,因此有化學鍵斷裂的一定是化學變化
D.因為結構和組成相似的物質的沸點一般隨相對分子質量增大而升高,所以NH3沸點低于PH3
解析:共價化合物溶于水,分子內共價鍵可以被破壞,如SO3等,也可以不被破壞,如乙醇等,單質溶于水,分子內共價鍵可以不被破壞,如O2等,也可以被破壞,如F2、Cl2等,故A項錯誤。分子晶體中相鄰分子之間一定存在分子間作用力,但分子內相鄰原子之間不一定存在化學鍵,如固態稀有氣體單質,故B項正確。并非所有的物質中均含化學鍵,如稀有氣體單質中無化學鍵,只有分子間作用力;有化學鍵斷裂的不一定是化學變化,有化學鍵的斷裂和形成過程才是化學變化,故C項錯誤。氨分子之間存在氫鍵,且比磷化氫分子間的范德華力強,因此氨的沸點高于磷化氫,故D項錯誤。
答案:B
點評:(1)化學鍵存在于原子或離子之間,作用力大,影響的是物質的化學性質和物理性質;離子化合物溶于水或受熱熔化,離子鍵會被破壞。(2)具有分子式的共價化合物受熱熔化時,共價鍵不會被破壞,溶于水時可能會被破壞,如鹵化氫(HX)等;但晶體硅、二氧化硅、碳化硅等只有化學式而沒有分子式的共價化合物受熱熔化時,需要克服相鄰原子之間的作用力(或共價鍵)。(3)分子間作用力只影響物質的物理性質,不影響物質的化學性質。(4)范德華力的大小與分子的相對分子質量之間存在正相關的關系,對結構和組成相似的分子形成的物質,相對分子質量越大,其熔點、沸點越高。(5)氫鍵比分子間作用力稍大,影響的是物質的物理性質(如熔點、沸點、溶解度)。
五、真題演練
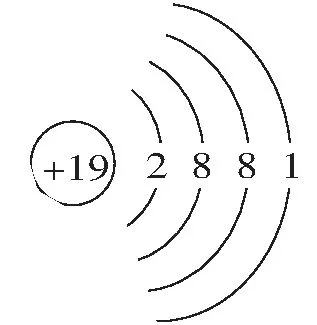
1.原子序數依次增大的元素a、b、c、d,它們的最外層電子數分別為1、6、7、1。a-的電子層結構與氦相同,b和c的次外層有8個電子,c-和d+的電子層結構相同。下列敘述錯誤的是( )。
A.元素的非金屬性順序為c>b>a
B.a和其他3種元素均能形成共價化合物
C.d和其他3種元素均能形成離子化合物
D.元素a、b、c各自最高和最低化合價的代數和分別為0、4、6
2.短周期元素X、Y、Z、W在元素周期表中的相對位置如表1所示。已知Y、W的原子序數之和是Z的3倍,下列說法正確的是( )。

表1
A.原子半徑:X B.氣態氫化物的穩定性:X>Z C.Z、W均可與Mg形成離子化合物 D.最高價氧化物對應水化物的酸性:Y>W 3.某晶體中含有極性鍵,關于該晶體的說法錯誤的是( )。 A.不可能有很高的熔沸點 B.不可能是單質 C.可能是有機物 D.可能是離子晶體 4.下列關于化學用語的表示正確的是( )。 5.下列有關氯元素及其化合物的表示正確的是( )。 A.分子式為C3H6N3O3 B.分子中既含極性鍵,又含非極性鍵 C.屬于共價化合物 D.生成該物質的上述反應為中和反應 7.在“石蠟→液體石蠟→石蠟蒸氣→裂化氣”的變化過程中,被破壞的作用力依次是( )。 A.范德華力、范德華力、范德華力 B.范德華力、范德華力、共價鍵 C.范德華力、共價鍵、共價鍵 D.共價鍵、共價鍵、共價鍵 8.下列各組中兩種微粒所含電子數不相等的是( )。 A.H3O+和OH-B.CO和N2 9.元素單質及其化合物有廣泛用途,請根據周期表中第三周期元素相關知識回答下列問題: (1)按原子序數遞增的順序(稀有氣體除外),以下說法正確的是____。 a.原子半徑和離子半徑均減小 b.金屬性減弱,非金屬性增強 c.氧化物對應的水合物堿性減弱,酸性增強 d.單質的熔點降低 (2)原子最外層電子數與次外層電子數相同的元素名稱為____,氧化性最弱的簡單陽離子是____。 (3)已知(如表2): 表2 工業制鎂時,電解MgCl2而不電解MgO的原因是____;制鋁時,電解Al2O3而不電解AlCl3的原因是____。 (4)晶體硅(熔點1 410℃)是良好的半導體材料。由粗硅制純硅過程如下: (5)P2O5是非氧化性干燥劑,下列氣體不能用濃硫酸干燥,可用P2O5干燥的是____。 a.NH3b.HI c.SO2d.CO2 (6)KClO3可用于實驗室制O2,若不加催化劑,400 ℃時分解只生成兩種鹽,其中一種是無氧酸鹽,另一種鹽的陰、陽離子個數比為1∶1。寫出該反應的化學方程式:____。 表3 由元素周期律可知,非金屬性:Cl>S>H,故A項正確。氫、硫、氯都是非金屬,鉀是金屬,則氫與硫、氯能形成共價化合物H2S、HCl,但氫元素與鉀元素不能形成共價化合物,只能形成離子化合物KH,故B項錯誤。鉀與氫、硫、氯均能形成屬于離子化合物的KH、K2S、KCl,故C項正確。氫元素的最高和最低價分別為+1、-1,硫元素的最高和最低價分別為+6、-2,氯元素的最高和最低價分別為+7、-1,+1+(-1)=0,+6+(-2)=4,+7+(-1)=6,故D項正確。 2.C 3.A 5.C 7.B 9.(1)b (2)氬 Na+或鈉離子 (3)MgO的熔點高,熔融時耗費更多資源,增加生產成本 AlCl3是共價化合物,熔融態難導電 (5)b (責任編輯 謝啟剛)