磷脂酶A1(Lecitase Ultra)的氨基酸序列分析及催化機(jī)理
張康逸 張麗霞 王興國(guó) 屈凌波 劉元法
(河南省農(nóng)科院農(nóng)副產(chǎn)品加工研究所1,鄭州 450002)(鄭州大學(xué)化學(xué)系2,鄭州 450001)(江南大學(xué)食品學(xué)院3,無錫 214122)
磷脂酶A1(LecitaseUltra)的氨基酸序列分析及催化機(jī)理
張康逸1,2張麗霞1王興國(guó)3屈凌波2劉元法3
(河南省農(nóng)科院農(nóng)副產(chǎn)品加工研究所1,鄭州 450002)(鄭州大學(xué)化學(xué)系2,鄭州 450001)(江南大學(xué)食品學(xué)院3,無錫 214122)
研究磷脂酶A1(LecitaseUltra)的純化、酶蛋白的氨基酸序列及活性中心的氨基酸殘基組成,并推導(dǎo)水解磷脂酰膽堿(PC)的機(jī)理。超濾法和RP-HPLC純化酶液,除去了山梨醇和山梨醇鹽,純度97.7%;基質(zhì)輔助激光解吸電離飛行時(shí)間質(zhì)譜(MALDI SYNAPT Q-TOF MS)和二級(jí)質(zhì)譜(MS/MS)對(duì)酶蛋白進(jìn)行分析,確定了氨基酸序列組成;數(shù)據(jù)庫(kù)(http: //www.matrixscience.com)比對(duì),發(fā)現(xiàn)氨基酸序列信息與棉狀嗜熱絲孢菌(T.lanuginosus)脂肪酶和尖孢鐮刀菌(F.oxysporum)脂肪酶高度吻合,序列中1-284是T.lanuginosus脂肪酶的氨基酸序列,序列中285-339是F.oxysporum脂肪酶的氨基酸序列;LecitaseUltra和Sn-1-C16∶0/sn-2-C2∶0-PC的分子對(duì)接證實(shí)了酶活中心的三聯(lián)體“Ser-His-Asp”催化機(jī)理。
磷脂酶A1氨基酸序列 二級(jí)質(zhì)譜 催化機(jī)理
磷脂酶A1(LecitaseUltra)是一種成熟工業(yè)用酶,被廣泛應(yīng)用于生物催化劑。它能水解磷脂Sn-1位脂肪酸酰基[1],已經(jīng)被成功應(yīng)用到油脂化學(xué)工業(yè)催化水解三酰甘油酯或者磷脂,并顯示出較高的催化活性[2-3]。目前,與LecitaseUltra相關(guān)的研究主要集中在工藝應(yīng)用方面[4-7]。盡管水相體系LecitaseUltra催化水解大豆粉末磷脂制備甘油磷脂酰膽堿(L-alpha glycerylphosphorylcholine, L-α-GPC)和甘油磷脂酰乙醇胺(L-alpha glycerylphosphorylethanolamine, L-α-GPE)的工藝已有研究[8-10], 但是在活性中心催化水解機(jī)理及酶的氨基酸序列組成方面鮮有探討。研究LecitaseUltra的氨基酸序列組成和活性中心的催化機(jī)理可以更好地從機(jī)理上了解其水解磷脂的特性, 并對(duì)其水解過程進(jìn)行有條件的調(diào)控, 獲得預(yù)期的水解產(chǎn)物。
電噴霧電離質(zhì)譜(ESI-MS)具有不損傷正常蛋白結(jié)構(gòu)的情況下準(zhǔn)確測(cè)定相對(duì)分子質(zhì)量的優(yōu)勢(shì)[11-12];基質(zhì)輔助激光解吸電離飛行時(shí)間質(zhì)譜(MALDI-TOF-MS)技術(shù)在分析酶蛋白氨基酸組成過程中具有直接、準(zhǔn)確、快速、靈敏度高和所需樣品少(最低樣品量可做到約10-18mol,一般可達(dá)到10-12mol)等優(yōu)點(diǎn)[13]。本研究擬通過超濾法和RP-HPLC純化酶液,ESI-MS確定酶蛋白分子質(zhì)量,MALDI SYNAPT Q-TOF MS和MS/MS分析酶蛋白氨基酸序列。在此基礎(chǔ)之上,利用LecitaseUltra和Sn-1-C16∶0/sn-2-C2∶0-PC的分子對(duì)接,確定酶活中心的氨基酸殘基組成,并研究水解磷脂酰膽堿(Phosphatidylcholine,PC)的催化機(jī)理。研究結(jié)果為生物技術(shù)催化制備醫(yī)藥級(jí)磷脂單體的工業(yè)化應(yīng)用提供基礎(chǔ)數(shù)據(jù)和理論參考。
1 材料與方法
1.1 材料
1.1.1 原料與試劑
LecitaseUltra(酶活力9 500 U/mL):Novozymes A/S;鹽酸胍、巰基乙醇和TPCK-處理的胰蛋白酶:生工生物工程(上海)有限公司;碳酸氫銨、尿素、濃鹽酸、磷酸二氫鈉和甲酸(均為分析純):國(guó)藥集團(tuán)化學(xué)試劑有限公司;乙腈和醋酸銨(均為色譜純):國(guó)藥集團(tuán)化學(xué)試劑有限公司。
1.1.2 儀器設(shè)備
Kromasil C18反相柱:瑞典AKZO NOBEL公司;MALDI -TOF-MS:布魯克·道爾頓公司;Waters ZMD400液相色譜-質(zhì)譜聯(lián)用儀:美國(guó)Waters公司;RP-HPLC(Shimadzu Lc-8A Preparative Liquid Chromatograph/SPD 10 Avp):日本島津;Pellicon 2 切向流超濾裝置:上海邁飛生物技術(shù)有限公司。
1.2 試驗(yàn)方法
1.2.1 超濾法
在室溫條件下,使用PeLLicon-2切向流超濾裝置分離純化。先使用截留分子質(zhì)量10 ku的超濾膜對(duì)LecitaseUltra進(jìn)行一級(jí)超濾,壓力為0.15 Mpa,濃度為10 mg/mL;再用截留分子質(zhì)量5 ku的超濾膜對(duì)濾過的溶液進(jìn)行二級(jí)超濾,壓力為0.18 Mpa,濃度為10 mg/mL,將超濾后的溶液進(jìn)行凍干。
1.2.2 半制備RP-HPLC
稱取1.2.1中超濾后的酶蛋白,用超純水配置成20 mg/mL溶液,0.22 μm微濾膜抽濾,使用RP-HPLC對(duì)濾液進(jìn)行純化和制備。色譜條件:色譜柱Hanbon Hedera C-18 ODS-2 10 μm(30×250 mm);上樣量20 mL;流速25 mL/min;檢測(cè)波長(zhǎng)220 nm;梯度洗脫(流動(dòng)相A:0.1%三氟乙酸+100%乙腈;流動(dòng)相B:0.1%三氟乙酸+100%水);A相的梯度,開始25 min,以25%梯度增加到75%,之后0.1 min,以梯度75%增加到100%,保持4.9 min。自動(dòng)收集各個(gè)組分,將樣品重復(fù)進(jìn)樣,多次收集,真空濃縮除去三氟乙酸、乙腈和大部分水,冷凍干燥,進(jìn)行MALDI SYNAPT Q-TOF MS分析。
1.2.3 胰蛋白酶水解Lecitase Ultra
將1.2.2中LecitaseUltra酶蛋白變性,降解并斷裂二硫鍵,然后再進(jìn)行胰蛋白酶水解。具體步驟如下:
①將20 mgLecitaseUltra溶解在6 mol/L鹽酸胍、50 mmol/L Tris-HCl(pH 8)和2~5 mmol/L巰基乙醇中。
②在95 ℃下加熱15~20 min,反應(yīng)液室溫冷卻。
③在蛋白質(zhì)中加入50 mmol/L NH4HCO3(pH 7.8),直至鹽酸胍濃度降到1 mol/L。為了完全得到天然蛋白的水解物,將蛋白用緩沖液稀釋至pH 7~9。
④將胰蛋白酶作為最后的酶加入,酶蛋白比例按1∶50,在37 ℃下反應(yīng)6 h,取樣,并放在-20 ℃條件下貯存,然后進(jìn)行酶蛋白水解后肽序分析及氨基酸序列預(yù)測(cè)。
1.2.4 MALDI SYNAPT Q-TOF MS
色譜條件:色譜柱BEH C18 1.7 μm(2.1×100 mm);柱溫45 ℃;流速0.3 mL/min;上樣量5μm;梯度洗脫,流動(dòng)相A:100%乙腈,流動(dòng)相B:0.1%甲酸;A項(xiàng)的梯度,開始0.1 min,保持0%,0.1~15 min,以0%梯度增加到30%,15~20 min,以30%梯度增加到100%,保持2 min,22~22.1 min,以100%梯度降低到0%,之后保持4.9 min。
質(zhì)譜條件:掃描范圍50~2 000m/z;毛細(xì)管電壓:3.5 kV;錐孔電壓:30 V;一級(jí)質(zhì)譜和二級(jí)質(zhì)譜的碰撞能量分別是:6 eV、20 eV;脫溶劑溫度:250 ℃;離子源溫度:100 ℃。
1.2.5 MALDI-TOF-MS和TOF-MS/MS
蛋白質(zhì)分子質(zhì)量測(cè)定方法:LP 20~50 ku、LP 30~200 ku(LP, 線性正離子模式)。酶解液多肽測(cè)定方法:RP 700~3 500 u(RP, 反射正離子模式;分子質(zhì)量范圍700~3 500 u)。
2 結(jié)果與分析
2.1 超濾法純化Lecitase Ultra
超濾是以壓力為推動(dòng)力的膜分離技術(shù),可以實(shí)現(xiàn)大分子與小分子的分離[14]。本研究中分別使用截留分子質(zhì)量為10 ku和5 ku的超濾膜對(duì)LecitaseUltra進(jìn)行超濾處理,超濾時(shí)將10 ku超濾膜透過液作為5 ku超濾膜的起始液,收集超濾透過液,冷凍干燥。超濾僅能截留水中的膠體、顆粒和分子質(zhì)量相對(duì)較高的物質(zhì),而小分子物質(zhì)并不能分離。從圖1可以看出,超濾法純化后的酶液中仍含有大量雜質(zhì),主要是山梨醇和山梨醇鹽等穩(wěn)定劑成分。

圖1 Lecitase Ultra的基質(zhì)輔助激光解吸電離飛行時(shí)間質(zhì)譜圖
2.2 半制備RP-HPLC純化Lecitase Ultra
RP-HPLC目前已廣泛應(yīng)用在蛋白質(zhì)、肽等生物樣品的分離、分析和制備,尤其是反相高效液相色譜已成為實(shí)驗(yàn)室研究蛋白質(zhì)的主要分離手段[15]。這項(xiàng)技術(shù)具有速度快、靈敏度高、分辨率高、重現(xiàn)性好而成為最有效蛋白質(zhì)的分離純化與制備辦法[16-17]。從圖2中可以看出,半制備RP-HPLC分離純化過后,樣品中的山梨醇和山梨醇鹽幾乎完全去除,產(chǎn)品的純度得到了很好的提高,達(dá)到了97.7%。
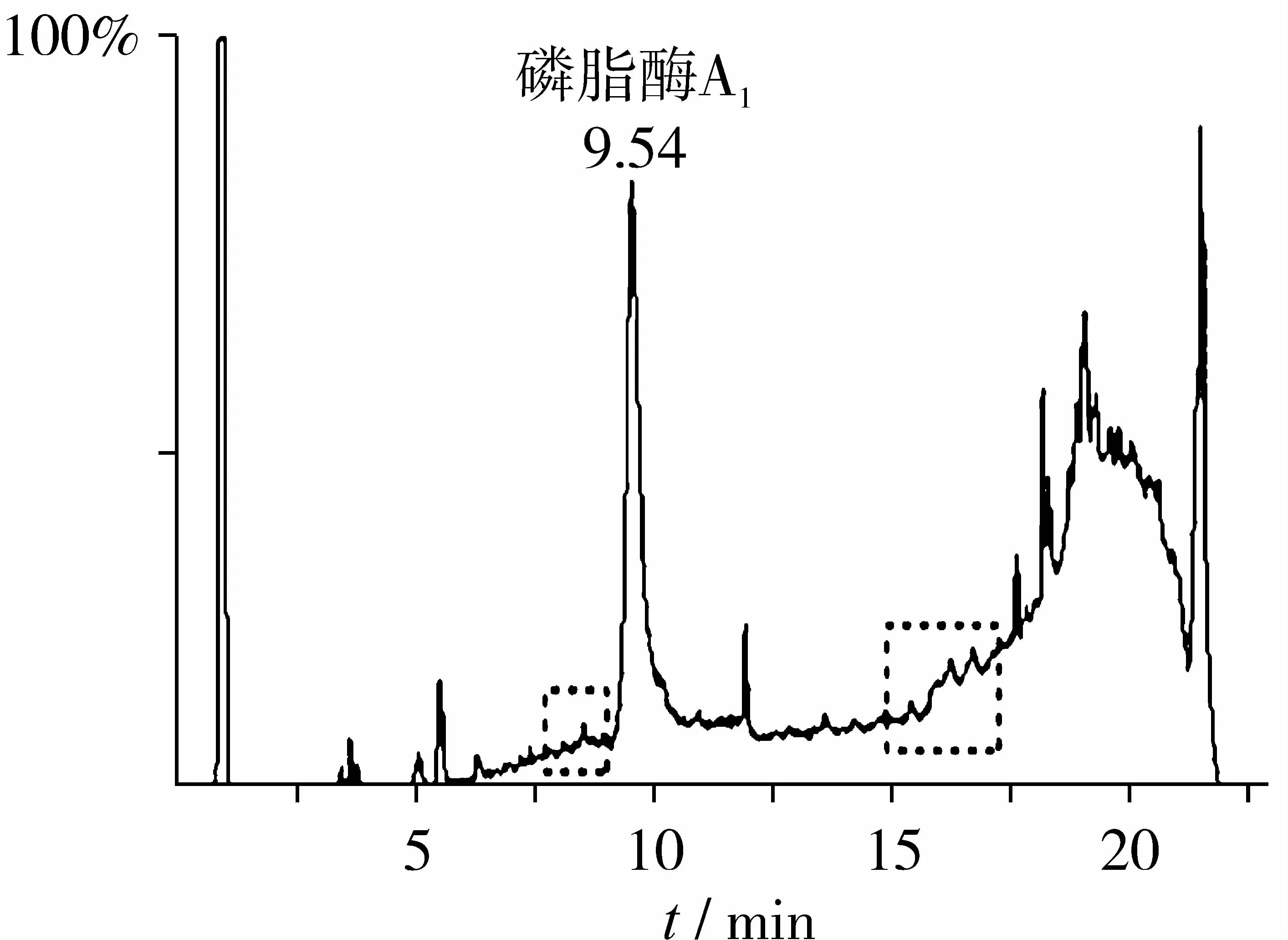
圖2 純化后Lecitase Ultra的基質(zhì)輔助激光解吸電離飛行時(shí)間質(zhì)譜圖
2.3 分析Lecitase Ultra的分子質(zhì)量
圖3是LecitaseUltra的一級(jí)質(zhì)譜圖譜,圖中的橫坐標(biāo)為離子的質(zhì)荷比(m/z),縱坐標(biāo)為離子的相對(duì)豐度。質(zhì)荷比(m/z)2 802.7、2 568.8、2 372.2、2 203.7、2 056.8、1 928.4、1 814、1 714.2、1 624.1、1 542.9、1 468.5、1 402.7、1 341.8、1 285.8、1 234.4分別是LecitaseUltra帶11e、12e、13e、14e、15e、16e、17e、18e、19e、20e、21e、22e、23e、24e和25e的離子形式,使用Peptide Companion軟件得到最后相對(duì)分子質(zhì)量為30 838.0。

圖3 Lecitase Ultra的基質(zhì)輔助激光解吸電離飛行時(shí)間質(zhì)譜圖
2.4 Lecitase Ultra的氨基酸序列分析
MALDI-TOF-MS和TOF-MS/MS技術(shù)可以直接預(yù)測(cè)肽段中的氨基酸序列。從單級(jí)質(zhì)譜中選擇信號(hào)強(qiáng)度最高的母離子,進(jìn)入二級(jí)質(zhì)譜,使用惰性原子撞擊肽段使其肽鍵斷裂,分別對(duì)碎片進(jìn)行檢測(cè),得到LecitaseUltra的質(zhì)譜圖數(shù)據(jù),使用儀器上自配的軟件自動(dòng)分析,通過計(jì)算各肽段相對(duì)分子質(zhì)量數(shù)值上的差值進(jìn)行推斷肽段的氨基酸序列[18]。本研究先將高純LecitaseUltra進(jìn)行變性降解并斷裂其二硫鍵,再進(jìn)行胰蛋白酶水解,得到水解后的短肽;然后用MALDI-TOF/TOF MS技術(shù)準(zhǔn)確測(cè)定多肽的相對(duì)分子質(zhì)量,從單級(jí)質(zhì)譜中選擇信號(hào)強(qiáng)度高的母離子,進(jìn)行MS/MS檢測(cè),得到它的二級(jí)質(zhì)譜肽段信息;使用儀器上自配的軟件自動(dòng)分析,推出LecitaseUltra的氨基酸序列,見表1。
獲得的氨基酸序列信息,通過(http: //www.matrixscience.com)數(shù)據(jù)庫(kù)比對(duì)分析,發(fā)現(xiàn)LecitaseUltra的氨基酸序列與棉狀嗜熱絲孢菌(T.lanuginosus)脂肪酶、尖孢鐮刀菌(F.oxysporum)脂肪酶高度吻合。LecitaseUltra序列中1~284是T.lanuginosus脂肪酶的氨基酸序列,用正常字體表示;序列中285~339是F.oxysporum脂肪酶的氨基酸序列,用斜體加粗表示;其中113、118和121可能是基因突變G113A、D118W和E121K,已分別加下劃線表示。

表1 Lecitase Ultra的氨基酸序列
2.5 Lecitase Ultra氨基酸組成對(duì)比分析
LecitaseUltra氨基酸組成的液相色譜圖,見圖4。酶蛋白中含有主要的17種主要氨基酸,分別為Asp (D)、Glu (E)、Ser (S)、His (H)、Gly (G)、Thr (T)、Arg (R)、Ala (A)、Tyr (Y)、Cys (C)、Val (V)、Met (M)、Phe (F)、Ile (I)、Leu (L)、Lys (K)、Pro (P)。這些氨基酸組成與測(cè)序得到的氨基酸序列組成是一致,從這個(gè)角度也說明了MALDI-TOF/TOF MS和MS/MS對(duì)LecitaseUltra的測(cè)序是成功的。
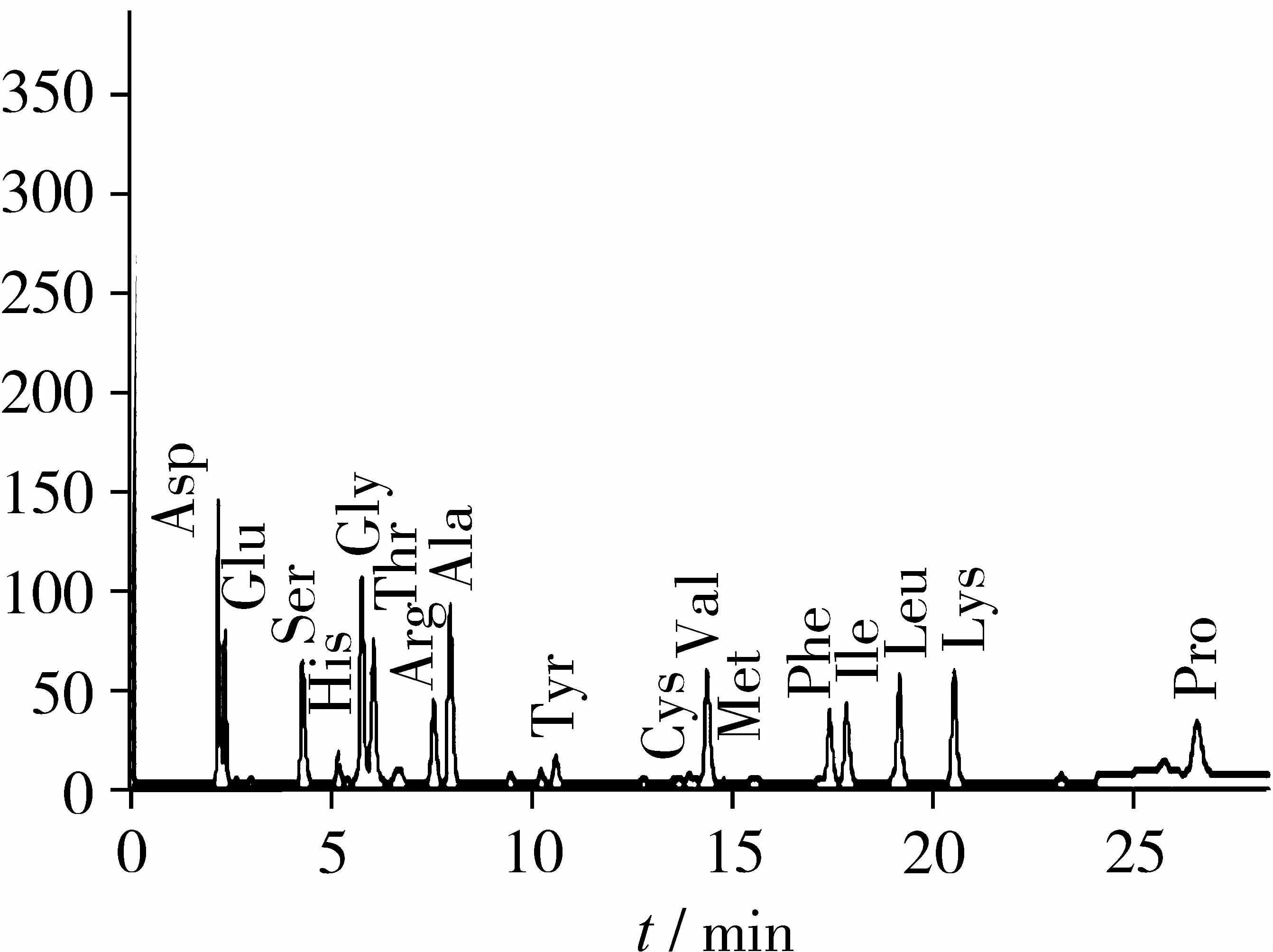
圖4 Lecitase Ultra氨基酸組成的液相色譜圖
2.6 分子對(duì)接
選擇具有柔性的Sn-1-C16∶0/sn-2-C2∶0-PC為底物,給底物分子加Charmm力場(chǎng),然后能量最小化,建立其3D結(jié)構(gòu),見圖5。將磷脂酰膽堿與LecitaseUltra采用LibDock進(jìn)行分子對(duì)接。經(jīng)過對(duì)接發(fā)現(xiàn)只有site 2可以實(shí)現(xiàn)分子對(duì)接,并且發(fā)現(xiàn)97個(gè)可能的結(jié)合模式。選擇打分最高的一個(gè)114.62,見圖6。

圖5 底物的空間構(gòu)型
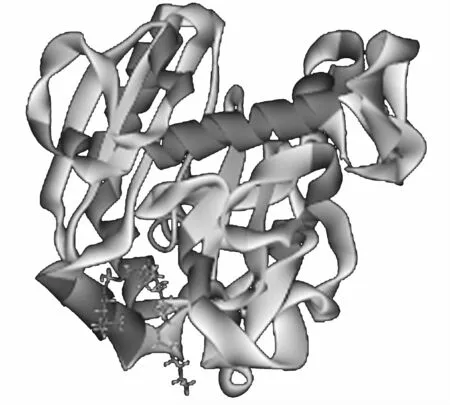
圖6 Lecitase Ultra和底物的最佳對(duì)接模式
2.7 催化活性中心氨基酸殘基組成分析
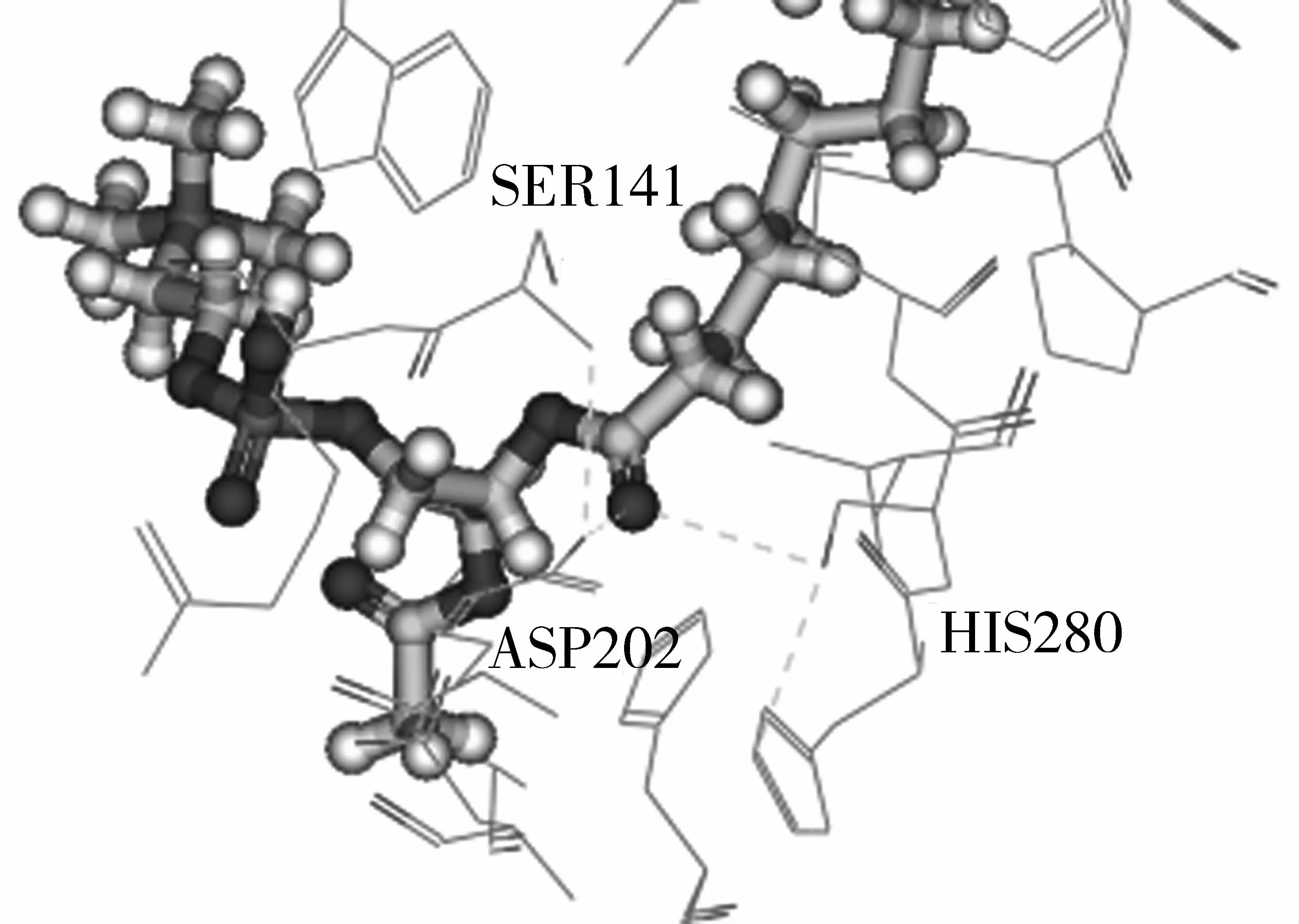
圖7 Lecitase Ultra活性中心的空間構(gòu)型
2.8 Lecitase Ultra水解PC的機(jī)理研究
依據(jù)LecitaseUltra和Sn-1-C16∶0/sn-2-C2∶0-PC分子對(duì)接的研究,發(fā)現(xiàn)其活性中心有Asp202、His280和Ser141 3個(gè)氨基酸殘基組成,證明其催化機(jī)理是“Ser-His-Asp” 三聯(lián)體催化。本研究擬利用 “Ser-His-Asp” 三聯(lián)體催化原理對(duì)水相體系LecitaseUltra水解PC制備L-α-GPC的工藝進(jìn)行機(jī)理分析。LecitaseUltra活性中心“Ser-His-Asp”三聯(lián)體通過氫鍵相連,當(dāng)?shù)孜颬C的脂肪酸酰基通過疏水作用力吸附到LecitaseUltra的活性中心,Ser上面的羥基氧孤對(duì)電子進(jìn)攻羰基碳正離子形成四元環(huán)中間體,一般中間體的能量比較高不穩(wěn)定,這時(shí)Ser和His之間的氫鍵斷裂,釋放產(chǎn)物和Ser酰基脂肪酸。在水分子的作用下,Sn-2-LPC經(jīng)過自動(dòng)酰基轉(zhuǎn)移生成Sn-1-LPC,而活性中心受水分子的作用,Ser酰基脂肪酸重新形成新的四元環(huán)中間體,為了使體系能量降至最低,“Ser-His-Asp”三聯(lián)體釋放出另一個(gè)產(chǎn)物脂肪酸,這時(shí)“Ser-His-Asp”重新通過氫鍵相連等待Sn-1-LPC的吸附水解。同樣是經(jīng)過Ser的羥基氧孤對(duì)電子進(jìn)攻Sn-1-LPC中酰基脂肪酸的羰基碳正離子形成四元環(huán)中間體,釋放L-α-GPC和Ser酰基脂肪酸,活性中心受到水分子的作用,形成新的四元環(huán)中間體,“Ser-His-Asp”三聯(lián)體釋放出脂肪酸,體系能量降至最低。詳細(xì)過程見圖8。

圖8 Lecitase Ultra水解磷脂酰膽堿的機(jī)理
3 結(jié)論
本研究利用MALDI-TOF/TOF MS和TOF-MS/MS測(cè)定了LecitaseUltra的氨基酸序列,根據(jù)氨基酸序列信息,通過查找(http: //www.matrixscience.com)數(shù)據(jù)庫(kù), 發(fā)現(xiàn)它的氨基酸序列與棉狀嗜熱絲孢菌(T.lanuginosus)脂肪酶和尖孢鐮刀菌(F.oxysporum)脂肪酶的氨基酸序列高度吻合,LecitaseUltra序列中1~284是T.lanuginosus脂肪酶的氨基酸序列,序列中285~339是F.oxysporum脂肪酶的氨基酸序列,其中113G、118D和121E可能是基因突變成A、W和K。在此基礎(chǔ)之上,通過LecitaseUltra和Sn-1-C16∶0/sn-2-C2∶0-PC分子對(duì)接,確定酶活中心的氨基酸殘基組成為“Ser-His-Asp” 三聯(lián)體結(jié)構(gòu),并推導(dǎo)出了水解PC的催化機(jī)理。
[1]Liu N, Wang Y, Zhao Q, et al. Fast synthesis of 1, 3-diacyglycerol by lecitase?ultra-catalyzed esterification in solvent-free system [J]. European Journal of Lipid Science and Technology, 2011, 113(8): 973-979
[2]Manjula S, Jose A, Divakar S, et al. Degumming rice bran oil using phospholipase A1 [J]. European Journal of Lipid Science and Technology, 2011, 113(5): 658-664
[3]Hu M, Li Y, Decker E A, et al. Impact of layer structure on physical stability and lipase digestibility of lipid droplets coated by biopolymer nanolaminated coatings [J]. Food Biophysics, 2010, 6(1): 37-48
[4]李晶, 胡婕倫, 謝明勇, 等. 響應(yīng)曲面法優(yōu)化磷脂酶Lecitase Ultra用于茶油脫膠工藝的研究[J] . 食品科學(xué), 2008,29(9): 326-330
[5]潘明喆, 柴玉華, 杜鵬. 磷脂酶A1用于大豆油酶法脫膠技術(shù)的研究[J]. 食品工業(yè)科技, 2008, 29(5): 219-222
[6]王永華, 楊博, 楊繼國(guó), 等. 新型磷脂酶用于米糠油酶法脫膠的研究[J]. 中國(guó)油脂, 2004, 29(12): 24-27
[7]李秋生, 楊繼國(guó), 楊博, 等. 不同磷脂酶用于植物油脫膠的研究[J]. 中國(guó)油脂, 2004, 29(1): 19-22
[8]Zhang K Y, Wang X G, Liu Y F. Aqueous medium enzymatic preparation of L-alpha glycerylphosphorylcholine optimized by response surface methodology [J]. European Food Research and Technology, 2012, 234(3): 485-491
[9]Zhang K Y, Liu Y F, Wang X G. Enzymatic preparation of L-alpha glycerylphosphorylcholine in an aqueous medium [J]. European Journal of Lipid Science and Technology, 2012, 114(11): 1254-1260
[10]張康逸, 康志敏, 范運(yùn)乾, 等. 水相體系酶法制備甘油磷脂酰乙醇胺的研究[J]. 中國(guó)油脂, 2013, 8(38):58-61
[11]Wild B J, Green B, Cooper E K, et al. Rapid identification of hemoglobin variants by electrospray ionization mass spectrometry [J]. Blood Cells Molecules and Diseases, 2001, 27(3): 691-704
[12]Shimizu A, Toyofumi N, Masahiki K, et al. Detection and identification protein variants and adducts in blood and tissues: an application of soft ionization mass spectrometry to clinical diagnosis [J]. Journal of Chromatography B, 2002, 776(1): 15-30
[13]Reilly C T H. Rapid analysis of hemoglobin from whole human blood by matrix-assisted laser desorption/ionization time of flight mass spectrometry [J]. Rapid Comm Mass Spectrom, 1997, 11(13): 1435-1439
[14]鄧成萍, 薛文通, 孫曉琳,等. 超濾在大豆多肽分離純化中應(yīng)用[J]. 食品科學(xué), 2006, 27(2): 192-196
[15]李明, 宋俊梅. 大豆多肽分離提純方法研究進(jìn)展[J]. 糧食加工, 2010, 35(4): 69-73
[16]Sanz N V, Benavente F , Toro I, et al. Optimization of HPLC conditions for the separation of complex crude mixtures produced in the synthesis of therapeutic peptide hormones [J]. Chromatographia, 2001, 53(1): 167-173
[17]白泉, 葛小娟, 耿信篤. 反相液相色譜對(duì)多肽分離純化與制備[J]. 分析化學(xué), 2002, 30(9): 1126-1129
[18]蔣菁莉, 徐彥軍, 婁飛等. 反相高效液相色譜-電噴霧質(zhì)譜法分析食源血管緊張素轉(zhuǎn)換酶抑制肽[J]. 分析化學(xué), 2007, 35(3): 427-430.
Amino Acid Sequence Analysis and Catalytic Mechanism of Lecitase Ultra
Zhang Kangyi1,2Zhang Lixia1Wang Xingguo3Qu Lingbo2Liu Yuanfa3
(Henan Academy of Agricultural Sciences Institute of Agricultural Products Processing1, Zhengzhou 450001)(Zhengzhou University Department of Chemistry2, Zhengzhou 450001)(Jiangnan University School of Food Science and Technology3, Wuxi 214122)
The purification, amino acid sequence of enzyme protein, and amino acid residues of the active center of phospholipase A1(LecitaseUltra) were studied. The hydrolysis mechanism ofLecitaseUltrawas further deduced. Sorbitol and sorbitol salt were removed through the ultrafiltration method and semi-preparative RP-HPLC, purity 97%. Amino acid sequence ofLecitaseUltrawas highly consistent with cotton-like thermophilic hyphomycete lipase (T.lanuginosus) and fusarium oxysporum lipase (F.oxysporum) through the website (http: //www.matrixscience.com) database comparison. The results showed that the sequence 1-284 ofT.lanuginosusand sequence 285-339 ofF. oxysporum were the same with amino acid sequence ofLecitaseUltra. The “Ser-His-Asp” triplet catalytic mechanism of activity center was confirmed by the molecular docking ofLecitaseUltraandSn-1-C16∶0/sn-2-C2∶0-PC. The results provided the theoretical basis and data support for the industrial preparation of pharmaceutical grade L-α-GPC to further explore.
phospholipase A1, amino acid sequence, MALDI-TOF MS/MS, catalytic mechanism
TS229
A
1003-0174(2016)02-0070-06
國(guó)家自然科學(xué)基金(31301502),河南省農(nóng)業(yè)科學(xué)院優(yōu)秀青年科技基金(2013YQ25)
2014-06-19
張康逸,男, 1981年出生,博士,脂質(zhì)科學(xué)
劉元法,男,1974年出生,教授,油脂加工

