二氧化硫轉化過程分析
陳巖,王全貴,張曉晶
(中國中輕國際工程有限公司,北京,100026)
二氧化硫轉化過程分析
陳巖,王全貴,張曉晶
(中國中輕國際工程有限公司,北京,100026)

三氧化硫磺化技術在我國合成洗滌劑工業中已廣泛使用,為我國洗滌劑生產技術及產品質量的提高和發展起到了積極的推動作用,并已推廣應用到石油和化工行業。二氧化硫轉化單元也稱為三氧化硫制備單元,是SO3磺化裝置中的重要組成部分。文中著重描述了二氧化硫轉化的重要性及其反應過程,說明了二氧化硫的轉化必須在觸媒的作用下才可以實現工業化生產的事實。
二氧化硫轉化;轉化率;溫度;觸媒;壓力
1. 概述
三氧化硫磺化裝置是合成洗滌劑工業中不可缺少的化工裝置之一,其工藝技術的先進性、產品質量的優劣直接關系到合成洗滌劑的質量。該技術最早應用于洗滌劑行業是上世紀50年代后期,是洗滌劑生產工藝的一大突破,它具有原材料消耗低、產品質量高、適應性強、操作彈性大、三廢處理好等優點。三氧化硫磺化技術在我國的應用始于上世紀70年代末,20世紀80年代中期至20世紀90年代末,是我國三氧化硫磺化技術高速發展時期。我國磺化技術經過50多年的發展,已經具備了自主開發三氧化硫磺化裝置和磺化產品的能力,其水平已與國外的磺化技術相近。三氧化硫磺化技術的應用也從洗滌劑行業向石油、化工等行業擴展。
三氧化硫磺化裝置由多個化工單元組成。當談到三氧化硫磺化技術,人們的目標總會轉移到磺化反應器上來,因為它是三氧化硫磺化裝置的核心設備。但很少有人提及二氧化硫轉化的問題,其實二氧化硫轉化在三氧化硫磺化裝置中也占有相當重要的地位。如果二氧化硫轉化器設計不合理或操作不當,它將給后來的生產帶來很多不便。它不僅會增加原料硫磺的消耗,更重要的會給環境帶來大量的二氧化硫廢氣,給人們的安全帶來威脅,至而影響到磺化產品的質量,甚至于被迫停車。
2. SO2/SO3轉化工藝過程簡述
磺化裝置的SO2轉化器一般由304不銹鋼制成,為圓桶式塔體結構,頂端和中間段設有插入式U形列管式換熱器。塔內裝有三層或四層V2O5催化劑。在所有床層上的催化劑均為“三明治”式,即在催化劑的上下各有氧化鋁惰性瓷球,其中上下層均為φ1"氧化鋁瓷球構成,底部有不銹鋼格柵支撐,格柵上鋪有6~10目的不銹鋼絲網。催化劑上層的瓷球保證了氣體經過適當分配后在進入下面的催化劑床層。而下層的瓷球防止催化劑小球掉落,同時SO2經過重新分布進入下一床層。
來自燃硫爐的混合爐氣大約650℃左右,SO2氣濃約6%~7%。混合氣體經過轉化塔頂SO2冷卻器被冷卻到約435℃進入催化劑床層,此時第一層SO2的轉化率可達到70%以上。在第一床層和第二床層之間設有層間冷卻器,反應氣體通過冷卻,溫度降至礬觸媒的起燃溫度約445℃,即第二層催化劑的入口溫度。
因經過第二床層反應后的溫升相對較小,同時爐氣中的氧含量也逐漸降低,因此在第二床層與第三床層間利用冷激風冷卻,同時提高氧含量,促使反應過程向產物方向發展。溫度由約490℃冷卻到440℃后,進入第三層催化劑。反應后的混合氣體的溫度由440℃升高至約445℃,此時SO2的轉化率達到95%以上。
經過第三床層反應后的溫升僅為5~10℃,因此在第三床層與第四床層間再次補充干燥的空氣進行冷卻,溫度降至425℃后,進入第四層催化劑。反應后的混合氣體的溫度升高至426℃,此時SO2的轉化率可達97%~98%。
為了使SO2進入塔內能即時轉化,開車前需將轉化塔進行預熱,將塔內催化劑預熱至起燃溫度,預熱時間的長短主要取決于預熱器的熱負荷及塔內換熱器的能力以及催化劑的填裝量,但同時必須按照催化劑的性能要求,升溫梯度一般為20~30℃/h;新催化劑在150℃前應控制在10~15℃/h。
在轉化器頂第一層氣體進口,裝有列管式SO2冷卻器,在第一、二催化劑層之間設SO2/SO3層間冷卻器,用以保證各層的反應溫度控制在最佳值。轉化器各床層的溫度均采用自動控制,保證轉化的最佳溫度。
SO2-SO3轉化系統流程詳見(圖1)。
2.1 二氧化硫轉化反應為可逆反應過程
二氧化硫是一種對人體十分有害的氣體。在一般情況下,二氧化硫轉化為三氧化硫是不能進行或進行非常緩慢的,需借助于觸媒的催化作用,其反應方程式如下。
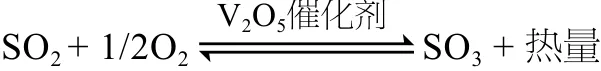
從以上反應方程式可知,此反應為可逆反應。在二氧化硫與氧反應生成三氧化硫的同時,三氧化硫也有部分分解為二氧化硫和氧,已反應的二氧化硫與起始二氧化硫的總量之百分比叫做轉化率,我們通常所說的轉化率就是指它。
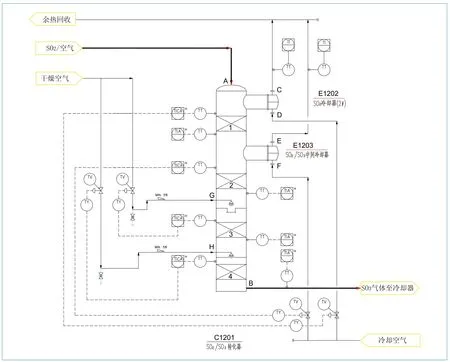
圖1 SO2-SO3轉化系統流程
從反應動力學我們知道,在反應開始時(圖1 A口),由于反應物(SO2、O2)的濃度較高,而生成物(SO3)則等于零,所以反應速度很快。隨著反應的進行,二氧化硫和氧的濃度減少,正反應速度逐漸減慢,而隨著三氧化硫濃度的增加,逆反應速度加快,一個變快,一個變慢,相互接近,最后正反應和逆反應速度相當,這時轉化成的三氧化硫剛好等于分解掉的三氧化硫的量。只要反應條件不變化,無論時間多長,反應物不再減少,生成物不再增加。此時反應便達到了化學平衡狀態,反應速度等于零。各個組分的濃度稱為平衡濃度,這時二氧化硫的轉化率稱為平衡轉化率。化學反應達到平衡就是在一定條件下達到了反應極限。所以平衡轉化率就是在設定條件下所可能達到的最大轉化率。平衡轉化率越高,則實際可能的轉化率也越高。
二氧化硫轉化反應的平衡是相對的,不是絕對的。正反應、逆反應的速度隨條件的變化而變化。只要條件變化了,原來的平衡就會破壞,重新建立新的平衡。在不同溫度、不同壓力、不同的原始氣體和生成物濃度條件下,二氧化硫的平衡轉化率是不同的。如果從轉化過程中,把生成物三氧化硫除去,逆反應速度必然大大減小,平衡狀態立即打破,反應就朝有利于正反應的方向進行,進一步提高轉化率。在工程設計中,就是根據以上規律,為了得到較高的SO3轉化率,往往采用在SO2-SO3轉化塔(C1201)的第三層(或第四層)加入冷激空氣。圖1中,來自空氣干燥單元的干燥空氣由C1201第三層催化劑上方G口及第四層催化劑上方H口分別通過空氣分配器加入到SO2-SO3轉化器(C1201)中,目的即是增加氧氣的濃度,相對的減少三氧化硫的濃度,同時也降低了反應溫度,從而達到提高平衡轉化率的目的。
2.2 二氧化硫轉化是在一定溫度下進行的放熱反應
我們知道,一切放熱的化學反應,降低反應溫度都能使反應率提高,這是一般的化學反應規律。二氧化硫轉化反應正是一個放熱反應,因此平衡轉化率隨反應溫度的降低而提高。所以在設計中SO2-SO3轉化器(C1201)的第一層和第二層催化劑的出口都設有空氣冷卻器(圖1中E1202和E1203)。其目的就是降低反應溫度而提高轉化率。二氧化硫的平衡轉化率與溫度關系如表1所列。
從表1可以看出,在二氧化硫和氧氣的濃度不變的情況下,隨著溫度升高,而轉化率卻下降。因此,從平衡轉化率和濃度的關系來看,要想獲得較高的轉化率,反應溫度應盡可能控制的低一些。在實際生產的二氧化硫轉化過程中,一定要移走一部分反應熱,維持一定的反應溫度。但并不是溫度降的越低越好。這主要是由以下因素決定的:
(1)對于放熱反應,隨著反應溫度的降低,平衡轉化率可提高;但從另一個角度來看,反應溫度降低卻抑制了反應速度。這是因為反應速度和反應溫度成正比關系,如表2。
如果單純追求平衡轉化率,而把反應溫度控制的很低,雖然轉化率很高,但反應速度卻很慢,事實上三氧化硫的得率將是很少,失去生產的實際意義。從表2看出,反應速度隨溫度升高而加快,增快的倍數相當大。溫度由400℃升到525℃反應速度增大13.5倍。因此,在單位時間內,對于一定的轉化器和一定量的觸媒來說,提高反應溫度可使二氧化硫的轉化數量增加很多。從而大大提高了轉化設備的生產能力。
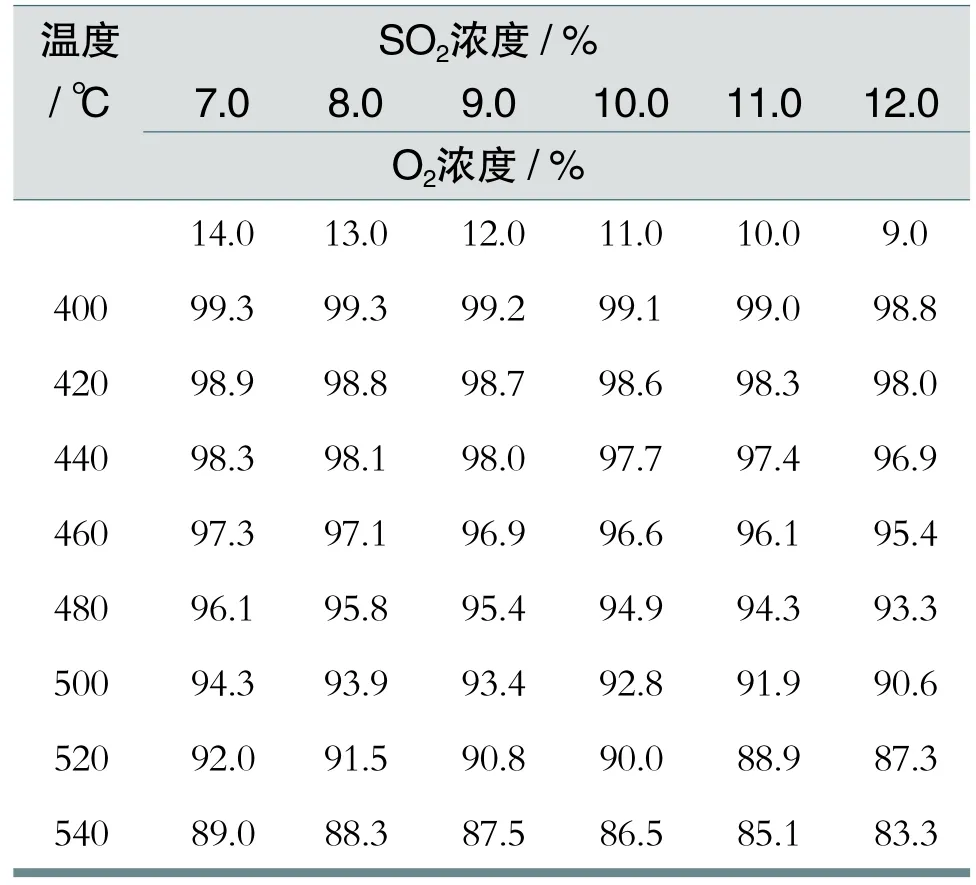
表1 二氧化硫的平衡轉化率與溫度關系
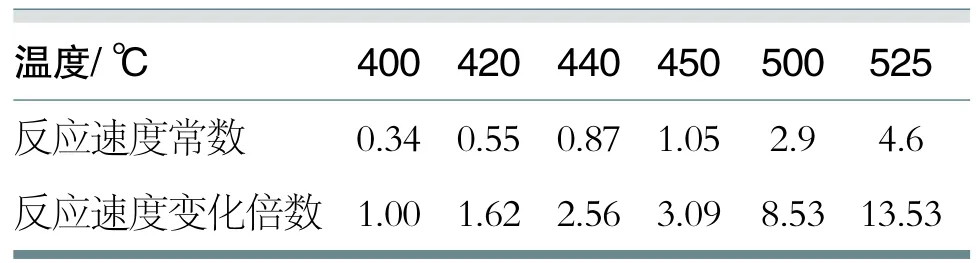
表2 反應速度常數與溫度關系
(2)當溫度降到一定限度時,觸媒便不能再起催化作用,而使轉化反應停止。這個不能使觸媒起催化作用的溫度,我們稱為起燃溫度。因此,觸媒的起燃溫度應當低一些較好。其起燃溫度的高低與觸媒的特性及進入轉化器的氣體成分有關。國內生產裝置(包括從國外引進裝置)觸媒的起燃溫度一般在380~430℃之間。從上述情況可見,只考慮反應速度,則反應溫度越高越好,如只考慮轉化率,則反應溫度越低越好,可見這是一對矛盾。因此在選擇轉化溫度指標時,不但要考慮有效轉化率,還要考慮反應速度。所以在轉化過程中,就不應該自始至終保持一個反應溫度。圖1中,反應的初期即SO2-SO3轉化塔(C1201)氣體進口A與第一層催化劑之間,二氧化硫和氧氣的濃度高,三氧化硫的濃度低,距離平衡狀態較遠,宜使氣體在較高溫度下轉化,實際生產中A口進氣溫度通常在650℃左右,這時反應速度要快些合適;氣體經過E1202冷卻至450℃左右(由儀表TI監測)進入第一層催化劑轉化,由于反應放熱使氣體升溫至約600℃(由儀表TI監測)進入E1203冷卻器,冷卻至450℃左右(由儀表TI監測)后進入第二層催化劑中進行轉化反應,此時氣體溫度為500~550℃(由儀表TI監測);反應后期即氣體經過第三層以及第四層催化劑后,氣體濃度關系正好相反,距離平衡狀態較近,宜使氣體在較低溫度下轉化,所以在此處增加冷激風(圖1 G口及H口接入干燥冷空氣)而降低氣體溫度,冷激風進氣量由儀表TI通過調節閥來控制。裝置設計理念或在工廠的實際應用中,氣體在SO2-SO3轉化塔的每層催化劑進出位置均設計有溫度儀表隨時監測,以獲得較高轉化率。
2.3 二氧化硫轉化反應必須在觸媒催化作用下進行
在反應壓力和反應物濃度一定的條件下,加快反應速度有兩種方法。一個是提高反應溫度,使其反應物分子能量提高,增加其中大于反應活化能分子的數量。另一個方法是采用觸媒。觸媒也稱為催化劑或接觸劑。在轉化反應中反應物分子先與觸媒結合成過渡性的“表面中間化合物”,然后再分解得到生成物和觸媒,這個“表面中間化合物”的生成和分解的反應所需要的活化能比反應物直接反應成生成物的活化能要小得多。觸媒雖參加了反應過程,卻沒有進入生成物,而實際只是使反應沿著一條活化能較小的途徑進行。這樣在同樣的反應溫度下就會大大加快反應速度。
二氧化硫的轉化反應,一般在高溫下如400~600℃,反應速度仍然很慢,還不能達到工業生產的需要,溫度在1000℃以上時,雖然反應速度很快,但如前面所述,平衡轉化率卻很低,并且給設備制造以及現場操作帶來了極大的不便。因此即使能創造高溫條件,也會因平衡轉化率過低而無法實現工業化生產。為使轉化反應能在工業化生產中實現,就只有采用催化劑來加快反應速度。使反應在不太高的溫度下能足夠快的進行,而且能有較高的轉化率。
二氧化硫的轉化一般采用釩催化劑。據資料記載,1930年以前,在接觸法硫酸生產中,幾乎全是采用鉑觸媒。鉑觸媒的活性比現在應用中的其他種類的觸媒都好,但鉑觸媒易中毒,而又價格昂貴,因此后來逐漸被其他觸媒取而代之,目前多采用釩觸媒。
二氧化硫轉化過程中觸媒是怎樣起到催化作用呢?一般可分為以下四步進行:
a. 觸媒表面與氧結合;
b. 觸媒表面的氧原子與二氧化硫分子結合;
c. 在觸媒表面上,由原子重排形成SO3分子團;SO2· O · 觸媒→SO3· 觸媒
d. 三氧化硫分子從接觸劑表面上解吸。
以上四步,每個步驟的活化能以及它們綜合起來顯示的活化能比二氧化硫分子直接在氣相中與氧反應的活化能低的多。在無觸媒的情況下,二氧化硫轉化反應活化能為50000卡/mol。在釩觸媒的作用下,反應活化能下降到22000~23000卡/mol,因而反應速度大大加快。如475℃的反應速度,用釩觸媒比不用觸媒要快一億六千萬倍。如果不用觸媒要達到同樣的反應速度,則要把反應溫度提高到1400℃以上。可見觸媒的重要性。在釩觸媒的作用下(380~430℃),平衡轉化率可以達到98%以上。觸媒解決了二氧化硫轉化率和反應速度對溫度要求的矛盾。總之,如果不采用觸媒,二氧化硫的轉化反應則無法在工業化生產中實現。
現階段,常用的釩觸媒按起燃溫度分為中溫型和低溫型兩種。綜合考慮經濟、起燃溫度、轉化率、通氣阻力等各方面因素,四層催化劑中一般第一、二層填裝中溫型觸媒,第三、四層填裝低溫型觸媒。
2.4 二氧化硫轉化是氣體體積縮小的反應過程
從二氧化硫轉化反應的方程式知道,每1.5份體積反應物變為1份體積的生成物,這是一個體積縮小的反應。因此,增加壓力,可以提高平衡轉化率。當其他條件不變時,平衡轉化率就隨壓力增大而升高。壓力與平衡轉化率的關系見表3。
表3可以看出,雖然加壓能提高轉化率,但提高的并不多;而且動力消耗較大(因轉化氣中80%以上是不參與反應的氮氣),同時還要解決加壓后的設備易腐蝕問題。可見在常壓下操作是可取的。在國內的一些生產裝置上,一般操作壓力在0.1MPa(表)左右。而由國外引進的SO3磺化裝置(如意大利Ballestra公司)操作壓力一般控制在0.03~0.05 MPa (表),其轉化率一般可達到97%以上。據報道,世界上也出現過加壓過程。用氣體壓縮機,轉化器進口壓力控制在0.5MPa ,轉化率可達99.85%,基建投資比一般廠低了10%,而耗電量卻大大增加。

表3 二氧化硫平衡轉化率與壓力的關系
3. 結論
綜上所述,二氧化硫轉化是一個催化氧化過程,它能應用于工業生產中,主要由于有觸媒的催化作用。只有借助觸媒的作用并且合理的選擇轉化溫度和冷卻方式,才能很好的完成SO2-SO3轉化,并使三氧化硫磺化裝置順利運行。
[1] W.Herman de Groot. 工業磺化/硫酸化生產技術[M].北京中國輕工業出版社.
[2] 王全貴. 我國SO3磺化技術的現狀與前景[D]. 2002(第二屆)全國三氧化硫磺化/硫酸化技術與市場研討會(文集), 2002 ∶ 16-23.
[3] 王全貴. SO2-SO3轉化系統節能分析[J].日用化學品科學, 2008, 31(11).
Analysis of sulfur dioxide conversion process
Chen Yan,Wang Quangui,Zhang Xiaojing
(China Light Industry International Engineering Co., Ltd., Beijing , 100026)
Sulfur trioxide sulfonation technology has been widely used in synthetic detergent industry in our country, for our detergent production technology and product quality improvement and development has played a positive role in promoting, and has been applied to the petroleum and chemical industries. Sulfur dioxide conversion unit is also called sulfur trioxide preparation unit, and is an important part of the apparatus. This paper mainly describes the importance of the conversion of sulfur dioxide and the reaction process, illustrating The conversion of sulfur dioxide can be realized in the industrial production must be the role of the catalyst.
Sulfur dioxide conversion;Conversionrate;Temperature;Catalys;Pressure
TQ649.5
A
1672-2701(2016)01-52-06

