冠心病患者采用心可舒片治療對其纖維蛋白原、血脂的影響分析
周亞芬
(吉林省公主嶺市第三人民醫院內科,吉林 公主嶺 136100)
冠心病患者采用心可舒片治療對其纖維蛋白原、血脂的影響分析
周亞芬
(吉林省公主嶺市第三人民醫院內科,吉林 公主嶺 136100)
目的 分析心可舒片對冠心病患者纖維蛋白原與血脂指標的影響。方法 選取我院于2014年5月~2016年5月收治106例冠心病患者進行研究,隨機分為常規組與心可舒片組各53例,比較兩組的血脂以及纖維蛋白原指標。結果 ①心可舒片組治療后的纖維蛋白原指標改善效果優于常規組,兩組數據資料經統計軟件對比,差異具有統計學意義(P<0.05)。②心可舒片組患者經治療后,患者的的HDL-C上升,LDL-C、TG、TC水平下降,與常規組對比,差異具有統計學意義(P<0.05)。結論 冠心病患者采用心可舒片治療,可使血脂降低,改善纖維蛋白原指標,值得臨床推廣。
冠心病;心可舒片;血脂
隨著人們飲食結構、生活習慣變化,我國的冠心病患病率逐年提升。數據資料表明[1],在心血管疾病中,冠心病所占比例高達53%,可見,冠心病的患病率非常高。心可舒片具有降血脂、降血液黏度、擴張冠狀動脈的功效,在冠心病的治療效果顯著[2],本文探討心可舒片對冠心病患者纖維蛋白原與血脂指標的影響現報道如下。
1 資料與方法
1.1 一般資料
以我院收治的106例冠心病患者(2014年5月~2016年5月)為研究對象,隨機將其分成心可舒片組(53例)、常規組(53例)。常規組為常規治療,女23例,男30例,年齡50~81歲,平均年齡(69.68±6.94)歲。心可舒片組在常規組基礎上加用心可舒片治療,女24例,男29例,年齡50~80歲,平均年齡(68.13±6.42)歲。兩組患者一般資料,差異無統計學意義(P>0.05)。
1.2 方法
常規組:給予常規的β-受體阻滯劑、阿司匹林、他汀類藥物、ACEI等治療。
心可舒片組:加用心可舒片(山東沃華醫藥科技股份有限公司國藥準字Z37020042)治療,2片/次,口服,3次/d。兩組患者均接受30天的治療。
1.3 觀察指標
觀察患者的血脂水平與纖維蛋白原。血脂指標包括HDL-C(高密度脂蛋白)、LDL-C(低密度脂蛋白)、TG(甘油三酯)、TC(總膽固醇),所有數據資料由醫護人員記錄與整理。
1.4 統計學方法
利用SPSS 20.0軟件分析數據資料,計數計量資料分別進行x2、t檢驗,以P<0.05為差異具有統計學意義。
2 結 果
2.1 纖維蛋白原
治療前兩組患者的纖維蛋白原對比,差異無統計學意義(P>0.05),治后心可舒片組的纖維蛋白原指標顯著下降,與常規組相比,差異具有統計學意義(P<0.05)。見表1。
2.2 血脂水平
治療前兩組病患的血脂水平經統計軟件對比,差異無統計學意義(P>0.05),治后心可舒片組的HDL-C增加,LDL-C、TG、TC指標均下降,與常規組相較,差異具有統計學意義(P<0.05)。見表2。
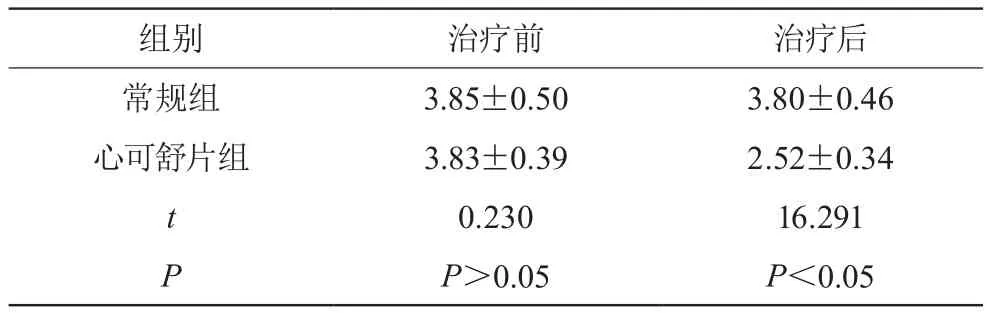
表1 兩組的纖維蛋白原指標

表2 患者的血脂水平
3 討 論
冠心病在中老年人中比較常見,受到冠狀動脈血管病變的影響,導致心肌出現缺氧、缺血癥狀的一種心臟病[3]。疾病康復慢、病程長、復發率高,因疾病癥狀反復發作,致使患者的生活質量大幅度降低。以往采用常規治療藥物對冠心病患者進行治療,雖然常規藥物能夠在一定程度上改善患者病情,但是無法改變患者的抑郁、焦慮等癥狀。研究表明[4],冠心病患者的抑郁、焦慮等不良心理狀態會可導致心悸、胸悶加重。
心可舒片在冠心病的治療中能夠取得良好的效果,它包含丹參、三七、木香、葛根、山楂五種中藥,其中葛根能達到擴張血管目的;山楂對受損細胞有保護作用,還可消食降脂;三七有活血化瘀的功效;丹參可抗抑郁、抗焦慮;木香能行氣止痛。
從研究來看,心可舒片組加用心可舒片治療后,患者的纖維蛋白原與血脂水平有明顯改善。本研究證實,心可舒片能有效改善冠心病患者的血脂與纖維蛋白原指標效果確切。綜上所述,冠心病患者經心可舒片治療,值得臨床推廣。
[1] 李 喆.心可舒片治療冠心病心絞痛的臨床療效分析[J].中國醫藥指南,2013,02:477-478.
[2] 梁小華.心可舒片雙心治療冠心病不穩定心絞痛200例觀察[J].中西醫結合心腦血管病雜志,2014,04:405-406.
[3] 郝佳佳.心可舒片治療冠心病的綜合療效觀察[J].中西醫結合心腦血管病雜志,2014,11:1408-1409.
[4] 安 然.心可舒片與復方丹參片治療冠心病的療效對比[J].中西醫結合心血管病電子雜志,2015,31:36-37.
本文編輯:劉欣悅
R541.4
B
ISSN.2095-6681.2016.18.072.02

