英國(guó)患者用藥可及性方案實(shí)施經(jīng)驗(yàn)及對(duì)我國(guó)的啟示
常 峰 崔鵬磊 夏 強(qiáng)
中國(guó)藥科大學(xué)國(guó)際醫(yī)藥商學(xué)院 江蘇南京 211198
·藥物政策·
英國(guó)患者用藥可及性方案實(shí)施經(jīng)驗(yàn)及對(duì)我國(guó)的啟示
常 峰*崔鵬磊 夏 強(qiáng)
中國(guó)藥科大學(xué)國(guó)際醫(yī)藥商學(xué)院 江蘇南京 211198
風(fēng)險(xiǎn)分擔(dān)協(xié)議在提高患者對(duì)藥品的可及性、降低藥品成本效果的不確定性和控制醫(yī)保基金財(cái)務(wù)風(fēng)險(xiǎn)等方面取得了顯著成效,受到各國(guó)政府或保險(xiǎn)人的廣泛關(guān)注。本文系統(tǒng)梳理了英國(guó)患者用藥可及性方案,包括方案的起源、分類(lèi)、應(yīng)用流程、實(shí)施效果等。指出我國(guó)已基本具備了實(shí)施風(fēng)險(xiǎn)分擔(dān)協(xié)議的條件,但仍需進(jìn)一步明確風(fēng)險(xiǎn)分擔(dān)協(xié)議實(shí)施主體,構(gòu)建風(fēng)險(xiǎn)分擔(dān)協(xié)議標(biāo)準(zhǔn)化流程,同時(shí)加強(qiáng)衛(wèi)生技術(shù)評(píng)估在衛(wèi)生資源配置中的應(yīng)用,以逐步推進(jìn)風(fēng)險(xiǎn)分擔(dān)協(xié)議的實(shí)施等建議,以期完善我國(guó)藥品談判制度,提高藥品談判的科學(xué)性和效率。
風(fēng)險(xiǎn)分擔(dān)協(xié)議; 患者用藥可及性方案; 衛(wèi)生技術(shù)評(píng)估; 價(jià)格談判
2016年1月12日,國(guó)務(wù)院發(fā)布了《關(guān)于整合城鄉(xiāng)居民基本醫(yī)療保險(xiǎn)制度的意見(jiàn)》(國(guó)發(fā)〔2016〕3號(hào)),指出應(yīng)建立健全醫(yī)保經(jīng)辦機(jī)構(gòu)與醫(yī)療機(jī)構(gòu)及藥品供應(yīng)商的談判協(xié)商機(jī)制和風(fēng)險(xiǎn)分擔(dān)機(jī)制,形成合理的醫(yī)保支付標(biāo)準(zhǔn)。[1]隨著我國(guó)全覆蓋、保基本、多層次、可持續(xù)的醫(yī)療保障體系的深入推進(jìn),山東青島、江蘇、江西、浙江、湖南等省市陸續(xù)開(kāi)展了特藥、特材談判工作,并與藥品供應(yīng)商簽訂風(fēng)險(xiǎn)分擔(dān)協(xié)議(risk-sharing agreements,RSA),在提高患者對(duì)藥品的可及性、維持財(cái)政預(yù)算平衡和鼓勵(lì)新藥研發(fā)等方面做出了積極探索。RSA在國(guó)際上應(yīng)用也較為廣泛,在英國(guó),RSA即為患者用藥可及性方案(patient access schemes,PAS),由于PAS在英格蘭、威爾士實(shí)施時(shí)間較長(zhǎng)且運(yùn)作和管理機(jī)制較為成熟,因此本文將重點(diǎn)分析英格蘭、威爾士的PAS,以期構(gòu)建我國(guó)風(fēng)險(xiǎn)分擔(dān)協(xié)議標(biāo)準(zhǔn)化流程,完善我國(guó)藥品談判制度。
1 PAS概述
1.1 PAS起源
英國(guó)PAS最早可追溯至2002年。2002年1月,英國(guó)國(guó)家衛(wèi)生與服務(wù)優(yōu)化研究院(National Institute for Health and Care Excellence,NICE)發(fā)布了利用β-干擾素和醋酸格拉替雷治療多發(fā)性硬化(multiple sclerosis,MS)的技術(shù)評(píng)價(jià)指南,由于該治療手段的長(zhǎng)期成本效果存在不確定性,NICE做出了不推薦臨床使用的決定。但為了保證患者能夠在國(guó)家衛(wèi)生服務(wù)體系(NHS)中使用該藥品,同時(shí)確保其成本效果,英國(guó)衛(wèi)生部(Department of Health, DH)與英國(guó)神經(jīng)病學(xué)家協(xié)會(huì)、MS信托機(jī)構(gòu)、MS社會(huì)團(tuán)體以及β-干擾素和醋酸格拉替雷廠商共同協(xié)商,于2002年2月發(fā)起了MS風(fēng)險(xiǎn)分擔(dān)協(xié)議。協(xié)議規(guī)定NHS將會(huì)補(bǔ)償藥品費(fèi)用,但需要進(jìn)行至少10年的隊(duì)列研究并收集至少5 000名患者的疾病進(jìn)展情況,來(lái)監(jiān)控藥品的成本效果。同時(shí)規(guī)定每增加一個(gè)質(zhì)量調(diào)整生命年(Quality-Adjusted Life Year,QALY)的費(fèi)用閾值為36 000英鎊,如果藥品實(shí)際費(fèi)用超過(guò)該閾值,則廠商必須降價(jià)。[2-3]
2007年2月,英國(guó)公平交易辦公室(Office of Fair Trading,OFT)研究指出,當(dāng)前英國(guó)藥品價(jià)格調(diào)控計(jì)劃(Pharmaceutical Price Regulation Scheme,PPRS)框架下許多品牌藥價(jià)格過(guò)高,與類(lèi)似臨床療效的替代藥品相比,價(jià)差可能高達(dá)10倍,導(dǎo)致現(xiàn)行藥價(jià)未能充分體現(xiàn)藥品價(jià)值,影響了NHS資源配置效率。因此OFT提出英國(guó)應(yīng)考慮實(shí)施價(jià)值定價(jià)機(jī)制(value-based pricing,VBP)[4],由政府和廠商在對(duì)藥品臨床價(jià)值進(jìn)行科學(xué)評(píng)估的基礎(chǔ)上進(jìn)行費(fèi)用談判[5]。同時(shí)NICE在制定推薦意見(jiàn)時(shí),也面臨著該如何科學(xué)評(píng)估藥品價(jià)值,保證藥品物有所值的問(wèn)題。在此背景下,DH和英國(guó)制藥行業(yè)協(xié)會(huì)協(xié)商2009版PPRS時(shí),開(kāi)始實(shí)施患者用藥可及性方案,旨在幫助患者早日獲得NICE原本評(píng)估為不符合成本效果的藥品。[6]這標(biāo)志著PAS正式成為未獲得NICE正面評(píng)價(jià)、成本效果具有不確定性的藥品獲得NHS補(bǔ)償?shù)姆绞健?/p>
在英國(guó)必須由廠商率先提出PAS申請(qǐng)。當(dāng)前NICE主要依據(jù)QALY來(lái)評(píng)估藥品價(jià)值,其閾值設(shè)定為20 000~30 000英鎊。一般而言,當(dāng)NICE認(rèn)為藥品每增加1個(gè)QALY就要增加30 000英鎊以上費(fèi)用時(shí),廠商通常就需要提出PAS申請(qǐng)。而對(duì)于某些延長(zhǎng)臨終壽命的治療方式,可適當(dāng)提高閾值,適用情況需滿(mǎn)足以下全部條件:(1)患者預(yù)期壽命通常少于24個(gè)月;(2)與NHS現(xiàn)行治療方式相比,有足夠的證據(jù)顯示該治療方式至少可延長(zhǎng)3個(gè)月壽命;(3)該治療方式必須經(jīng)批準(zhǔn)上市,且適用于少部分患者人群。[7]
1.2 PAS分類(lèi)
2009版PPRS將PAS劃分為兩種類(lèi)型:以財(cái)務(wù)為基礎(chǔ)(financially-based)和以結(jié)局為基礎(chǔ)(outcome-based)的方案。如圖1所示。其中證明價(jià)值是指廠商與NICE達(dá)成協(xié)議,當(dāng)廠商收集的新證據(jù)足以證明藥品的成本效果時(shí),可提高藥品價(jià)格。預(yù)期價(jià)值是指如果依據(jù)新證據(jù)再次評(píng)估藥品,發(fā)現(xiàn)新證據(jù)并不支持現(xiàn)有價(jià)格時(shí),廠商將面臨還款或降價(jià)的風(fēng)險(xiǎn)。風(fēng)險(xiǎn)分擔(dān)是指需要測(cè)量患者報(bào)告結(jié)局和臨床結(jié)局,基于測(cè)量的結(jié)局,廠商和NHS可選擇價(jià)格調(diào)整和/或現(xiàn)金轉(zhuǎn)移的方式來(lái)分擔(dān)風(fēng)險(xiǎn)。廠商可結(jié)合使用不同類(lèi)型的方案。2014年,DH與英國(guó)制藥工業(yè)協(xié)會(huì)開(kāi)始實(shí)施新版PPRS,并對(duì)PAS內(nèi)容進(jìn)行修改,將其劃分為簡(jiǎn)單折扣方案(simple discount schemes)和復(fù)雜方案(complex schemes)。其中簡(jiǎn)單折扣方案需保證不會(huì)對(duì)NHS造成顯著的、持續(xù)的、額外的負(fù)擔(dān)。該方案下,廠商可選擇改變藥品目錄價(jià)格或者向NHS提供折扣或固定價(jià)格(低于目錄價(jià)格)。復(fù)雜方案則包括其它所有類(lèi)型的PAS,例如還款、劑量上限、部分藥品免費(fèi)、以結(jié)局為基礎(chǔ)的方案等。
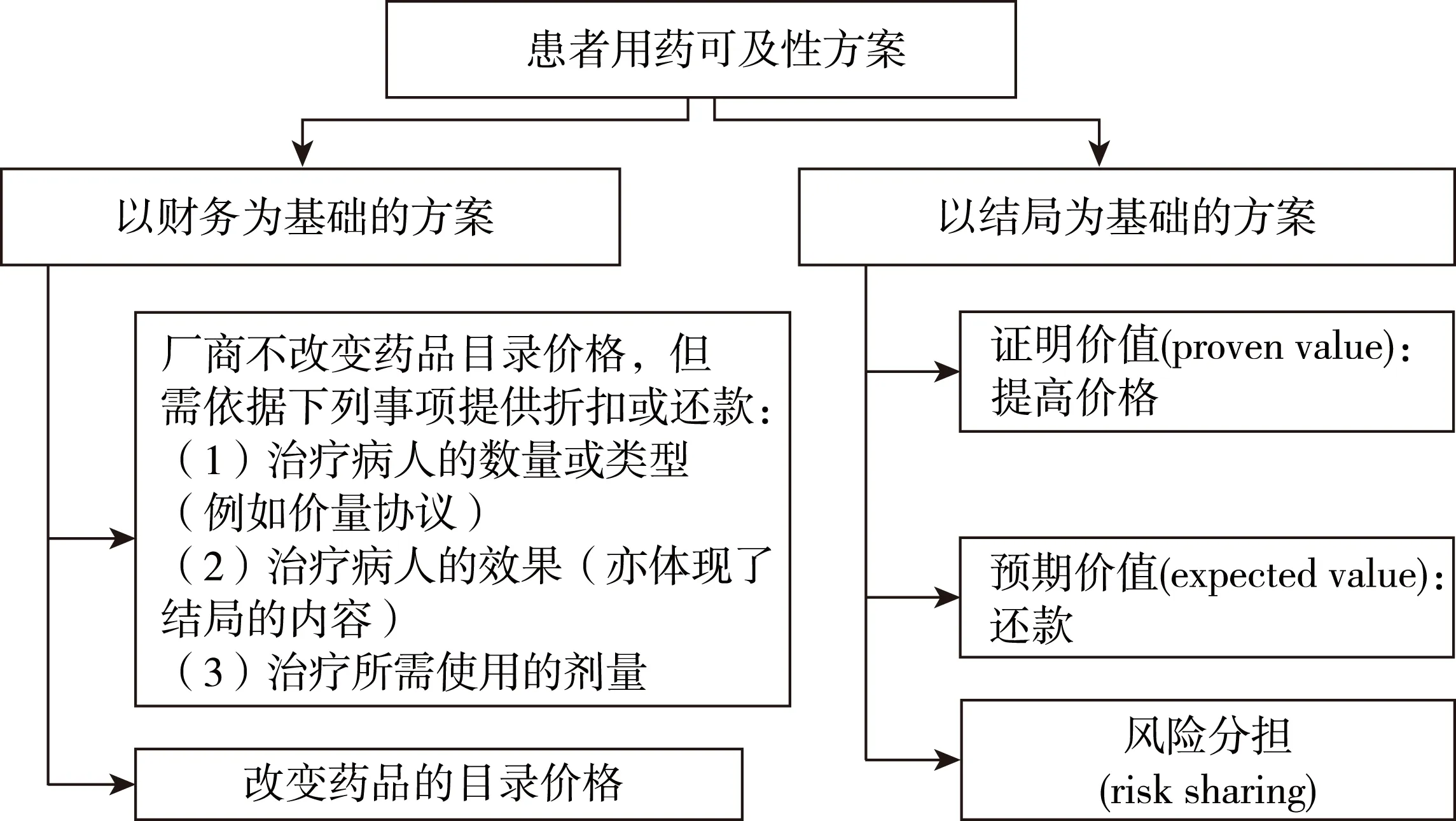
圖1 2009版PPRS中PAS分類(lèi)
2 PAS應(yīng)用流程
PAS應(yīng)用流程重點(diǎn)包括以下五個(gè)方面:(1)前期討論。廠商向DH提交PAS前,事先與DH討論草案內(nèi)容,DH往往會(huì)針對(duì)草案內(nèi)容提供建議,然后由廠商決定是否提交PAS以及提交何種類(lèi)型的PAS。(2)廠商向DH提交計(jì)劃書(shū)模板。模板分為兩類(lèi):簡(jiǎn)單折扣方案模板和標(biāo)準(zhǔn)方案模板(適用于其它所有類(lèi)型的PAS)。(3)患者用藥可及性方案聯(lián)絡(luò)單位(Patient Access Scheme Liaison Unit,PASLU)審查PAS的可行性,并向DH提供指導(dǎo)建議。(4)NICE進(jìn)行技術(shù)評(píng)價(jià)并發(fā)布指南。(5)NHS實(shí)施并與DH、NICE共同監(jiān)測(cè)PAS(圖2)。
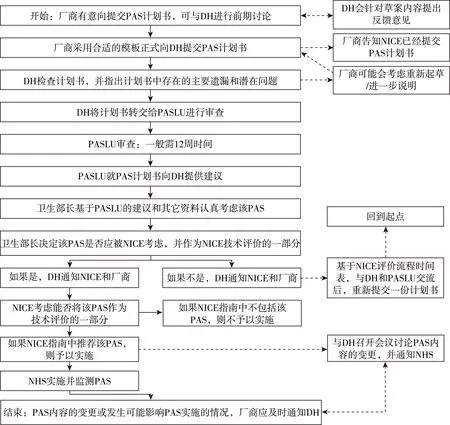
圖2 PAS應(yīng)用流程
2.1 實(shí)施PAS的關(guān)鍵性原則
(1)PAS計(jì)劃書(shū)需要首先由DH與廠商進(jìn)行討論并原則上達(dá)成一致;(2)PAS必須尊重NICE向NHS提供獨(dú)立評(píng)估和評(píng)價(jià)證據(jù)(針對(duì)某干預(yù)措施)的角色;(3)NHS實(shí)施PAS的所有成本都應(yīng)包含于評(píng)價(jià)委員會(huì)需要考量的成本之中;(4)PAS在臨床應(yīng)用中應(yīng)具備穩(wěn)健、合理、適當(dāng)和可監(jiān)測(cè)的特性;(5)對(duì)NHS而言,任何PAS在運(yùn)作過(guò)程中都應(yīng)是可管理的,沒(méi)有過(guò)于復(fù)雜的監(jiān)測(cè)、不成比例的額外費(fèi)用和過(guò)多的繁文縟節(jié);(6)PAS應(yīng)具有明確的實(shí)施期限和終止標(biāo)準(zhǔn);(7)PAS運(yùn)作過(guò)程中對(duì)各方當(dāng)事人造成的累積行政負(fù)擔(dān)應(yīng)是可管理的;(8)實(shí)施PAS時(shí)應(yīng)考慮優(yōu)先級(jí)問(wèn)題,比如可以解決先前未能滿(mǎn)足的需要或者能夠讓更多患者獲益的方案;(9)PAS資金流應(yīng)與NHS和地方行政部門(mén)現(xiàn)有的資金流相一致;(10)任何PAS計(jì)劃書(shū)必須咨詢(xún)NHS。
2.2 廠商提出PAS的背景與時(shí)間
廠商首先需要明確提交PAS的必要性和恰當(dāng)性(圖3)。對(duì)于復(fù)雜方案,廠商可以在NICE技術(shù)評(píng)價(jià)開(kāi)始前提出PAS,也可以在評(píng)價(jià)結(jié)束時(shí),收到任何申訴及NICE發(fā)布最終指南后提出PAS。評(píng)價(jià)開(kāi)始階段是指廠商向NICE提交證據(jù)時(shí)提出PAS,這意味著提交給DH的PAS計(jì)劃書(shū)必須在向NICE提交證據(jù)之前進(jìn)行,以保證DH在第一次評(píng)價(jià)委員會(huì)會(huì)議之前有足夠的時(shí)間考慮該P(yáng)AS,并保證證據(jù)審查團(tuán)隊(duì)或評(píng)估團(tuán)隊(duì)有足夠的時(shí)間審查該方案,如果NICE沒(méi)有收到DH的正式通知,評(píng)價(jià)委員會(huì)則不能考慮該P(yáng)AS。同時(shí)在指南發(fā)布16周內(nèi),廠商仍可提交PAS,當(dāng)DH轉(zhuǎn)交給NICE某PAS后,NICE啟動(dòng)快速審查機(jī)制對(duì)其進(jìn)行優(yōu)先審評(píng)。如果時(shí)間超過(guò)16周,NICE則采用標(biāo)準(zhǔn)審查程序考慮PAS。對(duì)于簡(jiǎn)單折扣方案,廠商還可以在技術(shù)評(píng)價(jià)流程中發(fā)布評(píng)價(jià)咨詢(xún)文件或最終評(píng)價(jià)決定后提出PAS。[9]
2.3 PASLU審查流程
NICE在衛(wèi)生技術(shù)評(píng)估中心下設(shè)有PASLU,負(fù)責(zé)審查PAS計(jì)劃書(shū)的可行性,PASLU流程并不是NICE技術(shù)評(píng)價(jià)流程的一部分。PASLU流程包括3個(gè)階段:(1)廠商啟動(dòng)PAS并提交資料。(2)PASLU審查證據(jù)并制定建議草案。PASLU在收到廠商的PAS計(jì)劃書(shū)后,會(huì)依據(jù)模板要求,檢查計(jì)劃書(shū)的完整性。如果計(jì)劃書(shū)不完整,PASLU會(huì)要求廠商做進(jìn)一步說(shuō)明;如果計(jì)劃書(shū)完整,PASLU則會(huì)審查計(jì)劃書(shū)并制定建議草案。然后PASLU將建議草案轉(zhuǎn)交給廠商,廠商將在5天內(nèi)檢查建議草案中是否存在實(shí)質(zhì)性錯(cuò)誤(數(shù)據(jù)錯(cuò)誤、引用不恰當(dāng)、文字表述不清楚等)。(3)組織專(zhuān)家小組會(huì)議考慮建議草案,并向DH提交最終建議。PASLU將選擇臨床、藥學(xué)、NHS和病患專(zhuān)家,與專(zhuān)家小組共同舉行會(huì)議考慮PAS計(jì)劃書(shū)的可行性(圖4)。[10]
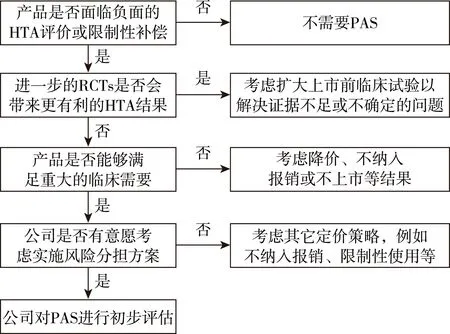
圖3 廠商提出PAS的背景
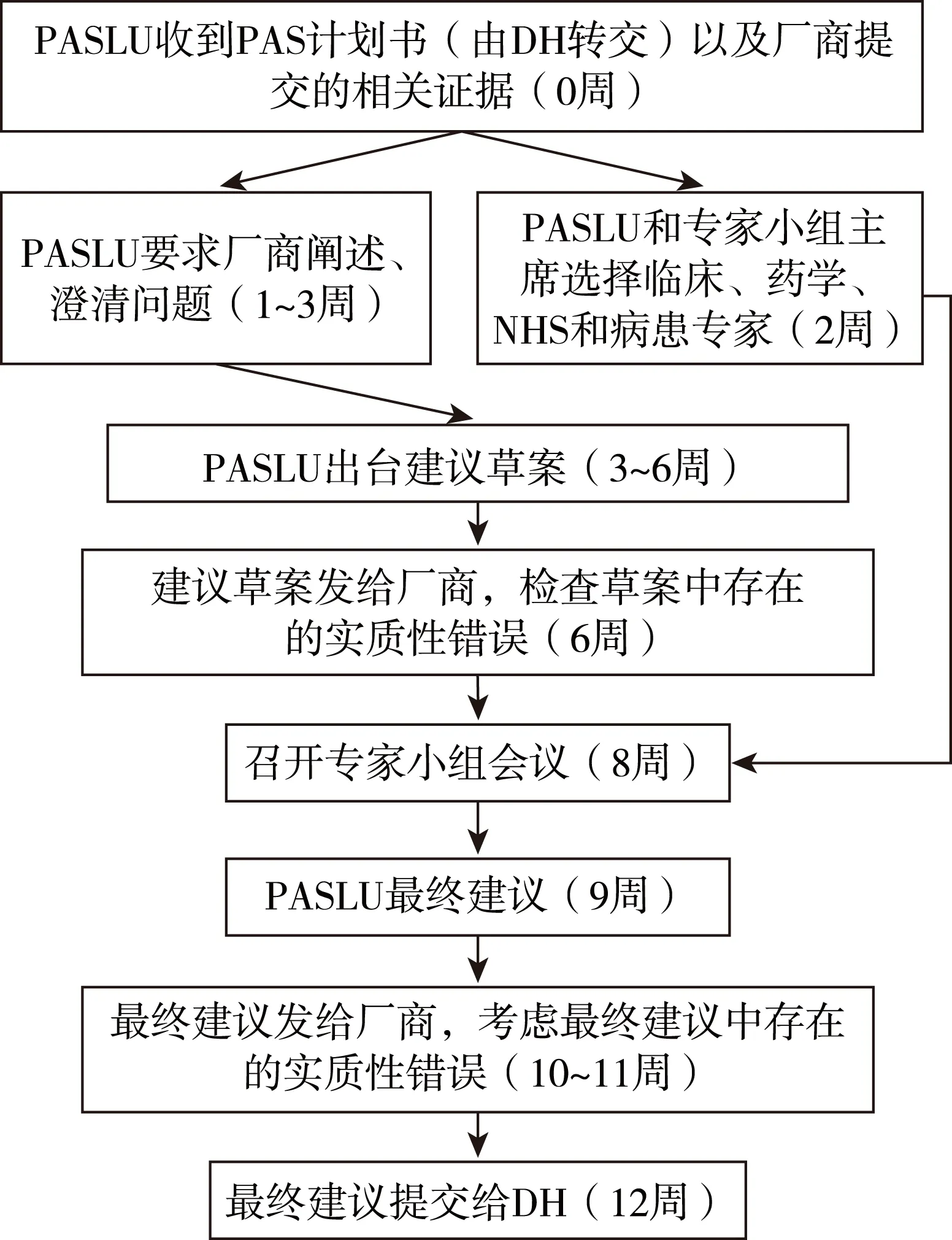
圖4 PASLU審查流程
2.4 NICE技術(shù)評(píng)價(jià)流程
NICE只有在收到DH的正式通知后才能評(píng)價(jià)PAS。基于廠商提出PAS計(jì)劃書(shū)的時(shí)間節(jié)點(diǎn)不同,NICE技術(shù)評(píng)價(jià)流程有所差異。首先由證據(jù)審查團(tuán)隊(duì)或評(píng)估團(tuán)隊(duì)審查PAS計(jì)劃書(shū)并提交報(bào)告。然后評(píng)價(jià)委員會(huì)基于PAS計(jì)劃書(shū)進(jìn)行討論制定最初的推薦意見(jiàn)(技術(shù)評(píng)價(jià)前提交PAS)或者考慮是否需要修正最初的推薦意見(jiàn)或已發(fā)布的評(píng)價(jià)指南(技術(shù)評(píng)價(jià)期間或結(jié)束后提交PAS),委員會(huì)委員主要來(lái)自NHS、患者及照護(hù)者團(tuán)體、學(xué)術(shù)界和醫(yī)藥產(chǎn)業(yè)界。技術(shù)評(píng)價(jià)流程如圖5所示,其中評(píng)價(jià)咨詢(xún)文件是指評(píng)價(jià)委員會(huì)向NICE提交的暫定建議,只有當(dāng)評(píng)價(jià)委員會(huì)不推薦使用或限制性使用某項(xiàng)技術(shù)時(shí),才會(huì)發(fā)布此文件。然后征詢(xún)各方主體意見(jiàn),其中顧問(wèn)和評(píng)論員在四周內(nèi)對(duì)評(píng)價(jià)咨詢(xún)文件進(jìn)行評(píng)論,該文件也會(huì)在NICE網(wǎng)站上進(jìn)行公布,供公眾進(jìn)行評(píng)論。最終評(píng)價(jià)決定是指評(píng)價(jià)委員對(duì)所有的評(píng)論進(jìn)行討論,并向NICE提供最終建議。NICE會(huì)將最終評(píng)價(jià)決定發(fā)給顧問(wèn),由其在限定時(shí)間內(nèi)提出書(shū)面申訴。如果沒(méi)有必須處理或申訴理由不成立,NICE將發(fā)布最終指南。[9]
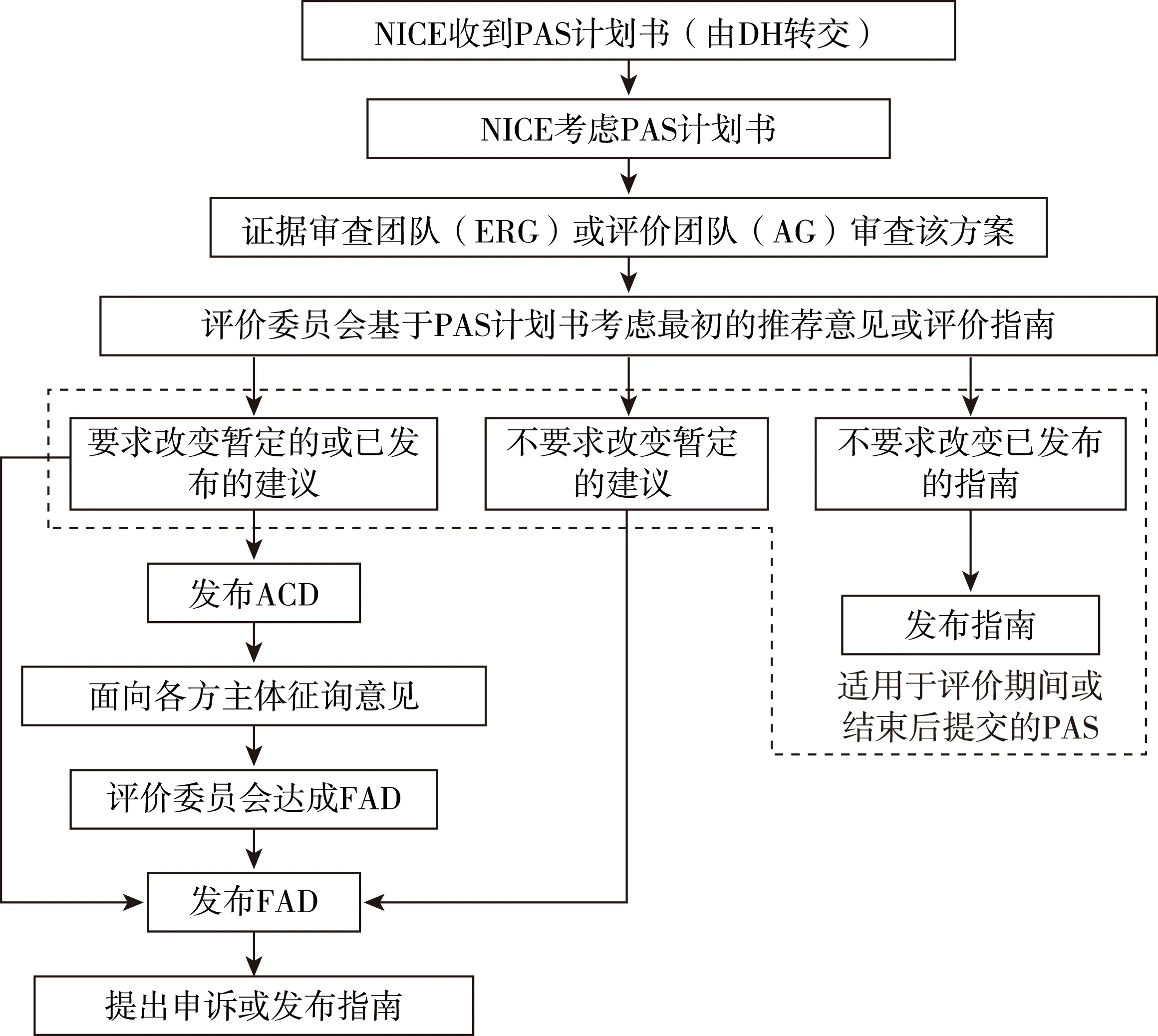
圖5 NICE技術(shù)評(píng)價(jià)流程
2.5 后續(xù)監(jiān)測(cè)與透明度問(wèn)題
PAS實(shí)施后,DH、NICE和NHS三者會(huì)對(duì)PAS進(jìn)行周期性監(jiān)測(cè),監(jiān)控PAS運(yùn)作過(guò)程可能出現(xiàn)的問(wèn)題,如管理成本增加、藥品健康效益降低等。一旦發(fā)現(xiàn)問(wèn)題,廠商和NHS應(yīng)快速查明原因,并與DH商討,然后由NICE制定解決方案。同時(shí)技術(shù)評(píng)價(jià)指南中規(guī)定了NICE重新審查指南的日期,對(duì)于指南中包括PAS的案例,NICE將會(huì)在必要時(shí)重新審查PAS的運(yùn)作情況,并考慮是否對(duì)PAS進(jìn)行修訂以簡(jiǎn)化和提高PAS運(yùn)作能力。其中任何變動(dòng)都需要與DH進(jìn)行討論并得到DH同意后方可執(zhí)行。關(guān)于PAS的透明度,盡管這類(lèi)方案在全球皆具有保密性,但公眾仍可獲知NICE技術(shù)評(píng)價(jià)指南中的PAS內(nèi)容。DH的基本立場(chǎng)是所有運(yùn)作的PAS都應(yīng)是透明的,但簡(jiǎn)單折扣方案的折扣率不對(duì)外公布。
3 PAS實(shí)施效果分析
PAS不會(huì)影響廠商的目錄價(jià)格,因此可以避免國(guó)際市場(chǎng)的藥價(jià)連鎖反應(yīng)。廠商為了加速產(chǎn)品獲得補(bǔ)償,提高銷(xiāo)售量,有動(dòng)機(jī)與政府或保險(xiǎn)人簽訂PAS。但當(dāng)前以結(jié)局為基礎(chǔ)的方案由于實(shí)施過(guò)程較為復(fù)雜,嚴(yán)重影響了藥品在臨床上的應(yīng)用情況。如2002年提出的MS風(fēng)險(xiǎn)分擔(dān)協(xié)議,直到2005年4月才招募到隊(duì)列研究所需的患者(5 610人),共有72個(gè)試驗(yàn)中心參與其中。[2]Boggild M等學(xué)者通過(guò)歷史性隊(duì)列研究方法對(duì)2002年5月—2005年4月參與風(fēng)險(xiǎn)分擔(dān)協(xié)議的MS患者的殘疾進(jìn)展?fàn)顩r進(jìn)行研究,發(fā)現(xiàn)實(shí)際的臨床結(jié)局比模型預(yù)期值和對(duì)照組的臨床結(jié)局更加糟糕,然而英國(guó)官方并沒(méi)有啟動(dòng)降價(jià)機(jī)制,理由是在沒(méi)有進(jìn)一步追蹤和分析的情況下重新定價(jià)為時(shí)尚早,原因包括評(píng)分者存在主觀性、遺失數(shù)據(jù)造成潛在偏差、歷史性隊(duì)列研究可能忽視了疾病的進(jìn)展情況等,因此有待于進(jìn)一步研究才能明確MS風(fēng)險(xiǎn)分擔(dān)協(xié)議的長(zhǎng)期成本效果。[11-12]同時(shí)該方案還存在監(jiān)測(cè)周期長(zhǎng)、管理成本高、患者用藥依從性差的問(wèn)題,雖然廠商報(bào)告在臨床試驗(yàn)中有90%的患者具有依從性,但實(shí)際只有70%~80%。[13]
2009年英國(guó)癌癥網(wǎng)絡(luò)藥師論壇通過(guò)問(wèn)卷調(diào)查的形式對(duì)2007年7月—2009年7月131個(gè)NHS Trusts運(yùn)作的4項(xiàng)癌癥用藥PAS進(jìn)行數(shù)據(jù)收集。其中37(28%)個(gè)NHS Trusts進(jìn)行了回復(fù),回收有效問(wèn)卷61份。結(jié)果顯示各NHS Trust對(duì)復(fù)雜方案的理解與執(zhí)行有限,以西妥昔單抗為例,45份問(wèn)卷中只有15%能夠說(shuō)明其所屬的Trusts在執(zhí)行該P(yáng)AS。[14]由于以結(jié)局為基礎(chǔ)的PAS的復(fù)雜性、執(zhí)行的困難度,英格蘭、威爾士逐漸傾向于使用以折扣為主的PAS。DH與ABPI同樣認(rèn)為簡(jiǎn)單折扣方案應(yīng)是最簡(jiǎn)單的也是首選的PAS,因?yàn)樵摲桨附oNHS和廠商帶來(lái)的負(fù)擔(dān)最低。而以結(jié)局為基礎(chǔ)的方案,由于其在設(shè)計(jì)和測(cè)量結(jié)局方面的復(fù)雜性,實(shí)施和監(jiān)測(cè)方案的成本較高,會(huì)給NHS和廠商帶來(lái)繁重的行政工作,因此認(rèn)為該方案應(yīng)適用于特例案件而非普遍情況。[6]
4 討論與建議
風(fēng)險(xiǎn)分擔(dān)協(xié)議是政府、保險(xiǎn)人與廠商基于藥品、醫(yī)療器械或診斷試劑等醫(yī)療技術(shù)的不確定性和預(yù)算約束等原因簽訂的協(xié)議,旨在提高患者對(duì)新醫(yī)療技術(shù)的可及性、降低新醫(yī)療技術(shù)成本效果的不確定性、控制醫(yī)保基金財(cái)務(wù)風(fēng)險(xiǎn)和鼓勵(lì)醫(yī)藥企業(yè)研發(fā)創(chuàng)新,該協(xié)議對(duì)于保險(xiǎn)人、廠商、患者等利益相關(guān)者而言,是一種多方共贏的方案。我國(guó)部分地區(qū)在開(kāi)展特藥、特材談判工作時(shí),對(duì)RSA的應(yīng)用進(jìn)行了積極的探索,主要表現(xiàn)為價(jià)量協(xié)議、買(mǎi)贈(zèng)計(jì)劃兩種形式。如青島市2012年開(kāi)始試行大病醫(yī)療救助制度,由市社會(huì)保險(xiǎn)經(jīng)辦機(jī)構(gòu)與特藥、特材供應(yīng)商進(jìn)行談判,并通過(guò)流行病學(xué)數(shù)據(jù)、醫(yī)保人群基數(shù)和基因檢測(cè)陽(yáng)性率等指標(biāo)來(lái)確定藥品年度人數(shù)限額,超過(guò)限額的人員則由廠商承擔(dān)責(zé)任。[15]江西省醫(yī)保經(jīng)辦機(jī)構(gòu)與某國(guó)際藥企針對(duì)治療乳腺癌的赫賽汀進(jìn)行談判并簽訂協(xié)議,規(guī)定全省使用人數(shù)為700人及以下時(shí),醫(yī)保結(jié)算價(jià)為20 281元;多于700人時(shí),醫(yī)保結(jié)算價(jià)降為20 028元,同時(shí)買(mǎi)6支贈(zèng)8支。浙江省則成立大病保險(xiǎn)特殊用藥工作領(lǐng)導(dǎo)小組、專(zhuān)家評(píng)審小組和談判小組與廠商進(jìn)行談判,其中協(xié)議甲磺酸伊馬替尼片(格列衛(wèi))的價(jià)格為每盒10 800元,同時(shí)患者連續(xù)購(gòu)買(mǎi)3個(gè)月后,贈(zèng)送9個(gè)月。但我國(guó)RSA尚未全面付諸執(zhí)行且運(yùn)作和管理體系尚不成熟,還有待參考國(guó)外成熟經(jīng)驗(yàn),進(jìn)一步完善。
4.1 明確風(fēng)險(xiǎn)分擔(dān)協(xié)議實(shí)施主體,構(gòu)建風(fēng)險(xiǎn)分擔(dān)協(xié)議標(biāo)準(zhǔn)化流程
英國(guó)構(gòu)建了完備高效的PAS組織架構(gòu)和應(yīng)用流程,保證了PAS的順利實(shí)施。組織架構(gòu)中涉及DH、PASLU、NICE、NHS四個(gè)部門(mén)。應(yīng)用流程包括前期討論、提交計(jì)劃書(shū)模板、審查、評(píng)估、反饋、發(fā)布指南、后期監(jiān)測(cè)、復(fù)審等事項(xiàng),同時(shí)邀請(qǐng)臨床、藥學(xué)、NHS、病患專(zhuān)家、公眾以及顧問(wèn)和評(píng)論員參與其中,通過(guò)各方協(xié)商參與,提高了RSA的科學(xué)性和適應(yīng)性。在我國(guó)實(shí)施RSA時(shí),首先應(yīng)明確實(shí)施主體,鑒于RSA是藥品談判的重要組成部分,而我國(guó)藥品談判涉及專(zhuān)利、獨(dú)家品種采購(gòu)談判和特藥、特材醫(yī)保準(zhǔn)入談判,不同談判形式下參與主體各異,造成職能部門(mén)冗雜,談判結(jié)果互不適應(yīng)的窘境。因此建議融合兩種談判制度,由衛(wèi)生計(jì)生、醫(yī)保部門(mén)協(xié)同組織談判,銜接藥品采購(gòu)和醫(yī)保制度,保證信息互通有無(wú)。無(wú)論是國(guó)家級(jí)談判還是省級(jí)談判,對(duì)于談判成功的藥品直接納入醫(yī)保目錄和省增補(bǔ)目錄,或單獨(dú)制定高值藥品目錄,談判形成采購(gòu)價(jià)格和醫(yī)保支付標(biāo)準(zhǔn),創(chuàng)新我國(guó)藥品談判制度,同步改革我國(guó)醫(yī)保目錄周期性調(diào)整機(jī)制。在構(gòu)建標(biāo)準(zhǔn)化流程方面,應(yīng)事先明確計(jì)劃書(shū)模板的內(nèi)容和形式,以提高審查和評(píng)估的可操作性、規(guī)范性和精簡(jiǎn)性。成立衛(wèi)生技術(shù)評(píng)估研究機(jī)構(gòu)負(fù)責(zé)審查、評(píng)估、復(fù)審RSA,收集、分析反饋意見(jiàn),并在保證機(jī)密性和透明度兩者平衡的基礎(chǔ)上發(fā)布技術(shù)評(píng)價(jià)報(bào)告。衛(wèi)生計(jì)生、醫(yī)保部門(mén)則負(fù)責(zé)監(jiān)測(cè)方案的運(yùn)作情況,對(duì)于不滿(mǎn)足預(yù)期效果的藥品,啟動(dòng)降價(jià)、折扣、還款響應(yīng)機(jī)制。同時(shí)保證政府、廠商、醫(yī)療機(jī)構(gòu)、行業(yè)團(tuán)體、專(zhuān)家、患者代表等主體多方參與,形成風(fēng)險(xiǎn)分擔(dān)協(xié)議標(biāo)準(zhǔn)化流程。
4.2 加強(qiáng)HTA在衛(wèi)生資源配置中的應(yīng)用,以逐步推進(jìn)風(fēng)險(xiǎn)分擔(dān)協(xié)議的實(shí)施
當(dāng)前我國(guó)實(shí)施的RSA主要針對(duì)治療重大(罕見(jiàn))疾病臨床必需、療效顯著、價(jià)格昂貴且難以用其他治療方案替代的非醫(yī)保藥品和特殊醫(yī)用材料,并在臨床遴選藥品、專(zhuān)家評(píng)審、談判協(xié)商過(guò)程中均將藥品療效、經(jīng)濟(jì)性納入考量標(biāo)準(zhǔn)。由此可見(jiàn),HTA是RSA應(yīng)用過(guò)程中的關(guān)鍵性手段,但我國(guó)尚未成立專(zhuān)業(yè)的HTA機(jī)構(gòu),HTA在我國(guó)衛(wèi)生資源配置中的應(yīng)用仍然任重道遠(yuǎn)。因此近期可擴(kuò)大特藥談判試點(diǎn)省份,繼續(xù)探索實(shí)施以財(cái)務(wù)為基礎(chǔ)的RSA。中長(zhǎng)期應(yīng)以藥品談判為契機(jī),由相關(guān)部委主導(dǎo),通過(guò)多部門(mén)、多學(xué)科合作,成立由臨床、藥學(xué)、流行病學(xué)、藥物經(jīng)濟(jì)學(xué)等專(zhuān)家組成的國(guó)家級(jí)HTA研究機(jī)構(gòu),負(fù)責(zé)評(píng)估藥品療效和經(jīng)濟(jì)性。并由廠商提交HTA資料,包括:(1)產(chǎn)品資料:藥品臨床療效、可替代藥品、國(guó)際市場(chǎng)價(jià)格等;(2)經(jīng)濟(jì)性資料:藥品成本效果分析、預(yù)算影響分析等;(3)疾病資料:流行病學(xué)數(shù)據(jù)、疾病嚴(yán)重程度、潛在患者數(shù)量等,以提高HTA在藥品談判中的應(yīng)用程度,并逐漸擴(kuò)展到醫(yī)療器械、診斷技術(shù)、手術(shù)操作的遴選和推廣上,以及制定醫(yī)保目錄、規(guī)范醫(yī)師用藥、指導(dǎo)臨床合理用藥和指導(dǎo)新藥研發(fā)等領(lǐng)域。隨著HTA理論與實(shí)踐經(jīng)驗(yàn)的不斷成熟,可探索對(duì)于成本效果具有不確定性、無(wú)替代藥品但為延長(zhǎng)患者壽命所必需的藥品,實(shí)施以結(jié)局為基礎(chǔ)的RSA,同步考慮在醫(yī)療器械和診斷試劑間實(shí)施RSA。通過(guò)從廣度和深度兩個(gè)維度逐步推廣RSA,以解決財(cái)政預(yù)算有限而醫(yī)療服務(wù)需求無(wú)限的現(xiàn)實(shí)矛盾,最優(yōu)化我國(guó)醫(yī)療衛(wèi)生資源配置。
[1] 國(guó)務(wù)院. 國(guó)務(wù)院關(guān)于整合城鄉(xiāng)居民基本醫(yī)療保險(xiǎn)制度的意見(jiàn)[EB/OL]. (2016-01-12)[2016- 01- 17].http://www. gov.cn/zhengce/content/2016-01/12/content_10582.htm
[2] Barham L Achieving market access in the UK with a little help from Patient Access Schemes[EB/OL].(2014-07-17)[2016-01- 17].http://www.pharmaphorum.com/articles/achieving-market-access-in-the-uk-with-a-little-help-from-patient-access-schemes
[3] Palace J, Bregenzer T, Tremlett H, et al. UK multiple sclerosis risk-sharing scheme: a new natural history dataset and an improved Markov model[J]. BMJ open, 2014, 4(1): e004073.
[4] Office of Fair Trading. The Pharmaceutical Price Regulation Scheme: An OFT market study[R]. 2007.
[5] 茅鴦對(duì), 常峰. 英國(guó)藥品價(jià)值定價(jià)機(jī)制研究[J]. 上海醫(yī)藥, 2013, 34(19): 32-35.
[6] Department of Health. Pharmaceutical price regulation scheme 2014[EB/OL]. (2013-12-03)[2016-05- 17].https://www.gov. uk/government/uploads/system/uploads/attachment_data/file/282523/Pharmaceutical_Price_Regulation.pdf
[7] NICE. Appraising life-extending, end of life treatments[EB/OL]. (2009-07-01)[2016-01- 17].https://www. nice.org.uk/guidance/gid-tag387/resources/appraising-life-extending-end-of-life-treatments-paper2
[8] Department of Health.Hints and tips for companies considering a Patient Access Scheme (PAS) proposal in England [EB/OL]. https://www.gov.uk/government/uploads/system/uploads/attachment_data/file/217037/PAS-Good-Practice-Guidance.pdf
[9] NICE. Guide to the processes of technology appraisal [EB/OL]. (2014-09-01)[2016-01-17].https://www.nice. org.uk/article/pmg19/chapter/5-Patient-access-schemes-and- flexible-pricing
[10] NICE. Process for advising on the feasibility of implementing a patient access scheme[EB/OL]. (2009-10-28)[2016-01- 17].https://www.nice.org.uk/Media/Default/About/what-we-do/PASLU/PASLU-process-guide.pdf
[11] Boggild M, Palace J, Barton P, et al. Multiple sclerosis risk sharing scheme: two year results of clinical cohort study with historical comparator[J]. BMJ, 2009, 339: b4677.
[12] Raftery J. Multiple sclerosis risk sharing scheme: a costly failure[J]. BMJ, 2010, 340: 1282-1284
[13] Neumann P J, Chambers J D, Simon F, et al. Risk-sharing arrangements that link payment for drugs to health outcomes are proving hard to implement[J]. Health Affairs, 2011, 30(12): 2329-2337.
[14] Cancer Network Pharmacist Forum. A Report into the Uptake of Patient Access Schemes in the NHS[R]. 2009.
[15] 賀小林,梁鴻,劉軍帥. 青島市高值藥品救助政策的實(shí)踐與創(chuàng)新[J]. 中國(guó)醫(yī)療保險(xiǎn), 2014, 7(8): 36-38.
(編輯 趙曉娟)
The implementing experience of patient access schemes in UK and its implication for China
CHANGFeng,CUIPeng-lei,XIAQiang
SchoolofInternationalPharmaceuticalBusiness,ChinaPharmaceuticalUniversity,NanjingJiangsu211198,China
The Risk-sharing agreements have achieved remarkable success in improving patients’ access to drugs, lowering the uncertainty of the drugs cost-effectiveness, financial risk control and other aspects of medical insurance fund, so they have attracted widespread attention by the concerned governments and insurers. This paper systematically reviewed the patient access schemes in UK from several aspects, including the origin of the program, classification, application processes and the implementation effects as well. The results of the research indicated that China has basically met the conditions for implementation of the risk-sharing agreements. In order to gradually promote the risk-sharing agreements implementation, this paper suggests that China should clarify the main root of risk-sharing agreements implementation, establish risk-sharing agreements standardization process and strengthen the application of health technology assessment in health resources allocation to improve the Chinese medicines bargaining system more scientifically and efficiently.
Risk-sharing agreements; Patient access schemes; Health technology assessment; Price negotiation
江蘇省普通高校研究生科研創(chuàng)新計(jì)劃資助項(xiàng)目(SJZZ15_0081)作者簡(jiǎn)介:常峰,男(1972年—),副教授,主要研究方向?yàn)樗幤穬r(jià)格、醫(yī)療保障和醫(yī)藥流通規(guī)制。E-mail:cpucf@163.com
崔鵬磊。E-mail:cuipenglei1991@163.com
R197
A
10.3969/j.issn.1674-2982.2016.07.010
2016-01-19
2016-04-05

