鎘對體外培養小鼠皮膚細胞存活的影響
王 晶, 商 旋, 張曉敬, 常世民,2, 馬 爽
(1.廊坊師范學院生命科學學院,河北 廊坊 065000;2.河北省高校食藥用菌應用技術研發中心,河北 廊坊 065000;3.廊坊市食用菌技術重點實驗室,河北 廊坊 065000)
鎘對體外培養小鼠皮膚細胞存活的影響
王 晶1,2,3, 商 旋1, 張曉敬1, 常世民1,2, 馬 爽1
(1.廊坊師范學院生命科學學院,河北 廊坊 065000;2.河北省高校食藥用菌應用技術研發中心,河北 廊坊 065000;3.廊坊市食用菌技術重點實驗室,河北 廊坊 065000)
研究不同濃度的氯化鎘對體外培養的小鼠皮膚細胞存活影響。采用組織塊法啟動小鼠皮膚細胞的原代培養,胰酶消化法傳代培養,利用光鏡觀察、MTT細胞毒性分析、熒光染色和DNA瓊脂糖凝膠電泳等方法研究鎘對小鼠皮膚細胞的毒性作用。結果顯示,在37 ℃,含20 %胎牛血清的DMEM/F12培養條件下,小鼠皮膚組織原代啟動第2天即有細胞遷出,為成纖維樣細胞形態,生長分裂旺盛,第6天即可長成匯合的細胞單層,并能穩定連續傳代。20~160 μmol/L氯化鎘可顯著降低體外培養的小鼠皮膚細胞的存活率,具有濃度和時間的依賴性。處理24和48 h對肝細胞的半致死率濃度分別為39.81和22.39 μmol/L。CdCl2處理導致皮膚細胞染色質的凝縮和片段化,誘導細胞凋亡。
鎘;皮膚細胞;細胞培養;細胞凋亡
鎘是環境中常見的金屬污染物,存在于大氣、飲水、食品中。近年來,這種污染物頻頻出現在各種報紙及文獻資料中,如,湖南和廣州的大米鎘超標事件[1~2]、資生堂化妝品的鎘超標事件[3]等。鎘中毒可導致神經系統[4]、泌尿系統[5]、呼吸系統[6]和生殖系統[7]功能障礙。而目前國內對鎘的細胞毒性研究主要集中于神經細胞[4]、肝細胞[8]、腎細胞[5]和肺細胞[9]等方向,尚未見有鎘對皮膚細胞的毒性作用及相關機制的研究報道。本實驗以體外培養的小鼠胚胎皮膚細胞為實驗對象,研究鎘對皮膚細胞的存活及凋亡的影響,從而推測含鎘的皮膚接觸性物品對皮膚細胞的影響作用。
1 材料與方法
1.1 材料與設備
材料與試劑。BALB/C小鼠6~8周齡,體重18~22 g,購自中國醫學科學院實驗動物研究所;胎牛血清(FBS) 和氯化鎘,上海生物工程有限公司;DMEM/F12培養基 美國Gibco公司;胰蛋白酶和四甲基偶氮唑藍(MTT),美國Amresco公司;細胞凋亡-DNA Ladder抽提試劑盒和Hoechst 33342染色液,上海碧云天生物技術有限公司;實驗中所用其他試劑均為分析純。
儀器與設備。ZHJH-C超凈工作臺,上海智城分析儀器制造有限公司;BX50系統顯微鏡和CKX41SF倒置顯微鏡(配有CCD成像系統),日本Olympus公司;MCO-20AIC二氧化碳培養箱和MLS-3750高壓蒸汽滅菌鍋,日本SONYA公司;MJ-160B型恒溫水浴鍋,上海躍進醫療器械廠;iMark酶標儀酶標儀,美國Bio-Rad公司;Milli-Q超純水機,美國Millipore公司。VCX130超聲波細胞破碎儀,美國Sonics公司;細胞培養瓶、細胞培養板,美國Corning公司。
培養基。小鼠皮膚細胞培養液DMEM/F12 (g/L): 15.6 g、NaHCO31.2、青霉素0.06(100 U/mL)、鏈霉素0.1(100 U/mL),pH 7.2。
1.2 方法
1.2.1 小鼠皮膚細胞體外培養的原代啟動和傳代培養 雌鼠受孕。將處于發情期的雌鼠和雄鼠同籠,檢栓后,記為0 d。
組織塊法啟動原代培養。取懷孕15 d的雌鼠,頸部脫臼處死,75 %乙醇浸泡處理2次,超凈工作臺中無菌取出子宮,取出胚胎,磷酸緩沖溶液(PBS)漂洗3次,DMEM/F12完全培養液(5 % FBS)漂洗1次,取胚胎背部皮膚,剪成1 mm3大小的組織碎塊,離心,棄上清,沉淀用DMEM/F12完全培養液(5 % FBS)懸浮后均勻接種于25 cm2培養瓶底部,翻轉倒置,37 ℃培養箱中培養6 h后,補加DMEM/F12完全培養液(20 % FBS)至5 mL/瓶,置37 ℃、5 %CO2培養箱中啟動原代培養。
胰蛋白酶消化法進行分離培養(傳代)。小鼠皮膚細胞匯合率達80 %~90 %后,吸棄舊培養液,PBS漂洗,2.5 g/L胰蛋白酶溶液消化處理1~2 min,吹下貼壁細胞,用含20 % FBS 的DMEM/F12完全培養液重懸并接種至2個細胞培養瓶中,置5 % CO2、37 ℃培養箱中靜置培養。
1.2.2 小鼠皮膚細胞的生長曲線制作 按上述傳代方法制備細胞懸液,臺盼藍染色,統計活細胞數量,含15 % FBS的DMEM/F12完全培養液調整細胞密度為1×105個/L,均勻接種至24孔細胞培養板中,每孔1 mL,37 ℃,5 % CO2培養箱中靜置培養。每12 h取3個孔的細胞分別進行細胞計數,取平均值。以時間為橫坐標、細胞平均密度為縱坐標繪制出生長曲線。
1.2.3 細胞接種和氯化鎘處理 取10代前的對數生長期的小鼠皮膚細胞,胰蛋白酶消化,臺盼藍染色,統計活細胞數量,DMEM/F12完全培養液(20 % FBS)調整細胞密度為5×104個/mL,接種至96孔細胞培養板中,每孔180 μl,37 ℃,5 % CO2培養箱中靜置培養24 h后,添加終濃度分別為0、5、10、20、40、80和160 μmoL/mL的氯化鎘(CdCl2),37 ℃,5 % CO2培養箱中繼續培養。
1.2.4 MTT法測定細胞存活率 不同濃度CdCl2處理24和48 h 后,添加5 mg/mL MTT溶液,每孔20 μl,37 ℃,5 % CO2培養箱中培養4 h 后,棄上層液體,PBS漂洗2次,添加DMSO,每孔150 μl,低速震蕩15 min,酶標儀測定490 nm光吸收值A490,每個濃度設10個重復,按照公式“抑制率=(1-實驗組平均OD 值/對照組平均OD 值)×100 %”計算CdCl2對細胞的抑制率, 用Logit 法計算半致死濃度(IC50)。
1.2.5 Hoechst 33342染色 制備細胞懸液并接種至潔凈且無菌的蓋玻片上,每個蓋玻片上的細胞數為1000~2000個,37 ℃、5 %CO2培養箱中培養24 h后,添加不同濃度CdCl2處理一定時間后,吸棄舊培養液,PBS漂洗3次,4 %多聚甲醛固定15 min,PBS漂洗3次,滴加Hoechst33342染液,避光染色25~30 min,PBS漂洗3次,將蓋玻片置于干凈載玻片上,熒光顯微鏡觀察,拍照。
1.2.6 DNA瓊脂糖凝膠電泳 按上述傳代方法接種細胞,添加終濃度為40 μmol/L的CdCl2,相同培養條件培養一定時間后,細胞刮刀收集細胞,離心,去上層液體,200 μl PBS重懸細胞后,加入4 μl RNaseA,混勻,室溫放置3~5 min,添加20 μl蛋白酶K,混勻,70 ℃孵育10 min后,添加200 μl樣品裂解液B,混勻后加入到DNA純化柱內,≥6000 g離心1 min,倒棄廢液收集管內液體。加入500 μl洗滌液I,≥6000 g離心1 min,倒棄廢液收集管內液體。加入600 μl洗滌液II,≥18 000 r/min離心1 min,倒棄廢液收集管內液體,再≥18 000 r/min離心1 min,以去除殘留的乙醇。將DNA純化柱置于1.5 mL離心管中,加入50~100 μl洗脫液。室溫放置3 min。≥12 000 r/m離心1 min后得純化的總DNA。取總DNA進行1 %瓊脂糖凝膠電泳,上樣量為5~10 μl,50 v電泳4~6 h(電泳緩沖溶液1×TAE),EB染色,凝膠成像系統觀察、拍照。
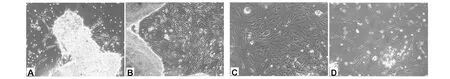
A.原代培養啟動第2天; B.原代培養啟動第3天; C.原代培養細胞長成單層; D.第1代細胞A. 2 days after primary culture ; B. 3 days after primary culture; C. Primary cultured murine skin cells monolayer; D. Murine skin cells at passage 1圖1 原代培養和傳代培養的小鼠皮膚細胞(200×)Fig.1 Primary cultured and subcultured murine skin cells
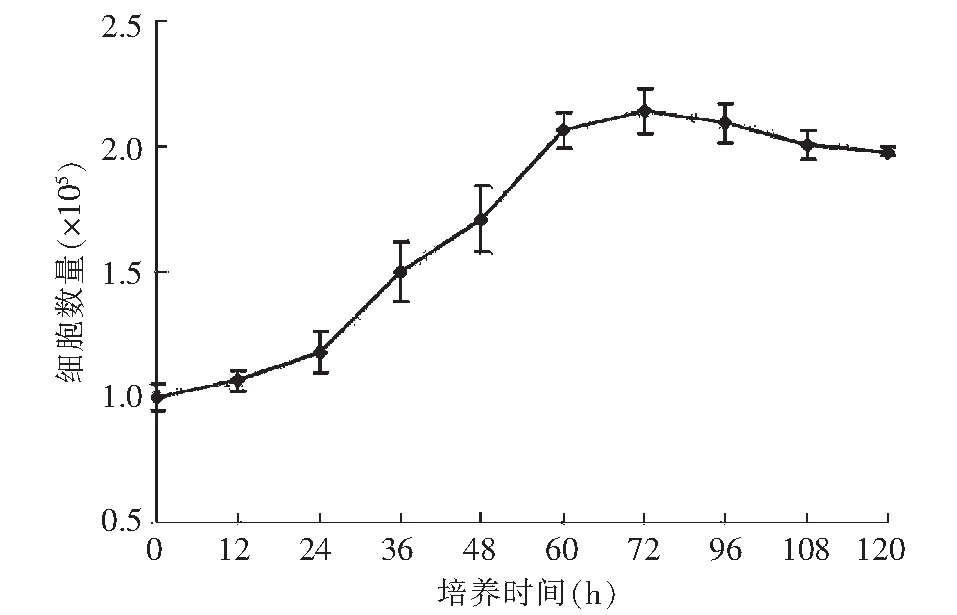
圖2 第8天小鼠皮膚細胞生長曲線Fig.2 The growth curve of murine skin cells at the eighth days
1.2.7 數據處理 實驗結果用平均數±標準差表示,軟件SPSS 20.0分析處理數據,方差分析采用單因素ANOVA,P<0.05,表示差異顯著,P<0.01,表示差異極顯著。
2 結果與分析
2.1 小鼠皮膚細胞的原代培養與傳代培養
小鼠皮膚細胞原代啟動后第2天,組織塊邊緣開始有細胞遷出,遷出細胞多數呈成纖維細胞樣形態(圖2A),細胞生長分裂旺盛。隨著培養時間的延長,細胞在組織塊周圍形成較大生長暈(圖1B)。說明原代培養條件適合皮膚細胞的遷出和增殖。
原代培養啟動第6天,皮膚細胞即可相互匯合成單層(圖1C)。胰蛋白酶消化法傳代后,細胞仍為成纖維細胞樣形態,細胞透光性較好,細胞增殖速度較快,第5~7天可再次長滿單層,說明胰酶消化法比較適宜于體外培養的小鼠皮膚細胞。
2.2 小鼠皮膚細胞生長曲線
每12 h收集培養板中的小鼠皮膚成細胞,臺盼藍染色后血細胞計數板統計活細胞數量,以時間為橫坐標,細胞濃度為縱坐標,繪制細胞生長曲線(圖2),從圖2可以看出,小鼠皮膚細胞在接種后0~24 h處于遲緩期,36~60 h處于對數期,而到達60~72 h后處于平臺期,72 h后處于衰退期,因此收集培養36~60 h的細胞進行再接種和CdCl2處理實驗。
2.3 鎘對小鼠皮膚細胞形態的影響
不同濃度CdCl2處理小鼠皮膚細胞24 h后,與對照組(圖3A)相比,5~20 μmol/L CdCl2處理組細胞的形態與貼壁能力沒有太大的變化(圖3B~D),40 μmol/L CdCl2處理組細胞皺縮變圓或者脫離細胞培養瓶底部(圖3E);80~160 μmol/L CdCl2處理組細胞絕大部分已變圓脫落(圖3F和G)。

A~G:氯化鎘添加濃度分別為0、5、10、20、40、80、160 μmol/L A-G: Treated group by CdCl2: 0,5,10,20,40,80,160 μmol/L 圖3 不同濃度氯化鎘處理24 h的小鼠皮膚細胞(200×)Fig.3 Murine skin cells treated with CdCl2 for 24 hours

A~G: 氯化鎘添加濃度分別為0、5、10、20、40、80、160 μmol/LA-G: Treated group by CdCl2: 0,5,10,20,40,80,160 μmol/L 圖4 不同濃度氯化鎘處理48 h的小鼠皮膚細胞(200×) Fig.4 Murine skin cells treated with CdCl2 for 48 hours
不同濃度CdCl2處理小鼠皮膚細胞48 h后,與空白對照組(圖4A)相比,5~10 μmol/L CdCl2處理組少量細胞皺縮變圓(圖4B和C);20~160 μmol/L CdCl2處理均可不同程度引起小鼠皮膚細胞變圓脫落,隨著添加濃度的增加,變圓脫落的細胞數量逐漸增加(圖4D~G)。
2.4 鎘對小鼠皮膚細胞存活的影響
MTT實驗結果顯示,與空白對照組相比,20~160 μmol/L的CdCl2處理皮膚細胞24和48 h均可顯著的降低小鼠肝細胞的存活率(P<0.05),且隨著添加濃度的增加,細胞存活率逐漸降低(圖5)。經寇氏法計算得,CdCl2處理24和48 h對肝細胞的半致死率濃度分別為39.81和22.39 μmol/L。
細胞凋亡起始以后,細胞會經歷一系列的形態學變化,如細胞核染色質凝縮等[10]。Hoechst33342是一種可以穿透細胞膜的常用于細胞凋亡檢測的熒光染料,進入細胞核后與雙鏈DNA結合,在紫外光激發下,Hoechst-DNA發出藍色熒光(圖6A),凋亡細胞因染色質凝縮,會呈現致密濃染(圖6B)。

圖5 MTT法檢測細胞存活率Fig.5 Murine skin cells’ viability determined by MTT assay
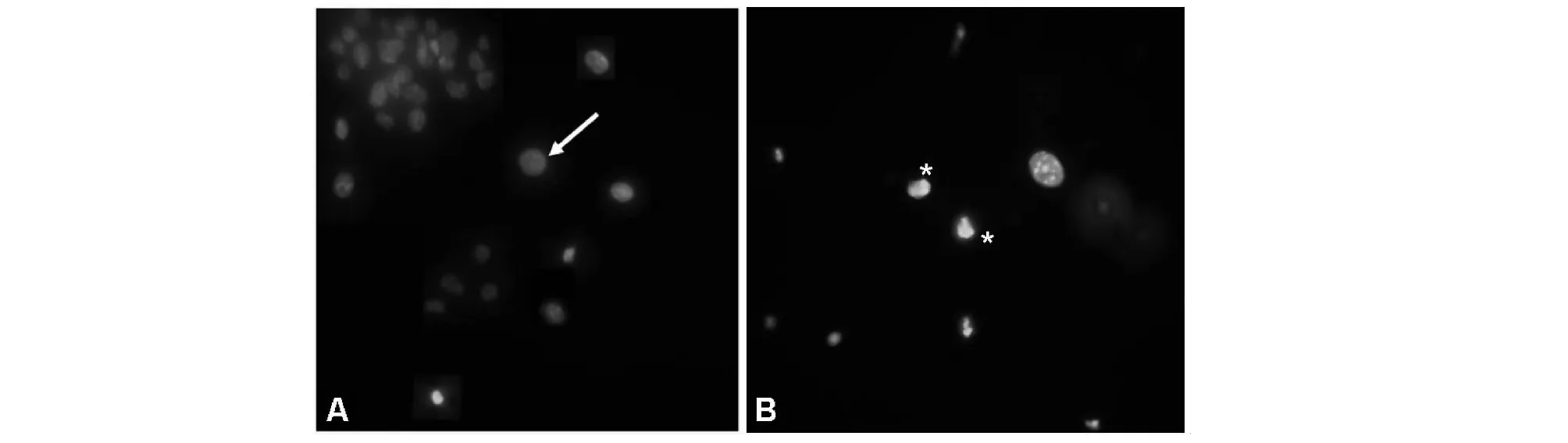
A.對照組; B.40μmol/L的CdCl2處理48h, A.control; B.treated group by 40μmol/L CdCl2 for 48h,“↙”示正常細胞核;“*”示致密濃染的凋亡細胞細胞核;‘↙’ control;‘ *’ apoptotic cell nucleus 圖6 Hoechst33342染色后小鼠皮膚細胞細胞核(400×)Fig.6 Murine skin cells’ nucleus stained by Hoechst33342
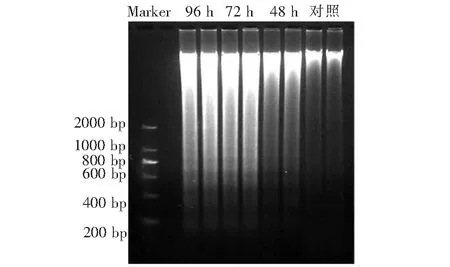
圖7 DNA 瓊脂糖電泳Fig.7 DNA agarose gel electrophoresis
細胞凋亡晚期,內源性核酸酶被激活,基因組DNA鏈在核小體之間被切割,形成180~200個堿基或其整數倍的DNA片段,將這些DNA片段抽提出來進行電泳,可得到DNA梯狀條帶(DNA ladder)[10]。瓊脂糖凝膠電泳結果顯示,與陰性對照相比,CdCl2處理小鼠皮膚細胞48 h后,基因組DNA出現梯狀條帶;處理72和96 h后,小鼠皮膚細胞基因組DNA出現明顯的梯狀條帶,且200、400、600、800 bp的DNA條帶清晰可見(圖7),說明CdCl2處理導致小鼠皮膚細胞的凋亡。
3 討論與結論
鎘(Cd)是一種生物體非必須的元素,具有潛在毒性,因其在工業上應用廣泛,已逐漸成為環境中主要的污染物之一[11]。鎘在土壤和植物中有蓄積作用,并不可逆的通過胃腸,肺和皮膚吸收后積累于人體組織和器官中(特別是腎臟[5]和肝臟[12]),其在人體中的半衰期長達15 至20年,并可持續產生毒性作用[13]。
本文利用組織塊法啟動了皮膚細胞的體外培養,并利用傳代次數少于10次的皮膚細胞培養體系,研究一定量的CdCl2對其存活的影響作用。結果表明,一定濃度(20~160 μmoL/mL)CdCl2處理皮膚細胞一定時間均可引起細胞染色質凝縮和DNA的損傷進而誘導皮膚細胞的凋亡。CdCl2處理24和48 h對肝細胞的半致死率濃度分別為39.81和22.39 μmol/L。相關認為,鎘誘導的細胞凋亡信號通路主要為3 條:①內質網應激(ER stress)介導的,通過未折疊蛋白應激反應(UPR)途徑[14-15]和calpain-caspase途徑[16-17];②線粒體介導的,caspase 依賴性[18]和非caspase依賴性途徑[19];③P53 依賴性途徑。而CdCl2通過上面哪種或者哪幾種信號轉導通路誘導皮膚細胞的凋亡有待進一步研究。
[1]高 志, 崔海濤, 張高科, 等. 什么污染了我們的大米?——關于湖南攸縣 “鎘大米” 的調查[J].中國農資, 2013 (22): 5-7.
[2]周少君, 鄧小玲, 梁 輝, 等. 2012 年廣東省市售大米鎘含量調查及初步膳食暴露評估[J]. 華南預防醫學, 2013, 39(6): 4-9.
[3]趙 雪.資生堂被查出鎘超標[N].中國企業報,2013-03-12(017).
[4]朱俊德, 余資江, 戈 果, 等. 慢性鎘中毒對小鼠學習記憶及海馬 CA3 區的影響[J]. 環境與健康雜志, 2009 (7): 576-579.
[5]李穎超, 武 昕, 嚴家榮, 等. 亞慢性鎘中毒腎功能性損傷小鼠模型的研究[J]. 山西醫科大學學報, 2013, 44(4): 267-270.
[6]張巧耘, 鄒 芳. 急性鎘中毒并發中毒性肺水腫的臨床護理[J]. 上海護理, 2011, 11(5): 46-47.
[7]周 雍, 鄭 尊. 急性鎘中毒大鼠睪丸氧化損傷機制的研究[J]. 第二軍醫大學學報, 2002, 23(1): 64-66.
[8]陳 強, 肖銀霞, 王立成, 等. 鎘對雞肝臟抗氧化系統功能以及中藥四君子湯拮抗效應的影響研究[J]. 中國農學通報, 2012, 28(23): 66-68.
[9]常云峰. 鎘致肺纖維化作用機制的初步研究[D]. 長沙: 中南大學, 2013.
[10]翟中和,王喜忠,丁明孝. 細胞生物學[M]. 第四版. 北京:高等教育出版社, 342-343.
[11] 陳桂芬,雷 靜,黃雁飛,等.廣西稻田鎘污染狀況及硅對稻米鎘的消減作用[J].南方農業學報,2015,46(5):772- 776.
[12]Eum K D, Lee M S, Paek D.Cadmium in blood and hypertension[J]. Sci Total Environ, 2008, 407(1): 147-253.
[13]蔣廷亞, 周 陽, 林 毅, 等. 鎘代謝分子機制研究進展[J]. 安徽農業大學學報, 2013, 40(4): 678-684.
[14]Yokouchi M, Hiramatsu N, Hayakawa K, et al. Atypical, bidirectional regulation of cadmium-induced apoptosis via distinct signaling of unfolded protein response[J]. Cell Death & Differentiation, 2007, 14(8): 1467-1474.
[15]Yokouchi M, Hiramatsu N, Hayakawa K, et al. Involvement of selective reactive oxygen species upstream of proapoptotic branches of unfolded protein response[J]. Journal of Biological Chemistry, 2008, 283(7): 4252-4260.
[16]Thévenod F. Cadmium and cellular signaling cascades: to be or not to be [J]. Toxicology and Applied Pharmacology, 2009, 238(3): 221-239.
[17]Yeh J H, Huang C C, Yeh M Y, et al. Cadmium-induced Cytosolic Ca2+Elevation and Subsequent Apoptosis in Renal Tubular Cells[J]. Basic & Clinical Pharmacology & Toxicology, 2009, 104(5): 345-351.
[18]Liu Y, Templeton D M. Initiation of caspase-independent death in mouse mesangial cells by Cd2+: Involvement of p38 kinase and CaMK-II [J]. Journal of Cellular Physiology, 2008, 217(2): 307-318.
[19]Lee W K, Abouhamed M,and Thevenod F. Caspase-dependent and-independent pathways for cadmium-induced apoptosis in cultured kidney proximal tubule cells[J]. Am J Physiol Renal Physiol, 2006, 291(4):F823-832.
(責任編輯 李 潔)
Effect of Cadmium on Survival of Cultured Murine Skin Cellsinvitro
WANG Jing1,2,3, SHANG Xuan1, ZHANG Xiao-jing1, CHANG Shi-min1,2, MA Shuang1
(1.College of Life Sciences, Langfang Teachers University, Hebei Langfang 065000, China;2.Edible and Medicinal Fungi Research and Development Center of Hebei Universities, Hebei Langfang 065000, China;3.Edible Fungi Key Laboratory of Langfang City, Hebei Langfang 065000, China)
To investigate the effect of cadmium on survival of cultured murine skin cellsinvitro, primary murine skin cells were cultured with tissue block method and subcultured by trypsin digestion. Toxic effect of cadmium on cultured murine skin cells were examined with microscope, MTT assay, fluorescent staining and DNA agarose gel electrophoresis. The results showed that cells migrated from skin tissue 2 days after the primary culture initiated in Dulbecco’s Modified Eagle Medium: Ham’s Nutrient F-12(1∶l)(DMEM/F12)medium supplemented with 20 % fetal bovine serum (FBS) DMEM/F12(contained) at 37 ℃. The skin cells in primary culture and subculture were in fibroblast morphology, proliferated to continuous monolayer within 8 days and propagated stably. Cadmium chloride (CdC12) at the concentration of 20~160 μmol/L had obvious inhibitory effects on skin cells survival in dose-and time-dependent manner. The half lethal concentration (IC50) at 24 and 48 h was 39.81 and 22.39 μmol/L, respectively. Treatment of CdC12caused chromatin condensation and fragmentation (DNA ladder). Meanwhile, skin cells initiated apoptosis process.
Cadmium; Skin cell; Cell culture; Cell apoptosis
1001-4829(2016)09-2244-05
10.16213/j.cnki.scjas.2016.09.041
2015-10-12
河北省生物學實驗教學示范中心(031040302);河北省生物科學專業綜合改革試點(031040503);河北省高等學校科學技術研究青年基金項目(QN2016019);廊坊師范學院微生物學重點學科項目(201501);廊坊師范學院教育教學改革項目(2013022);廊坊師范學院大學生創新創業訓練計劃(201310100022);廊坊師范學院生命科學學院本科生參與研究項目(SKCYZ201303)
王 晶(1983-),女,山東東平,博士,講師,研究方向為細胞毒理學和細胞免疫學,E-mail: oucflora@163.com。
R114
A

