鹵化氫的酸性及其度量方法
孫逸明+占小紅
摘要:鹵化氫的酸性是高中化學的重要內容。由于知識水平的限制,學生只能定性地認識到在水中完全電離的HCl、HBr、HI是強酸,不完全電離的HF是弱酸,而對其酸性強弱的原因及度量方法認識不足,甚至有些教師也可能存在認知上的錯誤。實際上,鹵化氫在氣態、純液態、濃稀水溶液等不同環境中呈現酸性的具體形式不同,需要用質子親和能、酸度函數、電離常數、表觀電離度等不同物理量來度量。拉平效應使得HCl、HBr、HI在稀水溶液中的酸性差別很小,表現為“完全電離”;在甲醇等部分非水溶劑中,區分效應使得三者酸性差別很大。
關鍵詞:鹵化氫;酸性;度量方法;拉平效應;區分效應
文章編號:1005–6629(2016)11–0093–04 中圖分類號:G633.8 文獻標識碼:B
鹵化氫(HX,X=F,Cl,Br,I)是高中化學中常見的酸。教科書常以它們為例說明元素性質的規律和有關化學概念、原理。例如,蘇教版必修《化學1》指出HCl在水中完全電離,從物質分類的角度來說屬于強電解質;選修《化學反應原理》給出HF在水溶液中的電離常數,大約在10-4的數量級,屬于弱酸。
化學高考題對鹵化氫也頗為青睞,常考查與其相關的離子方程式的書寫,例如,2012年新課標理科綜合試題化學部分第26題要求學生寫出FeCl3溶液和HI溶液反應的離子方程式;也有考查學生對強弱電解質電離的理解,例如,2010年浙江省理科綜合試題化學部分第26題給出了T=25℃時2.0×10-3 mol·L-1 HF水溶液中H+和F-的濃度隨pH變化的曲線圖,要求學生計算該溫度下HF的電離平衡常數。
如此看來,鹵化氫的酸性是學生需要掌握的重要化學性質。通過高中化學的學習,學生認識到HCl、HBr、HI在水中完全電離,都是強酸;HF在水中不完全電離,是弱酸。由于高中階段學生的知識有限,教科書對鹵化氫酸性的介紹僅限于稀水溶液的定性比較,不涉及鹵化氫呈現酸性的機制以及稀水溶液以外狀態下的酸性比較。在實際的教學過程中,教師通常會采取模糊處理的方法避開學生難以理解之處,因此學生可能會因對相關知識的認識不足而產生科學性錯誤。那么,HCl、HBr、HI三者的酸性是否完全等同呢?四種鹵化氫的酸性強弱如何排序呢?針對這些疑問,本文就不同狀態下鹵化氫的酸性及其度量方法進行梳理、討論,為中學教師提供參考,在教學過程中盡可能避免錯誤的解釋。
1 鹵化氫呈現酸性的機制
根據酸堿質子理論,鹵化氫是典型的質子酸。其表現酸性的過程就是將質子轉移給其他物質的過程,酸性的強弱即為轉移質子能力的大小。在這個過程中,鹵化氫是質子給予體(酸),其他物質是質子接受體(堿)。給予質子的鹵化氫種類不同、接受質子的物質種類不同,都會導致鹵化氫表現出來的酸性不同。
2 不同條件下鹵化氫的酸性及其度量方法
在高中階段,由于所學知識有限,學生只能根據鹵化氫在水中是否完全電離來定性地判斷其酸性強弱。而實際上,鹵化氫處于氣態、純液態及濃或稀水溶液中時,由于所處的環境不同,導致其呈現酸性的具體方式不同,度量方法也不同,不能簡單地一概而論。
2.1 氣態
當鹵化氫處于氣態時,不存在水溶液中的溶劑化作用,而且鹵化氫之間相互的質子轉移反應發生的程度極小[2HX(g)→H2X+(g)+X-(g)],幾乎不存在[1],因此產生質子的機制可以視為HX(g)解離成簡單的H+(g)和X-(g):
HX(g)→H+(g)+X-(g)
此時可以用鹵離子的質子親和能A來度量其酸性[2]。質子親和能A即1mol X-(g)結合1mol H+(g)生成1mol HX(g) [H+(g)+X-(g)→HX(g)]時的能量變化。
也即焓變ΔH,正值代表吸收能量,負值代表放出能量。該反應的ΔH常有上百、上千kJ·mol-1,遠大于TΔS項,故ΔG≈ΔH,用質子親和能作為反應趨勢大小的判據沒有問題[3]。四種鹵離子的質子親和能如表1所示。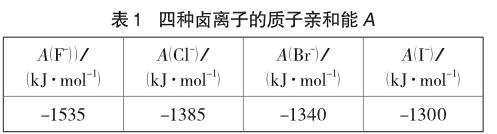
由表1數據可知,從左至右鹵離子與質子結合時放出的能量越來越少,反應趨勢減小,鹵離子結合質子的能力減弱、堿性減弱,對應的共軛酸——鹵化氫的酸性增強。因此,在氣態時,鹵化氫的酸性由強到弱的順序依次為HI、HBr、HCl、HF。
2.2 純液態及濃水溶液
由于缺少反映HCl、HBr、HI在純液態及濃水溶液時行為的數據,故此處只討論HF的性質。
在純液態和濃水溶液中,常用Hammett酸度函數[4]來度量物質的酸性。Hammett酸度函數的表達式為: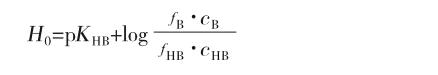
其中KHB是共軛酸HB的解離常數,f是活度系數,c為濃度,f與c的乘積即活度a,H0越小HB的酸性越強。
在純液態時,整個體系為非水體系,HF既是質子給予體,也是質子接受體,發生自偶電離,產生溶劑化質子和二氟氫根離子: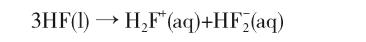
其酸性需用H0度量。已知無水H2SO4的H0=-11.93,通常將H0與無水H2SO4相當或比其更小的酸稱為超強酸。液態HF的H0≈-11,因此它是一種超強酸,具有極強的轉移質子的能力,例如,常見的強酸HNO3能夠被液態HF質子化而顯堿性:

2.3 稀水溶液
2.3.1 利用Ka或pKa度量
在稀的水溶液中,鹵化氫將質子轉移給水分子形成水合質子與鹵離子:
HX(aq)+H2O(l)→H3O+(aq)+X-(aq)
高中階段通常將反應中的水省略不寫,故該過程又被稱為鹵化氫的電離。該過程是一個化學平衡,可以用電離常數Ka或其負對數pKa來度量其進行程度的大小。Ka越大,或pKa越小,該反應進行的程度就越大,對應的鹵化氫的酸性就越強。四種鹵化氫在水中的電離常數Ka及其負對數pKa如表2[8]所示。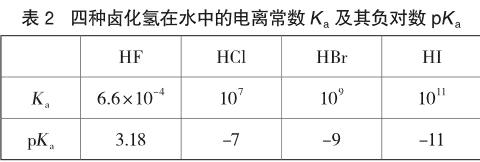
由表2數據可知,電離常數Ka由大到小的順序依次為HI、HBr、HCl、HF,pKa由大到小順序依次為HF、HCl、HBr、HI,故四種鹵化氫的酸性由強到弱的順序依次為HI、HBr、HCl、HF。通常認為,平衡常數大于105或106的反應幾乎能進行到底,故而盡管HCl、HBr、HI三者的電離常數存在數量級的差異,但反應都進行得較為完全,表觀上差異很小、難以區分。事實上,也較少用在水中的電離常數Ka來度量三者的酸性大小,因為水是一種接受質子能力較強的溶劑,幾乎能夠接受HCl、HBr、HI給出的所有質子,使三者表現出的酸性幾乎相同、難以分別,這便是分析化學中的“拉平效應”,水是HCl、HBr、HI酸性的“拉平溶劑”。若使用接受質子能力弱于水的甲醇、乙酸等作為溶劑,則能使三者表現出不同的酸性,這便是“區分效應”,甲醇、乙酸等溶劑是HCl、HBr、HI酸性的“區分溶劑”。
若沒有直接的Ka或pKa數據,也可以將鹵化氫與水分子間的質子傳遞過程設計為如下BornHaber循環[9],總共6個步驟: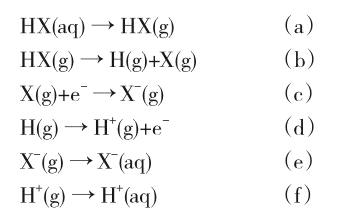
a~f步驟各自的能量變化為:HX(aq)的脫水能、HX(g)的鍵能、X(g)的電子親和能、H(g)的電離能、X-(g)的水合能、H+(g)的水合能。在T=298K時,查表可知各步的ΔH,運用Hess定律,將上述各步疊加即可得到總反應——HX(aq)電離成H+(aq)與X-(aq)的ΔH;再查得總反應的ΔS,根據Gibbs-Helmholtz公式即可算出總反應的ΔG=ΔH-TΔS;最后利用下列公式求出反應平衡常數Ka,再求得pKa。
ΔG=-RTlnKa
例如,對于HI而言,a~f各步的ΔH數據(單位:kJ·mol-1)依次為23、298、-302、1318、-308、-1091,加和可得總反應的ΔH=-62 kJ·mol-1;查得總反應的ΔS=11 J·mol-1·K-1,根據上述公式求得,在T=298K時,反應的ΔG=-65.3 kJ·mol-1,Ka=2.77×1011,pKa=-11.4。
2.3.2 利用表觀電離度度量
除了Ka和pKa,也可以用表觀電離度來度量電離過程的進程度。在已知鹵化氫初始濃度的條件下,測量H3O+的濃度,即可得到鹵化氫在水溶液中的表觀電離度。在T=291K時,0.1 mol·L-1的水溶液中鹵化氫的表觀電離度如表3[10]所示。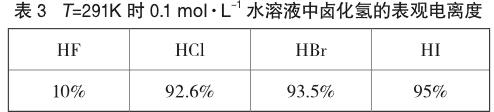
由表3數據可知,所謂“完全電離”的HCl、HBr、HI,其表觀電離度也沒有達到100%。這主要是因為,溶液中的陰、陽離子并非完全獨立自由地運動,它們會吸引異號離子在自身周圍對稱分布形成“離子氛”,離子氛的束縛使它們不能完全發揮離子應有的功能,“外觀上”表現出的濃度小于理論濃度。通常用a表示活度(即有效濃度)、c表示理論濃度、f表示活度系數(f<1),三者之間的關系是a=fc,故活度小于理論濃度。當初始濃度均為0.1 mol·L-1時,從左至右表觀電離度依次上升,說明H3O+的濃度依次上升,即越來越多的鹵化氫將質子轉移給水分子,轉移質子的程度、能力增強,因此該條件下鹵化氫的酸性由強到弱的順序依次為HI、HBr、HCl、HF。
上述四者中,HF的表觀電離度特別小。然而普遍的觀點[11]認為,HF在稀溶液中的電離是相當完全的,即絕大多數HF將質子轉移給水分子形成H3O+。但是,H3O+和F-能夠通過氫鍵形成結合強度很大的離子對[H3O+…F-],該離子對很難解離,導致絕大多數H3O+受到束縛無法自由移動,因此HF表現出的酸性很弱。而其他鹵化氫較少形成這種離子對,表現出的酸性遠強于HF。
需要指出的是,有些教師認為,可以將鍵能作為稀水溶液中鹵化氫酸性強弱的判據[12]。即氫鹵鍵的鍵能越大,鹵化氫越難解離,酸性越弱,并以四種鹵化氫的鍵能數據為依據,如表4所示。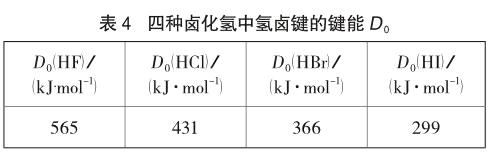
但是,這個方法是錯誤的。因為鍵能表示的是氣態鹵化氫解離成氣態氫原子和氣態鹵原子所需的能量:
HX(g)→H(g)+X(g)
該過程與鹵化氫在水中的質子轉移并不相同,不可直接套用。
3 小結
鹵化氫的酸性是高中化學的重要內容。由于高中階段知識水平的限制,學生只能定性地比較鹵化氫在稀水溶液中的酸性強弱,對其酸性強弱及其原因的認識存在明顯不足。
實際上,在不同環境中,鹵化氫酸性呈現的具體形式及度量方法不同。
在氣態時,鹵化氫發生自偶電離的程度極小,可以認為其小部分單純地解離為簡單的氣態質子和鹵離子,可用鹵離子的質子親和能度量其酸性,酸性按照HF、HCl、HBr、HI的順序依次增強。
在純液態時,HF可發生自偶電離,質子在HF分子之間轉移,其Hammett酸度函數的值約為-11,是一種超強酸,具有極強的轉移質子的能力。
在濃水溶液中,HF與F-通過很強的氫鍵締合形成穩定且堿性很弱的締合離子,釋放大量的水合質子,酸性很強。
在稀水溶液中,鹵化氫將提供質子給水分子,酸性按照HF、HCl、HBr、HI的順序依次增強。其中HF之所以酸性特別弱,并非其提供質子的能力弱,而是由于形成了難解離的離子對[H3O+…F-],絕大多數H3O+受到束縛無法自由移動。而HCl、HBr、HI三者盡管電離常數Ka、表觀電離度確實存在大小差異,但“外觀上”難以區分,它們的酸性需要借助接受質子能力弱于水的溶劑才能較好地分別。
上述內容并非高中學生需要掌握的知識,但教師若要向學生解釋它們酸性的強弱,要注意區分不同環境下的鹵化氫酸性的特殊性和度量方法,尤其需要關注常見的情況——稀水溶液狀態下鹵化氫的酸性定量衡量問題,盡量避免出現張冠李戴的不科學解釋。
參考文獻:
[1][3]鐵麗云,王成剛.用氣態質子親和能表示物質的固有酸堿性[J].高等函授學報,1997,(4):47~51.
[2]周毅.氫鹵酸的強度規律及其理論解釋[J].陰山學刊,1995,12(3):97~101.
[4]胡縉昌.談Hammett酸度函數[J].建材高教理論與實踐,1996,(3):50~51.
[5][7]黃元喬.幾種狀態下HF的酸性強度性質及結構特性[J].湖北教育學院學報,2002,19(5):10~11.
[6]夏懋,林德昌. F-H…F是最強的氫鍵嗎[J].科教文匯,2010,(8):73~74.
[8]林紫榮,劉榕芳,劉德發,范興.計算氫鹵酸強度的三個經驗公式[J].揚州師院學報,1995,15(1):42~45.
[9]余文.氫鹵酸強度與鹵素離子的大小[J].玉林師專學報,1994,15(3):79~81.
[10]汪戰彪.淺談氫鹵酸酸性遞變規律[J].重慶工業高等專科學校學報,2003,18(2):24~25,29.
[11][12]姜斌,傅春華,劉俊寧.氫鹵酸酸性遞變規律探究[J].教育教學論壇,2011,(34):172~174.

