金針菇工廠化栽培過程中游離氨基酸變化情況的初步研究
王紅梅,程向陽,張光忠,余養朝,王瑞娟,鮑大鵬,茅文俊*
(1上海市農業科學院農產品質量標準與檢測技術研究所,上海 201403;2上海市農業科學院食用菌研究所,農業部南方食用菌資源利用重點實驗室,國家食用菌工程技術研究中心,國家食用菌加工技術研發分中心,上海市農業遺傳育種重點開放實驗室,上海 201403;3江蘇華綠生物科技股份有限公司,江蘇 223700)
金針菇工廠化栽培過程中游離氨基酸變化情況的初步研究
王紅梅1,程向陽2,張光忠3,余養朝3,王瑞娟2,鮑大鵬2,茅文俊2*
(1上海市農業科學院農產品質量標準與檢測技術研究所,上海 201403;2上海市農業科學院食用菌研究所,農業部南方食用菌資源利用重點實驗室,國家食用菌工程技術研究中心,國家食用菌加工技術研發分中心,上海市農業遺傳育種重點開放實驗室,上海 201403;3江蘇華綠生物科技股份有限公司,江蘇 223700)
為了探索金針菇栽培過程中氮素營養成分的變化規律,對金針菇整個栽培周期基質-菌絲體混合物中游離氨基酸含量和子實體中游離氨基酸含量的動態變化進行了研究。結果表明:基質-菌絲體混合物中總游離氨基酸含量在發菌期顯著上升,至出原基期達到最高為初始狀態的12.95倍,搔菌前含量最豐富的氨基酸為精氨酸,達到最高值2 279.57 μg/g(占比15.57%),搔菌后,精氨酸快速積累趨勢改變,而谷氨酸、丙氨酸、天冬酰胺等氨基酸繼續積累,至原基形成時,含量最高的氨基酸分別是精氨酸2 213.39 μg/g(占比10.41%)和谷氨酸2 147.53 μg/g(占比10.10%),出原基到子實體成熟過程中基質菌絲體中幾乎所有游離氨基酸含量都逐漸減少。在子實體中谷氨酸、谷氨酰胺、丙氨酸是含量最高的氨基酸。由此推測在金針菇子實體形成過程中,菌絲可以轉運與利用精氨酸、谷氨酸、丙氨酸等多種氨基酸,多種游離氨基酸的運輸為金針菇子實體的快速發育提供了物質保障。
金針菇;菌絲體;子實體;氮素營養;氨基酸;工廠化栽培
金針菇(Flammulina velutipes)又名樸菇、冬菇、毛柄金錢菌、構菌、青杠菌等[1],營養豐富,口感鮮美,受到廣大消費者喜愛,又因其富含賴氨酸和精氨酸,因此被稱之為增智菇。金針菇在我國是一種普遍栽培食用菌,也是我國工廠化生產的主要食用菌之一[2]。為了提高金針菇的產量,同時降低生產成本,金針菇栽培基質配方的研究受到了廣泛重視。氮源是食用菌生長發育的重要營養源,是合成氨基酸、蛋白質和核酸的原料[3]。目前對于金針菇栽培基質的配方研究主要集中于碳氮源的種類與比例方面[4],鮮有報道與碳素、氮素營養的吸收、傳遞等相關的分子基礎的研究。
在叢枝菌根真菌中,基質菌絲吸收的氮素大部分儲存于精氨酸中[5],通過精氨酸酶水解為尿素和鳥氨酸,鳥氨酸由鳥氨酸氨基轉移酶和鳥氨酸脫羧酶轉化為谷氨酸[6-8]。在金針菇中,氮素營養的儲存、傳遞、轉運是否與叢枝菌根真菌類似,還是有其自身特點,都需要通過對金針菇的氮源代謝進行研究后才能給出解答。
試驗研究金針菇整個栽培周期中基質菌絲體、子實體中氨基酸含量的動態變化情況,旨在探索金針菇栽培過程中菌絲吸收利用氮后合成的有機氮載體種類以及轉運和傳遞方式,為深入研究金針菇栽培過程中氮素營養代謝規律奠定基礎,為優化金針菇培養料提供理論支持。
1 材料與方法
1.1 供試材料
1.1.1 供試菌株
金針菇134菌種由上海市農業科學院食用菌研究所保藏和提供。
1.1.2 子實體栽培及樣品收集
本試驗中子實體栽培方式為瓶栽。培養料配方:棉籽殼77%,石膏粉1%,白糖1%,石灰3%,玉米粉18%,菜籽餅5%,含水量65%。栽培過程簡述如下:接種后,將菌種瓶移入培養室發菌培養,溫度20—22℃,相對濕度60%—70%,二氧化碳濃度0.3%。搔菌處理是在菌絲體布滿培養料的90%—100%時進行。搔菌后進行催菇,溫度14—15℃,濕度95%—99%,二氧化碳濃度0.1%—0.2%。當菇蕾出現2—3 d后,把菌瓶移到抑制室,采用光線抑制,抑制期需要5—7 d,抑制后期進入伸長期,當菇蕾伸出瓶口2 cm左右,套紙筒。控制在6—8℃,濕度在80%—85%。
在金針菇樣品采集點分別是原始培養料(第0天)、搔菌當天(第30天)、搔菌處理第6天(第36天)、原基(第38天)、小子實體(第41天)、中子實體(第50天)與大子實體(第54天)。其中出原基前只采集培養料基質,出原基后分別對培養料基質和子實體共同采集。
對培養瓶中含有菌絲的基質的采集,挖取距離瓶口7—10 cm處的全部培養料,置于65℃烘箱經10 h烘干至樣品恒重,用DJ-10A型粉碎機(上海淀久中藥機械制造有限公司)粉碎,粉碎樣品過20目的篩子,備用。對子實體和原基樣品采集子實體的菌柄中部部分。采集到的樣品經液氮快速凍結后,置于真空冷凍干燥機內,抽真空1—3 d,直至水分完全升華。
1.2 儀器與設備
L-8900氨基酸自動分析儀。
1.3 方法
1.3.1 游離氨基酸含量測定
參照王逍君等[9]與高燕紅等[10]的方法,略作修改,簡述如下:準確稱取待測樣品1 g于Eppendorf管中,加入30 mL 0.1 N的鹽酸,40℃超聲提取30 min,室溫靜置30 min后于5 000 r/min離心機離心5 min,取上清800 μL,以1∶1比例加入10%磺基水楊酸,混合液4℃放置30 min,12 000 r/min 4℃離心30 min,取上清,加入10 mol/L氫氧化鈉調節pH至2左右,12 000 r/min 4℃離心10 min,取上清過0.22 μm MCE微孔濾膜,通過L-8900氨基酸自動分析儀進行游離氨基酸含量測定。
1.3.2 數據分析
所有數據均是通過3次重復試驗所得。所得數據采用Excel 2003和SPSS 13.0軟件進行統計學分析。
2 結果與分析
2.1 金針菇整個栽培周期基質菌絲體中氨基酸含量的動態變化
工廠化生長金針菇的生長周期約為55 d。本研究中金針菇原始栽培料中總游離氨基酸初始狀態含量為1 641.85 μg/g,含量極低。在為期30 d的發菌期內,菌絲活動使培養料基質分解產生大量的游離氨基酸,含量達到14 633.27 μg/g,是初始狀態的8.92倍。游離氨基酸含量在出原基點達到最高值,為21 260.31 μg/g,是初始狀態的12.95倍。其后隨著金針菇子實體的發育,總量逐漸減少,到大子實體時為5 222.86 μg/g,是初始狀態的3.18倍。發菌和搔菌處理階段,金針菇培養料中含量豐富的氨基酸是精氨酸,含量占游離氨基酸總量的8.90%—15.57%。谷氨酰胺含量在搔菌處理后達到最高水平為917.01 μg/g。隨生長延續其含量逐漸降低,到大子實體時含量為242.55 μg/g,是搔菌處理后最高水平的26.5%。其余游離氨基酸如谷氨酸、天冬氨酸、蘇氨酸、絲氨酸、天冬酰胺、甘氨酸、亮氨酸、脯氨酸等游離氨基酸含量在出原基前逐漸升高。所有的游離氨基酸在出原基之后均表現為一致的變化趨勢,即隨著子實體的發育,培養料中的各游離氨基酸含量逐漸下降(表1)。
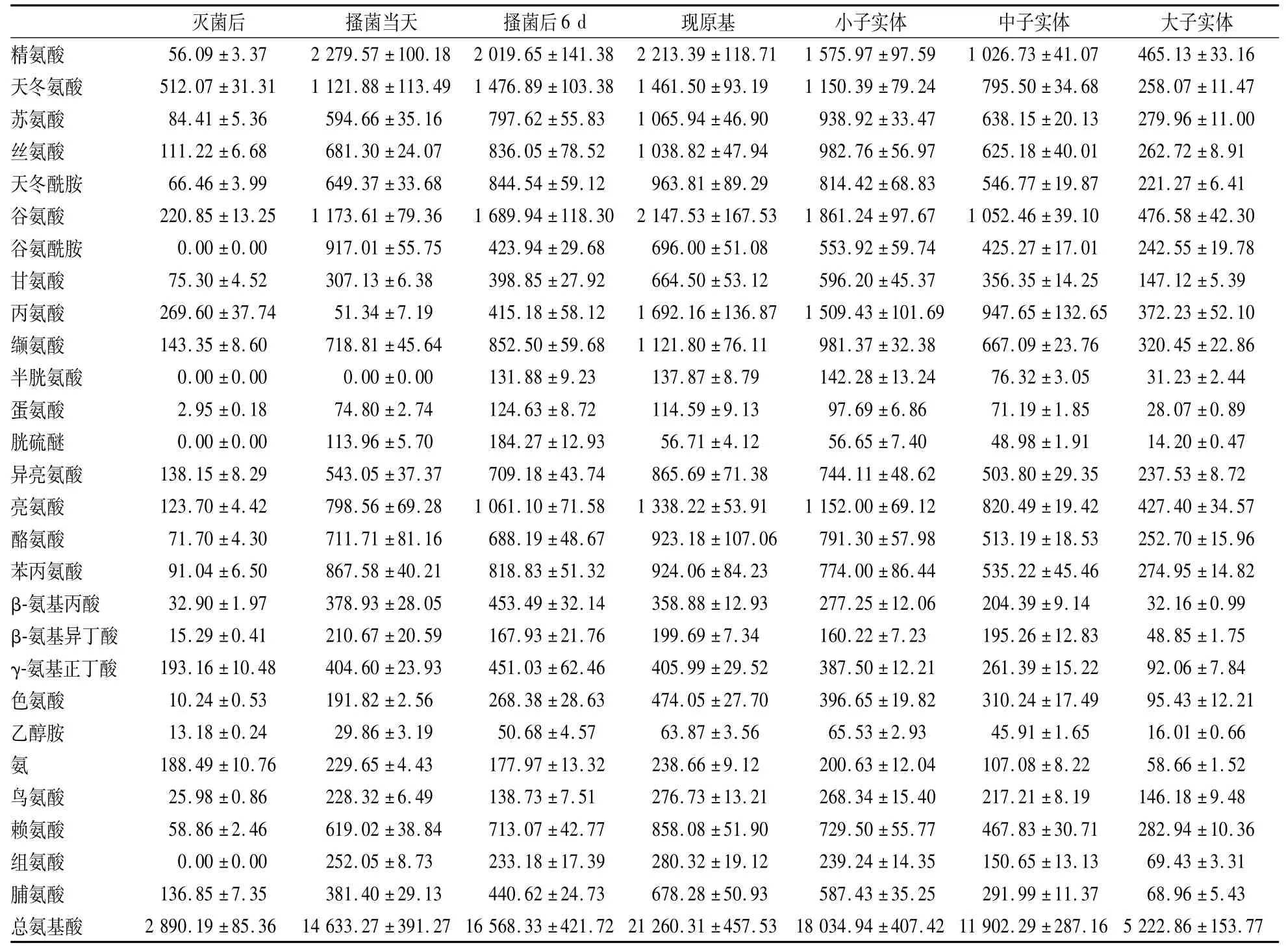
表1 金針菇整個栽培周期中基質-菌絲體混合體中氨基酸含量Table 1 Amino acid contents of substrate-mycelium mixture in whole F.velutipes cultivation cycleμg·g-1
2.2 金針菇整個栽培周期子實體中游離氨基酸含量的動態變化
金針菇子實體中游離氨基酸含量(以大子實體期計)較高的主要有:谷氨酸7 648.34 μg/g、谷氨酰胺3 909.90 μg/g、丙氨酸5 178.80 μg/g、苯丙氨酸3 276.18 μg/g等。從表2可以看出,原基期谷氨酸含量(8 407.35 μg/g)和中子實體期丙氨酸含量(5 649.67 μg/g)較其他幾種氨基酸高。谷氨酸在子實體發育進程中,變化不顯著;丙氨酸在由中子實體向大子實體生長過程中含量有所降低;谷氨酰胺在子實體發育初期有所上升,到中子實體向大子實體轉變時,變化不顯著,精氨酸在子實體游離氨基酸中含量較低,且維持在較低的含量,變化不顯著;鳥氨酸含量在出原基后緩慢上升,子實體發育后期顯著升高。
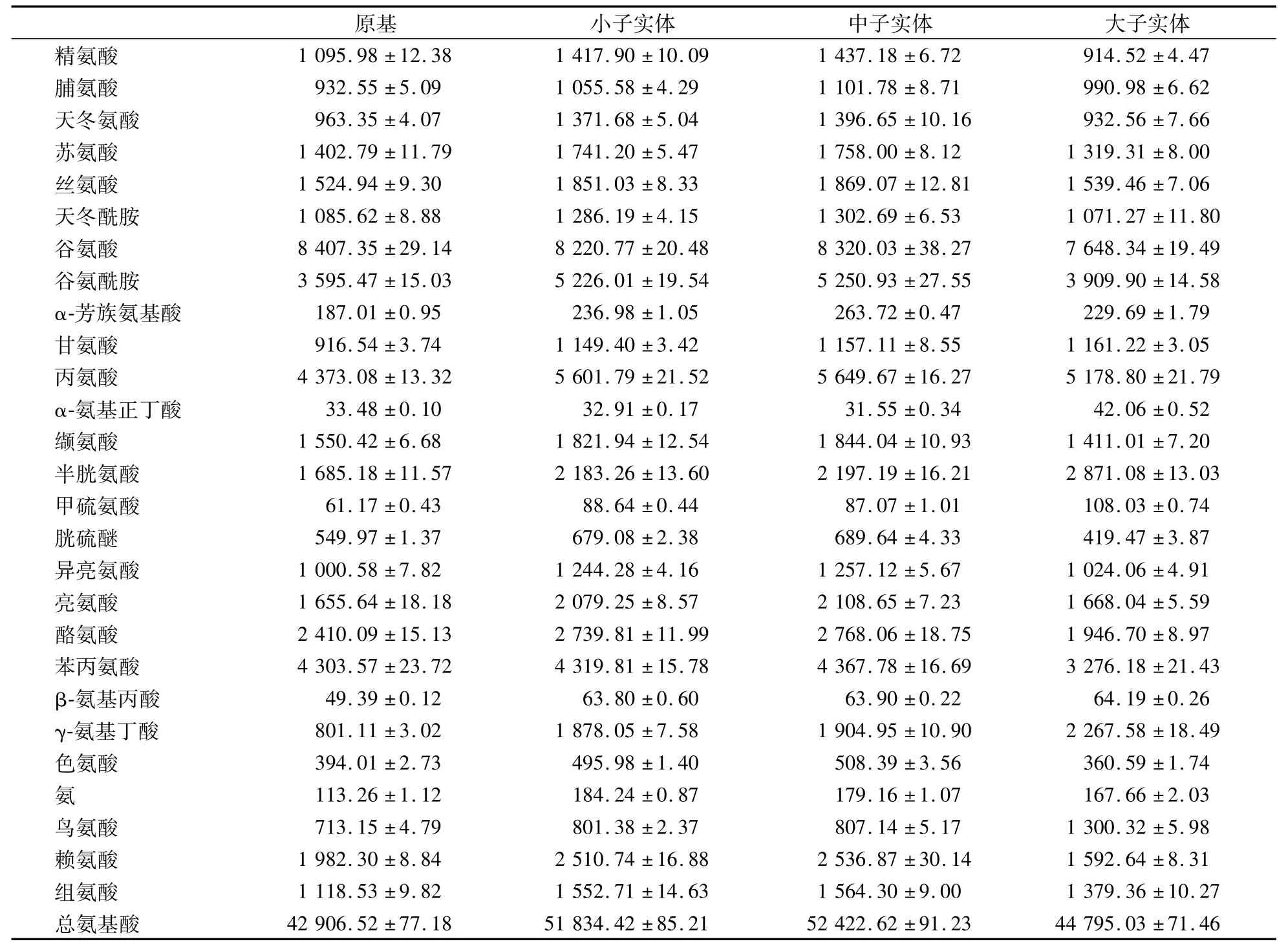
表2 金針菇整個栽培周期子實體中氨基酸含量Table 2 Amino acid contents of fruiting bodies in whole F.velutipes cultivation cycleμg·g-1
3 討論
相較于總氨基酸,游離氨基酸的含量變化對反映生物體不同生長發育時期氮代謝的變化,對氮素的吸收、運輸、同化及營養狀況等更具重要意義。食用菌菌絲接種之后,進入發菌階段,該過程是通過菌絲“吃料”,使菌絲充盈整個培養基質[11]。之后進入發菌后期,進一步堆積菌絲生物量,基質間隙完整被菌絲體充盈。在本研究中發現金針菇培養料中總的游離氨基酸的量以及大多數氨基酸在接種后都在增加,搔菌后繼續增加或維持不變。這說明這一階段前期菌絲代謝活動旺盛,能夠大量的分解培養料中的氮素營養并轉化為游離氨基酸,并且其生成游離氨基酸的速率大于其自身利用與運輸游離氨基酸的速率,完成營養積聚,為形成子實體做準備。
在發菌過程中,由于菌絲生長造成呼吸熱使水分蒸發,上層菌絲老化,甚至形成菌皮菌膜,阻礙空氣相對濕度與內部菌絲接觸,對新鮮空氣接觸不暢[12]。搔菌處理一方面使新生菌絲充分接觸新鮮空氣和空間相對濕度,提高菌絲生命力,另一方面在有效的物理刺激能使菌絲由營養生長向生殖生長轉變。在本研究中發現,搔菌處理還會影響金針菇培養料中多種氨基酸的積累趨勢,從接種到搔菌處理前精氨酸在金針菇培養料中快速積累,為各氨基酸中積累速度最快,至搔菌處理時已占總氨基酸含量的比例達到15.6%,但是在搔菌處理后培養料中的精氨酸未進一步提高,并保持著相對高的含量,可能是精氨酸的生成與運輸形成了一種平衡。與此同時,培養料中谷氨酸、天冬氨酸等其他多種氨基酸在搔菌處理后至原基形成前進一步積累。其中谷氨酸搔菌后至出原基的增速是搔菌前的3.8倍,丙氨酸增速則由搔菌前的-7.27 μg/(g·d)變為搔菌后的205.1 μg/(g·d)。出原基后,金針菇子實體迅速形成,需要大量的氮源物質,各種游離氨基酸同步減少,推測在金針菇中,與已報道的叢枝菌根真菌不同,精氨酸只是菌絲能轉運氨基酸的其中一種形式,而不是唯一的,多種氨基酸可能都可以被金針菇菌絲轉運與利用,這可能也是金針菇子實體發育比較迅速的原因。
谷氨酸在真菌進行氨基酸生物合成中起到了橋梁作用。無機氮被還原成氨,氨與α-酮戊二酸結合,形成L-谷氨酸,L-谷氨酸積極參與轉氨反應并在特殊的合成途徑中形成其它氨基酸。此反應是可逆反應,谷氨酸失去的氨基后,其骨架以α-酮戊二酸的形式進入三羧酸循環。本研究中,谷氨酸、丙氨酸的積累速度在原基形成前不斷提高,于搔菌后6 d至原基形成期增速達到最高。此后在金針菇子實體發育中,谷氨酸含量和丙氨酸含量也均保持較高水平,谷氨酸的代謝和三羧酸循環相關[13],丙氨酸則由糖酵解的中間產物生成,這也側面證實金針菇子實體的發育中氮代謝和碳代謝之間是相互聯系、相互交織的。丙氨酸的含量在形成大子實體時明顯下降,表明隨著金針菇子實體的成熟與擔孢子的形成,丙氨酸含量相應減少。鳥氨酸循環在真菌中的作用是提供合成蛋白質所需的精氨酸。在此循環中,精氨酸水解生成尿素并再生鳥氨酸,金針菇鳥氨酸的含量變化可以反映尿素的含量變化,從本實驗結果可見鳥氨酸是少數在金針菇的子實體發育后期仍然增高的氨基酸,由此可見金針菇的子實體發育后期尿素含量有所積累。尿素的積累是擔子菌處理剩余氮素的一種表現,避免過多的NH4+對細胞的毒害,這部分尿素會轉移到菌蓋中,尿素吸水平衡滲透壓[14]。
[1]于榮利,秦旭升,宋鳳菊.金針菇研究概況[J].食用菌學報,2004,11(4):63-68.
[2]苗人云,周潔,譚偉,等.金針菇栽培基質替代原料初步篩選研究[J].菌物學報,2014,33(2):411-424.
[3]林辰壹,馬娟,楊婷婷,等.優化氮源種類及碳氮比對阿魏菇液體種生長的效應[J].新疆農業科學,2012,49(11):2042-2047.
[4]王家季,劉化民.培養料碳氮比對金針菇生長發育及產量的影響[J].中國食用菌,2004(4):30-31.
[5]JIN H R.Arginine bi-directional translocation and breakdown into ornithine along the arbuscular mycorrhizal mycelium[J].Science in China(Series C:Life Sciences),2009,52:381-389.
[6]BORSUK P,DZIKOWSKA A,EMPEL J,et al.Structure of the arginase coding gene and its transcript in Aspergillus nidulans[J].Acta Biochimica Polonica,1999,46:391-403.
[7]DZIKOWSKA A,KACPRZAK M,TOMECKI R,et al.Specific induction and carbon/nitrogen repression of arginine catabolism gene of Aspergillus nidulans functional in vivo analysis of the otaA promoter[J].Fungal Genetics and Biology,2003,38:175-186.
[8]WAGEMAKER M J M,EASTWOOD D C,VANDERDRIFT C,et al.Argininosuccinate synthetase and argininosuccinate lyase:two ornithine cycle enzymes from Agaricus bisporus[J].Mycol Res,2007,111:493-502.
[9]王逍君,谷大海,王雪峰,等.五種云南野生食用菌中非揮發性的主要呈味物質比較研究[J].現代食品科技,2016,32(3):306-312.
[10]高燕紅,魯琳,劉應亮.6種食用菌蛋白質與氨基酸的含量分析及評價[J].現代預防醫學,2010,37(10):1843-1846.
[11]張引芳,劉遐,陳建華,等.杏鮑菇工廠化生產工藝研究[J].食用菌學報,2003,10(2):36-39.
[12]蘇琍英.金針菇搔菌技術的研究[J].浙江林學院學報,1992,9(2):185-189.
[13]MONSEFI M,LOHRASBI P.Utilization of glutamine and of tca cycle constituents as precursors for transmitter glutamate and gaba[J]. Toxicological&Environmental Chemistry,1993,15(3/4/5):367-377.
[14]SIU W C,MOORE D.Segregation of genotypically diverse progeny from self-fertilized haploids of the Chinese straw mushroom,Volvariella volvacea[J].Mycol.Res.,1999,103(10):1335-1345.
(責任編輯:程智強)
Preliminary study on variation of free amino acids during factory cultivation of Flammulina velutipes
WANG Hong-mei1,CHEN Xiang-yang2,ZHANG Guang-zhong3,YU Yang-chao3,WANG Rui-juan2,BAO Da-peng2,MAO Wen-jun2*
(1Institute for Agro-Food Quality Standards and Testing Technology,Shanghai Academy of Agricultural Sciences,Shanghai 201403,China;2Institute of Edible Fungi,Shanghai Academy of Agricultural Sciences;Key Laboratory of Southern Edible Fungi Resources and Utilization,Ministry of Agriculture;National Engineering Research Center of Edible Fungi;National R&D Center for Edible Fungi Processing;Shanghai Key Laboratory of Agricultural Genetics and Breeding,Shanghai 201403,China;3Jiangsu Hualü Biological Technology Co.Ltd.,Jiangsu 223700,China)
In order to explore the component variation of nitrogen nutrition during F.velutipes cultivation,the free amino acid contents of both substrate-mycelium mixture and fruiting bodies were investigated in the whole culturing period.The results showed that the total free amino acid content of the mixture significantly increased at the spawn running stage and reached the highest at the primordial stage,being 12.95 times as much as the initial quantity;Before scratching,arginine was the most abundant in the amino acids of the mixture and reached the highest value of 2 279.57 μg/g(15.57%);while after scratching,the trend of accumulating arginine was changed,some other amino acids such as glutamic acid,alanine and aspartic acid still accumulated,and at the primordium initiation stage the highest contents of amino acids were respectively arginine 2 213.39 μg/g(10.41%)and glutamic acid 2 147.53 μg/g(10.10%).From the primordium initiation to the fruiting body maturation the contents of almost all amino acids gradually decreased.Glutamic acid,glutamine and alanine werethe most abundant in the amino acids of the fruiting body.From the above results it was concluded that in the formation of F.velutipes fruiting bodies,the mycelia could transport and utilize a variety of amino acids such as arginine,glutamic acid and alanine,and transporting various free amino acids provided a material basis for rapid development of F.velutipes fruiting bodies.
Flammulina velutipes;Mycelium;Fruiting body;Nitrogen nutrition;Amino acids;Factory cultivation
S646.15
A
1000-3924(2016)06-005-05
2016-04-25
上海市科學技術委員會工程技術研究中心能力提升項目(16DZ2281300)
王紅梅(1968—),本科,高級實驗師,主要從事農產品質量檢測。E-mail:wanghm@hotmail.com
*通信作者,E-mail:mwjtry123@126.com

