熱應激誘導豬腎小管上皮(LLC-PK1)細胞線粒體凋亡相關因子的時效表達
霍愛華,孫雪榮,于文慧,李華濤,李 樂,李洪才,田文儒
(青島農業大學 動物科技學院,山東 青島 266109)
熱應激誘導豬腎小管上皮(LLC-PK1)細胞線粒體凋亡相關因子的時效表達
霍愛華,孫雪榮,于文慧,李華濤,李 樂,李洪才,田文儒
(青島農業大學 動物科技學院,山東 青島 266109)
擬探討熱應激誘導LLC-PK1細胞線粒體凋亡相關因子的表達和活性情況,以及激活線粒體凋亡通路的時間。采用qRT-PCR方法和Caspase活性檢測試劑盒分別檢測42 ℃熱應激處理后0,2,4,8,16 h以及37 ℃培養的LLC-PK1細胞中HSP72、Bcl-2、Bax、AIF和Cyt.c的基因表達以及Caspase-9和Caspase-3的活性。結果顯示,42 ℃熱應激1 h,LLC-PK1細胞Bcl-2/Bax(P<0.05)和AIF(P<0.01)基因表達以及 Caspase-3(P<0.01)活性從0 h開始升高(P<0.01),到2 h達到最高(P<0.01);HSP72基因表達和Caspase-9活性0 h即達到最高(P<0.01);Cyt.c基因表達在2 h開始極顯著升高(P<0.01),并且此時最高,8 h以后全部因子恢復到正常水平。結果表明,42 ℃熱應激1 h即激活LLC-PK1細胞線粒體凋亡通路,且熱應激后的0~8 h線粒體凋亡通路處于活化狀態,其中2 h時最為活躍。
熱應激;豬腎小管上皮細胞;線粒體凋亡
地球溫度在升高,人類正面臨高溫的影響。已經證明,高溫使動物產生熱應激反應,降低繁殖力和生產力。研究表明,熱應激可誘導細胞凋亡[1],引起豬腎小管上皮細胞損傷[2-3]。線粒體凋亡通路是細胞凋亡的主要通路之一。線粒體凋亡通路中,凋亡信號誘導線粒體釋放細胞色素C(Cyt.c)和AIF等凋亡誘導因子,線粒體Cyt.c在電子傳遞鏈中扮演傳遞電子的角色,而釋放到細胞質中后,與Apaf-1結合活化Caspase-9,激活的Caspase-9可以切割并激活Caspase-3,導致細胞凋亡[4];從線粒體中釋放出的AIF則轉移至細胞核,切割DNA,誘導細胞凋亡[5]。而熱休克蛋白(HSPs)對熱應激反應極其敏感,起到保護細胞的作用,其中HSP72對熱應激反應最為敏感[6],是細胞受到應激刺激而合成的1組高度保守的蛋白。研究表明,HSP72能提高細胞的熱耐受性[7],抑制線粒體上游和下游的凋亡因子活性[8],保護線粒體[9]。研究證明,凋亡細胞線粒體膜通透性發生改變,導致跨膜電位下降[10],而Bcl-2家族在細胞凋亡中起著關鍵作用,其中Bax為促凋亡主要的蛋白,作用于細胞線粒體膜上,促進線粒體跨膜通道的開放,改變線粒體通透性,進而促進Cyt.c和AIF等促凋亡蛋白的釋放;Bcl-2是Bcl-2家族中主要的抑制凋亡蛋白,主要分布于線粒體膜和內質網膜等,起到抑制Bax的促凋亡的作用[11]。Bcl-2蛋白家族可以調控線粒體通透性轉換孔(MPTP)的開閉,同時熱應激時誘導細胞線粒體內的Ca2+超載,ROS增加,能量衰竭等也影響MPTP的開閉[12]。因此,研究熱應激誘導的線粒體凋亡相關因子的表達以及活性情況,有利于深入理解細胞凋亡的機理,并可為降低熱應激誘導的細胞凋亡、緩解動物的熱應激反應,提供一定的理論基礎。
1 材料和方法
1.1 試劑
DMEM培養基購自Gibco公司,胎牛血清購自Thermo公司,胰蛋白酶購自Sigma公司,青霉素與鏈霉素混合液(100×)購自Solarbio公司;RNA提取試劑盒購自Aidlab Biotech公司,反轉錄試劑盒購自Thermo 公司,LighCycler?480 SYBR Green I Master 購自Roche公司;Caspase-9 和Caspase-3活性檢測試劑盒購自碧云天生物技術研究所。
1.2 細胞系及其培養
豬腎小管上皮細胞系(LLC-PK1)購自美國ATCC公司,購買時為3代細胞系。用高糖 DMEM 培養液+10%胎牛血清+1%青鏈霉素混合液(100×),在37 ℃、含5% CO2的培養箱中培養,待細胞貼壁達80%~90%時,進行胰酶消化傳代。
1.3 線粒體凋亡相關基因時效表達的檢測
豬腎小管上皮細胞進行42 ℃熱應激1 h,分別于熱應激處理后0,2,4,8,16 h后提取熱應激處理細胞以及37 ℃培養細胞(作為對照組)的總RNA,并按照RNA反轉錄試劑盒說明進行反轉錄,反轉錄體系為20 μL:提取的RNA 7 μL,隨機引物(0.2 μg/μL) 1 μL,DEPC水4 μL,5×Reaction Buffer 4 μL,Ri-bolockTMRNase Inhibitor 1 μL;10 mmol/L dNTP Mix 2 μL;反轉錄酶(RevertAidTM M-MuLV Reverse Transcriptase)1 μL,反轉錄條件為:25 ℃ 5 min,42 ℃ 1 h,70 ℃ 5 min。反轉錄后,使用滅菌雙蒸水稀釋到90 μg/mL,然后用Roche Ligh Cycler480Ⅱ熒光定量PCR儀進行檢測,其反應體系(10 μL)為:cDNA 1 μL,ddH2O 3.6 μL,LighCycler?480 SYBR Green I Master 5 μL,引物上游0.2 μL、下游0.2 μL。引物由上海生工生物工程技術服務有限公司合成(表1)。qRT-PCR 反應條件:95 ℃ 10 min;95 ℃ 10 s,60 ℃ 20 s,72 ℃ 30 s,共 45個循環。各組以β-action基因為內參,采用2-ΔΔCt進行相對定量分析[13]。

表1 引物列表Tab.1 Primer sequences for the qRT-PCR assay
注:HSP72.熱休克蛋白72基因;Bcl-2.B細胞淋巴瘤/白血病-2基因;Bax.B細胞淋巴瘤/白血病-2相關X蛋白基因;Cyt.c.細胞色素C基因;AIF.促凋亡蛋白基因;β-action.β-肌動蛋白基因。
Note:HSP72 .Heat shock protein 72 gene;Bcl-2.B-cellymphoma/leukemia-2 gene;Bax.Bcl-2 associated X protein gene;Cyt.c.Cytochrome c gene;AIF.Apoptosis inducing factor gene;β-action.β-non-muscle actin gene.
1.4 Caspase-9和Caspase-3活性檢測
參照Caspase活性檢測試劑盒說明書進行檢測,首先測定酶產物標準曲線,將酶產物標準品稀釋為0,10,20,50,100,200 μmol/L,作為標準品,分光光度分別檢測A405下的吸光值,制作標準曲線。然后將42 ℃熱應激1 h的豬腎小管上皮細胞分別于熱應激處理后0,2,4,8,16 h熱應激組以及37 ℃培養的對照組用胰酶收集至細胞培養液中,以2 557 r/min離心5 min,PBS洗滌一次,加入裂解液進行冰浴裂解15 min,在4 ℃條件下,以13 210 r/min離心10 min,收集上清,進行Caspase活性以及蛋白濃度測定。Caspase酶活性反應體系為檢測緩沖液50 μL+樣品40 μL+底物10 μL。37 ℃孵育1 h,用微量分光光度計在A405nm處測定。蛋白濃度用Bradford方法檢測。計算出每毫克蛋白中含多少酶活力單位(一個酶活力單位為底物飽和時在37 ℃ 1 h內剪切1 nm底物產生1 nm產物Caspase的酶量)。
1.5 統計分析
數據使用Graph Pad Prism 5 進行統計學處理,LSD多重比較分析,均值間進行t檢驗。
2 結果與分析
2.1 熱應激誘導的LLC-PK1細胞HSP72、Bcl-2和Bax基因的時效表達
qRT-PCR檢測結果(圖1)顯示,42 ℃熱應激1 h處理豬腎小管上皮細胞,HSP72 mRNA迅速轉錄,與37 ℃對照組相比極顯著增高(P<0.01),且在熱應激后立即達到最高點,隨后逐漸下降,在0~2 h內下降迅速,2~4 h內下降緩慢,8 h后趨于平穩與對照組相比沒有顯著差異(P>0.05)。Bcl-2熱應激后0~16 h內mRNA的表達量先升高后降低,在2 h時表達量最高,極顯著高于對照組(P<0.01),隨后逐漸下降,4 h后表達量與對照組相比沒有顯著性差異(P>0.05);BaxmRNA表達趨勢與Bcl-2 相反,在0~16 h內先降低后升高而后趨于對照組表達量,在2 h表達量最低,顯著低于對照組(P<0.05),8 h表達量最高,顯著高于對照組(P<0.05);Bcl-2/Bax表達曲線顯示在0~16 h內,其比值先升高后降低,2 h時最高,極顯著高于對照組(P<0.01),4~16 h內與對照組相比沒有顯著差異(P>0.05)。
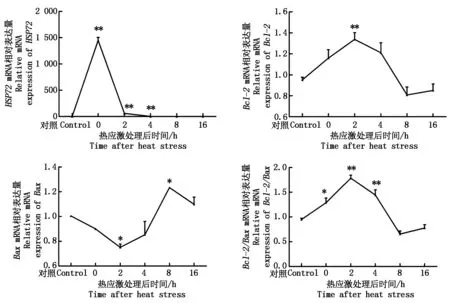
*.與對照組相比差異顯著(P<0.05);**.與對照組相比差異極顯著(P<0.01)。圖2-3同。*.Significant difference compared to control(P<0.05);**.Extremely significant difference compared to control(P<0.01).The same as Fig.2-3.
2.2 熱應激誘導的LLC-PK1細胞Cyt.c和AIF基因的時效表達
qRT-PCR檢測結果(圖2)表明,熱應激后16 h內,AIF和Cyt.cmRNA表達量逐漸增高,2 h后開始降低。其中0,2 hAIF表達量極顯著高于對照組(P<0.01),4 h后趨于平穩,與對照組相比沒有顯著差異(P>0.05);Cyt.c的表達量在2,4 h時極顯著高于對照組(P<0.01),8 h的表達量略高于對照組但與對照組相比沒有顯著性差異(P>0.05),16 h的表達量亦與對照組相比沒有顯著差異(P>0.05),且2 h后Cyt.c的表達量一直是降低趨勢,直到16 h。
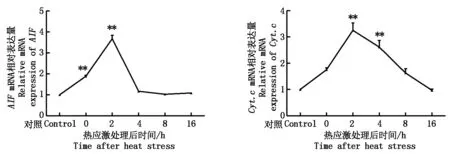
圖2 各組細胞中AIF和Cyt.c mRNA表達Fig.2 Heat stress induces the production of AIF and Cyt.c mRNA in LLC-PK1 cells
2.3 熱應激誘導的LLC-PK1細胞Caspase-9和Caspase-3活性
Caspase活性檢測結果表明(圖3),熱應激處理后的16 h內,Caspase-9的活性在熱應激剛剛結束后最高,且極顯著高于對照組(P<0.01);而后逐漸降低,8 h后其活性逐漸恢復到平穩,與對照組相比沒有顯著差異(P>0.05)。Caspase-3的活性也是先升高后降低。在2 h處活性最高,極顯著高于對照組(P<0.01),而后逐漸降低,其中0~4 h活性仍然極顯著高于對照組(P<0.01),8 h以后與對照組相比沒有顯著差異(P>0.05)。
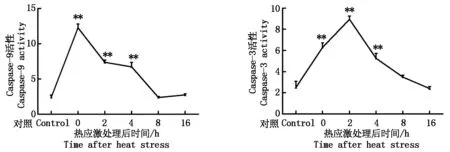
圖3 各組細胞中Caspase-9和Caspase-3活性檢測Fig.3 Heat stress induces the activity of Caspase-9 and Caspase-3 in LLC-PK1 cells
3 討論
HSPs是在受熱或其他理化以及生物等刺激后發生應激反應而產生的一類蛋白。其中HSP70家族的成員最為保守,廣泛分布于細胞的各個部分[14]。其中HSP72在正常細胞中不表達或者很少表達,但在熱應激條件下可以迅速表達。HSP72參與蛋白質的合成、折疊、積聚、裝配、運輸和降解,能幫助新生肽正確折疊以及修正或降解錯誤的蛋白,以維持細胞的正常結構和功能,增強細胞的耐受性,保護細胞[15]。另一方面,HSP72也通過抗細胞凋亡作用,增強細胞的耐受性。研究表明,HSP72經線粒體通路抗細胞凋亡,HSP72可抑制Cyt.c的釋放以及其與Apaf-1結合,阻止Caspase-9前體募集到Apaf-1,從而抑制Caspase-9的激活[16];Garg等[17]研究表明,HSP72阻止Bax轉移到線粒體上,維持線粒體膜的通透性,抑制凋亡因子AIF和Cyt.c等的釋放,從而抑制線粒體凋亡通路。HSP72在細胞應激中扮演著重要角色,本研究表明,42 ℃熱應激1 h后LLC-PK1細胞HSP72 mRNA迅速表達,并立即達到最高點,而后逐漸下降。可能是由于胞質中HSP72基因沒有內含子,可以迅速大量轉錄出HSP72 mRNA[18];而且,HSP72基因的轉錄主要受熱休克因子HSF調控、啟動迅速,當熱應激反應時,HSF磷酸化,形成有活性的三聚體,轉入核內,在核內與熱休克基因上游啟動子區域HSE序列結合,并進一步被激酶磷酸化,啟動熱休克基因的表達,這個過程迅速快捷,在受熱后數分鐘便可達到最高水平[19]。邱定杰[20]研究在不同的熱應激持續時間中,肝臟HSP72 mRNA的轉錄量急劇升高,至1 h達到峰值,與本試驗結果基本一致。
Bcl-2家族蛋白在細胞凋亡過程中起著重要作用,線粒體在細胞凋亡過程中起著重要作用,而有研究表明,Bcl-2家族蛋白的主要作用位點就在線粒體膜上[21-22]。Bcl-2家族的大部分抗凋亡蛋白一般作為細胞器膜(如線粒體、內質網和核膜)的整合膜蛋白被隔離起來,而促凋亡蛋白則以非活性的形式定位分布于胞液中或細胞質骨架上。其中Bax是主要的促凋亡因子,當細胞受一定刺激時,其轉移到線粒體等膜上,使線粒體膜的通透性增強,釋放凋亡因子AIF和Cyt.c等,激活線粒體凋亡通路;而抑制凋亡蛋白Bcl-2與Bax結合形成異二聚體,從而拮抗Bax的抗凋亡作用。Scopa等[23]、Oshikawa等[24]以及Adhya等[25]研究發現,Bcl-2/Bax可作為預測腫瘤或者癌癥臨床治療療效的標志物。本試驗結果顯示熱應激處理后,Bcl-2先升高后降低,在2 h處最高;而Bax先降低后升高,2 h最低,Bcl-2/Bax比值升高表示其發揮抗凋亡的作用,而非促進凋亡。而熱應激處理后,AIF和Cyt.c基因表達增高,也是在2 h處達到最高,其次Caspase-9和Caspase-3也不同程度的增高,因此,42 ℃熱應激1 h處理豬腎小管上皮細胞其線粒體凋亡通路被激活。因此猜測,其線粒體通路激活是由其他因素導致的,不是Bax引起的。Bcl-2家族中Bad也能與Bcl-2形成異二聚體,拮抗Bcl-2的抗凋亡作用;Wei等[26]、Kataoka等[27]研究發現,被激活的tBid和Bcl-rambo也能引起線粒體膜通透性的改變,促進Cyt.c等的釋放,誘發細胞凋亡。同時,線粒體膜通透性的改變也受到活性氧增加、Ca2+超載和能量衰竭等多種因素的影響。
線粒體凋亡過程中,促凋亡蛋白從線粒體的釋放至關重要[28],一旦釋放促凋亡蛋白(Cyt.c、AIF),激活Capsase-9和Caspase-3等,級聯放大凋亡信號,導致蛋白降解,DNA切割,誘導細胞凋亡。Caspase不僅是細胞凋亡的執行者,還可以激活第二信使,修飾Bcl-2(將Bcl-2轉變為促凋亡的Bax樣因子),改變細胞內氧化還原水平,過表達Bax和Bak等促凋亡因子,再作用于線粒體,實現凋亡信號的放大,加快凋亡進程。這也可能是本研究中,Caspase-9的表達首先達到最高點,而后AIF和Cyt.c等隨后達到最高點的原因。
本研究從分子水平揭示了熱應激誘導LLC-PK1細胞線粒體凋亡通路相關因子基因以及相關活性的時效表達情況,但是細胞凋亡的調控過程精密而又錯綜復雜,需要進一步研究。
42 ℃熱應激1 h即激活LLC-PK1細胞線粒體凋亡通路,且熱應激后的0~8 h線粒體凋亡通路處于活化狀態,其中2 h時最為活躍。
[1] Guo X,Chi S,Cong X,et al.Baicalin protects sertoli cells from heat stress-induced apoptosis via activation of the Fas/FasL pathway and Hsp72 expression[J].Reproductive Toxicology,2015,57(1):88-93.
[2] Zhang B Z,Guo X T,Chen J W,et al.Saikosaponin-D attenuates heat stress-induced oxidative damage in LLC-PK1 cells by increasing the expression of anti-oxidant enzymes and HSP72[J].The American Journal of Chinese Medicine,2014,42(5):1261-1277.
[3] 陳健偉,國曉瞳,趙 園,等.燈盞花乙素(Scu)對豬腎小管上皮細胞(LLC-PK1)細胞熱休克蛋白72(HSP72)及凋亡相關基因表達的影響[J].農業生物技術學報,2014,22(10):1261-1268.
[4] 蔣 顯.線粒體釋放細胞凋亡因子的機理研究[D].北京:北京協和醫學院,2014.
[5] Sánchez A,Espinosa P,García T,et al.The 19 kDa mycobacterium tuberculosis lipoprotein (LpqH) induces macrophage apoptosis through extrinsic and intrinsic pathways:a role for the mitochondrial apoptosis-inducing factor[J].Clinical & Developmental Immunology,2012(2):950503.
[6] 張建鑫,陳 輝,張競乾.動物熱應激蛋白研究進展[J].飼料研究,2008(3):26-27,30.
[7] 李 燕.有機鉻對熱應激肉鴨腸黏膜形態、HSP70 mRNA和抗氧化能力的影響[D].武漢:華中農業大學,2013.
[8] 曾 濤,李國勤,盧立志,等.熱休克蛋白70及27的研究進展[J].中國家禽,2012,34(8):40-43.
[9] Yenari M A,Liu J,Zheng Z,et al.Antiapoptotic and anti-inflammatory mechanisms of heat-shock protein protection[J].Annals of the New York Academy of Sciences,2005,1053:74-83.
[10] 古正濤.線粒體途徑介導熱打擊誘導人臍靜脈內皮細胞凋亡的研究[D].廣州:南方醫科大學,2014.
[11] Bielaszewska M,Rüter C,Kunsmann L,et al.EnterohemorrhagicEscherichiacolihemolysin employs outer membrane vesicles to target mitochondria and cause endothelial and epithelial apoptosis[J].PLOS Pathogens,2013,9(12):e1003797.
[12] Risso A,Braidot E,Sordano M C,et al.BMAP-28,an antibiotic peptide of innate immunity,induces cell death through opening of the mitochondrial permeability transition pore[J].Molecular and Cellular Biology,2002,22(6):1926-1935.
[13] Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method[J].Methods,2001,25(4):402-408.
[14] Leandro N S,Gonzales E,Ferro J A,et al.Expression of heat shock protein in broiler embryo tissues after acute cold or heat stress[J].Molecular Reproduction and Development,2004,67(2):172-177.
[15] Sharma D,Masison D C.Hsp70 structure,function,regulation and influence on yeast prions[J].Protein and Peptide Letters,2009,16(6):571-581.
[16] 鮑 娟.GGA誘導AD大鼠海馬HSP70表達及其抗細胞凋亡機制的研究[D].長沙:中南大學,2008.
[17] Garg M,Kanojia D,Seth A,et al.Heat-shock protein 70-2 (HSP70-2) expression in bladder urothelial carcinoma is associated with tumour progression and promotes migration and invasion[J].European Journal of Cancer,2010,46(1):207-215.
[18] Gray C C,Amrani M,Yacoub M H.Heat stress proteins and myocardial protection:experimental model or potential clinical tool? [J].The International Journal of Biochemistry & Cell Biology,1999,31(5):559-573.
[19] Price B D,Calderwood S K.Ca2+is essential for multistep activation of the heat shock factor in permeabilized cells[J].Molecular and Cellular Biology,1991,11(6):3365-3368.
[20] 邱定杰.熱應激對大鼠肝臟HSP70表達及其mRNA豐度變化規律的研究[D].福州:福建農林大學,2010.
[21] Zhao J Y,Chen Z H,Lin W,et al.Bear bile powder (熊膽粉) induces apoptosis of human hepatocellular carcinoma cells via mitochondrion-dependent pathway[J].Chinese Journal of Integrative Medicine,2014,20(2):123-129.
[22] Ching B,Chen X L,Yong J H,et al.Increases in apoptosis,caspase activity and expression of p53 and bax,and the transition between two types of mitochondrion-rich cells,in the gills of the climbing perch,Anabas testudineus,during a progressive acclimation from freshwater to seawater[J].Frontiers in Physiology,2013,4:135.
[23] Scopa C D,Vagianos C,Kardamakis D,et al.bcl-2/bax ratio as a predictive marker for therapeutic response to radiotherapy in patients with rectal cancer[J].Applied Immunohistochemistry & Molecular Morphology,2001,9(4):329-334.
[24] Oshikawa T, Okamoto M, Ahmed S U, et al.The relationship between gene expression of Bcl-2 and Bax and the therapeutic effect in oral cancer patients[J].Gan to Kagaku Ryoho Cancer & Chemotherapy, 2006, 33(12): 1723-1725.
[25] Adhya A K,Srinivasan R,Patel F D.Radiation therapy induced changes in apoptosis and its major regulatory proteins,Bcl-2,Bcl-XL,and Bax,in locally advanced invasive squamous cell carcinoma of the cervix[J].International Journal of Gynecological Pathology,2006,25(3):281-287.
[26] Wei M C,Lindsten T,Mootha V K,et al.tBID,a membrane-targeted death ligand,oligomerizes BAK to release cytochrome c[J].Genes & Development,2000,14(16):2060-2071.
[27] Kataoka T,Holler N,Micheau O,et al.Bcl-rambo,a novel Bcl-2 homologue that induces apoptosis via its unique C-terminal extension[J].The Journal of Biological Chemistry,2001,276(22):19548-19554.
[28] Gao W,Pu Y,Luo K Q,et al.Temporal relationship between cytochrome c release and mitochondrial swelling during UV-induced apoptosis in living HeLa cells[J].Journal of Cell Science,2001,114(Pt15):2855-2862.
Expression of Factors Related to Mitochondrial Apoptosis in Pig Kidney Proximal Tubular (LLC-PK1) Cells Induced by Heat Stress
HUO Aihua,SUN Xuerong,YU Wenhui,LI Huatao,LI Le,LI Hongcai,TIAN Wenru
(College of Animal Science and Technology,Qingdao Agricultural University,Qingdao 266109,China)
To investigate the expression and the activity of factors related to mitochondrial apoptosis in LLC-PK1 cells induced by heat stress,and the time of activation of mitochondrial apoptotic pathway,we assessed theHSP72,Bcl-2,Bax,AIF,Cyt.cexpressions in LLC-PK1 cells by qRT-PCR and Caspase-9,Caspase-3 activity by caspase activity assay kit at 0,2,4,8,16 h after 42 ℃ heat stress treatment for 1 h.The above factors were also measured in cells cultured at 37 ℃ as control.Results demonstrated thatBcl-2/BaxandAIFgene expressions and Caspase-3 activity significantly increased from 0 h,and reached the highest point at 2 h after heat stress;HSP72 gene expression and Caspase-9 activity reached the highest point at 0 h;Cyt.cgene expression significantly increased and reached the highest point at 2 h,and all the measured factors returned to normal level at 8 h after heat stress.The above results reveal that mitochondrial apoptotic pathway in LLC-PK1 cells is in a state of activation in 0-8 h after 42 ℃ heat stress for 1 h and is the most active at 2 h.
Heat stress;LLC-PK1 cells;Mitochondrial apoptosis
2016-04-15
國家自然科學基金項目(31572590;31502138);山東省自然科學基金項目(BS2015NY001)
霍愛華(1987-),女,山東菏澤人,碩士,主要從事動物生殖生理與疾病研究。
田文儒(1959-),男,黑龍江蘭西人,教授,博士,博士生導師,主要從事動物生殖生理與疾病研究。
Q78
A
1000-7091(2016)06-0094-06
10.7668/hbnxb.2016.06.015

