GFP標記的馬鈴薯大麗輪枝菌生物學特性研究
王 凱,東保住,張 貴,張 鍵,張園園,周洪友,趙 君
(內蒙古農業大學 農學院,內蒙古 呼和浩特 010018)
GFP標記的馬鈴薯大麗輪枝菌生物學特性研究
王 凱,東保住,張 貴,張 鍵,張園園,周洪友,趙 君
(內蒙古農業大學 農學院,內蒙古 呼和浩特 010018)
為了研究馬鈴薯黃萎病菌的侵染機制,將綠色熒光蛋白基因(GFP)通過農桿菌介導的遺傳轉化方法轉入馬鈴薯黃萎病菌VD012中,經過潮霉素選擇性培養基的篩選和分子鑒定,獲得了47株有綠色熒光信號的陽性轉化子。隨機挑取8株陽性轉化子,以野生型菌株為對照,對轉化子的菌落形態、菌絲的生長速率、產孢量、粗毒素含量和致病力進行了研究。結果表明,8株陽性轉化子中有3株微菌核產生的數量明顯高于野生型,1株轉化子微菌核產生量低于野生型菌株;各陽性轉化子的生長速率和野生型菌株差異不顯著;陽性轉化子的產孢量與對照相比,有2株差異不顯著。其余均有不同程度的降低。保濕培養8 h,所有陽性轉化子的平均萌發率低于野生型菌株。相比對照,粗毒素的含量表現為升高趨勢的轉化子有7株,1株表現為下降趨勢。致病力測定的結果表明,致病力增強的轉化子有1株,2株轉化子的致病力呈現降低的趨勢。
馬鈴薯黃萎病;大麗輪枝菌;GFP標記轉化子;生物學特性
馬鈴薯黃萎病是嚴重影響馬鈴薯產量和品質的一種土傳維管束病害。自從1916年馬鈴薯黃萎病在美國明尼蘇達州首次發現后,在美國愛達荷州76%的馬鈴薯地塊都發生了不同程度的黃萎病,導致馬鈴薯大量減產[1]。我國在1944年由戴倫焰[2]首次報道馬鈴薯黃萎病在四川發生;隨后,河北、貴州、新疆地區的馬鈴薯地塊中也相繼發現了馬鈴薯黃萎病。輕者單位面積產量損失20%~30%,重者能達到50%以上[3]。目前的研究結果顯示,引起該病的病原菌主要有大麗輪枝菌(Verticilliumdahliae)和黑白輪枝菌(Verticilliumalboatrum)。在發病初期,微菌核在地下萌發成菌絲體侵染寄主根部,進入寄主維管組織,下部葉片表現變褐干枯癥狀,但不卷曲,不脫落,隨著植物的蒸騰作用向上擴展,最終導致全株萎蔫的癥狀[4-5]。
根癌農桿菌(Agrobacteriumtumefaciens) 介導的轉化是目前研究最多、技術方法最成熟的一種遺傳轉化技術。首次用根癌農桿菌介導的是1995 年Bundock等[6]對酵母菌實現遺傳轉化,到目前為止已經有100多種真菌獲得了成功轉化的例子。利用農桿菌介導的大麗輪枝菌遺傳轉化已有報道,如趙鳳軒[5]、Zhao等[7]把GFP標記轉入棉花和擬南芥的大麗輪枝菌中,對病原菌侵染過程進行了觀察。國外已有對從萵苣[8]、菠菜[9]等分離出的大麗輪枝菌進行了熒光標記并開展不同侵染階段的研究報道。
本試驗利用根癌農桿菌介導對馬鈴薯黃萎病株分離到的大麗輪枝菌分生孢子進行遺傳轉化,通過抗性標記的篩選以及PCR鑒定,獲得47株穩定表達綠色熒光的馬鈴薯大麗輪枝菌轉化子。以野生型菌株為對照,選出8株陽性轉化子,研究這些菌株的生物學特性以及致病力。這一研究結果將為后續進一步研究大麗輪枝菌侵染馬鈴薯的過程以及確定馬鈴薯種子或者塊莖帶菌傳播奠定了理論基礎。
1 材料和方法
1.1 試驗材料
供試馬鈴薯品種:將內蒙古農業大學植物病理實驗室保存的馬鈴薯品種云薯301的塊莖播種于滅菌的營養土基質中,待長出4~6片葉片時用于接菌鑒定。
供試菌株和質粒:采自內蒙古武川縣的馬鈴薯大麗輪枝孢菌株VD012由內蒙古農業大學植病教研室周洪友教授提供。根癌農桿菌LBA4404由本實驗室保存;pCH-sGFP質粒由江蘇省農業科學院張保龍教授惠贈。質粒的報告基因為潮霉素抗性標記和綠色熒光蛋白GFP。質粒以凍融法轉入LBA4404中備用。
1.2 農桿菌介導遺傳轉化
大麗輪枝菌的遺傳轉化步驟參照Dobinson等[10]的方法。
1.3 馬鈴薯大麗輪枝菌陽性轉化子的分子鑒定
用無菌水對野生型及轉化子菌株分生孢子進行梯度稀釋,均勻涂布在含有 50 mg/mL 潮霉素的 PDA 平板上,培養 4~5 d后,挑取單菌落獲得純培養。采用CTAB法提取野生型及陽性轉化子菌株DNA。用gfp引物(GFP-F:GACGTAAACGGCCAC AAGTT,GFP-R:GAACTCCAGCAGGACCATGT)以原始質粒和野生型菌株的DNA分別作為正對照和負對照進行PCR擴增和凝膠電泳鑒定。PCR采用25 μL反應體系,反應條件為:預變性94 ℃ 5 min;變性94 ℃ 40 s,退火58 ℃ 40 s,延伸72 ℃ 40 s,35個循環;72 ℃ 延伸10 min。將鑒定為陽性轉化子的菌絲體和分生孢子,在熒光顯微鏡下觀察GFP綠色熒光信號,并拍照記錄。
1.4 菌落形態觀察和生長速度的測定
將表達有GFP的陽性轉化子以及野生型菌株VD012菌株接種于 PDA 培養基上,在 25 ℃培養14 d后用直徑約為8 mm打孔器在菌落邊緣打取菌餅至新的PDA 培養基中,用十字交叉法測量培養5,10,20 d的菌落直徑。同時觀察野生型和轉化子的菌落形態,拍照記錄,每個菌株設3個重復[11]。
1.5 產孢量和萌發率的測定
菌株培養15 d后,用20 mL無菌水沖洗,并用血球計數板計算分生孢子數目。用瓊膠玻片法測定孢子萌發率,將分生孢子液濃度稀釋為 30~40 個孢子/視野,涂布在水瓊脂玻片上,分別記錄在8,16,24 h 3個時間點100個分生孢子萌發情況,每個菌株重復3次[12]。
1.6 粗毒素含量和致病力測定
參照甘莉等[13]方法測定粗毒素的分泌量。毒素粗濾液采用紫外分光光度法測定OD280值,以牛血清蛋白(BSA)作標準曲線獲得的曲線方程估測樣品粗毒素的含量(單位是mg/mL)。
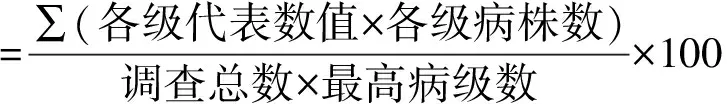
表1 黃萎病的病情分級標準Tab.1 The criteria of potato yellow wilt disease index
2 結果與分析
2.1 陽性轉化子的篩選
將在潮霉素培養基上篩選到的47個轉化子轉接到新的PDA培養基上,依次命名為Vdgfp1~Vdgfp47(圖1)。2.2 大麗輪枝菌轉化子的分子鑒定及GFP熒光觀察
經潮霉素篩選后,隨機選取8株轉化子,在無潮霉素抗性選擇壓力下連續培養5代,轉接后都能在含潮霉素抗性的培養基正常生長,重新命名為G1~G8,確定是穩定的陽性轉化子[16]。gfp引物分子鑒定的結果表明,轉化子經PCR擴增后都獲得與正對照條帶大小一致的片段,而野生型菌株即負對照未見條帶出現(圖2-A)。8個陽性轉化子熒光觀察結果見圖2-B。菌絲體、分生孢子梗和分生孢子均可以觀察到GFP熒光,表明gfp基因已經整合到了大麗輪枝菌的基因組中并能夠正常表達。
圖1 潮霉素培養基篩選轉化子Fig.1 The screening of transformants on the selection medium contained,hygromycin B 50 μg/mL

A.馬鈴薯大麗輪枝菌轉化子的PCR鑒定:M.D2000;+.正對照PCH-sGFP質粒;-.野生型菌株;G1~G8.轉化子;B.表達GFP的陽性轉化子的菌絲體和分生孢子。A.PCR identification the transformants of Verticillium dahliae:M.D2000;+.Positive control plasmid pCH-sGFP;-.Wild type;G1-G8.Transformants;B.The GFP labeled hyphae and conidia of positive transformant.
2.3 大麗輪枝菌轉化子的菌落形態和生長速度
培養20 d后,所有供試的轉化子與野生型一樣不僅能夠產生白色氣生菌絲,而且在培養基中形成微菌核。轉化子G6、G7和G8微菌核產生量高于野生型;轉化子G2微菌核少于對照。而轉化子G1、G3、G4和G5微菌核形成數量和野生型大致相同(圖3)。
從培養5,10,20 d的菌落直徑大小可以看出,各轉化子的菌落直徑與野生型差異不明顯(圖4)。表明gfp基因的插入對大麗輪枝菌的生長速度影響較小。

圖3 野生型菌株與馬鈴薯大麗輪枝菌陽性轉化子菌落形態Fig.3 The colony morphology of wild type and Verticillium dahliae positive transformants

圖4 野生型菌株與馬鈴薯大麗輪枝菌陽性轉化子菌落直徑的測定Fig.4 The colony diameter of wild type and Verticillium dahliae positive transformants
2.4 大麗輪枝菌轉化子的產孢量和萌發率的測定
結果如圖5所示,除了G3和G5轉化子的產孢量和野生菌株(3.83×108個/mL)沒有顯著差異外,其余的6個轉化子產孢量均顯著降低,其中轉化子G1和G2的產孢量較低,分別為1.21×108,1.08×108個/mL。

圖中數據為平均數±標準誤;在P<0.05水平差異顯著性用不同字母標出。圖6-8同。Data in the figure represents the mean±SD;The significant difference at P<0.05 level was indicated with different letters.The same as Fig.6-8.
所有分生孢子在培養8 h后均開始萌發,萌發率都低于野生型,但以轉化子G7和G8分生孢子萌發率較低,分別為22%和21%,顯著低于野生型菌株的萌發率52%。培養16 h后,轉化子G7的萌發率為最低68%,顯著低于野生型菌株萌發率82%;而轉化子G1和G2的孢子萌發率分別為96%和94%,顯著高于野生型菌株。培養24 h后各菌株萌發率都達到100%,無顯著差異(圖6)。
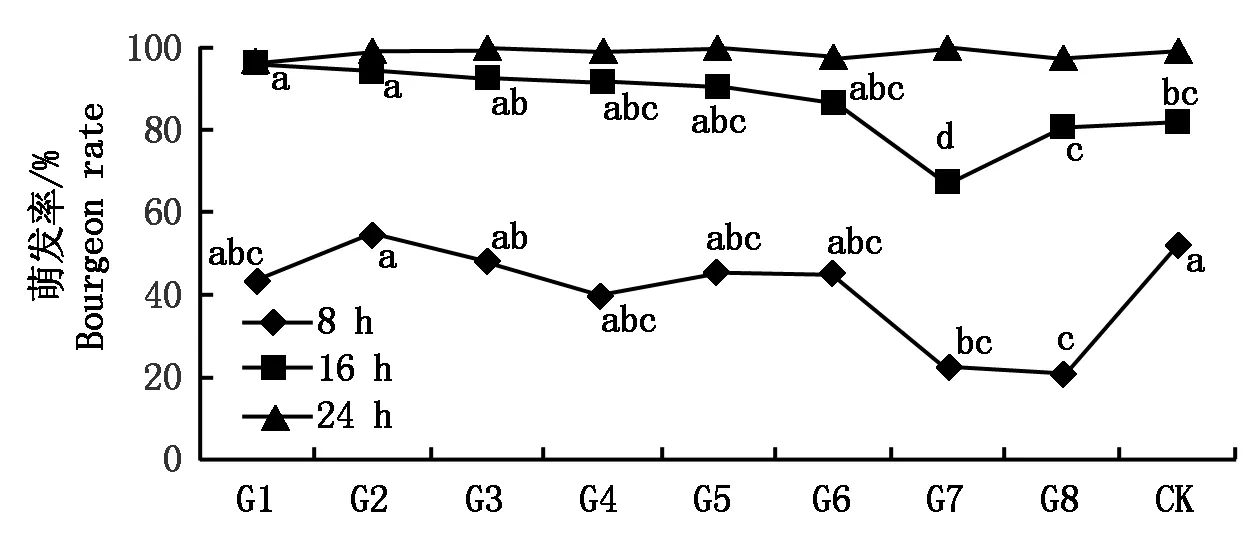
圖6 野生型菌株與馬鈴薯大麗輪枝菌陽性轉化子萌發率的測定Fig.6 The comparation of spores germination rate between wild type and Verticillium dahliae positive transformants
2.5 大麗輪枝菌陽性轉化子粗毒素含量和致病力的測定
由圖7所示,轉化子G1、G7和G8的粗毒素蛋白濃度顯著高于野生型(0.131 mg/mL),分別為0.186,0.258,0.255 mg/mL;而轉化子G6的粗毒素含量顯著低于野生型菌株,其蛋白濃度僅為0.072
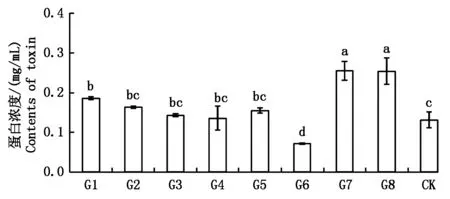
圖7 野生型菌株和馬鈴薯大麗輪枝菌陽性轉化子粗毒素分泌量的測定Fig.7 The comparation of crude toxin between wild type and Verticillium dahliae positive transformants
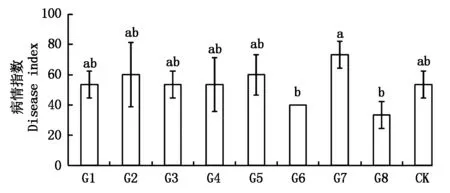
圖8 野生型菌株和馬鈴薯大麗輪枝菌陽性轉化子致病力比較Fig.8 The comparison of the wilting capability between wild type and Verticillium dahliae positive transformants
mg/mL;轉化子G2、G3、G4和G5的粗毒素含量略高于野生型菌株,但均未達到顯著水平。
各菌株的致病力測定結果見圖8。其中接種轉化子G7孢子液的馬鈴薯植株病情指數為73.33,高于野生型的病情指數(53.33);而轉化子G6和G8侵染馬鈴薯后的病情指數(40.00,33.33)低于野生型菌株。部分馬鈴薯發病癥狀見圖9。

圖9 大麗輪枝菌接種馬鈴薯后的癥狀Fig.9 The symptom of potato after inoculated with Verticillium dahliae
3 討論
GFP 熒光標記可以實時觀察病原菌與寄主植物的互作,結合其他研究手段可以對病原菌的侵染過程和致病機理作出全方位的、立體的分析和判斷[17]。以ATMT轉化法獲得的8個陽性轉化子為本試驗研究對象,對其菌落形態、產孢量、分生孢子萌發率、粗毒素產量以及致病力與野生型菌株進行了對比。結果表明,1個轉化子(G2)的微菌核形成低于野生型菌株,3個轉化子(G6、G7和G8)的生成量高于野生型菌株,各菌株表型沒有差異,原因可能是由于質粒DNA整合到與微菌核形成有關的某個基因位點中,對微菌核的形成有影響。這一結果和Klimes 等[18]的研究類似,即T-DNA的插入使調控微菌核產量有關的基因大量表達,從而影響微菌核的形成。在產孢量方面,轉化子G3和G5與野生型沒有顯著差異,其余轉化子的產孢量均顯著低于野生型菌株(3.83×108個/mL);而不同轉化子分生孢子的萌發率由于外源基因的插入也受到了不同程度影響,這一結果也說明外源gfp整合到大麗輪枝菌基因組中,能夠不同程度地影響分生孢子的形成和萌發。這與徐榮旗等[19]的研究結果即轉化子的生長速度、產孢量隨著插入位點的不同而變化結果相吻合。轉化子粗毒素含量測定的結果表明,G7和G8轉化子的粗毒素含量顯著高于野生型菌株,而G6轉化子產毒能力最弱。采用蘸根法對馬鈴薯幼苗進行人工接種,結果表明轉化子G6和G7在接種49 d后馬鈴薯的病情指數分別低于或者高于對照,說明外源gfp基因在大麗輪枝菌基因組中整合對其致病力會產生影響[20]。
此外,47 個陽性轉化子均能發出綠色熒光,但其信號強度不均一,這可能是由外源基因在大麗輪枝菌基因組上的插入拷貝數不同引起。其GFP熒光信號主要集中在細胞質區域,而液泡部分信號較弱,這種現象與Freitag等[21]研究結果相同。而趙鳳軒[5]的研究結果即通常幼齡菌絲具有強的熒光信號,老齡菌絲的信號強度變弱的現象在本試驗中沒有發現。今后還需在菌絲生長不同階段觀察熒光信號從而確定GFP熒光信號的強度是否與菌齡有一定相關性。本試驗過程中還發現,將gfp通過農桿菌轉入馬鈴薯大麗輪枝菌中后,與野生型相比較一些陽性轉化子的生物學特性和致病力在外源基因整合后沒有發生顯著變化,獲得了菌落形態、致病性和野生型大致相同的轉化子。因此,未來馬鈴薯黃萎病侵染過程的研究,應該首先選用的是生物學特性和致病力與野生型菌株沒有顯著差異的,表達有GFP熒光的轉化子來觀察大麗輪枝菌侵染馬鈴薯的過程以及馬鈴薯種子和塊莖帶菌的可能性。
[1] Davis J R,Pavek J J,Corsini D L,et al.Influence of continuous cropping of several potato clones on the epidemiology ofVerticillumwilt of potato[J].Phytopathology,1994,84(2):207-214.
[2] 戴倫焰.嘉定作物病害之調查[J].武漢大學理科季刊,1944,8(2):1-5.
[3] 張成禮.馬鈴著黃萎病的發生與防治[J].植物醫生,2004,17(5):6.
[4] 肖紅利,孔志強,包郁明,等.大麗輪枝菌侵染抗感棉種的組織學過程觀察[J].植物病理學報, 2014,44(3): 287-294.
[5] 趙鳳軒.綠色熒光蛋白標記的大麗輪枝菌的獲得及其在棉花中侵染過程研究[D].北京:中國農業科學院,2010.
[6] Bundock P,den Dulk-Ras A,Beijersbergen A,et al.Trans-kingdom T-DNA transfer fromAgrobacteriumtumefacienstoSaccharomycescerevisiae[J].EMBO J,1995,14(13):3206-3214.
[7] Zhao P,Zhao Y L,Jin Y,et al.Colonization process ofArabidopsisthalianaroots by a green fluorescent protein-tagged isolate ofVerticilliumdahliae[J].Protein Cell,2014,5(2):94-98.
[8] Vallad G E,Subbarao K V.Colonization of resistant and susceptible lettuce cultivars by a green fluorescent protein-tagged isolate ofVerticilliumdahliae[J].Phytopathology,2008,98(8):871-885.
[9] Maruthachalam K,Klosterman S J,Anchieta A,et al.Colonization of spinach byVertcilliumdahliaeand effects of pathogen localization on the efficacy of seed treatments[J].Phytopatholigy,2013,103(3):268-280.
[10] Dobinson K F,Grant S J,Kang S.Cloing and targeted disruption,viaAgrobacteriumtumefaciens-mediated transformation,of a trypsin protease gene from the vascular wilt fungusVerticilliumclahliae[J].Current Genetics,2004,45(2):104-110.
[11] 王麗麗, 李 芳, 日孜旺古麗, 等. 馬鈴薯黃萎病菌生物學特性及室內藥劑篩選[J]. 新疆農業大學學報, 2014, 37(3):218-222.
[12] 付劍樺,郭慶元,穆 磊. 向日葵黃萎病菌生物學特性及致病性研究[J]. 新疆農業科學, 2012, 49 (8): 1440-1448.
[13] 甘 莉,呂金殿.棉花黃萎病菌毒素的分離提純及致萎活性測定[J].西北農業大學學報,1991,19(1):49-54.
[14] Njoroge S M C,Vallad G E,Park S Y, et al. Phenological and Phytochemical Changes Correlate with DifferentialInteractions ofVerticilliumdahliaewith Broccoli and Cauliflower[J]. PHYTOPATHOLOGY, 2011, 5(101): 523-534.
[15] Zhang Wenwei ,Jiang Tengfei ,Cui Xiao, et al. Colonization in cotton plants by a green fluorescent protein labelled strain ofVerticilliumdahliae[J]. Eur J Plant Pathol, 2013, 135(3): 867-876.
[16] 徐 明,桂月晶,祁偉彥,等.綠色熒光蛋白基因標記棉花黃萎病菌[J].植物保護,2013,39(5):128-133.
[17] 鄧 晟,王彩月,張 昕,等.大麗輪枝菌的綠色熒光蛋白標記[J].江蘇農業學報,2012,28(5):1197-1199.
[18] Klimes A,Amyotte S G,Grant S,et al.Microsclerotia development inVerticilliumdahliae:Regulation and differential expression of the hydropHobin gene VDH1[J].Fungal Genetics and Biology,2008,45(12):1525-1532.
[19] 徐榮旗,汪佳妮,陳捷胤,等.棉花黃萎病菌 T-DNA 插入突變體表型特征和側翼序列分析[J].中國農業科學,2010,43(3):489-496.
[20] 王曉楠,齊 宏,張金鳳,等.熒光標記基因轉化棉花黃萎病菌及標記菌系選育[J].棉花學報,2014,26(3):221-227.
[21] Freitag M,Selker E U.Expression and visualization of Green Fluorescent Protein(GFP) inNeurosporacrassa[J].Fungal Genetics Newsletter,2005,52(1):14-17.
The Study on Biological Characteristics of GFP Labeled Potato Verticillium dahliae
WANG Kai,DONG Baozhu,ZHANG Gui,ZHANG Jian,ZHANG Yuanyuan,ZHOU Hongyou,ZHAO Jun
(Agricultural College,Inner Mongolia Agricultural University,Huhhot 010018,China)
In order to unravel the infection mechanism ofV.dahliaeto potato,a binary construct containedGFPgene was transferred viaAgrobacteriumtumefaciens-mediated system intoV.dahliaeisolate VD012.47 positive transformants were obtained by hygromycin B selection and molecular verification.Eight tansformants were randomly selected to characterize the colony morphology,growth rate,conidia production,toxin production and pathogenicity.The results showed that three transformants could produce more microsclerotia compared with the wild type strain;whereas,one transforment produced less microsclerotia.The significant difference on the growth rate of eight transformants. The conidia production ability of the transformants were decreased to certain degree.except two among them were not remarkable overall.The average germination rate of all the tested transformants was lower than that of the wild strain after 8 h germination.Regarding to the toxin production,seven transformants showed increased tendency,while only one decreased compared with the wild type.The pathogencity results showed that,compared with wild strain,only one transformant showed increased tendency,the left two strains showed decreased pattern.
Potato wilt;Verticilliumdahliae;GFP labelled transformants;Biological characteristics
2016-04-28
公益性行業(農業)科研專項經費資助(201503109)
王 凱(1989-),男,遼寧遼陽人,在讀碩士,主要從事分子植物病理研究。
趙 君(1969-),女,內蒙古呼和浩特人,教授,博士,博士生導師,主要從事分子植物病理研究。
S435.32
A
1000-7091(2016)06-0088-06
10.7668/hbnxb.2016.06.014

