極大螺旋藻高光合速率藻種的紫外誘變篩選
楊生輝,祖廷勛,羅光宏,*,王丹霞,陳天仁,高自成
極大螺旋藻高光合速率藻種的紫外誘變篩選
楊生輝1,祖廷勛1,羅光宏1,*,王丹霞1,陳天仁1,高自成2
(1.河西學院凱源生物中心,甘肅省微藻工程技術研究中心,甘肅省河西走廊特色資源利用重點實驗室,甘肅 張掖 734000;2.張掖市生產力促進中心,甘肅 張掖 734000)
目的:篩選高光合速率極大螺旋藻藻種。方法:結合自然分離篩選、超聲處理、紫外誘變和高CO2條件脅迫等方法進行誘變篩選。結果:得到3 株極大螺旋藻突變株KYZ1、KYZ2、KYZ3,通過藻絲形態、生長量、CO2利用率、蛋白質含量、葉綠素含量等因素對比,并采用綜合評分法,篩選出1株優質藻株KYZ2。結論:與出發藻株相比具有藻絲長度均明顯變長、藻絲個體大、生長速度快、光合速率高、蛋白質和葉綠素含量高等優點,是一株具有工業養殖潛力的藻株。
極大螺旋藻;紫外誘變;突變藻株
螺旋藻(Spirulina)是一種螺旋狀、不分枝的多細胞絲狀微藻(Microalga),藻體長200~500 μm,寬5~10 μm,系藍藻門(Cyanophyta)、段殖體目(Hormogonales)、顫藻科(Oscilatoriaceae)、螺旋藻屬(Spirulina)的古老低等原核生物[1]。它含有豐富蛋白質、不飽和脂肪酸和各種維生素等多種營養成分,具有極高的營養保健價值。同時螺旋藻中還含有多種生物活性物質,具有增強機體免疫功能、防治癌癥、降低血脂、減肥等多種臨床功效[2-4]。
20世紀90年代初以來,螺旋藻已成為全球范圍內產業開發最為成功的微藻[5]。目前螺旋藻的產業化培養中應用的碳源主要是NaHCO3,張峰等[6]的研究表明:CO2替代NaHCO3,不僅使碳源成本減少58%、產量提高20%,還可使鉛、砷、汞等重金屬元素含量遠遠低于利用NaHCO3作碳源生產的螺旋藻的重金屬含量。對于生產而言,優良的螺旋藻藻種是關鍵。目前螺旋藻的誘變育種主要集中于耐低溫、富含某種功能成分等方面,尚鮮見對高光合速率螺旋藻藻種進行誘變育種的報道。本研究采用超聲處理極大螺旋藻,制備單細胞懸液,用紫外線對該單細胞體進行誘變,并利用高濃度CO2進行脅迫處理,篩選獲得優良的高光合速率極大螺旋藻藻種。
1 材料與方法
1.1 材料與培養基
極大螺旋藻(Spirulina maxima Setch. et Gardn)藻種:KY1,本實驗室保存。
液體培養基為本實驗室改進型的Zarrouk培養基。實驗培養基為改進型的Zarrouk培養基配方中不添加NaHCO3,其他成分不變。因pH 9.0~10.0是螺旋藻最適生長pH值,而pH值低于9.3會影響CO2的吸收速率[7],因此用NaOH調節pH值為9.5。
1.2 儀器與設備
SY-200型超聲處理器 上海寧商超聲儀器有限公司;DR6000紫外-可見分光光度計 美國哈希公司;SP-1500型噴霧干燥機 上海順義實驗設備有限公司。
1.3 方法
1.3.1 藻絲單絲篩選擴大培養
培養7 d螺旋藻培養液,用培養基稀釋50 倍,在40 倍體式顯微鏡下用挑針挑取健壯、長度較長、形態規則的單株藻絲,放入含適量培養基的試管中培養30 d,培養條件:光照3 000 lx、溫度25~27 ℃、光暗周期14∶10;再加入少量新鮮培養基,繼續培養15 d。轉入250 mL三角瓶加入50 mL新鮮培養基培養7 d,再加入50 mL新鮮培養基繼續培養7 d,培養條件:光照8 000 lx、溫度30~32 ℃、光暗周期14∶10。篩選出生長速度較快的1 株作紫外誘變的出發藻株。前期為單絲培養,強光容易造成藻體灼傷死亡,選擇弱光和中溫,有利于生長繁殖;后期藻絲體數量增加,相互間有光遮蔽效應,選擇較高的光強和溫度,更有利于生長。
1.3.2 CO2脅迫預實驗
培養好的藻液過濾,藻體用實驗培養基清洗,接入1 000 mL三角瓶,加入500 mL實驗培養基,用橡皮塞密封,于光照8 000 lx、溫度30~32℃、光暗周期14∶10的條件下培養10 d。分別通入含0.25%、0.5%、0.75%、1% CO2的空氣(質量分數),通氣頻率2 s/min(光周期),流量為0.2~0.25 L/min,設置3 個平行,根據藻體對CO2的利用率,確定實驗通入空氣的CO2含量。
1.3.3 單細胞液制備
取生長期6~7 d的極大螺旋藻培養液5 mL,在冰浴條件下,利用20 kHz、200 W的超聲細胞破碎儀處理藻體,使藻絲體斷裂。超聲處理1、2、4、8、10 s,顯微鏡觀察處理效果。使藻絲體斷裂成1~3 個細胞長度的藻絲段為最佳。
1.3.4 紫外誘變
取超聲處理最好的一組,用培養基調節螺旋藻細胞密度為106~107CFU/mL,將8 mL單細胞懸液置于無菌直徑10 mm培養皿中,厚度約1 mm,用紫外燈進行遠紫外線輻照,照射時間分別為0、30、60、90、120、150 s,紫外燈功率為20 W,樣品與紫外燈的距離為20 cm。
1.3.5 突變藻株篩選
將紫外輻照后的藻懸液在暗處靜置24 h,加入10 倍體積實驗培養基,移入250 mL三角瓶,用橡皮塞密封,根據預實驗結果通入含1% CO2的空氣,通氣頻率2 s/min(光周期),流量為0.2~0.25 L/min,于光照8 000 lx、溫度30~32 ℃、光暗周期14∶10的條件下培養,隔日顯微鏡觀察一次;挑選形態和長度恢復較快的單株藻絲段于試管中加適量實驗培養基,并通入預實驗確定的含CO2的空氣,通氣頻率2 s/h(光周期),流量為0.1~0.15 L/min,于光照3 000 lx、溫度25~27 ℃、光暗周期14∶10的條件下培養。在此條件下進行反復篩選,根據生長期內平均生長速率挑選高光合速率的突變藻株。
1.3.6 突變藻株培養
篩選出的藻株,移入1 000 mL三角瓶,加入500 mL實驗培養基,用橡皮塞密封,根據預實驗結果通入含CO2的空氣,通氣頻率2 s/min(光周期),流量為0.2~0.25 L/min,于光照8 000 lx、溫度30~32℃、光暗周期14∶10的條件下培養10 d。同時以出發藻株做對比實驗。
1.3.7 CO2用量計算
CO2用量/g=通氣頻率×流量×通氣時間×通入空氣中CO2含量×1.977 (1)
式中:1.977為CO2密度/(g/L)。
1.3.8 指標測定
1.3.8.1 形態特征觀測
鏡檢觀察測定突變株藻體長、螺旋寬、螺距、藻絲寬、螺旋數,每個參數測定50 條藻絲。
1.3.8.2 生長量的測定
取突變藻株培養液3 mL,紫外-可見分光光度計測定560 nm波長處吸光度(A560nm)。
1.3.8.3 CO2利用率的測定
根據李夜光等[8]測定螺旋藻對CO2利用率測定的方法,按公式(2)計算CO2的利用率。

式中:C為CO2的利用率/%;B為干藻量/g;Qg為CO2用量/g;0.47為螺旋藻含碳量系數;0.27為CO2含碳量系數。
1.3.8.4 蛋白質含量的測定
參照GB 5009.5—2010《食品中蛋白質的測定》第一法。
1.3.8.5 葉綠素含量的測定
將突變藻株和出發藻株用帶蓋的5 L廣口瓶(裝液量4 L),按1.3.6節條件培養10 d,用300 目尼龍網過濾清洗采收,利用SP-1500型實驗噴霧干燥機干燥成粉,干燥條件:進風溫度150 ℃、出風溫度60 ℃。稱取3.0 g螺旋藻粉,在45 ℃避光條件下烘干1.5 h, 然后置干燥器中冷卻至室溫,精確稱取0.050 g藻粉樣品于50 mL的具塞玻璃刻度試管中,加入20 mL浸提液(85%丙酮-95%乙醇體積比1∶1),34 ℃恒溫避光浸提6 h,每隔2 h攪動3~5 min,靜置后沉淀30 min,浸出浸提液于25 mL的棕色容量瓶中,用浸提液定容于刻度線,并記錄定容液的體積(mL)。以浸提液作空白,用帶塞的1 cm的玻璃比色皿在652 nm波長處測定吸光度(A652nm),根據公式(3)、(4)計算葉綠素含量。

式中:C為測定液中葉綠素含量/(mg/L);V為色素提取丙酮和乙醇混合液的體積/mL;N為測定葉綠素時稀釋倍數;M為樣品的質量/g。
1.3.8.6 綜合評價
參照胡海燕等[9]的綜合評價方法,以螺旋藻的蛋白質含量和生長速率為評價指標,權重系數分別設為0.6和0.4,按公式(5)進行評分,對突變藻株進行綜合評價。
1.3.8.7 突變藻株的傳代穩定性分析
將確定的優良突變藻株接入新鮮實驗培養基,按1.3.6節方法連續培養10代,對第10代藻株用1.3.8.1節方法觀測形態特征、用1.3.8.2節方法測定其生長量、用1.3.8.4節方法測定其蛋白質含量、用1.3.8.5節方法測定葉綠素含量,與第1代突變藻株比較。
1.4 數據處理
數據采用Excel結合SPSS軟件進行處理。
2 結果與分析
2.1 CO2脅迫預實驗結果
出發藻株按1.3.2節方法培養,通入空氣中CO2含量不同,采收的干藻量和CO2利用率不同,結果見表1。

表1 出發藻株CO2脅迫預實驗結果Table1 Biomass and CO2 utilization rate of the parental strain under extremely highh CO2 conditiioonnss
由表1可知,通入空氣中的CO2含量為0.25%時,CO2利用率最高,但收獲的干藻量較少,可能是CO2含量較少,不能滿足藻體光合作用需要導致;隨著空氣中CO2的含量升高,收獲的干藻量逐漸增加,但CO2的利用率降低;當空氣中CO2的含量達到0.75%時,收獲的干藻量和CO2的利用率均降低,可能是極大螺旋藻對高濃度CO2的培養環境不適應造成的,為了得到在高CO2質量分數條件下高光合速率的突變藻株,選擇實驗CO2質量分數為1%。
2.2 超聲處理對藻細胞的影響
采用超聲處理使螺旋藻藻絲體破碎成1~3 個細胞的藻絲段,通過鏡檢不同處理時間的藻液發現,以超聲處理8 s效果最好,僅有少量細胞破碎;而超聲處理時間過短,螺旋藻絲狀體僅斷裂成稍短的藻絲段;處理時間過長,螺旋藻細胞則完全破碎。因此超聲處理時間為8 s。
2.3 突變藻株形態特征
突變藻株經多次篩選和傳代培養,獲得了3株生長速度較快藻株,編號為KYZ1、KYZ2、KYZ3。按1.3.8.1節方法鏡檢觀察,發現藻絲形態發生變異:藻絲長度變化明顯、藻絲寬度和螺旋數量增加,測定結果見表2。而較大形體使螺旋藻藻絲體更易被過濾采收,因此藻絲體變長是理想特征之一。

表2 出發藻種和突變藻種主要形態特征比較Table2 Comparison of the main morphological characteristics between the parental strain and the mutants
2.4 突變藻株與出發藻株生長速度比較
突變藻株與出發藻株相比,不但形態有明顯差異,生長速度也發生了明細變化,用實驗培養基,通入含1% CO2的空氣,按1.3.6節方法培養10 d,用1.3.8.2節方法每2 d測定A560nm,結果見圖1。
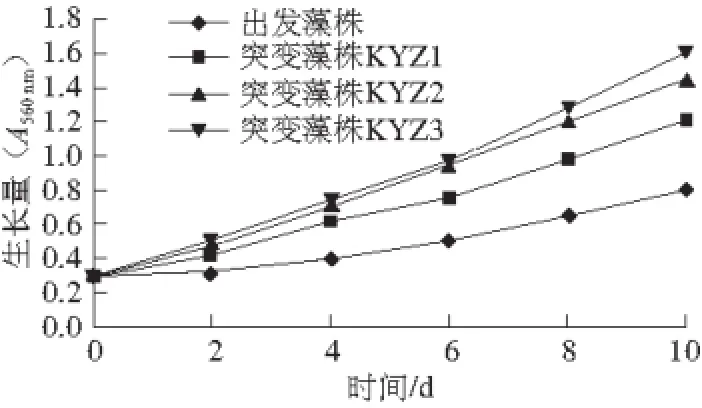
圖1 出發藻株和突變藻株在實驗培養基條件下的生長曲線Fig. 1 Growth curves of the parental strain and the mutants in the culture medium used in this experiment
3 株突變藻株生長速度明顯快于出發藻株,KYZ3生長速度最快,KYZ1和KYZ2生長速度接近,生長高峰出現在6 d以后。
出發藻株用普通培養基,在光照8 000 lx、溫度30~32 ℃、光暗周期14∶10的條件下培養,其生長速度高于實驗培養基條件,對比結果見圖2。

圖2 出發藻株在普通培養和實驗培養基條件下生長曲線對比Fig. 2 Comparison of the growth curves of the parental strain in a common culture medium and in the culture medium used in this investigation
圖1 、2表明,3 株突變藻株在高質量分數CO2條件下生長較快,出發藻株則對高質量分數CO2條件不適應,生長較慢。2.5 突變藻株與出發藻株CO2利用率比較
將突變藻株和出發藻株按1.3.6節方法培養至10 d采收烘干,根據采收的干藻量和CO2用量,用1.3.8.3節中公式計算CO2利用率,結果見表3。

表3 突變藻株與出發藻株CO利用率比較Table3 Comparison of the CO2availability between the mutants and the parental strain
由表3可知,所有突變藻株中CO2利用率比出發藻株平均高52%左右,其中最高的是KYZ3,比出發藻株高出56%。
2.6 突變藻株與出發藻株蛋白質含量和葉綠素含量比較
測定采收烘干的藻粉蛋白質和葉綠素含量,由表4可知,所有突變藻株中蛋白質含量比出發藻株平均高2.5%左右,其中最高的是KYZ2,比出發藻株高出13%,含量最低的KYZ3比出發藻株低6.5%;葉綠素含量出發藻株平均高13.3%左右,其中最高的是KYZ2,比出發藻株高出24.6%。

表4 突變藻株與出發藻株蛋白質含量和葉綠素含量比較Table4 Comparison of the contents of protein and chlorophyll between the mutants and the parental strain
出發藻株應用普通培養基,在光照8 000 lx、溫度30~32 ℃、光暗周期14∶10的條件下培養,烘干后的藻粉其蛋白質和葉綠素含量分別為61.2%、7.9 g/kg,高于實驗培養基條件。
2.7 綜合評價
綜合評分法是當評價指標無法用統一的量綱進行定量分析時使用的一種分析方法。評分時以各指標的最大值為參照將數據進行歸一化,再給每個指標一個權重,權重的大小根據各指標在總體中的貢獻比重給定[10]。對突變藻株進行綜合評分,結果見表5。

表5 突變藻株綜合評分情況Table5 Comprehensive evaluation of the mutants
由表5可以看出,突變藻株KYZ2的生長速率、蛋白質含量和綜合評分最高,分別為0.132 g/(L·d)、65.9%、98.3。因此,突變藻株KYZ2可以作為工業化培養的藻株。
2.8 優良突變藻株傳代穩定性分析

表6 突變藻株主要形態特征穩定性測試Table6 Stability of the main morphological characteristics of the mutant KKYYZZ22

圖3 突變藻株KYZ2第1代與第10代生長曲線比較Fig. 3 Comparison of the growth curves of the 1stgeneration and 10thgeneration of the mutant strain KYZ2
突變藻株的穩定性分析見表6和圖3。對優良突變藻株KYZ2經過10 代的傳代培養,藻體形態保持穩定,第1代和第10代生長曲線未發生明顯變化,蛋白質和葉綠素含量下降對比不顯著(表7),表明這是一株性狀穩定的突變藻株。

表7 突變藻株第1代與第10代蛋白質含量和葉綠素含量比較Table7 Comparison of the contents of protein and chlorophyll between thhee 11ssttgeneration and10tthhgeneration of the mutant strain KYZ2
3 討 論
螺旋藻生產中藻種混雜退化、生長慢、單位面積產量低、質量不穩定、采收困難等問題,已嚴重阻礙螺旋藻產業的發展[10]。目前國內外學者采用馴化、自然選擇、物理或化學誘變、基因工程等方法已篩選出一些新品系[11]。紫外線誘變是一種有效的育種方法[12],紫外誘變技術以其簡便快捷和效果顯著,備受誘變育種研究者的青睞[13]。陳新美等[14]用紫外線誘變鈍頂螺旋藻,結果表明,與出發藻株相比,藻絲長度均明顯變長,螺旋數超過40個,形體較大,易于采收;王妮等[15]通過紫外線誘變篩選出2株耐低溫鈍頂螺旋藻藻種;李建宏等[16]成功利用紫外誘變獲得優良穩定鈍頂螺旋藻突變藻株。
本研究通過超聲處理后,利用紫外誘變和高CO2條件脅迫,篩選出的3株極大螺旋藻藻株KYZ1、KYZ2、KYZ3,利用實驗培養基培養10 d后的藻細胞生長量(A560nm)平均比通過單細胞分離的出發藻株KY1高出約75.7%,CO2利用率高52%,這與陳明明等[17]的研究結果紫外誘變育種技術可以提高微藻的生長速率、耐受CO2濃度以及固定CO2效率及葉麗[18]的研究結果三角褐指藻經紫外輻射處理后生長速率提高相符;在這3 株藻中,KYZ3的生長速率提高的最多,但其蛋白質含量低于出發藻株,與劉曉娟[19]的研究結果采用紫外誘變的方法篩選微綠球藻突變藻株,蛋白質含量有所下降相符;KYZ2的蛋白質含量提高,與葉麗等[20]的研究結果紫外誘變的突變藻株與出發藻株相比可以提高綠藻蛋白質及梁譯之等[21]的研究結果利用單細胞分離技術和紫外誘變技術,篩選獲得海水小球藻和鹽生杜氏藻,胞內蛋白含量分別高于對照組18.2%和14.5%的結果相符。引起這些變化的原因尚需繼續研究。出發藻株在普通培養基下培養,其生長速度、蛋白質和葉綠素含量與在實驗培養基條件下差別顯著,說明出發藻株不適應高質量分數CO2條件、光合速率低,而3株突變藻株與出發藻株相比是適應高質量分數CO2條件、光合速率高的藻株。
適合固定高用量CO2的微藻,其最適宜生長的CO2用量約在10%~20%[22]。Yun等[23]在利用漸增CO2濃度法來提高小球藻對CO2的耐受性的研究中所獲得的最大CO2固定速率為0.936 g/(L·d);Sung等[24]分離出最大CO2固定速率達1.859 g/(L·d)的小球藻藻種KR-1;Kodama等[25]從海水中分離出最高可耐受60% CO2含量的海灘綠球藻(Chlorococcum littorale);黃云[26]釆用60Co-Y射線核誘變和高用量CO2梯度馴化的方法提高了蛋白核小球藻對高用量CO2的適應性,提高了誘變藻種的生物質產量和固碳效率,微藻的生物質產量提高了115%,達到2.41 g/L,對15%高用量CO2固定速率和效率分別達到1.538 g/(L·d)和32.7%;楊闖[27]通過紫外誘變選育的方法,篩選出耐受20% CO2的小球藻藻株。可以看出提高經濟微藻CO2的耐受性和固定速率還有很大的提升空間。夏建榮等[28]研究認為高用量CO2可減輕極大螺旋藻的光抑制,提高強光條件下其光合速率。因此在后續的工作中采取新的方法進行藻種選育,提高螺旋藻對CO2的耐受性、固定速率和光合速率是亟需解決的問題,也是螺旋藻藻種選育的方向。
4 結 論
本實驗通過比較出發藻株和突變藻株的主要生長性能和品質(藻絲形態、生長量、CO2利用率、蛋白質和葉綠素含量),并采用綜合評分法,從3 株突變藻株中篩選出1 株優質藻株KYZ2。此突變藻株主要具生長速度快、光合速率高、蛋白質和葉綠素含量高、藻絲個體大等優點,是一株具有工業化養殖潛力的藻株。
[1] CIFERRI O. Spirulina, the edible microorganism[J]. Microbiological Reviews, 1983, 47(4): 551-578.
[2] 王勇, 錢峰, 錢凱先, 等. 藻藍蛋白的抗癌活性研究[J]. 浙江大學學報(工學版), 2003, 35(6): 672-675. DOI:10.3785/j.issn.1008-973X.2001.06.018.
[3] HAYASHI K, HAYASHI T, MORITA N, et al. An extractfrom spirulina platensisis a selective inhibitor of herpes simplexvirus type 1 penetration into HeLa cells[J]. Phytotherapy Research, 1993, 7(1): 76-80. DOI:10.1002/ptr.2650070118.
[4] IM H M, LEE E H, CHO H H, et al. Inhibitory effect of mast cellmediated immediate type allergic reactions in rats by spirulina[J]. Biochem Pharmacol, 1998, 55(7): 1071-1076. DOI:10.1016/S0006-2952(97)00678-3.
[5] LI D M, QI Y Z. Spirulina industry in China: presentstatus and future prospects[J]. Applied Phycology, 1997, 9(1): 25-28. DOI:10.1023/ A:1007973823532.
[6] 張峰, 向文洲, 蕭邶, 等. 耦合二氧化碳減排的微藻產業化培養技術[J]. 微生物學報, 2012, 52(11): 1378-1384. DOI:10.13343/j.cnki. wsxb.2012.11.007.
[7] 李夜光, 胡鴻鈞. 螺旋藻培養液吸收CO2特性的研究[J]. 武漢植物學研究, 1996, 14(3): 253-260.
[8] 李夜光, 胡鴻鈞, 張良志, 等. 以CO2為碳源工業化生產螺旋藻工藝技術的研究[J]. 武漢植物學研究, 1996, 14(4): 349-356.
[9] 胡海燕, 張靜, 徐晶, 等. 螺旋藻培養液中碳、氮、磷的優化及其效應評價[J]. 食品科技, 2012, 37(1): 29-33. DOI:10.13684/j.cnki. spkj.2012.01.001.
[10] 吳曉娟, 鐘華, 劉海燕, 等. 螺旋藻優良藻株的選育[J]. 食品發酵與工業, 2013, 39(7): 104-108. DOI:10.13995/j.cnki.11-1802/ ts.2013.07.016.
[11] 王妮, 王素英, 師德強. 螺旋藻誘變育種研究進展[J]. 食品研究與開發, 2009, 30(2): 139-142. DOI:10.3969/j.issn.1005-6521.2009.02.041.
[12] 陳必鏈, 施巧琴. 螺旋藻藻種選育研究進展[J]. 食品與發酵工業, 2002, 26(3): 78-81. DOI:10.3321/j.issn:0253-990X.2000.03.016.
[13] 夏金蘭, 寧進軍, 陳程浩, 等. 耐高溫小球藻紫外誘變育種及其耐高溫性質研究[J]. 中南大學學報(自然科學版), 2013, 44(3): 867-873.
[14] 陳新美, 梅興國. 鈍頂螺旋藻藻種的紫外誘變初步篩選[J]. 生物技術, 2006, 16(2): 51-54. DOI:10.3969/j.issn.1004-311X.2006.02.021.
[15] 王妮, 王素英, 師德強. 耐低溫螺旋藻新品系的誘變選育[J].安徽農業科學, 2008, 36(29): 12552-12553. DOI:10.3969/ j.issn.0517-6611.2008.29.006.
[16] 李建宏, 鄭衛, 倪霞. 兩株鈍頂螺旋藻紫外誘變株的特征[J]. 水生生物學報, 2001, 25(5): 486-490. DOI:10.3321/j.issn:1000-3207.2001.05.009.
[17] 陳明明, 楊忠華, 吳高明, 等. 利用微藻技術減排CO2的研究[J].武漢科技大學學報, 2009, 32(4): 436-440. DOI:10.3969/ j.issn.1674-3644.2009.04.022.
[18] 葉麗. 3 種富 EPA 海洋微藻的誘變育種[D]. 寧波: 寧波大學, 2014: 12-23.
[19] 劉曉娟. 擬微綠球藻髙脂藻株的紫外、激光誘變育種研究[D].福州: 福建師范大學, 2014: 35-45.
[20] 葉麗, 蔣霞敏, 孫志鵬, 等. 紫外誘變對微綠球藻生長和營養成分的影響[J]. 生 物 學 雜 志, 2014, 31(1): 56-59. DOI:10.3969/ j.issn.2095-1736.2014.01.056.
[21] 梁譯之, 范禹辰, 高楊, 等. 利用紫外誘變技術獲得海水小球藻和鹽藻生長優勢株的研究[J]. 生物技術世界, 2012(9): 7.
[22] 楊啟鵬, 岳麗宏, 康阿青. 微藻固定高濃度CO2技術的研究進展[J]. 青島理工大學學報, 2009, 30(5): 69-74. DOI:10.3969/ j.issn.1673-4602.2009.05.014.
[23] YUN Y S, PARK J S, YANG J W. Enhance of CO2tolerance of Chloerlla vulgaris by gradual increase of CO2concentration[J]. Biotechnology Techniques, 1996, 10(9): 713-716. DOI:10.1007/ BF00168486.
[24] SUNG K D, LEE J S, SHIN C S, et al. Isolation of a new highly CO2[sup2]tolerant fresh water microalga Chlorella sp KR-1[J]. Renewable Enengy: An International Journal, 1999, 16(1): 1019. DOI:10.1016/S0960-1481(98)00362-0.
[25] KODAMA M, IKEMOTO H, MIAYCHI S. A new species of highly CO2-tolerant fast-growing marine microalga suitable for high-density culture[J]. Journal of Marine Biotechnology, 1993, 1(1): 21-25.
[26] 黃云. 微藻固定煙氣高濃度CO2的藻種改良和過程優化調控[D].杭州: 浙江大學, 2014: 47-70.
[27] 楊闖. 紫外線誘變選育耐高濃度CO2的微藻及不同株系的rbcL基因序列差異性分析[D]. 青島: 青島理工大學, 2010: 20-25.
[28] 夏建榮, 高坤山. 高濃度CO2條件下極大螺旋藻光抑制研究[J]. 水生生物學報, 2002, 26(1): 14-18. DOI:10.3321/j.issn:1000-3207.2002.01.003.
UV-Induced Mutagenesis and Screening of Spirulina maxima for High Photosynthetic Rate
YANG Shenghui1, ZU Tingxun1, LUO Guanghong1,*, WANG Danxia1, CHEN Tianren1, GAO Zicheng2
(1. Kai-yuan Biotechnology Center, Gansu Engineering Research Center for Microalgae, Key Laboratory of Hexi Corridor Resources Utilization of Gansu, Hexi University, Zhangye 734000, China; 2. Zhangye Productivity Promotion Center, Zhangye 734000, China)
Purpose: To screen a mutant strain of Spirulina maxima with high photosynthetic rate. Methods: The mutagenesis and screening were conducted by a combination of spontaneous isolation, ultrasonic treatment, UV irradiation and extremely high CO2stress. Results: Three mutants, namely KYZ1, KYZ2 and KYZ3, were obtained. The filament morphology, biomass, CO2availability, and protein and chlorophyll contents of these three mutants were compared. Finally, KYZ2 was screened as the best strain. Conclusions: Strain KYZ2 revealed longer and larger filaments, faster growth, higher photosynthetic rate, and higher contents of protein and chlorophyll compared with the starting strain. Thus, the mutant strain could have potential for industrial culture.
Spirulina maxima; UV irradiation; mutant strain
10.7506/spkx1002-6630-201702018
Q949.2
A
1002-6630(2017)02-0109-06
楊生輝, 祖廷勛, 羅光宏, 等. 極大螺旋藻高光合速率藻種的紫外誘變篩選[J]. 食品科學, 2017, 38(2): 109-114. DOI:10.7506/spkx1002-6630-201702018. http://www.spkx.net.cn
YANG Shenghui, ZU Tingxun, LUO Guanghong, et al. UV-induced mutagenesis and screening of Spirulina maxima for high photosynthetic rate[J]. Food Science, 2017, 38(2): 109-114. (in Chinese with English abstract)
10.7506/spkx1002-6630-201702018. http://www.spkx.net.cn
2016-03-31
2014年甘肅省農業領域知識產權優勢企業培育項目(14OPIPG002);甘肅省工程技術研究中心專項(1009FTGG017);河西學院科研創新與應用校長基金項目(XZ2011-08);張掖市科技重大專項(144JTCG254-08)
楊生輝(1976—),男,副教授,碩士,研究方向為特色農產品加工及螺旋藻生產及其產品開發。E-mail:15025888518@163.com
*通信作者:羅光宏(1965—),男,教授,碩士,研究方向為植物資源利用與產業化開發。E-mail:13993693452@163.com

