土壤水分梯度對灰胡楊光合作用與抗逆性的影響
王海珍,韓 路,徐雅麗,牛建龍,于 軍
新疆生產建設兵團塔里木盆地生物資源保護利用重點實驗室,塔里木大學植物科學學院, 阿拉爾 843300
土壤水分梯度對灰胡楊光合作用與抗逆性的影響
王海珍*,韓 路,徐雅麗,牛建龍,于 軍
新疆生產建設兵團塔里木盆地生物資源保護利用重點實驗室,塔里木大學植物科學學院, 阿拉爾 843300
以塔里木盆地珍稀漸危種灰胡楊(PopuluspruinosaSchrenk)幼苗為材料,采用盆栽方法研究土壤水分梯度對灰胡楊光合特征及抗逆性的影響。結果表明:(1) 灰胡楊凈光合速率(Pn)、蒸騰速率、氣孔導度、胞間CO2濃度和光能利用率均隨土壤水分遞減而降低,重度干旱比適宜水分依次降低了35.53%、25.32%、48.18%、15.62%和40.92%;而光合午休程度則明顯增強,Pn下降主要是由非氣孔因素限制造成。輕度干旱能夠提高灰胡楊水分利用效率(WUE)3.05%,維持相對較高的Pn和WUE。(2) 隨土壤水分遞降,灰胡楊光照生態幅縮窄,CO2補償點升高,RuBP再生受限,光與CO2利用效率、Rubisco活性和光合效率降低。與適宜水分相比,中度與重度干旱下最大凈光合速率(Pnmax)、表觀量子效率、光飽和點、羧化效率、光合能力(Amax)、光呼吸速率、最大羧化效率、最大電子傳遞速率和磷酸丙糖利用率均顯著降低(P<0.05),其中Pnmax、Amax和生化參數分別降低了42.65%、38.26%、57.10%;63.01%、65.88%、73.43%。(3) 土壤干旱顯著降低了灰胡楊的枝水勢和光合色素含量(P<0.01),并且改變了光系統反應中心色素的組成比例,膜脂過氧化程度顯著增強(P<0.01)。灰胡楊主要通過積累大量脯氨酸和可溶性蛋白質參與滲透調節來減輕土壤干旱對光合機構的損傷。重度干旱對灰胡楊葉片光合系統造成了不可逆的傷害,嚴重抑制了其正常生長和光合作用。綜上所述,塔里木干旱荒漠區灰胡楊生長適宜的土壤相對含水量為60%─65%,符合極端干旱區植被恢復與高效節水的管理原則。
灰胡楊;土壤水分梯度;氣體交換;光合響應參數;滲透調節物質
隨著全球氣候變遷、干旱發生頻繁,水分短缺已成為干旱區限制植物生長發育與分布的關鍵因素[1]。塔里木盆地地處歐亞大陸腹地,是我國典型的干旱荒漠區,沿塔里木河上游兩岸呈走廊狀分布著大片的天然灰胡楊林,是流域植被自然演替進程中近頂級的天然喬木群落。灰胡楊(PopuluspruinosaSchrenk)是楊柳科(Salicaceae)楊屬(Populus)中最古老、最原始的荒漠河岸林樹種,為我國首批確定的388種珍稀漸危種[2],其已成為抵御風沙、遏制沙化、維護區域生態平衡、保護生物多樣性和保障綠洲農牧業生產的重要屏障。自從20世紀50年代以來,受區域人口增長和經濟發展的驅使,大規模水土資源開發,致使塔里木河改道斷流、地下水位和土壤水分大幅下降,導致塔里木河沿岸植被衰敗、生物多樣性銳減、灰胡楊種群數量正在迅速減少,甚至出現了大面積死亡。土壤水分是影響植物光合作用、水分代謝及物質轉運等光合生理過程的重要生態因子,水分脅迫下光合效率顯著降低、生長受抑[3]。土壤水分到底是怎樣影響灰胡楊的生長與生理生態過程及生理機制,已成為當前迫切需要解決的問題。目前,國內外學者針對胡楊光合、水分與抗逆生理及生態適應機制等方面開展了廣泛研究[4-10],而關于土壤水分梯度對灰胡楊光合生理與抗逆性的影響及光合生理參數與土壤水分的定量關系、響應機制尚未見報道。本文以塔里木河上游灰胡楊幼苗為試材,采用人工控制試驗模擬灰胡楊生境系列水分條件,研究不同土壤水分梯度下灰胡楊的光合特征與抗逆性能,探討其光合特性對土壤水分梯度的響應規律和抵御干旱的生態對策,試圖闡明灰胡楊適應干旱荒漠環境的生理機制與生長適宜的水分條件,以期為塔里木荒漠區灰胡楊林的水分管理與種群恢復保護、更新復壯及改善日趨惡化的生態環境提供理論依據。
1 材料與方法
1.1 試驗區概況
試驗在塔里木大學農業試驗站進行。該站位于塔克拉瑪干沙漠北緣、塔里木河上游(40°35′N,80°50′E;海拔1 006 m)的阿拉爾墾區,屬典型暖溫帶大陸性干燥氣候。區內光熱資源豐富,晝夜溫差大。年日照時數2 750─3 029 h,年太陽總輻射達5.89×105J/cm2,≥0 ℃的有效積溫為4 132.7 ℃,平均氣溫≥10 ℃的持續日數為201 d,年平均降雨量<50 mm,年平均蒸發量>2 500 mm;風沙災害頻繁,春、夏季多大風天氣,是該地區風沙危害的主要季節。灰胡楊主要集中分布于塔里木河上游兩岸,呈階梯狀分布著幼齡林、中齡林、成熟林和過熟林,且距離河岸越遠其幼齡所占比例越低。生長季(4─10月)對離河岸不同距離的灰胡楊林下0─100 cm土壤水分測定,河岸幼齡林下1 m土壤含水量為19.41%─25.71%,隨遠離河岸逐漸降低,依次為13.28%─17.32%、8.76%─12.62%、4.05%─7.07%,至稀疏衰敗林土壤含水量為0.65%─2.37%。
1.2 試驗設計
試驗材料為塔里木盆地荒漠優勢樹種——灰胡楊的2年生幼苗,株高75─85 cm、地徑0.5─0.8 cm。盆栽直徑28 cm、高30 cm,盆土為林地土壤,盆中裝等量過篩棕鈣土(含水量0.84%)15 kg。土壤容重1.33 g/cm3、土壤有機質1.201%、全氮0.057%、全磷0.089%、pH 8.35、總鹽量0.137%、田間持水量(θf)24.43%。
試驗在塔里木大學農業試驗站自制人工防雨棚中進行,選擇大小基本一致的苗木于3月下旬植入塑料桶中。模擬灰胡楊自然生境土壤水分設計系列土壤水分梯度:①適宜水分(H1,75%—80%θf),土壤含水量(θt)為18.32%—19.54%;②輕度干旱(H2,60%—65%θf),θt為14.66%—15.88%;③中度干旱(H3,45%—50%θf),θt為10.99%—12.21%;④重度干旱(H4,30%—35%θf),θt為7.33%—8.55%。采用隨機區組設計,不同水分處理均設6次重復,每桶3株苗,并設置對照。各水分處理置于相同光照條件下,陰雨天用防雨棚遮擋。苗木栽植后澆水使之正常萌發與生長,然后按試驗設計進行土壤水分梯度處理。
1.3 測定方法與指標
1.3.1 土壤水分參數測定與控制
盆栽土壤含水量用烘干法測定,田間持水量用環刀法測定。根據田間持水量(θf)與占θf%計算出系列土壤水分梯度下的土壤含水量(θt),然后根據盆栽土壤含水量與裝盆土壤重量(15 kg)及θt、盆重、苗重計算出各土壤水分梯度的盆栽重量控制試驗范圍。各盆邊緣均直立一根塑料管,用于將補充的水分直接灌入盆底,以防止表面補水快速蒸發而影響試驗精度。6月1日之前緩苗期均充分灌溉,保證苗木正常生長;之后按設計的4種水分梯度控制試驗,每天20:00利用電子稱稱量測盆重量,根據連續2次稱重的差值以及控水上限計算補水量,用固定容器補充水分以控制土壤水分在設定范圍內。
1.3.2 氣體交換參數測定
8月中旬選擇晴朗天氣于8:00—20:00用Li-6400型便攜式光合儀(Li-COR,USA)測定盆栽苗木成熟葉的凈光合速率(Pn)、蒸騰速率(Tr)、氣孔導度(Gs)、胞間CO2濃度(Ci)等指標及光合有效輻射(PAR)、大氣CO2濃度(Ca)、氣溫(Tair)、葉溫(TLeaf)、空氣相對濕度(RH)、葉片內外水汽壓差(VPD)等微氣象參數。每處理測定3株,每株測定新梢上標記好的2片位置相同的成熟葉。試驗中為減少測定時間造成的誤差,各處理先只測1盆,全部處理測定完成后再測第2盆(第2重復),依次循環進行。葉片水平的瞬時水分利用效率WUE=Pn/Tr;光能利用率LUE=Pn/PAR。氣孔限制值(Ls)=1-Ci/Ca[11]。
1.3.3 光響應曲線的測定
自然光誘導1—1.5 h后,于北京時間9:30—13:00采用開放式氣路,設定溫度為25℃、大氣CO2濃度為(370±5) μmol/mol,應用Li-6400 紅藍光光源提供不同的光合有效輻射(PAR),梯度設置為3000、2800、2500、2000、1500、1000、500、200、100、50、20和0 μmol m-2s-1,分別測定灰胡楊成熟葉Pn(μmol m-2s-1),然后用直角雙曲線修正模型[12]擬合所測定的光響應曲線,得出最大凈光合速率(Pnmax)、表觀量子效率(AQY)、暗呼吸速率(Rd)、光補償點(LCP)和光飽和點(LSP)等參數。
1.3.4 CO2響應曲線的測定
選取與測定光響應相同部位的葉片,控制條件與光響應相同,應用Li-6400液化CO2鋼瓶提供不同的CO2濃度,分別在CO2濃度為2 000、1800、1600、1300、1000、800、600、400、200、150、100、50和0 μmol·mol-1的條件下,測定光合有效輻射(PAR)為1500 μmol m-2s-1時灰胡楊成熟葉Pn(μmol m-2s-1),然后用直角雙曲線修正模型[12]擬合所測定的CO2響應曲線,得出光合能力(Amax)、羧化效率(CE)、光呼吸速率(Rp)、CO2補償點(Γ)和飽和點(CSP)。為了給出灰胡楊成熟葉的生化參數,我們借助光合助手擬合CO2響應曲線,得到最大羧化速率(Vcmax)、最大電子傳遞速率(Jmax)和磷酸丙糖利用效率(TPU)。
1.3.5 小枝水勢、葉綠素、可溶性糖、可溶性蛋白質、游離脯氨酸及丙二醛含量測定
混合式教學不同于混合式學習,混合式教學是從教師的主導地位出發,借助網絡技術手段幫助學生提高教學效率[1]。混合式教學改變了以往以板書講授為主的傳統的授課方式,利用發達的網絡將教學與網絡相結合,通過線上教學以及在線學習的支持,使得教學方式迎來了轉變,教學效果獲得提升。現今正在提倡教師和學習者的雙主體地位教學[2],如何將混合式教學更好地應用到中小學中成為眾多學者研究的熱點。本文借助于可視化的研究軟件CiteSpace分析2007-2017年知網收錄的混合式教學和中小學相關的研究文獻,分析研究的趨勢和熱點[3],并對代表作者、機構之間的聯系進行可視化研究。
8月于9:00—11:00從各水分處理的灰胡楊幼苗中,選擇粗細大小基本一致的當年新萌枝進行水勢測定, 重復3次。測定儀器為植物壓力室(SKPM 1400,UK)。
8月采集各水分處理幼苗相同部位的葉片帶回實驗室,葉綠素含量用80%丙酮浸提、分光光度計測定[13];游離脯氨酸(Pro)、可溶性糖(SS)、可溶性蛋白質(SP)含量分別采用磺基水楊酸提取酸性茚三酮顯色法、硫酸-蒽酮比色法、考馬斯亮藍G-250染色法[13];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)比色法測定[13]。
1.3.6 數據分析
用SAS 6.12進行方差分析,多重比較采用DUNCAN法。
2 結果與分析
2.1 土壤水分梯度對灰胡楊光合作用日進程的影響
土壤水分梯度下灰胡楊Pn、Tr、Gs日變化趨勢一致,均呈“單峰”型(圖1)。一天中Pn、Tr、Gs均從8:00逐漸上升,分別于12:00─14:00、12:00和10:00時達到峰值,之后逐漸降低,Gs峰值出現時間明顯早于Pn、Tr。與Pn、Tr、Gs日變化趨勢不同,Ci日變化呈典型的“V”字型,呈現出早晚高、午間低的變化趨勢。土壤水分明顯影響了灰胡楊Pn、Tr、Gs和Ci,隨土壤水分降低Pn、Tr、Gs、Ci值均降低。H3和H4下灰胡楊Pn峰值明顯提早于H1、H22 h,峰值比H1分別降低17.53%和30.73%。各水分處理下的Pn、Tr、Gs、Ci日均值依次為H4
2.2 土壤水分梯度對灰胡楊光合作用-光響應參數的影響
植物光合作用-光響應曲線可表征植物對環境資源的利用能力。圖2可見,在低光合有效輻射(PAR<200 μmol m-2s-1),土壤水分梯度下灰胡楊Pn隨著PAR的增加近似呈線性增加;而后隨PAR增加Pn呈曲線式緩慢升高,當PAR上升到一定數值(接近LSP),曲線則漸趨平緩后降低。不同土壤水分處理灰胡楊Pn對PAR的響應不同,H1與H2處理Pn穩定在較高水平且隨PAR增大的變化不大,而H3與H4處理Pn表現出隨PAR增大而明顯下降趨勢;同一PAR下隨土壤水分降低,Pn降幅增大。利用直角雙曲線修正模型擬合土壤水分梯度下灰胡楊光合作用的光響應曲線并計算出相應參數(表1)。不同土壤水分處理灰胡楊LSP、AQY和Pnmax差異顯著(P<0.05)。隨土壤水分降低,H2、H3、H4Pnmax與LSP、AQY分別比H1下降了24.69%、42.65%、63.01%; 11.83%、32.72%、48.56%;4.92%、8.20%、18.03%。盡管LCP、Rd在不同水分處理下差異不顯著,但均明顯降

圖1 土壤水分梯度對灰胡楊氣體交換特性的影響Fig.1 Effects of soil water gradients on gas exchange characteristics of P.pruinosa

圖2 土壤水分梯度對灰胡楊葉片光合作用——光響應曲線與CO2響應曲線的影響Fig.2 Effects of soil water gradients on light and CO2 response curves of P.pruinosa
低,H2、H3、H4LCP分別比H1下降了46.13%、47.15%、57.31%。統計分析表明,干旱荒漠區灰胡楊Pnmax與LSP、AQY、LCP呈顯著正相關(P<0.05),與Rd呈不顯著的正相關(P>0.05)(圖3)。
利用直角雙曲線修正模型擬合土壤水分梯度下灰胡楊光合作用—CO2響應曲線(圖2B)、特征參數(表2)和運用Farquhar等[14]生化模型擬合CO2響應曲線得到的生化參數(表2)。由圖2B可見,土壤水分梯度下灰胡楊Pn對Ci的響應趨勢相似,低Ci時(Ci<200 μmol·mol-1)Pn隨Ci增加近似呈直線增加,之后Pn隨Ci增大速率逐漸減緩。當Ci上升到一定的數值時,Pn曲線則漸趨平緩后降低。不同土壤水分處理灰胡楊Pn對Ci的響應不同,相同CO2濃度下隨土壤水分降低,Pn降幅增大,表明灰胡楊RuBP羧化酶活性與碳同化能力隨土壤水分減少而降低。表2可見,不同土壤水分處理顯著影響了灰胡楊CO2響應參數(CE、Amax、Rp、Vcmax、Jmax、TPU) (P<0.05),但對CSP、Γ和Jmax/Vcmax影響不顯著(P>0.05)。隨土壤水分降低,CE、Amax、Rp、Vcmax、Jmax和TPU均顯著降低,相反Γ則明顯增大。其中CE、Vcmax和Jmax降幅較大,H2、H3、H4比H1分別降低了31.38%、69.65%、75.64%;33.07%、66.39%、73.74%;13.75%、64.51%、80.81%,表明重度干旱嚴重影響了灰胡楊的碳同化效率、電子傳遞速率和磷酸丙糖利用效率,導致其光合生理功能減弱、Amax極顯著降低。統計分析表明,灰胡楊Amax與CE、CSP、Rp、Vcmax、Jmax、TPU、Jmax/Vcmax均呈顯著正相關(P<0.05),但與Γ呈顯著負相關(P<0.05),其中Amax與TPU、Jmax的相關系數最大(r=0.9996*、0.9871*)。
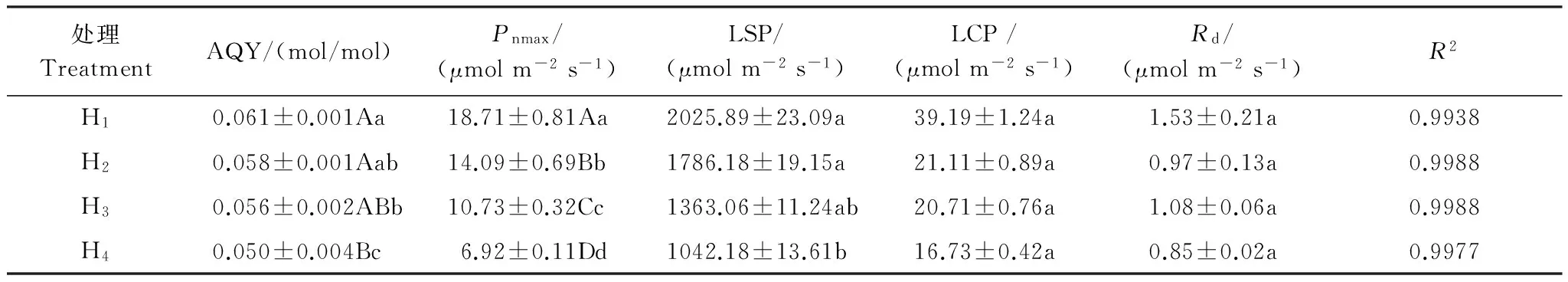
表1 土壤水分梯度對灰胡楊幼苗光合作用—光響應參數的影響(平均值±標準差,n =3)
AQY: 表觀量子效率 Aapparent quantum efficiency;Pnmax: 最大凈光合速率 Maximum net photosynthetic rate; LSP:光飽和點 Light saturation point; LCP:光補償點 Light compensation point;Rd: 暗呼吸速率 Dark respiration rate;R2: 決定系數 Determination coefficient; H1:適宜水分 Normal soil water;H2:輕度干旱 Light drought;H3:中度干旱 Moderate drought;H4:重度干旱 Severe drought; 同一列中,不同小寫字母表示差異顯著(P<0.05),不同大寫字母表示差異極顯著(P<0.01)

圖3 灰胡楊幼苗光合作用——光響應參數間的相關分析(平均值±標準差,n =3)Fig.3 Relationships among light response parameters in P.pruinosa (mean± SD,n =3)

處理TreatmentCE/(molm-2s-1)CSP/(μmol/mol)Amax/(μmolm-2s-1)Γ/(μmol/mol)Rp/(μmolm-2s-1)Vcmax/(μmolm-2s-1)Jmax/(μmolm-2s-1)TPU/(μmolm-2s-1)Jmax/VcmaxH10.213±0.017Aa1176.86±14.63a39.89±2.01Aa62.34±3.11a12.05±0.15Aa116.25±2.15Aa161.23±6.98a14.97±0.61Aa10.73±0.41aH20.146±0.015Ab1067.38±13.49a35.25±1.73Aa74.65±3.31a9.22±0.38Bb77.81±2.97Bb139.06±5.25a12.94±0.45Aa10.85±0.46aH30.065±0.010Bc1005.34±18.62a24.63±1.27Bb85.37±4.16a5.21±0.17Cc39.07±1.81Cc57.23±2.91b8.92±0.71Bb6.54±0.35aH40.052±0.010Bc972.65±11.29a13.61±0.65Cc91.48±4.43a4.11±0.21Cc30.52±1.94Cc30.95±1.81b5.13±0.59Cc6.24±0.32a
CE: 羧化效率 Carboxylation efficiency;CSP:CO2飽和點 CO2saturation point;Amax:光合能力 Photosynthetic capacity;Γ:CO2補償點 CO2compensation point;Rp:光呼吸速率 Photorespiratory rate;Vcmax:最大羧化速率 Maximum carboxylation rate;Jmax:最大電子傳遞速率 Maximum electron transport rate;TPU:磷酸丙糖利用率 Triose-phosphate utilization rate
2.4 土壤水分梯度對灰胡楊光合色素含量的影響
表3可見,灰胡楊葉綠素a(chla)、葉綠素b(Chlb)、類胡蘿卜素(Car)含量及其比值均隨土壤水分減少而降低,H3、H4處理顯著影響灰胡楊光合色素含量,各指標降幅均較大,其中chla降幅高達77.50%。灰胡楊Chla、Chlb、Car、Chl(a+b)和Chla/b在H1、H2間無顯著差異(P>0.05),但H1、H2的Chla、Chlb、Car、Chl(a+b)均與H3、H4差異顯著(P<0.05),H3與H4差異也顯著(P<0.05)。表明中度與重度干旱下灰胡楊光合色素合成受阻或降解增多,葉綠體受到一定程度損傷。同時,H2、H3、H4灰胡楊Chla含量降幅(11.74%、33.83%、77.50%)均高于Chlb(8.15%、21.28%、49.82%),即Chlb含量相對穩定,表明灰胡楊光系統反應中心比捕光天線系統更易受土壤水分虧缺的影響,這是導致其光合能力與LUE降低的原因之一。

表3 土壤水分梯度對灰胡楊幼苗葉片光合色素含量的影響(平均值±標準偏差,n=5)
2.5 土壤水分梯度對灰胡楊枝水勢、滲透調節物質與丙二醛含量的影響
圖4可見,不同土壤水分對灰胡楊小枝水勢(Ψp)產生極顯著的影響(P<0.01),H1Ψp最高(-1.14 MPa)。隨土壤水分下降,Ψp逐漸降低,H3、H4降至-1.65 MPa、-2.24 MPa,分別比H1降低了44.74%、96.05%。隨土壤水分降低,灰胡楊葉片中可溶性糖(SS)、游離脯氨酸(Pro)、可溶性蛋白質(SP)和丙二醛(MDA)含量均顯著增加(圖5),各生理指標增幅不同。H1與H2處理SS、Pro、SP和MDA含量均未達顯著差異(P>0.05),表明輕度干旱未明顯影響灰胡楊正常生理功能。但隨著干旱加劇,SS、Pro、SP和MDA含量顯著升高。SS和SP在H3、H4與H1間差異顯著(P<0.05),H3、H4的SS、SP分別比H1增長了65.87%、70.29%和96.77%、130.98%。H3、H4的Pro和MDA含量均與H1、H2差異達極顯著水平(P<0.01),且H3與H4間差異也極顯著(P<0.01)。H3、H4的Pro和MDA含量分別比H1升高了46.74%、252.64%和139.88%、189.42%。3種滲透調節物質中SP和Pro含量增幅最大,表明Pro和SP是灰胡楊抵御土壤干旱的主要滲透調節物質。同時,H4處理下MDA增幅是H1的2.89倍,表明重度干旱下活性氧引起光合色素嚴重降解(表3)和膜脂過氧化,光合機構膜系統遭到損傷。
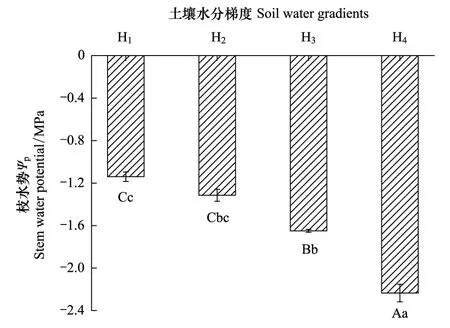
圖4 土壤水分梯度對灰胡楊小枝水勢(Ψp) 的影響(平均值±標準偏差,n =3)Fig.4 Effects of soil water gradients on stem water potential (Ψp) of P.pruinosa (mean ± SD,n =3)不同小寫字母表示差異顯著(P<0.05),不同大寫字母表示差異極顯著(P<0.01)
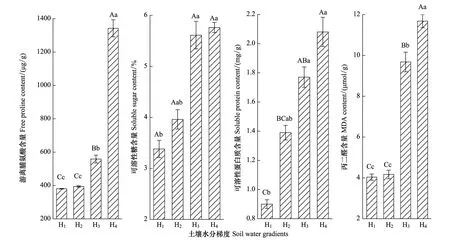
圖5 土壤水分梯度對灰胡楊葉片SS、Pro、SP和MDA含量的影響(平均值±標準偏差,n =3)Fig.5 Effects of soil water gradients on free proline, soluble sugar, soluble protein and malondialdehyde contents of P.pruinosa leaves (mean ± SD,n =3)
3 結論與討論
灰胡楊作為塔里木河流域生態關鍵種之一,主要分布于塔里木河流域的上游區域,在水分梯度上形成有規律的分異格局,且中下游基本已失去了蹤影。因此,探討灰胡楊適應極端干旱荒漠環境的生理生態機制和生存條件對保護珍稀漸危物種和促進區域生態恢復具有重要的意義。
光合作用是植物有機物質積累、生長發育的基礎,受植物本身生理特性和環境因素的共同影響, 其中土壤水分是影響光合生理過程的重要因素[15]。在水分條件較好時(H1),灰胡楊能充分利用各種環境資源,保持高光合效率;隨土壤水分降低,灰胡楊Pn、Tr、Gs、Ci和LUE均降低,水分條件越差,光合參數則降幅越大,但降幅Gs>Pn>Tr>Ci,表明隨土壤水分下降,灰胡楊通過自我調節降低Gs并相應降低枝水勢(圖4)從而降低Tr,以減少體內水分散失來應對土壤干旱,但同時也限制了CO2的吸收,導致Ci、Pn與LUE降低。同時,光合“午休”程度隨土壤水分遞減而加劇,中度與重度干旱下表現尤為明顯,這是灰胡楊在長期進化過程中形成的一種自我保護方式。通過補光色素復合體LHCII的可逆性脫離,導致光合系統的反應速度降低與光合效率下降及減少水分損失,使其在低水強光環境下避免受到損傷以求得繼續生存[16-17]。WUE在一定程度上衡量或評價植物對環境水分狀況變化的適應能力和能量的轉換效率[18]。輕度干旱下灰胡楊WUE有所提高,因為當土壤水分減少時,氣孔通過關閉來降低水分散失并使通過氣孔進入葉片的CO2減少、引起Ci下降,致使Tr(25.32%)大于Pn降幅(10.42%),從而提高WUE。這與李志軍等[19]、Rouhi等[20]研究結果一致,但與李菊艷等[21]報道胡楊在70%—80%田間持水量下WUE最高不同,這是不同物種光合特性與生態適應性存在差異所致。但隨土壤水分降低(H3、H4),灰胡楊Pn大于Tr降幅(圖1)致使WUE隨之降低。可見,輕度干旱灰胡楊采取了降低Gs和Tr,犧牲部分光合生產能力以提高WUE來抵御干旱逆境。
干旱、高溫、強光、CO2及O3濃度升高等環境脅迫均能影響植物光合作用——光-CO2響應參數,光-CO2響應參數能較好地反映逆境條件下植物的光合潛能、CO2與光能利用能力、光合電子傳遞與光合磷酸化活性及光抑制水平高低等特性[12,22-23]。伍維模等[6]報道土壤水分脅迫顯著影響胡楊與灰胡楊AQY、Pnmax、LSP,而對LCP、Rd無顯著影響,而陳亞鵬[8]等指出胡楊生化參數隨地下水埋深增加而增大,但不同地下水位間無顯著差異。本試驗應用直角雙曲線修正模型對灰胡楊光和CO2響應曲線擬合表明,不同土壤水分處理顯著影響了灰胡楊光合作用,同一PAR下隨土壤水分降低,Pn降幅增大,表明土壤干旱加重了灰胡楊光抑制發生強度、降低Rubisco活性與碳同化能力。灰胡楊光與CO2響應參數總體隨土壤水分下降而降低,但CO2補償點則增大。表明隨土壤水分降低,灰胡楊光抑制程度增強,光合潛能、光能轉化效率、電子傳遞速率、光合磷酸化活性、磷酸丙糖利用效率和RuBP再生、消耗過剩能量的能力降低,可有效利用PAR和CO2范圍縮窄,導致其在低水強光的荒漠環境下膜脂過氧化程度增大(圖5)、光合生理功能減弱和光合效率下降。試驗中也發現重度干旱灰胡楊出現明顯的葉色發黃、脫落等癥狀。但LCP與Rd的降低,可使其對弱光利用能力有所提高和減少對光合產物的消耗[24],這在一定程度上增強了其對資源的有效利用和抵御干旱脅迫能力。Jmax和Vcmax比值一直被認為是衡量N素在葉片光合系統內部分配格局的一個重要指標,該比值代表著光合作用內部電子傳遞和Rubisco能力(RuBP再生和消耗)間的一種功能平衡[25]。隨土壤水分下降其Jmax/Vcmax降低,表明灰胡楊僅將光合系統中少量N素分配給用于羧化作用的Rubisco,可能是土壤水分虧缺引起羧化能力下降的原因之一。此外,土壤水分梯度下灰胡楊Pnmax與伍維模等[6]報道結果相似,但LSP卻遠低于Ma等[5]報道結果,且遠遠高于伍維模等[6]報道的結果。其原因在于光響應曲線擬合時,Ma等[5]采用一元二次回歸模型,擬合LSP 是利用曲線中Pn達到最大值時所對應的PAR值,從而使結果遠高于直角雙曲線修正模型;伍維模等[6]采用的非直角雙曲線模型是一條沒有極點的漸進線,利用直線y=Pnmax與弱光下的線性方程的交點所對應X軸的數值為LSP,使結果遠低于直角雙曲線修正模型和實測值。直角雙曲線修正模型能較好地擬合土壤水分梯度下Pn-PAR響應過程(R2>0.993)及其響應參數,其與實測光響應曲線吻合度最高,且克服了非直角雙曲線模型無法擬合Pn隨PAR增加而降低的缺點,擬合效果最佳(圖2,表1)。因此,在光響應模型的應用中,應根據實際生境條件選擇最為合適的擬合模型,以最大限度地保證擬合光響應特征參數的正確性。
葉綠素含量和比例在一定程度上能反映植物光能利用、制造有機物與適應、利用環境因子的能力。灰胡楊Chla、Chlb、Car含量及葉綠體類囊體膜上光系統反應中心色素和聚光色素的組成比例隨土壤水分下降而降低,土壤水分越低則降低越顯著,表明輕度干旱對灰胡楊光合器官結構與功能影響甚微,但中度與重度干旱則影響較大,尤其重度干旱光合器官結構與功能的損傷明顯增大,這與光合特征研究結果相一致。同時,隨土壤水分降低,灰胡楊Chla含量降幅均高于Chlb,Car也大幅降低,表明灰胡楊光系統反應中心比捕光天線系統更易受損,膜脂過氧化程度增大(圖5),這也是導致其光合能力和LUE降低的原因之一。水勢(Ψp)是植物水分狀況的重要指標之一,Ψp能夠用來判斷植物水分虧缺的程度。土壤水分越低,灰胡楊Ψp降低越顯著,表明灰胡楊對干旱區土壤水分變化敏感。Ψp與Pn、Tr、Gs、Ci、LUE、Pnmax均呈極顯著的正相關(P>0.01),表明土壤水分下降而引起的水勢下降直接影響了灰胡楊的光合生理過程。不少研究認為環境脅迫常常直接作用于葉綠體。干旱逆境下,植物碳同化能力減弱以及PSⅡ活性降低導致激發能上升而引發能量代謝失調,產生過量的活性氧(ROS),造成膜脂過氧化作用加劇,導致生物膜結構與功能破壞,從而降低植物光合能力[26-28],其是光合作用非氣孔限制的主要原因[23]。Campos等研究指出干旱脅迫下滲透調節物質脯氨酸(Pro)和可溶性糖(SS)的積累增加,有助于清除干旱脅迫條件下植株體內的活性氧,避免細胞膜質過氧化[27];陳敏等指出塔里木河中游3種植物(胡楊、檉柳和蘆葦)通過積累脯氨酸與可溶性糖來增強抗旱性,且二者在抵御干旱脅迫過程中存在相互補償關系[29]。試驗發現,灰胡楊滲透調節物質對土壤水分響應存在差異,H2滲透調節物質增幅圴高于MDA,表明這些滲透調節物質能較快地清除活性氧,共同穩定了光合作用機構的功能,維持較高Pn。但隨土壤水分降低,滲透調節物質與MDA均顯著升高,但增幅Pro>MDA>SP>SS,表明土壤干旱下灰胡楊以積累大量Pro來保護細胞質內許多酶免受傷害和增強組織的抗脫水力,阻止了蛋白質分解與變性,從而維持了機體內環境的相對穩定。可見,土壤干旱下滲透調節物質積累是灰胡楊清除活性氧、維持生物膜結構和功能正常而采取的一種有效防御措施。但試驗中發現,土壤水分梯度下灰胡楊出現了葉色發黃癥狀(H3),H4則出現明顯葉色發黃、脫落癥狀,表明中度與重度干旱已對灰胡楊生物膜結構與功能造成一定程度的損傷,嚴重抑制了其正常的光合作用。綜合以上分析,塔里木干旱荒漠區灰胡楊生長適宜的土壤水分為田間持水量的60%—65%,此土壤水分能保證灰胡楊同時獲得較高的光合效率和WUE來適應荒漠逆境,也符合極端干旱區植被恢復、高效節水的管理原則。
[1] 李林芝,張德罡,辛曉平,閆玉春,楊桂霞,李瑾,王旭. 呼倫貝爾草甸草原不同土壤水分梯度下羊草的光合特性. 生態學報,2009,29(10):5271-5279.
[2] 蘇培璽,張立新,杜明武,畢玉蓉,趙愛芬,劉新民. 胡楊不同葉形光合特性、水分利用效率及其對加富CO2的響應. 植物生態學報,2003,27(1): 34-40.
[3] 裴斌,張光燦,張淑勇,吳芹,徐志強,徐萍. 土壤干旱脅迫對沙棘葉片光合作用和抗氧化酶活性的影響. 生態學報,2013,33(5):1386-1396.
[4] 王海珍,韓路,李志軍,彭杰,馬春暉. 塔里木河上游胡楊與灰楊光合水分生理特性. 生態學報,2009,29(11):5843-5850.
[5] Ma H C,Fung L,Wang S S,Altman A,Hüttermann A. Photosynthetic response ofPopuluseuphraticato salt stress. Forest Ecology and Management, 1997,93(1/2):55-61.
[6] 伍維模,李志軍,羅青紅,韓路. 土壤水分脅迫對胡楊、灰葉胡楊光合作用——光響應特性的影響. 林業科學,2007,43(5):30-35.
[7] Bogeat-Triboulot M B,Brosché M,Renaut J,Jouve L,Thiec D L,Fayyaz P,Vinocur B,Witters E,Laukens K,Teichmann T,Altman A,Hausman J F,Polle A,Kangasj?rvi J,Dreyer E. Gradual soil water depletion results in reversible changes of gene expression,protein profiles,ecophysiology,and growth performance inPopuluseuphratica,a poplar growing in arid regions. Plant Physiology,2007,143(2):876-892.
[8] 陳亞鵬,陳亞寧,徐長春,李衛紅,付愛紅. 塔里木河下游地下水埋深對胡楊氣體交換和葉綠素熒光的影響. 生態學報,2011,31(2):344-353.
[9] Gries D,Zeng F,Foetzki A,Arndt S K,Bruelheide H,Thomas F M,Zhang X,Runge M. Growth and water relations ofTamarixramosissimaandPopuluseuphraticaon Taklamakan desert dunes in relation to depth to a permanent water table. Plant,Cell & Environment,2003,26(5):725-736.
[10] Overdieck D,Ziche D,Yu R D. Gas exchange ofPopuluseuphraticaleaves in a riparian zone. Journal of Arid Land,2013,5(4):531-541.
[11] Berry J A,Downton W J S. Environmental regulation of photosynthesis // Govindjee,ed. Photosynthesis,VolⅡ. Development,Carbon Metabolism and Plant Productivity. New York:Academic Press,1982:263-343.
[12] 葉子飄. 光合作用對光和CO2響應模型的研究進展. 植物生態學報,2010,34(6):727-740.
[13] 高俊鳳. 植物生理學實驗指導. 北京:高等教育出版社,2006,122-125.
[14] Farquhar G D,von Caemmerer S,Berry J A. A biochemical model of photosynthetic CO2assimilation in leaves of C3species. Planta,1980,149(1):78-90.
[15] Sofo A,Dichio B,Montanaro G,Xiloyannis C. Photosynthetic performance and light response of two olive cultivars under different water and light regimes. Photosynthetica,2009,47(4):602-608.
[16] 許大全. 光合作用效率. 上海:上海科學技術出版社,2002.
[17] Chen Y,Xu D Q. Two patterns of leaf photosynthetic response to irradiance transition from saturating to limiting one in some plant species. New Phytologist,2006,169(4):789-798.
[18] 鄭海雷,黃子琛,董學軍. 毛烏素沙地油蒿和牛心樸子生理生態學研究. 植物生態學與地植物學學報,1992,16(3):197-208.
[19] 李志軍,羅青紅,伍維模,韓路. 干旱脅迫對胡楊和灰葉胡楊光合作用及葉綠素熒光特性的影響. 干旱區研究,2009,26(1):45-52.
[20] Rouhi V,Samson R,Lemeur R,van Damme P. Photosynthetic gas exchange characteristics in three different almond species during drought stress and subsequent recovery. Environmental and Experimental Botany,2007,59(2):117-129.
[21] 李菊艷,趙成義,孫棟元,閆映宇,張曾強,李君. 水分對胡楊幼苗光合及生長特性的影響. 西北植物學報,2009,29(7):1445-1451.
[22] Mishra K B,Iannacone R,Petrozza A,Mishra A,Armentano N,Vecchia G L,Trtílek M,Cellini F,Nedbal L. Engineered drought tolerance in tomato plants is reflected in chlorophyll fluorescence emission. Plant Science,2012,182:79-86.
[23] 張仁和,鄭友軍,馬國勝,張興華,路海東,史俊通,薛吉全. 干旱脅迫對玉米苗期葉片光合作用和保護酶的影響. 生態學報,2011,31(5):1303-1311.
[24] Brodribb T,Hill R S. Light response characteristics of a morphologically diverse group of southern hemisphere conifers as measured by chlorophyll fluorescence. Oecologia,1997,110(1):10-17.
[25] Wullschleger S D. Biochemical limitations to carbon assimilation in C3plants-a retrospective analysis of theA/Ci curves from 109 species. Journal of Experimental Botany,1993,44(5):907-920.
[26] Babita M,Maheswari M,Rao L M,Shanker A K,Rao D G. Osmotic adjustment,drought tolerance and yield in castor (RicinuscommunisL.) hybrids. Environmental and Experimental Botany,2010,69(3):243-249.
[27] de Campos M K F,de Carvalho K,de Souza F S,Marur C J,Pereira L F P,Filho J C B,Vieira L G E. Drought tolerance and antioxidant enzymatic activity in transgenic‘Swingle’ citrumelo plants over-accumulating proline. Environmental and Experimental Botany,2011,72(2):242-250.
[28] 杜偉莉,高杰,胡富亮,郭德林,張改生,張仁和,薛吉全. 玉米葉片光合作用和滲透調節對干旱脅迫的響應. 作物學報,2013,39(3):530-536.
[29] 陳敏,陳亞寧,李衛紅,陳亞鵬,何斌,灣疆輝. 塔里木河中游地區3種植物的抗旱機理研究. 西北植物學報,2007,27(4):747-754.
Effects of soil water gradient on photosynthetic characteristics and stress resistance ofPopuluspruinosain the Tarim Basin, China
WANG Haizhen*,HAN Lu,XU Yali,NIU Jianlong,YU Jun
KeyLaboratoryofBiologicalResourceProtectionandUtilizationofTarimBasin,XinjiangProductionandConstructionGroups,CollegeofPlantScience,TarimUniversity,Alar843300,China
Water deficit is a major limiting factor in vegetation recovery and reconstruction in the Tarim Basin in the extremely arid desert region of northwest China.PopuluspruinosaSchrenk is an ecologically important species growing in this region. However, theP.pruinosapopulation has been declining in recent years because of the low underground water table, mainly caused by increased human water consumption. Currently, the mechanisms underlying the decline in photosynthesis ofP.pruinosaunder soil water declines are not clear. The objective of our study was to investigate the effects of the soil water gradient on photosynthesis, and the relationship between photosynthesis and soil water content. Our study will enhance our understanding of the photo-physiological characteristics ofP.pruinosaexposed to soil water declines and provide valuable information for the protection of this vulnerable species. Saplings ofP.pruinosawere planted in pots under four different soil water gradients. The effects of the soil water declines on the photosynthetic characteristics and stress resistance ofP.pruinosawere evaluated by analyzing gas exchange, photosynthetic light and CO2response curves, pigments, stem water potential, and osmotic adjustment substances. The results showed that: (1) The net photosynthetic rate(Pn), transpiration rate, stomatal conductance, intercellular CO2concentration, and light use efficiency ofP.pruinosadecreased with a gradual decrease in soil water content by 35.53%, 25.32%, 48.18%, 15.62%, and 40.92%, respectively, under severe soil drought in comparison to normal soil water content(CK). However, the phenomenon of "noon break" was apparent, and non-stomatal limitation was responsible for a reduction inPn. Water use efficiency(WUE) could be improved by 3.05% under mild drought conditions relative to the CK, andPnwas maintained at a high level. (2) Light ecological amplitude decreased, CO2compensation point increased, ribulose 1,5-diphosphate (RuBP) regeneration was limited, and light/CO2utilization efficiency, rubisco activity, and photosynthetic efficiency ofP.pruinosadecreased with a decrease in soil water content. Compared to the CK, light response parameters(maximum net photosynthetic rate [Pnmax], apparent quantum efficiency [AQY], light saturation point [LSP], carboxylation efficiency [CE], Photosynthetic capacity [Amax], photorespiratory rate [Rp], maximum carboxylation rate [Vcmax], maximum electron transport rate [Jmax], and triose-phosphate utilization rate [TPU]) significantly decreased(P< 0.05). Notably,Pnmax,Amax, and biochemical parameters of photosynthesis decreased by 42.65%, 38.26%, and 57.10% (moderate drought) and 63.01%, 65.88%, and 73.43% (severe drought), respectively. (3) Stem water potential and pigment content were significantly reduced(P< 0.01), the pigment composition proportion of the light reaction center was altered, and membrane lipid peroxidation(MDA) was significantly enhanced(P< 0.01) with decreasing soil water content.P.pruinosamainly accumulated proline and soluble protein to eliminate reactive oxygen and alleviate the impairment of the photosynthetic apparatus under soil drought. Irreversible damage was caused to the photosynthetic system ofP.pruinosa, and normal photosynthesis was seriously inhibited under severe drought. Therefore, declines in soil water content resulted in drought stress and reduced photosynthetic ability. This indicated that the decline in theP.pruinosapopulation might be caused by the lower soil moisture. In conclusion, the soil water content for maintaining higherPnand WUE inP.pruinosaforestlands should be approximately 60%─65% of the field capacity in the Tarim arid-desert region to adhere to the management principles of efficient water conservation and vegetation restoration in extremely arid areas.
Populuspruinosa; soil water gradient; gas exchange; light-CO2response parameters; osmotic adjustment substance
國家科技支撐計劃資助項目(2014BAC14B00);國家自然科學基金資助項目(31260058, 30960033);中國科學院“西部之光”人才培養項目(RCPY201209)
2015-07-29;
日期:2016-06-13
10.5846/stxb201507291597
* 通訊作者Corresponding author.E-mail: whzzky@163.com
王海珍,韓路,徐雅麗,牛建龍,于軍.土壤水分梯度對灰胡楊光合作用與抗逆性的影響.生態學報,2017,37(2):432-442.
Wang H Z,Han L,Xu Y L,Niu J L,Yu J.Effects of soil water gradient on photosynthetic characteristics and stress resistance ofPopuluspruinosain the Tarim Basin, China.Acta Ecologica Sinica,2017,37(2):432-442.

