HBV感染者耐藥基因突變與肝細胞癌的相關性分析
龐 婷, 邢卉春
(1 首都醫科大學附屬北京地壇醫院 肝病中心, 北京 100015;2 首都醫科大學附屬北京世紀壇醫院 感染科, 北京 100038)
HBV感染者耐藥基因突變與肝細胞癌的相關性分析
龐 婷1,2, 邢卉春1
(1 首都醫科大學附屬北京地壇醫院 肝病中心, 北京 100015;2 首都醫科大學附屬北京世紀壇醫院 感染科, 北京 100038)
目的 探討HBV耐藥基因突變與肝細胞癌(HCC)的相關性。方法 收集2013年1月1日-12月31日在北京地壇醫院進行HBV耐藥基因突變檢測,且為核苷和核苷酸類藥物經治,但HBV DNA仍可檢測到的患者的臨床資料。對其進行隨訪,以出現HCC為臨床結局。分析HBV感染者耐藥基因突變與HCC發生的相關性。計數資料組間比較采用χ2檢驗,計量資料組間比較采用t檢驗,并采用log-rank檢驗比較組間HCC發生率的差異。結果 共有227例患者納入研究,其中HBV耐藥基因突變檢測結果中未檢測到耐藥基因突變者占45.37%(103/227),檢測到耐藥基因突變者占54.63%(124/227)。HBV耐藥基因突變組與未突變組的HBV DNA載量分別為(5.19±1.60)log10IU/ml、(5.44±1.75)log10IU/ml,兩組差異無統計學意義(t=-1.134,P=0.258)。HBV耐藥基因突變組與未突變組中肝硬化患者的比例分別為24.19%(30/124)、16.50%(17/103),兩組差異亦無統計學意義(χ2=2.026,P=0.155)。中位隨訪時間為28個月(4~58個月),HCC發生率為7.49%(17/227)。HBV耐藥基因突變者的HCC發生率為9.68%(12/124),未檢測到HBV耐藥基因突變者的HCC發生率為4.85%(5/103)。發生HCC的患者中基線時檢測出HBV耐藥基因突變者占70.59% (12/17),未發生HCC的患者中基線檢測出HBV耐藥基因突變者占53.33%(112/210)。結論 在抗病毒治療過程中HBV DNA未被有效控制的患者,其HCC發生率與未進行抗病毒的患者HCC發生率結果相當,有較高的HCC發生的風險;若出現HBV耐藥基因突變,其發生HCC的風險可能較高,未來需更長時間、更大樣本的研究來進一步證實。
肝炎病毒, 乙型; 癌, 肝細胞; 突變; 抗藥性
目前,全球估計有2.4億人感染HBV[1]。HBV感染可導致慢性乙型肝炎(CHB),進而發展為肝硬化甚至肝細胞癌(HCC)。抗病毒治療已成為治療HBV感染的關鍵。但是在使用核苷和核苷酸類藥物(NAs)治療的過程中,由于HBV的高復制率、低保真性,病毒為逃逸藥物壓力,最終出現耐藥突變,對NAs的敏感性下降[2]。HBV耐藥基因突變的出現,使患者的獲益減少或消失,且增加了后續治療的難度,還可增加肝硬化、肝功能失代償發生的風險[3]。有關HBV耐藥基因突變與HCC發生的相關性也受到越來越多關注,其中研究較多的是rtA181T和rtM204I。rtA181T突變可引起相應的表面抗原基因突變,生成截短的表面蛋白,即rtA181T/sW172*,Lai等[4-5]體外細胞實驗及動物實驗表明,rtA181T/sW172*具有潛在的致瘤性,但在臨床病例中,出現rtA181T突變的患者是否更易發生HCC,出現rtM204I突變與發生HCC有何關系等相關研究較少,結果也不盡一致。本研究擬通過分析NAs經治的、HBV DNA仍可檢測到的患者的臨床資料,試圖了解HBV感染者耐藥基因突變與HCC之間的關系。
1 資料與方法
1.1 研究對象 篩選2013年1月1日-12月31日在北京地壇醫院進行HBV耐藥基因突變檢測的683例患者,將NAs經治的、HBV DNA仍可檢測到且臨床資料完整者納入研究(包括病毒學突破和應答不佳的患者[6])。排除HBV耐藥基因突變檢測未擴增者;進行HBV耐藥基因突變檢測前即診斷為HCC者;HIV陽性者;合并HCV、HDV感染者;合并酒精性、藥物性、自身免疫性肝病等其他肝病者;肝轉移癌患者和資料不全者。1.2 HBV耐藥基因突變檢測方法 使用美國ABI 公司Veriti 96孔熱循環儀,巢氏PCR法擴增RT區,用引物RT1:5′-YCTCWSYCAYATCGTCAA和RT2:5′-GAGMCACAAAGGTTCCAC進行第1輪擴增后,用引物RT3:5′-GCACCGAACATGGAGARC和RT4:5′-AGGCAGGATAGCCACATT進行第2輪擴增(注:Y代表C或T,W代表A或T, S代表G或C ,M代表A或C, R代表A或G)。將PCR產物純化后測序,由華大基因公司完成,測序分析軟件為Vector NI。
1.3 分析HBV耐藥基因突變與HCC的相關性 比較HBV耐藥基因突變與未檢測到耐藥基因突變兩組之間HCC發生率之間的差異,HCC診斷標準參考《原發性肝癌診療規范(2011年版)》[7]。
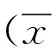
2 結果
2.1 一般資料 共納入患者227例,平均年齡(42.10±12.08)歲,其中CHB占79.30%(180/227),肝硬化占20.70%(47/227);HBV DNA平均載量(5.30±1.67)log10IU/ml;HBeAg陽性者占84.13%(159/189),HBeAg陰性者占15.87%(30/189)。HBV耐藥基因突變者占54.63%(124/227),男90例,女34例;未檢測到HBV耐藥基因突變者占45.37%(103/227),男82例,女21例。
2.2 HBV耐藥基因突變組與未突變組HBV DNA載量及肝硬化患者比例的比較 HBV耐藥基因突變組與未突變組的HBV DNA載量分別為(5.19±1.60)log10IU/ml、(5.44±1.75)log10IU/ml,兩組比較差異無統計學意義(t=-1.134,P=0.258)。HBV耐藥基因突變組與未突變組中肝硬化患者的比例分別為24.19%(30/124)、16.50%(17/103),兩組比較差異亦無統計學意義(χ2=2.026,P=0.155)。
2.3 隨訪時間與HCC發生率 對入組的227例患者進行隨訪,中位隨訪時間為28個月(4~58個月)。共有17例患者發生了HCC,HCC總發生率為7.49%。發生HCC者其耐藥基因突變類型見表1,其中基線時HBV耐藥基因突變者有12例,耐藥基因突變類型共有7種;未檢測到耐藥基因突變位點者有5例。
表1 發生HCC的HBV耐藥基因突變類型

2.4 HBV耐藥基因突變者與未檢測到HBV耐藥基因突變者HCC發生率的比較 HBV耐藥基因突變者的HCC發生率為9.68%(12/124),未檢測到HBV耐藥基因突變者的HCC發生率為4.85%(5/103),log-rank檢驗結果顯示HCC發生率在兩組之間差異無統計學意義(χ2=1.983,P=0.159)(圖1)。發生HCC的患者中基線時檢測出HBV耐藥基因突變者占70.59% (12/17),未發生HCC的患者中基線檢測出HBV耐藥基因突變者占53.33%(112/210)。

圖1 HBV耐藥基因突變與未檢測到HBV耐藥基因突變者
HCC發生率
2.5 不同HBV耐藥基因突變類型之間HCC發生率按不同耐藥基因突變類型分為rtM204V/I、rtA181T/V、rtL180M+rtM204V、多位點突變(rtL180M+rtM204V+rtS202G、 rtL180M+rtM204I+rtM250V)4組,其HCC發生率分別為8.7%、16.7%、14.3%、40.0%(表2)。

表2 不同HBV耐藥基因突變類型HCC發生率
3 討論
對于在NAs長期使用的過程中出現病毒學突破或者應答不佳的患者,可通過HBV耐藥基因突變檢測來指導下一步的治療。因此,耐藥檢測在臨床中的應用越來越廣泛。耐藥分為基因型耐藥和表型耐藥。目前,臨床上用于耐藥檢測的方法主要是基因型耐藥檢測,包括PCR產物直接測序法[8]、線性探針反向雜交法(INNO LiPA)[9]等。其中PCR產物直接測序法敏感度較低,突變株數量需達到準種的20%以上才能檢測到。本研究納入的是一組經NAs抗病毒治療后,HBV DNA仍處于較高水平的患者(主要為病毒學突破或者應答不佳的患者)。對于其中未檢測到耐藥基因突變的患者,推測可能與檢測方法的敏感性有關,可能有部分患者體內已經存在耐藥突變株,只因檢測方法敏感性不夠,未能檢測出。也不排除還有部分患者因用藥依從性差而出現病毒學突破[10]。
HBV DNA是一種部分環狀的雙鏈DNA病毒,有4個部分重疊的開放讀碼框(ORF),分別為S、C、P和X基因突變區,其中P區編碼DNA多聚酶,具有逆轉錄酶的活性,所以也稱rt區。S基因突變編碼表面蛋白,由于P區與S區完全重疊,因此,rt區的突變將相應地引起S基因突變。S基因突變可使其編碼的pre-S/S蛋白產生錯義突變、無義突變或者沉默突變。既往研究[11]發現pre-S/S突變可反式激活腫瘤蛋白基因的啟動子。目前,耐藥基因突變與HCC的相關性研究較多的是可產生截短突變的rtA181T和rtM204I。Rodriguez等[12]研究發現rtA181T突變者中有80%~90%發生sW172*突變。rtM204I可導致S基因突變出現sW196L、sW196S和sW196*[13]。
Lai和Yeh[4]發現一位HBsAg陰性、HBeAg陽性的從未接受過拉米夫定及阿德福韋酯治療的肝癌患者的血清、肝臟腫瘤組織和未發生腫瘤的組織中均能檢測出rtA181T/sW172*突變。同時,其裸鼠實驗發現5只裸鼠中有4只注射了可表達rtA181T/sW172*的NIH3T3細胞的裸鼠發生了腫瘤,而注射了野生株及空白對照的細胞則均未產生腫瘤。隨后,Lai等[5]又對8例既往使用拉米夫定并發生了HCC的患者進行研究,發現有7例發生rtA181T/sW172*突變,其細胞實驗和裸鼠實驗同樣說明了rtA181T/sW172*有潛在的致瘤性。但有關rtA181T/sW172*致瘤性的臨床研究較少。Yeh等[14]對123例拉米夫定耐藥者進行的臨床研究中10例檢出rtA181T突變的患者中有3例發生肝癌,而非rtA181T突變者中僅有2例發生肝癌,Kaplan-Meier生存分析顯示:rtA181T/sW172*突變與肝癌的發生呈顯著相關。
目前rtM204I與HCC發生的關系體外研究較少,多為臨床研究,且結果不盡一致。國內歐志英等[15]對47例CHB、45例肝硬化、60例肝癌患者進行了rtM204測序分析,結果表明rtM204突變與HCC的發病無關。國內另一相似研究[16]也認為rtM204突變與HCC的發病無關。而日本學者[17]對247例拉米夫定耐藥患者的研究表明rtM204I可增加HCC發生的風險。韓國學者[18]將432例耐藥者分為HCC組和非HCC組,對可能存在的與HCC相關的因素進行logistic回歸分析,結果提示rtM204I可增加HCC發生風險。
本研究中的227例患者雖進行抗病毒治療,但其病毒平均值在5 log10IU/ml以上,基線時肝硬化患者占20.7%,中位隨訪28個月的總HCC發生率為7.49%。此結果與臺灣的一項研究[19]相似,該研究對未進行抗病毒治療的215例進展期肝纖維化患者(Ishak肝纖維化評分>4分)中位隨訪32.4個月的HCC發生率為7.4%。提示HBV感染者雖進行了抗病毒治療,但如果HBV DNA未得到持續抑制,其HCC發生率與未進行抗病毒的患者HCC發生率結果相當,HCC發生的風險仍然較高。
本研究中HBV耐藥基因突變者的HCC發生率為9.68%,未檢測到HBV耐藥基因突變者的HCC發生率為4.85%,且兩組患者基線時HBV DNA水平及肝硬化患者的比例之間均無明顯差異。本研究還發現中位隨訪28個月后出現HCC的患者中在基線時檢測到耐藥基因突變者占70.59%,而未發生HCC的患者中在基線時檢測到耐藥基因突變者占53.33%。提示在使用NAs抗病毒治療過程中HBV未被有效控制的患者中,出現HBV耐藥基因突變者與未出現HBV耐藥基因突變者相比,其HCC發生的比率有增高的趨勢,但這種差異是否提示出現耐藥基因突變者HCC發生的風險增高,尚需更長時間、更大樣本的研究加以證實。
進一步對不同HBV耐藥基因突變類型之間HCC發生的差異進行研究發現,在rtM204 V/I突變基礎上同時發生rtL180M突變者較僅僅為rtM204V突變者HCC發生率高;在此基礎上再加另外一位點的突變如rtS202G或rtM250V,HCC的發生率也有所提高,提示突變位點增加可能會增加HCC的發生;對于12例發生rtA181T/V突變者,雖然僅為單位點突變,但也有2例發生了HCC(16.7%),其HCC的發生率高于rtM204V/I單位點或rtL180M+ rtM204V雙位點突變,提示rtA181T/V突變者可能更易發生HCC。但這些推論尚有待進一步擴大樣本來研究證實。
[1] World Health Organization. Guidelines for the prevention, care and treatment of persons with chronic hepatitis B infection[EB/OL]. [2015-03] http://www.who.int/hepatitis/publications/hepatitis-b-guidelines/en/.
[2] ZHUANG H. Interpretation of expert consensus on drug resistance in treatment of chronic hepatitis B with nucleos(t)ide analogues and its management[J]. J Med Res, 2013, 42(9): 1-2.(in Chinese) 莊輝. 核苷(酸)類藥物治療慢性乙型肝炎耐藥及其管理專家共識解讀[J]. 醫學研究雜志, 2013, 42(9): 1-2.
[3] di MARCO V, MARZANO A, LAMPERTICO P, et al. Clinical outcome of HBeAg-negative chronic hepatitis B in relation to virological response to lamivudine[J]. Hepatology, 2004, 40(4): 883-891.
[4] LAI MW, YEH CT. The oncogenic potential of hepatitis B virus rtA181T/surface truncation mutant [J]. Antivir Ther, 2008, 13(7): 875-879.
[5] LAI MW, HUANG SF, HSU CW, et al. Identification of nonsense mutations in hepatitis B virus S gene in patients with hepatocellular carcinoma developed after lamivudine therapy [J]. Antivir Ther, 2009, 14(2): 249-261.
[6] Chinese Society of Hepatology and Chinese Society of Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for chronic hepatitis B : a 2015 update[J]. J Clin Hepatol, 2015, 31(12): 1941-1960. (in Chinese) 中華醫學會肝病學分會, 中華醫學會感染病學分會. 慢性乙型肝炎防治指南(2015年更新版)[J]. 臨床肝膽病雜志, 2015, 31(12): 1941-1960.
[7] Ministry of Health of the People′s Republic of China. Updated standards for the diagnosis and treatment of primary liver cancer(2011)[J]. J Clin Hepatol, 2011, 27(11): 1141-1159.(in Chinese) 中華人民共和國衛生部. 原發性肝癌診療規范(2011年版)[J]. 臨床肝膽病雜志, 2011, 27(11): 1141-1159.
[8] LAMONTAGNE J, MILLS C, MAO R, et al. Screening and identification of compounds with antiviral activity against hepatitis B virus using a safe compound library and novel real-time immune-absorbance PCR-based high throughput system [J]. Antiviral Res, 2013, 98(1): 19-26.
[9] MESE S, ARIKAN M, CAKIRIS A, et al. Role of the line probe assay INNO-LiPA HBV DR and ultradeep pyrosequencing in detecting resistance mutations to nucleoside/nucleotide analogues in viral samples isolated from chronic hepatitis B patients [J]. J Gen Virol, 2013, 94(12): 2729-2738.
[10] HONGTHANAKORN C, CHOTIYAPUTTA W, OBERHELMAN K, et al. Virological breakthrough and drug-resistance in patients with chronic hepatitis B receiving nucleos (t) ide analogues in clinical practice [J]. Hepatology, 2011, 53(6): 1854-1863.
[11] KEKULé AS, LAUER U, MEYER M, et al. The preS2/S region of integrated hepatitis B virus DNA encodes a transcriptional transactivator [J]. Nature, 1990, 343(6257): 457-461.
[12] RODRIGUEZ C, CHEVALIEZ S, BENSADOUN P, et al. Characterization of the dynamics of hepatitis B virus drug-resistance to adefovir by ultra-deep pyrosequencing [J]. Hepatology, 2013, 58(3): 890-901.
[13] VIETHEER PT, NETTER HJ, SOZZI T, et al. Failure of the lamivudine-resistant rtM204I hepatitis B virus mutants to efficiently support hepatitis delta virus secretion[J]. J Virol, 2005, 79(10): 6570-6573.
[14] YEH CT, CHEN T, HSU CW, et al. Emergence of the rtA181T/sW172*mutant increased the risk of hepatoma occurrence in patients with lamivudine-resistant chronic hepatitis B[J]. BMC cancer, 2011, 11: 398.
[15] OU ZY, ZHANG YJ, ZHAGN R, et al. Relationship between mutation of HBV YMDD motif and pathogenesis of hepatocellular carcinoma[J]. J Trop Med, 2008, 8(6): 525-528. (in Chinese) 歐志英, 張耀軍, 張韌, 等. HBV YMDD模序突變及其與肝癌發生的關系[J]. 熱帶醫學雜志, 2008, 8(6): 525-528.
[16] WANG LN, LI XF. Correlation study on hepatitis B virus YMDD variation in primary hepatic carcinoma [J]. Lab Med, 2012, 27(12): 1047-1049. (in Chinese) 王麗娜, 李曉斐. 乙型肝炎病毒YMDD變異與原發性肝癌相關性研究[J]. 檢驗醫學, 2012, 27(12): 1047-1049.
[17] HOSAKA T, SUZUKI F, KOBAYASHI M, et al. Development of HCC in patients receiving adefovir dipivoxil for lamivudine-resistant hepatitis B virus mutants [J]. Hepatol Res, 2010, 40(2): 145-152.
[18] JUN CH, HONG HJ, CHUNG MW, et al. Risk factors for hepatocellular carcinoma in patients with drug-resistant chronic hepatitis B [J].World J Gastroenterol, 2013, 19(40): 6834-6841.
[19] LIAW YF, SUNG JJ, CHOW WC, et al. Lamivudine for patients with chronic hepatitis B and advanced liver disease [J]. N Engl J Med, 2004, 351(15): 1521-1531.
引證本文:PANG T, XING HC. Correlation between drug-resistance gene mutations and hepatocellular carcinoma in patients with hepatitis B virus infection[J]. J Clin Hepatol, 2017, 33(1): 82-86. (in Chinese) 龐婷, 邢卉春. HBV感染者耐藥基因突變與肝細胞癌的相關性分析[J]. 臨床肝膽病雜志, 2017, 33(1): 82-86.
(本文編輯:劉曉紅)
·國外期刊精品文章簡介·
Correlation between drug-resistance gene mutations and hepatocellular carcinoma in patients with hepatitis B virus infection
PANGTing,XINGHuichun.
(LiverResearchCenter,BeijingDitanHospital,CapitalMedicalUniversity,Beijing100015,China)
Objective To investigate the correlation between hepatitis B virus (HBV) drug-resistance gene mutations and hepatocellular carcinoma (HCC). Methods The clinical data of treatment-experienced patients, who underwent examination for HBV drug-resistance gene mutations in Beijing Ditan Hospital from January 1 to December 31, 2013, and still had detectable HBV DNA after being treated with nucleos(t)ide analogues, were collected. All the patients were followed up, and the development of HCC was considered as the clinical outcome. The correlation between drug-resistance gene mutations and the development of HCC in patients with HBV infection was analyzed. The chi-square test was used for comparison of categorical between groups, thet-test was used for comparison of continuous data between two groups, and the log-rank test was used for comparison of the incidence of HCC between two groups. Results A total of 227 patients were enrolled in this study. According to the results of the detection of HBV drug-resistance gene mutations, 103 patients (103/227, 45.37%) had no drug-resistance gene mutations and 124 (124/227, 54.63%) had drug-resistance gene mutations. There were no significant differences between the mutation group and the non-mutation group in HBV DNA load (5.19±1.60 log10IU/ml vs 5.44±1.75 log10IU/ml,t=-1.134,P=0.258) and the percentage of patients with liver cirrhosis (24.19% (30/124) vs 16.50% (17/103),χ2=2.026,P=0.155). The median follow-up was 28 months (range 4-58 months), and the incidence of HCC was 7.49% (17/227). Among the patients with HBV drug-resistance gene mutations, 12 (12/124, 9.68%) developed HCC, and among those without HBV drug-resistance gene mutations, 5 (5/103, 4.85%) developed HCC. Among the patients who developed HCC, 70.59% (12/17) had HBV drug-resistance gene mutations at baseline; among the patients who did not develop HCC, 53.33% (112/210) had HBV drug-resistance gene mutations at baseline. Conclusion The patients with poor control of HBV DNA during antiviral therapy have a comparable incidence of HCC to those not treated with antiviral therapy, with a relatively high risk of developing HCC; the treated patients with HBV drug-resistance gene mutations may have a higher risk of HCC than those without such mutations, which needs to be confirmed by the studies with a longer follow-up period and a larger sample size.
hepatitis B virus; carcinoma, hepatocellular; mutation; drug resistance
10.3969/j.issn.1001-5256.2017.01.017
2016-08-08;
2016-11-03。
“十二五”國家科技重大專項(2014ZX10005001);國家自然科學基金(81201160);北京市中醫藥科技項目(JJ2014-25)
龐婷(1988-),女,主要從事慢性病毒性肝炎及相關肝病的研究。
邢卉春,電子信箱:huichunxing@126.com。
R512.62; R735.7
A
1001-5256(2017)01-0082-05

