sco1135基因對天藍色鏈霉菌M145孢子形成及次級代謝產物合成的調控研究
馬軍霞張佩佩王世立曹廣祥(1. 濟南大學 山東省醫學科學院醫學與生命科學學院,濟南 250022;2. 山東省醫藥生物技術研究中心,濟南 250062;. 山東大學 微生物技術國家重點實驗室,濟南 250100)
sco1135基因對天藍色鏈霉菌M145孢子形成及次級代謝產物合成的調控研究
馬軍霞1,2張佩佩3王世立1,2曹廣祥1,2
(1. 濟南大學 山東省醫學科學院醫學與生命科學學院,濟南 250022;2. 山東省醫藥生物技術研究中心,濟南 250062;3. 山東大學 微生物技術國家重點實驗室,濟南 250100)
旨在研究sco1135基因缺失突變對天藍色鏈霉菌M145菌株形態及次級代謝的影響。通過PCR-targeting方法獲得重組質粒pSJ1135,通過接合轉移將其導入天藍色鏈霉菌M145,獲得sco1135基因缺失突變菌株△sco1135,并以pMS82為載體構建回補菌株△sco1135com,同時以pMS82為空載對照;隨后對野生型菌株、突變菌株和回補菌株進行表型分析和抗生素定量觀察。結果顯示,表型分析及抗生素定量測定發現,在YBP培養基上△sco1135產孢明顯延遲于野生型M145,放線紫紅素(ACT)產量明顯增加,突變株培養基中ACT產量是野生菌株培養基中的2-3倍;轉錄分析結果表明,48 h時突變株部分與產孢相關基因的轉錄水平較野生型降低了50%-75%,72 h時突變株部分與產ACT相關基因的轉錄水平較野生型提高13-20倍。sco1135基因參與調控M145的孢子形成及次級代謝產物ACT的產生。
天藍色鏈霉菌M145;sco1135;表型變化;孢子形成;次級代謝產物
鏈霉菌能產生大量具有重要生物活性的次級代謝產物,其中許多已被廣泛應用于醫學、農業和畜牧業等多個領域[1]。目前已經應用于臨床的抗生素有一半以上分離自鏈霉菌,如氯霉素、四環素、紅霉素、利福霉素等;鏈霉菌在發酵過程中產生的阿維菌素可以應用于畜牧業或農業生產中,作為殺螨劑、殺蟲劑使用。鏈霉菌次級代謝物的合成由營養和環境因素敏感的多個并行調控網絡共同調控[2,3]。
天藍色鏈霉菌[Streptomyces coelicolor A3(2)]作為鏈霉菌的模式菌株,已于2002年完成測序[4]。天藍色鏈霉菌生長繁殖過程極其復雜,具體過程為:首先孢子萌發長出絲狀體并延伸至培養基中形成基內菌絲,生長到一定階段后基內菌絲向培養基外部生長形成氣生菌絲,并合成一系列的次級代謝產物[5],隨后氣生菌絲頂端分化為孢子絲,成熟斷裂形成孢子。研究表明其可以產生至少4種次級代謝產物:放線紫紅素(Actinorhodin,ACT)、十一烷基靈菌紅素(Undecylprodigiosin,RED)、次甲基霉素(Methylenomycin,Mmy)、鈣依賴抗生素(Calciumdependent antibiotic,CDA),還有一種隱性代謝產物黃色色素coelimycin P1[6,7]。
雙組份信號轉導系統(TCS)是原核生物一種普遍且重要的信號轉導系統,TCS由組氨酸激酶(Histidine kinase,HK)和應答調節蛋白(Response regulator,RR)組成,通過蛋白磷酸化形式進行信號傳遞和轉換[8]。天藍色鏈霉菌中有67對典型的TCS,部分TCS的功能已被鑒定,如PhoR-P、AbsA1/A2和AfsQ1/Q2等。非典型的TCS包括不成對的HK和孤立的RR,目前對它們的調控研究并不深入,本研究中的sco1135為鏈霉菌中的孤立調控蛋白,為進一步研究sco1135參與次級代謝的復雜調控網絡,我們對sco1135在參與形態發育及次級代謝物合成方面的分子調控機制進行研究。
本研究在S. coelicolor M145的基礎上,運用分子生物學方法構建sco1135的缺失突變菌株△sco1135和回補菌株△sco1135com,通過表型分析、抗生素定量觀察以及qRT-PCR的方法,對△sco1135和△sco1135com的孢子生長、抗生素合成以及相應的分子機制進行研究,以期闡明sco1135對S. coelicolor M145的生長發育和次級代謝物合成的調控機制。
1 材料與方法
1.1 材料
1.1.1 菌株和質粒 本研究所用菌株及質粒,見表1。
1.1.2 引物 本研究所用的引物,見表2。
1.1.3 培養基及培養條件 LB培養基用于大腸桿菌培養,培養溫度30℃或37℃;MS(SFM)、YBP、R2、R2YE、MM、MYM培養基用于鏈霉菌培養,培養溫度30℃;培養基配制過程見鏈霉菌操作手冊[9]。
1.1.4 試劑 限制性內切酶及用于擴增的高保真酶Fastpfu DNA聚合酶購自Thermo Scientific公司,用于 qRT-PCR的 SYBR Premix Ex Taq(Tli RNaseH Plus)購于TaKaRa公司。
1.2 方法
1.2.1 天藍色鏈霉菌缺失突變菌株和回補菌株的構建 為了確定天藍色鏈霉菌基因組中sco1135的功能,本研究對sco1135進行了同框缺失突變(inframe deletion)。突變株的構建流程為:(1)擴增帶有sco1135基因上下45 bp序列的Apr抗性片段,大小為1 459 bp;(2)將cosmid7B11轉入BW25113/pIJ790,作為PCR-targeting[12]的宿主細胞;(3)抗性片段上sco1135的同源序列與7B11上的序列發生同源重組,得到突變cosmid 7B11∷aac(3)IV;(4)將突變cosmid 7B11∷aac(3)IV轉入ET12567/pUZ8002,與M145進行屬間接合轉移;(5)接合轉移在MS培養基上培養,待長出接合轉移子后接種到MS(Apr)培養基上進行兩輪篩選培養,得到突變株△sco1135;為了確定△sco1135的表型變化是否由sco1135基因缺失引起的,本研究以pMS82為載體,對△sco1135進行基因回補,將帶啟動子的sco1135整合到突變株中得到回補菌株△sco1135com,回補序列包括上游含啟動子的328 bp序列、目的基因和下游的94 bp序列。同時,為排除載體pMS82對鏈霉菌形態分化和抗生素合成的影響,用含有pMS82的M145菌株作對照。本研究所涉及的DNA相關的分子生物學實驗操作具體方法參見分子克隆實驗指南[13],鏈霉菌基因組的提取等具體方法參見鏈霉菌手冊[9]。
1.2.2 菌株平板表型觀察 將野生型M145、△sco-1135、△sco1135com和M145/pMS82菌株的孢子分別劃線于YBP、MS、R2、R2YE、MM和MYM固體培養基上,30℃倒置培養,從24 h開始每隔12 h觀察記錄各個菌株的生長狀態和表型差異。

表1 本研究中所用的菌株及質粒

表2 本研究中所用的引物及其序列
1.2.3 菌體生長曲線、放線紫紅素和十一烷基靈菌紅素產量的測定 利用YBP固體培養基對不同時間點M145、△sco1135和△sco1135com的菌體生長量及天藍色鏈霉菌中ACT和RED的產量進行測定,具體參見Yu等[14]方法。
1.2.4 M145野生型菌株和突變菌株的部分基因轉錄水平分析 利用試劑盒進行天藍色鏈霉菌野生型和突變型菌株總RNA的提取,得到的RNA與六核苷酸隨機引物在65℃下進行退火,在反轉錄酶M-MLV作用下,將總RNA樣品中的mRNA反轉錄成cDNA。選取部分與孢子形成及產素有關的基因,根據序列設計特異性引物,以M145基因組中的hrdB基因為內參,以cDNA為模板,對M145野生型菌株和突變菌株中部分基因進行qRT-PCR分析,定量測定基因表達水平的差異。
2 結果
2.1 sco1135突變菌株和回補菌株的構建及驗證
我們通過同框缺失突變的方法獲得了突變菌株△sco1135和回補菌株△sco1135com,利用表2中引 物 1135-Verify-Forward和1135-Verify-Reverse對△sco1135和△sco1135com進行PCR驗證。理論上,發生雙交換的突變株會擴增出一條1 591 bp的條帶,由于回補DNA片段整合到突變株基因組上的位置并不是整合到sco1135的原先位置,所以擴增可以得到兩條帶:1 591 bp的回補片段擴增條帶和679 bp的sco1135基因原位缺失后的擴增條帶。
如圖1-D所示,野生型M145擴增出一條約679 bp的條帶(泳道1);突變菌株(泳道2)對應的擴增條帶1 591 bp,回補菌株擴增出一條野生型條帶和一條突變型條帶,與理論(圖1)相一致。
2.2 sco1135對M145孢子產生的調節
本研究分別在MS、R2、R2YE、MM、YBP和MYM培養基上對M145野生型、△sco1135、△sco1135com及M145/pMS82對照菌株的孢子生長過程進行表型觀察。發現四者在MS、R2、R2YE、MM和MYM固體培養基上的孢子形成過程基本相同。如圖2所示,在YBP培養基上,M145在60 h時開始生長出氣生菌絲,隨著培養時間的延長,ACT擴散到培養基中,氣生菌絲分化成孢子,120 h M145已產生大量孢子,并且孢子豐滿,顏色為灰色;而△sco1135產孢明顯延遲于野生型M145;pMS82空載對照菌株形態發育基本同步于突變菌株。
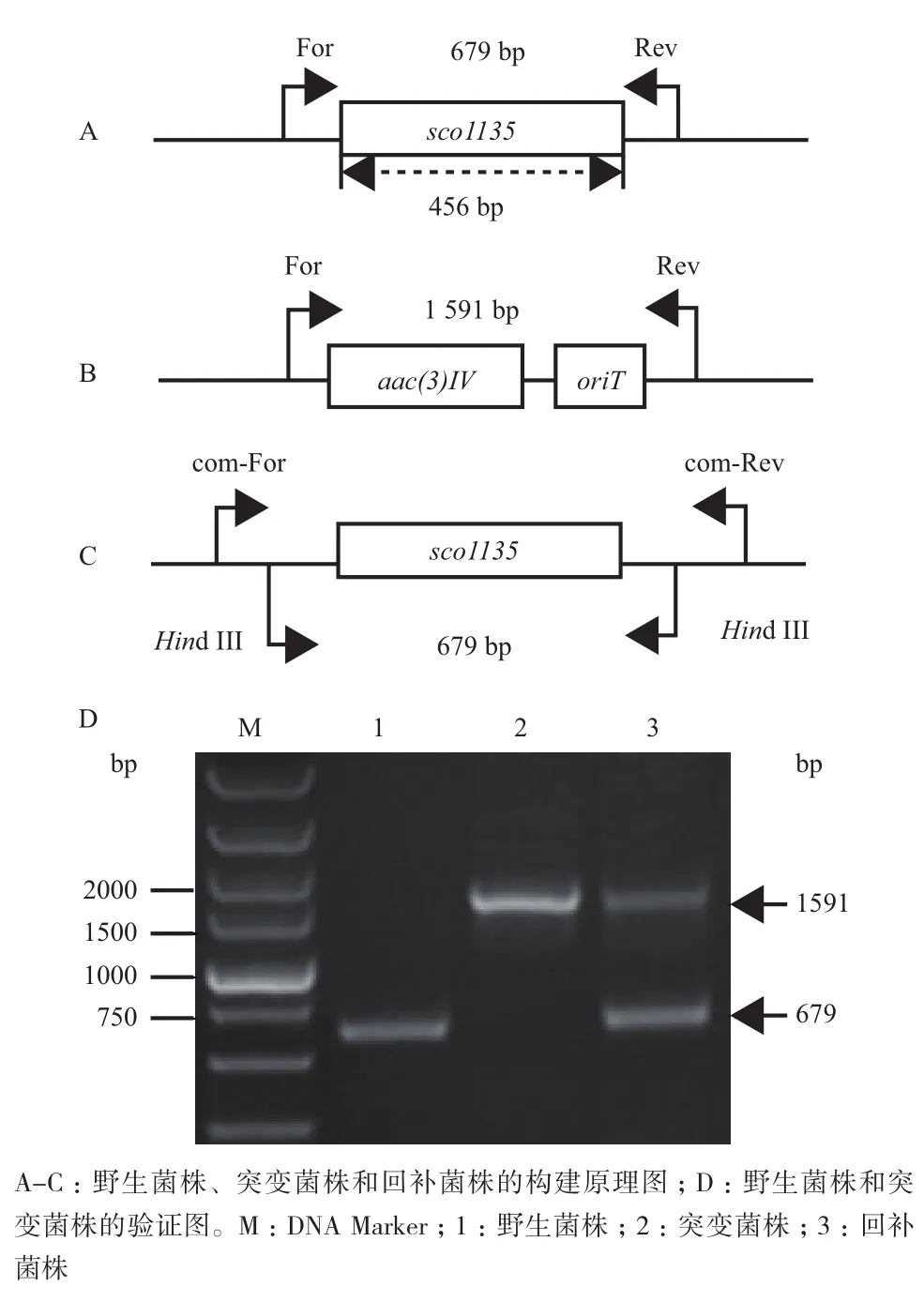
圖1 △sco1135和△sco1135com構建原理圖及菌株驗證

圖2 M145、△sco1135、△sco1135com和M145/pMS82在YBP培養基上產孢對比
2.3 sco1135對M145次級代謝產物的調節
為了研究sco1135 對M145次級代謝產物的影響,我們在YBP培養基上分別培養M145、△sco1135及△sco1135com進行抗生素定量觀察。如圖3所示,野生型M145生長至60 h時開始產生ACT,ACT產量隨著培養時間的延長不斷累積,120 h培養基整體呈現深藍色;72 h后,△sco1135培養基顏色深于同期的M145。
圖3 M145、△sco1135和△sco1135com在YBP培養基上次級代謝差異
檢測不同發酵時間點YBP固體培養基和菌體的上清液吸光度值OD640。定量ACT的產生水平,如圖4-A和B顯示,后期培養基和菌體中突變菌株的ACT產量是野生菌株的2-3倍,測定結果經統計學分析發現,72 h后同一時間點野生菌株和突變菌株中的ACT產量均具有顯著差異。
檢測不同發酵時間點的菌體沉淀甲醇鹽酸浸出液的、吸光度值OD530定量RED的產生水平,結果(圖4-C)顯示,△sco1135在各個時間點的RED產生水平跟野生型并沒有明顯差異,與培養基觀察結果(圖3)基本一致。
同時對M145野生型、突變型及回補菌株的菌體干重進行了定量分析,結果(圖4-D)顯示,突變菌株和回補菌株的菌體干重接近同期野生型。

圖4 M145、△sco1135和△sco1135com的ACT、RED產量和生長曲線對比
2.4 孢子形成相關基因的轉錄水平分析
我們選取部分與形態發育相關的基因:whi(sco3034、sco6029、sco1950、sco5819)、ram(sco6681、sco6682)、bld(sco1489、sco5723)、chp(sco1674、sco1800、sco2699、sco2716、sco7257、sco2699),對它們在M145和△sco1135中的表達水平進行定量分析。表型觀察(圖2)顯示,M145在60 h時已經生長出氣生菌絲,說明在60 h前M145和△sco1135生長情況已經開始發生變化,所以我們提取M145和△sco1135在YBP培養基上生長48、60和72 h的RNA,利用qRT-PCR對whi(sco3034、sco6029、sco1950、sco5819)、ram(sco6681、sco6682)、bld(sco1489、sco5723)和chp(sco1674、sco1800、sco-2699、sco2716、sco7257、sco2705)基因的表達水平進行了定量分析。
實驗結果表明48 h時產孢相關基因在突變株和野生型中的表達量有明顯差異,我們將每個基因在M145中48 h的表達值設定為1,突變株的數值為與M145中相應表達量的比值。chp基因分別在M145和△sco1135中48 h的表達水平比較(圖5-A)顯示,sco1800、sco2699、sco7257和 sco2705在M145和△sco1135中的表達水平并沒有明顯的差異,而sco2716(chpA)和sco1674(chpC)在M145中的表達量分別是在△sco1135中表達量的2.5倍和5倍;whi基因分別在M145和△sco1135中48 h的表達水平比較(圖5-B)表明,M145中sco5819(whiH)的表達水平約是在△sco1135中表達水平的2倍,而sco3034、sco6029和sco1950在M145和△sco1135中的表達水平并沒有明顯差異;檢測的其余部分ram、bld基因的表達量在M145和△sco1135中基本持平。以上結果說明sco1135能夠調控chpA、chpC和whiH基因的表達來調控孢子的形成。
2.5 次級代謝產物合成相關基因的轉錄水平分析
選取部分與次級代謝產物ACT合成相關的基因act(sco5085、sco5072、sco5086),對它們在M145和△sco1135中的表達水平進行定量分析。結果發現,72 h時基因在M145和△sco1135中的表達水平有明顯差異,將每個基因在M145中72 h的表達值設定為1,突變株的數值為與M145中相應表達量的比值。結果(圖6)顯示,sco5085、sco5072和sco5086在△sco1135中的表達水平約是在M145中表達水平的13-20倍,說明sco1135可通過調控sco5085、sco5072和sco5086的表達調控ACT的合成。
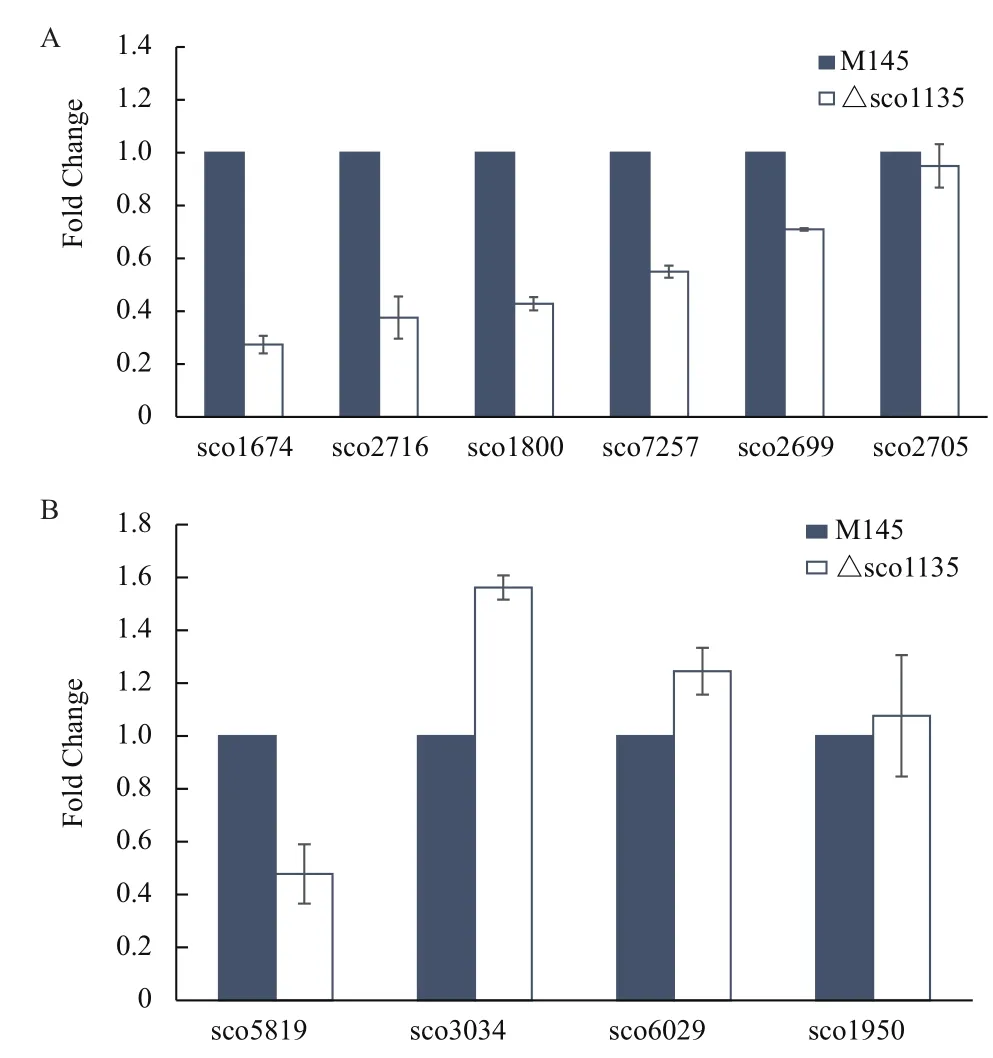
圖5 qRT-PCR檢測M145和△sco1135中chp(A)和whi(B)系列部分基因轉錄水平
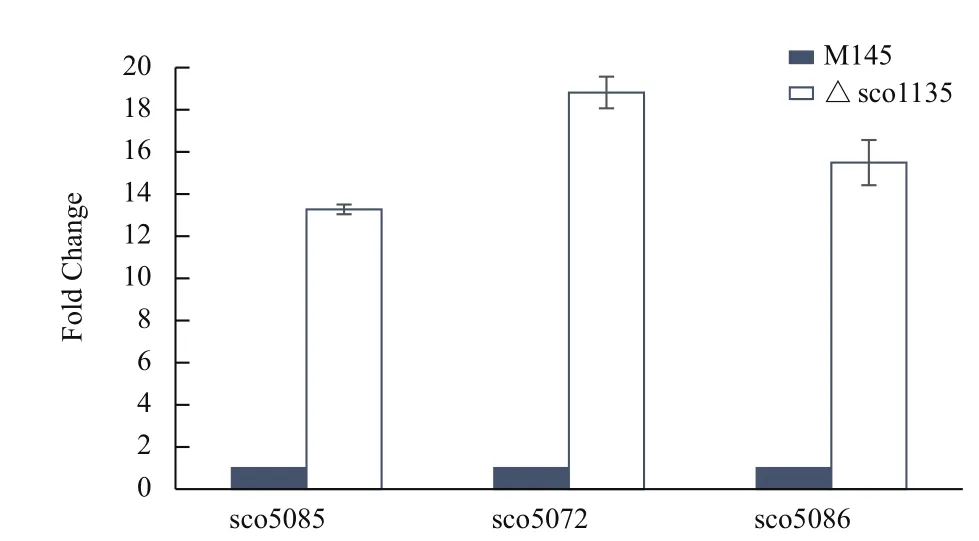
圖6 qRT-PCR檢測M145和△sco1135中act系列部分基因轉錄水平
3 討論
Brandan Hillerich教授課題組研究的天藍色鏈霉菌M145中sco1135基因的缺失導致突變株在培養基MYM上不產孢,與孢子產生相關的基因whiG(sco6021)、whiB(sco3034)和whiH(sco5819)在突變菌株中均不表達;該課題組的另一研究表明,sco1135基因產物是一種DNA結合蛋白,能夠直接與sco1135和sco1134間的基因間隔區反應抑制轉錄,增強黃嘌呤脫氫酶的活性[15]。與該研究不同的是,本研究構建了sco1135的突變菌株△sco1135和回補菌株△sco1135com,通過表型分析、抗生素定量觀察發現△sco1135在YBP培養基上出現產孢延遲,ACT產量提高的現象,因此我們通過qRT-PCR對sco1135部分產孢相關基因(whi、ram、bld、chp)和產ACT相關基因(act)進行了分析。其中whi基因是M145產孢所必需的基因[16],sco3034、sco6029、sco1950、sco5819基因在氣生菌絲和孢子發育過程中起到關鍵作用;ram基因簇(sco6681-sco6685)是M145孢子發育過程中的關鍵基因[17];bld基因簇包括bldA、sco1489、sco5723、sco3323等13個基因,sco1489(bldD)是M145孢子發育過程中起中心作用的調節子,負調控其它bld基因[18];chp基因簇包含M145氣生菌絲脫離基質菌絲周圍水性環境生長到空氣中所必需的基因[19],包括 sco1674、sco1675、sco1800、sco2699、sco2716、sco2717、sco2718、sco7257八個基因。通過數據分析發現,48 h時chpA、chpC和whiH基因在突變菌株中的表達水平較野生型中降低了50%-75%,與表型分析結果一致,說明sco1135能夠調控chpA、chpC和whiH基因的表達來調控孢子的形成。其次我們檢測了部分act基因(sco5085、sco5072、sco5086)在M145和△sco1135中表達水平的差異,act能夠特異性調控天藍色鏈霉菌中ACT的合成,act基因簇包括sco5072-sco5092,sco5085是調控基因,它可以正調控M145中放線菌素的合成,其基因缺失將導致放線菌素合成基因簇中部分基因不轉錄[20,21];sco5072和sco5086是結構基因,分別編碼羥脂酰-CoA脫氫酶和酮脂酰還原酶。轉錄水平分析結果發現72 h時sco5085、sco5072、sco5086在突變株中的轉錄水平較野生型提高13-20倍,因此sco1135可以通過調控sco5085、sco5072和sco5086的表達來調控ACT的合成。
4 結論
本研究構建了sco1135的缺失突變菌株△sco-1135和回補菌株△sco1135com發現,△sco1135在MYM培養基上能夠正常生長,而在YBP培養基上出現產孢延遲和ACT產量提高的現象,△sco1135com的孢子生長和抗生素ACT產量基本與同期野生菌株一樣。此外,轉錄水平分析發現,sco1135能夠調控基 因sco2716、sco1674、sco5819、sco5085、sco5072和sco5086的表達,從而間接參與調控M145的孢子形成及次級代謝產物ACT的產生。
[1]Challis GL, Hopwood DA. Synergy and contingency as driving forces for the evolution of multiple secondary metabolite production by Streptomyces species[J]. Proc Natl Acad Sci USA, 2003, 100(Suppl 2):14555-14561.
[2]Hopwood DA. Therapeutic treasures from the deep[J]. Nat Chem Biol, 2007, 3(8):457-458.
[3]Nodwell JR. Novel links between antibiotic resistance and antibiotic production[J]. J Bacteriol, 2007, 189(10):3683-3685.
[4]Bentley SD, Chater KF, Cerde?o-Tárraga AM, et al. Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2)[J]. Nature, 2002, 417(6885):141-147.
[5]Hwang KS, Kim HU, Charusanti P, et al. Systems biology and biotechnology of Streptomyces species for the production of secondary metabolites[J]. Biotechnol Adv, 2014, 32(2):255-268.
[6] Gomez-Escribano JP, Song L, Fox DJ, et al. Structure and biosynthesis of the unusual polyketide alkaloid coelimycin P1, a metabolic product of the cpk gene cluster of Streptomyces coelicolor M145[J]. Chemical Science, 2012, 3:2716-2720.
[7]Liu G, Chandra G, Tan H, et al. Molecular regulation of antibiotic biosynthesis in Streptomyces[J]. Microbiol Mol Biol Rev, 2013, 77(1):112-143.
[8]Wang W, Shu D, Lu Y, et al. Cross-talk between an orphan response regulator and a noncognate histidine kinase in Streptomyces coelicolor[J]. FEMS Microbiol Lett, 2009, 294(2):150-156.
[9]Kieser T, Bibb M, Buttner M, et al. Practical Streptomyces Genetics:a laboratory Manual[M]. Norwich:John Innes Foundation, 2000.
[10]Gust B, Challis GL, Fowler K, et al. PCR-targeted Streptomyces gene replacement identifies a protein domain needed for biosynthesis of the sesquiterpene soil odor geosmin[J]. Proc Natl Acad Sci USA, 2003, 100:1541-1546.
[11]Gregory MA, Till R, Smith MC. Integration site for Streptomyces phage phiBT1 and development of site-specific integrating vectors[J]. Journal of Bacteriol, 2003, 185(17):5320-5323.
[12]Gust B, Kieser T, Chater KF. Redireccted technology:PCR-targeting sysrem in Streptomyces coelicolor A3(2):a laboratory manual[M]. Norwich:John Innes Foundation, 2002.
[13]Sambrook J, Russell D. Molecular Cloning:A Laboratory Manual[M]. New York:Cold Spring Harbor Laboratory Press, 2001.
[14] Yu Z, Zhu H, Dang F, et al. Differential regulation of antibiotic biosynthesis by DraR-K, a novel two-component system in Streptomyces coelicolor[J]. Mol Microbiol, 2012, 85(3):535-556.
[15]Hillerich B, Westpheling J. A new TetR family transcriptional regulator required for morphogenesis in Streptomyces coelicolor[J]. Journal of Bacteriol, 2008, 190(1):61-67.
[16]Chater KF. Regulation of sporulation in Streptomyces coelicolor A3(2):A checkpoint multiplex?[J]. Current Opinion in Microbiology, 2001(4):667-673.
[17] Keijser BJ, van Wezel GP, Canters GW, et al. The Ram-dependence of Streptomyces lividans difference is by bypassed by copper[J]. J Molecul Microbiol Biotechnol, 2014, 82(6):1093-1098.
[18]Kim JM, Won HS, Kang SO. The C-terminal domain of the transcriptional regulator BldD from Streptomyces coelicolor A3(2)constitutes a novel fold of winged-helix domains[J]. Proteins, 2014, 82(6):1093-1098.
[19]Bibb MJ, Domonkos A, Chandra G, et al. Expression of the chaplin and rodlin hydrophobic sheath proteins in Streptomyces venezuelae is controlled by σBldN and a cognate anti-sigma factor, RsbN[J]. Molecular Microbiology, 2012, 84(6):1033-1049.
[20]Taguchi T, Itou K, Ebizuka Y, et al. Chemical characterisation of disruptants of the Streptomyces coelicolor A3(2)actVI genes involved in actinorhodin biosynthesis[J]. Journal of Antibiotics, 2000, 53(2):144-152.
[21]Iqbal M, Mast Y, Amin R, et al. Extracting regulator activity profiles by integration of de novo motifs and expression data:characterizing key regulators of nutrient depletion responses in Streptomyces coelicolor[J]. Nucleic Acids Res, 2012, 40(12):5227-5239.
(責任編輯 馬鑫)
Regulatory Effects of Gene sco1135 on the Sporulation and Secondary Metabolite Synthesis of Streptomyces coelicolor M145
MA Jun-xia1,2ZHANG Pei-pei3WANG Shi-li1,2CAO Guang-xiang1,2
(1. School of Medicine and Life Sciences,University of Jinan-Shandong Academy of Medical Sciences,Ji’nan 250022;2. Shandong Medicinal Biotechnology Center,Ji’nan 250062;3. The State Key Laboratory of Microbial Technology,Shandong University,Ji’nan 250100)
This work aims to study the effects of deletion and mutation of gene sco1135 on the morphogenesis and secondary metabolism in Streptomyces coelicolor strain M145. Recombinant plasmid pSJ1135 was obtained by PCR-targeting. Gene deletion mutant of sco1135(△sco1135)was acquired by introducing the recombinant plasmid into the Streptomyces coelicolor M145 via conjugation and transformation,and the complemented strain △sco1135com was constructed using the vector pMS82. Using pMS82 as a control,the phenotypes of the parental wild strain(M145),mutant strain(△sco1135)and complemented strain(△sco1135com)were analyzed and observed with quantitative antibiotics. The results of phenotypic analysis and observation with quantitative antibiotics revealed that the sporulation in △sco1135 obviously delayed than that of the wild type M145 on YBP medium;while the actinorhodin(ACT)production in △sco1135 increased to 2-3 folds of that in M145. The transcriptions of some sporulation-related genes decreased by 50%-75% in △sco1135 at 48 h,while the transcriptional expressions of genes related to ACT in △sco1135 increased to 13-20 folds at 72 h,compared to the M145. Conclusively,sco1135 is involved in regulating the sporulation in M145 and also the production of secondary metabolite ACT.
Streptomyce coelicolor M145;sco1135;phenotypic changes;sporulation;secondary metabolite
10.13560/j.cnki.biotech.bull.1985.2017.01.016
2016-09-20
山東省醫學科學院醫藥衛生科技創新工程
馬軍霞,女,碩士,研究方向:微生物次級代謝產物合成調控;E-mail:shuipin_gzuo@163.com
曹廣祥,男,副研究員,研究方向:微生物與生化藥物;E-mail:caozhong0402@163.com

