暖溫帶森林土壤酶活性對增溫的響應及其環境解析
王 一,劉彥春 ,劉世榮
(中國林業科學研究院森林生態環境與保護研究所, 國家林業局森林生態環境重點實驗室,北京 100091)
暖溫帶森林土壤酶活性對增溫的響應及其環境解析
王 一,劉彥春 ,劉世榮*
(中國林業科學研究院森林生態環境與保護研究所, 國家林業局森林生態環境重點實驗室,北京 100091)
[目的]模擬氣候變化背景下土壤酶活性季節變化規律和土壤酶活性對環境因子變異的響應,以深入理解氣候變化背景下微生物因素在調控土壤碳循環過程中的作用。[方法]以暖溫帶銳齒櫟林土壤為研究對象,采用紅外輻射增溫技術和96孔-微平板法測定了生長季和非生長季土壤水解酶和氧化酶活性,解析環境因子在調控土壤酶活性季節變異中的作用。[結果]顯示:增溫處理在生長季顯著提高土壤溫度1.91℃,導致土壤有機碳含量顯著降低了12.15%,微生物量碳氮顯著增加了40.30%和61.29%;增溫處理在非生長季顯著提高土壤溫度2.24℃,但對微生物量碳氮影響并不顯著。增溫處理對土壤專一酶活性的影響存在季節差異,生長季除N-乙酰-葡糖苷酶外增溫處理降低了土壤專一酶活性;非生長季除β-葡糖苷酶和蛋白酶外增溫處理增加了土壤專一酶活性。環境因子可以解釋土壤專一酶活性變異的82.5%,MBN和NH4-N極顯著影響土壤專一酶活性,二者共可以解釋變異的59.0%。[結論]MBN和NH4-N是影響土壤專一酶活性的主要環境因子,其他環境因子:土壤水熱配比、微生物量碳、微生物量碳氮比、溶解性有機碳和硝態氮等是影響土壤專一酶活性在處理間和季節間變異的主要驅動因子。
暖溫帶;銳齒櫟林;土壤酶活性;增溫;環境解析

河南省寶天曼國家級自然保護區位于北亞熱帶向南暖溫帶過渡區域,屬氣候變化敏感區。Luan等人在此研究表明:溫度是影響土壤呼吸的重要環境因子,土壤異氧呼吸的溫度敏感性高于自養呼吸[17],說明該區域微生物對氣候變暖的響應更敏感,預測未來氣候變暖背景下該區微生物分解作用導致土壤碳庫更容易分解。通過海拔土柱置換試驗模擬氣候變暖發現氣候變暖顯著增加了土壤CO2通量并改變土壤有機質層的分解過程[18]。本研究以該區域落葉闊葉林土壤為研究對象,采用紅外輻射增溫模擬氣候變暖進行進一步研究。旨在探明:(1)模擬氣候變化背景下,土壤酶活性季節變化規律;(2)土壤酶活性對環境因子變異的響應,以深入理解氣候變化背景下微生物因素在調控土壤碳循環過程中的作用。
1 研究區域

2 研究方法
2.1 樣地設置
采用隨機區組試驗設計,于2011年3月在研究區域典型林分中布設3個區組,具體試驗設計見文獻[20]。簡言之:在增溫樣地內,將長165 cm,寬15 cm的紅外線輻射加熱燈(MSR-2420,Kalglo Electronics Inc., Bethlehem, PA, USA)平行樣地短邊垂直懸掛于樣地正中央上方,懸掛高度2.25 m,額定功率為2 000瓦,全年持續供電;在對照樣地內,以相同的方式安裝與紅外線輻射加熱燈形狀和大小相同的假燈,以消除紅外線輻射加熱燈遮陰對試驗造成的誤差。
2.2 土壤樣品采集及土壤溫濕度測定

2.3 土壤酶活性及理化性質測定
土壤酶測定:把相當于1 g干土的鮮土或1.25 g鮮土加入125 mL的醋酸鈉緩沖液(50 mmol·L-1,pH=5.0)中,在攪拌機中處理1 min制成均質土壤懸液。水解酶測定采用熒光微平板法[21]:樣品控制(800 μL土壤懸液+200 μL酶底物),對照控制(800 μL土壤懸液+200 μL緩沖液),淬火控制(800 μL土壤懸液+200 μL標準液),底物控制(控制1∶200 μL緩沖液+50 μL酶底物,控制2∶200 μL緩沖液+50 μL標準底物),以上操作除底物控制加入96孔板(黑板)外,其余均加入96深孔板中;在25℃培養箱中暗培養3 h后加入10 μL NaOH(0.5 mol·L-1)停止反應,將96深孔板以5 000 r·min-1離心3 min后,用八通道微量取樣器取250 μL加到96孔板中(黑板),標儀(PerkinElmer Enspire,USA)進行熒光掃描(波長:365 nm,450 nm)。氧化酶測定采用比色法:以25 mmol·L-1L-DOPA作為底物,酚氧化酶測定中樣品控制(800 μL土壤懸液+200 μLDOPA),對照控制(800 μL土壤懸液+200μL緩沖液),底物控制(200 μL緩沖液+50 μLDOPA);過氧化物酶測定中樣品控制(800 μL土壤懸液+200 μL DOPA+40 μLH2O2),對照控制(800 μL土壤懸液+200 μL緩沖液+40 μL H2O2),底物控制(200 μL緩沖液+50 μL DOPA+10 μL H2O2)(H2O2濃度3%)。以上操作除底物控制加入96孔板(黑板)外,其余均加入96深孔板中。室溫震蕩暗培養1 h后,將96深孔板以5 000 r·min-1離心3 min后,用八通道微量取樣器取250 μL加到96孔板中(黑板),酶標儀(PerkinElmer Enspire,USA)進行吸光掃描(波長:465 nm)。(底物信息見表1,酶活性計算方法見文獻[22])
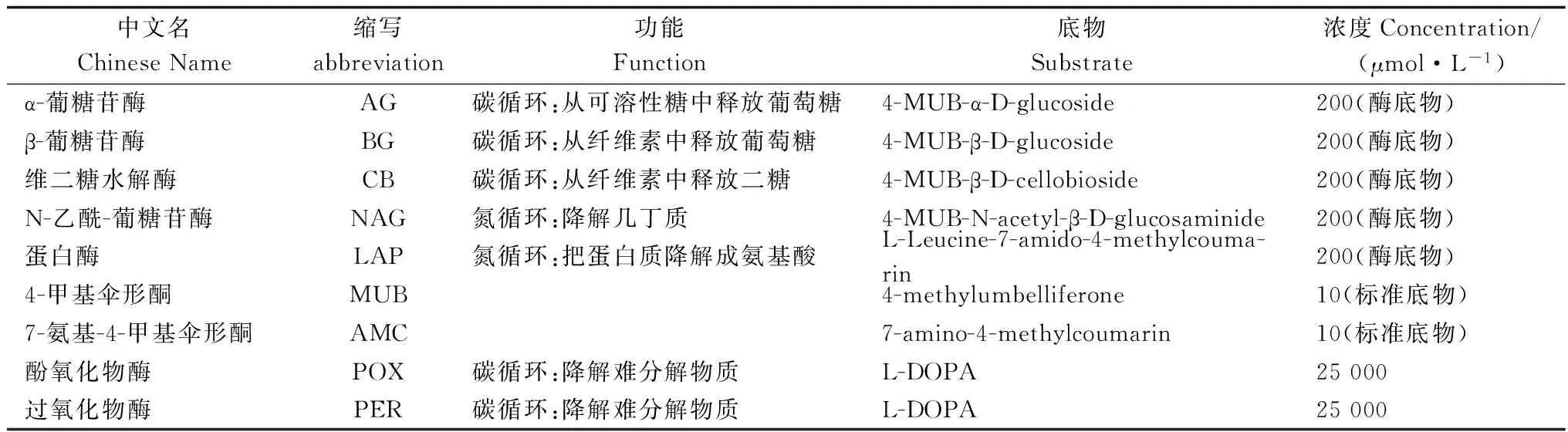
表1 底物基本信息Table 1 The substrate basic information
土壤理化性質測定:土壤有機碳含量采用重鉻酸鉀外加熱方法測定[23],土壤全氮含量采用凱氏定氮方法測定[24];土壤銨態氮、硝態氮含量通過2 mol KCL溶液提取過濾后采用流動分析儀測定[25];土壤pH采用玻璃電極法測定[26];微生物量碳氮采用氯仿熏蒸浸提法[27]。
2.4 數據統計分析
文章中所有酶活性均采用土壤專一酶活性,專一酶活性=土壤酶活性/微生物量碳[28]。采用水熱配比(S/T)作為衡量土壤環境因子的指標(S/T=平均土壤濕度/平均土壤溫度)。采用t檢驗比較增溫處理和對照處理土壤理化性質、生長季和非生長季內增溫處理和對照處理土壤活性碳庫、氮庫和專一酶活性以及相同處理下生長季和非生長季專一酶活性的差異。所有的數據都使用SPSS17.0進行統計分析,圖表采用Sigmaplot12.5繪制,用Canoco4.5分析專一土壤酶活性與環境因子間的關系。
3 結果與分析
3.1 樣地土壤基本理化性質
表2可知:與對照樣地相比,增溫處理土壤有機碳含量顯著低于對照處理 (P<0.05),土壤有機碳含量降低12.15%;增溫處理土壤總氮和pH值雖低于對照處理,但未達到顯著水平;增溫與對照處理對土壤碳氮比的影響也未達到顯著水平。
3.2 增溫處理對土壤環境和活性碳庫與氮庫的影響
表3和4表明:生長季和非生長季中,增溫處理顯著改變土壤環境,增溫處理顯著增加土壤溫度和降低土壤濕度導致土壤水熱配比顯著低于對照樣地,且增溫處理導致非生長季水熱配比下降幅度大于生長季的下降幅度;土壤溶解性有機碳含量在生長季和非生長季對增溫處理的響應均未達到顯著水平;生長季增溫處理土壤微生物量碳和微生物量氮顯著高于對照樣地,分別增加了40.30%和61.29%,微生物量碳氮比顯著低于對照樣地12.64%;非生長季增溫處理對土壤微生物量碳、微生物量氮和微生物量碳氮比的影響并不顯著;土壤硝態氮和銨態氮含量在生長季和非生長季對增溫處理的響應均未達到顯著水平。
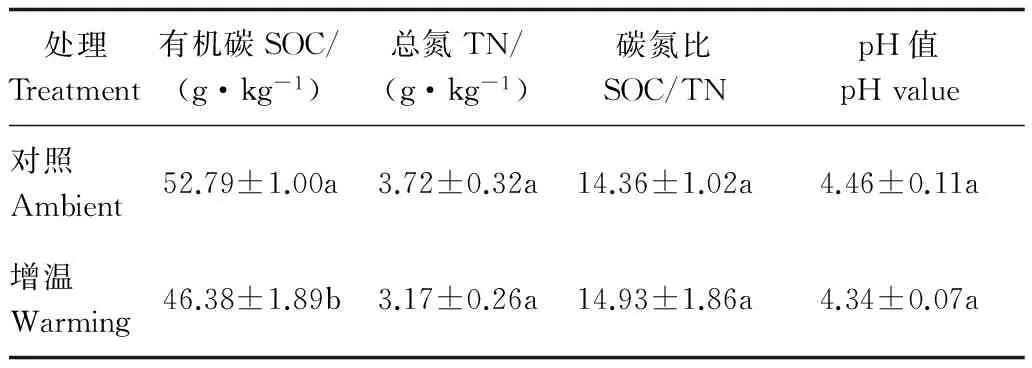
表2 樣地土壤基本理化性質Table 2 Soil physical and chemical properties
(不同字母表示在0.05水平上顯著差異)
(The different letters refer to significant effects atp<0.05)
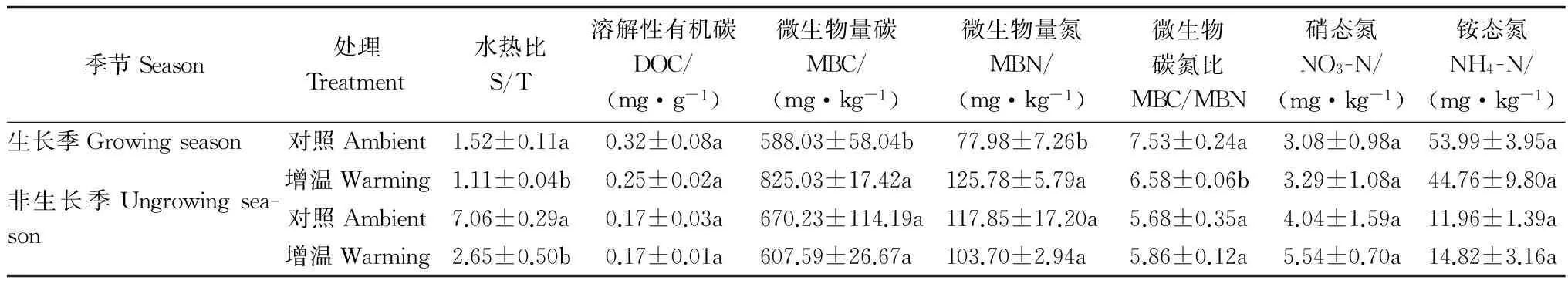
表3 土壤環境及土壤活性碳庫和氮庫的t檢驗結果Table 3 Results of t-test on soil labile carbon and nitrogen pools and environment
(不同字母表示在0.05水平上顯著差異)
(The different letters refer to significant effects atp<0.05)
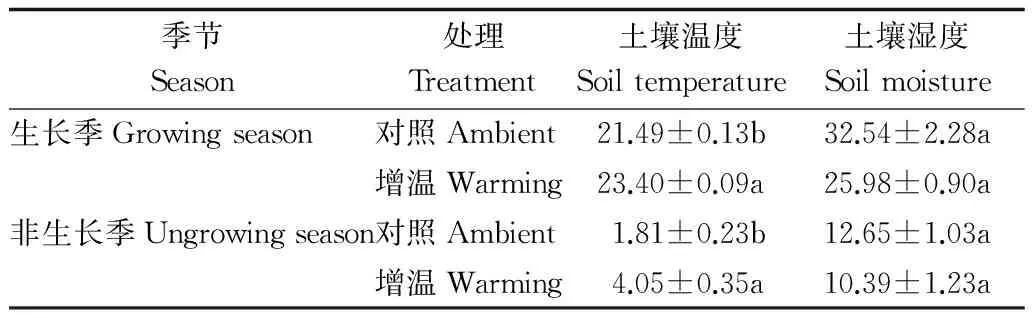
表4 增溫和對照處理土壤溫濕度的t檢驗結果Table 4 Results of t-test on soil moisture and temperature
(不同字母表示在0.05水平上顯著差異)
(The different letters refer to significant effects atp<0.05)
3.3 增溫處理對土壤酶活性的影響
增溫處理改變了土壤專一水解酶和氧化酶活性(圖1)。除NAG外,生長季增溫處理降低了AG、BG、CB和LAP專一酶活性,但均未達到顯著水平;增溫處理顯著降低了PER活性,未顯著改變POX活性。非生長季增溫處理增加了AG、CB、NAG、PER和POX專一酶活性,但降低了BG和LAP專一酶活性,且對LAP影響達到顯著水平;與生長季不同,增溫處理在非生長季不同程度地增加土壤專一酶活性,但未達到顯著水平。圖1和表5可知:除AG和LAP外,對照處理非生長季酶活性均低于生長季;增溫處理非生長季酶活性均高于生長季,且非生長季AG活性顯著高于生長季活性(P=0.019)。增溫處理在生長季普遍降低了土壤專一酶活性,但非生長季增溫處理則增加了土壤專一酶活性。說明土壤酶活性存在季節間變異,且增溫處理在不同季節間對土壤酶的影響不同。
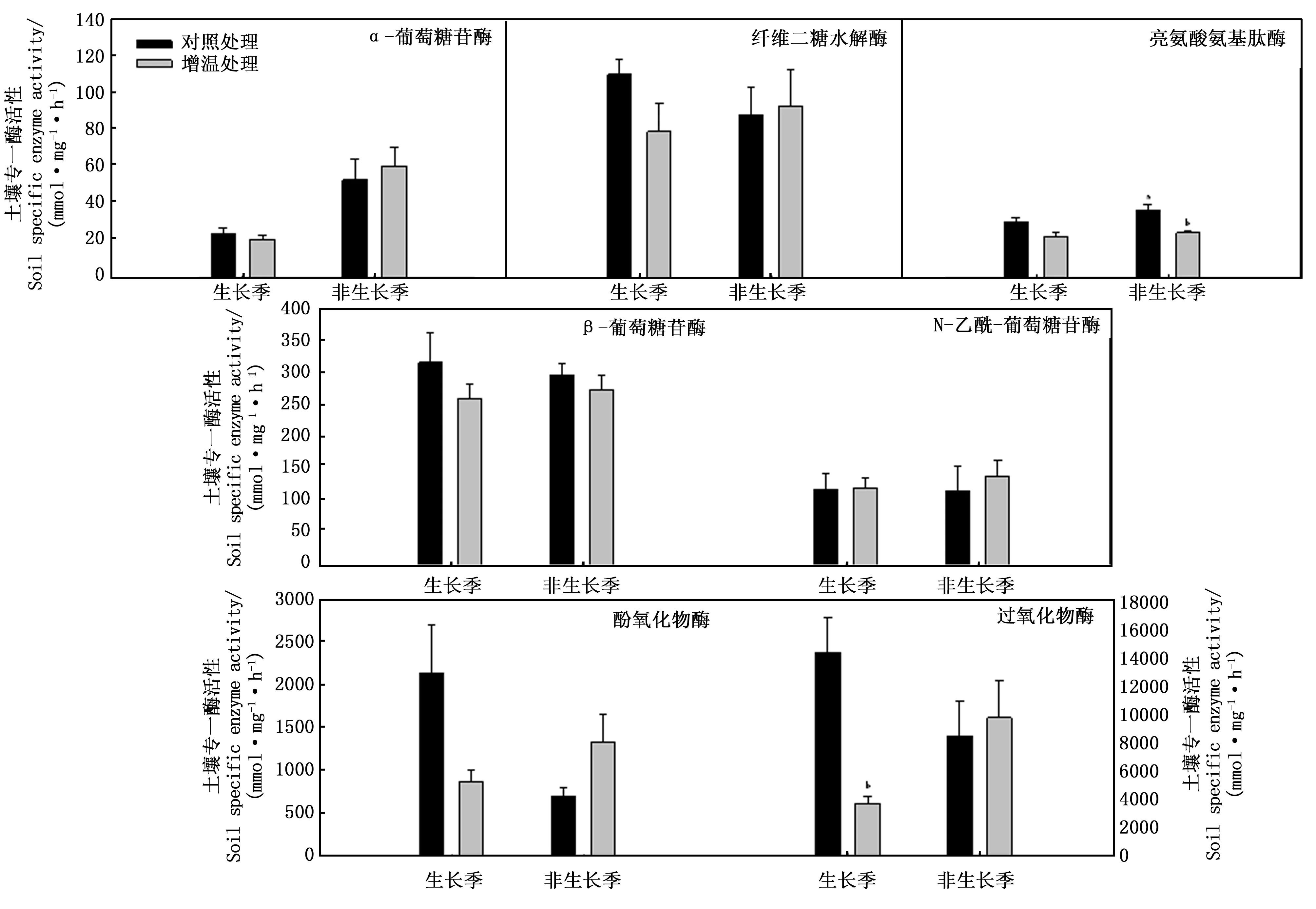
圖1 生長季和非生長季土壤專一酶活性t檢驗結果Fig.1 Results of t-test on soil specific enzyme activity in growing and ungrowing seasons

處理TreatmentAGBGCBNAGLAPPOXPER對照Ambient0.0600.7310.2770.9650.1630.0660.163增溫Warming0.0190.6770.5970.6060.4110.2470.086處理Treatment水熱比S/T溶解性有機碳DOC/(mg·g-1)微生物量碳MBC/(mg·kg-1)微生物量氮MBN/(mg·kg-1)微生物碳氮比MBC/MBN硝態氮NO3-N/(mg·kg-1)銨態氮NH4-N/(mg·kg-1)對照Ambient<0.010.1500.5560.100<0.010.634<0.01增溫Warming0.0370.013<0.010.0270.0570.1560.044
(加粗字體表示在0.05水平上顯著差異)
(The bold numbers refer to significant effects atp<0.05)
3.4 土壤酶活性的環境解析
冗余度分析(RDA)表明:9個環境因子變量中,有2個環境因子(NH4-N和MBN)與專一土壤酶活性顯著相關。RDA分析中第一主成分和第二主成分共可以解釋9個環境因子與7種土壤專一酶活性關系變異的82.5%(圖2)。NH4-N和MBN共可以解釋土壤專一酶活性變異的59.0%。RDA排序圖說明主要環境因子和土壤專一酶活性之間的特異關系。其中LAP和AG與S/T和NO3-N呈正相關關系,POX與NH4-N、DOC和MBC/MBN呈正相關關系,NAG、PER、BG和CB則與DOC和MBC/MBN呈正相關關系。說明土壤專一酶活性變異受多種環境因子同時調控。
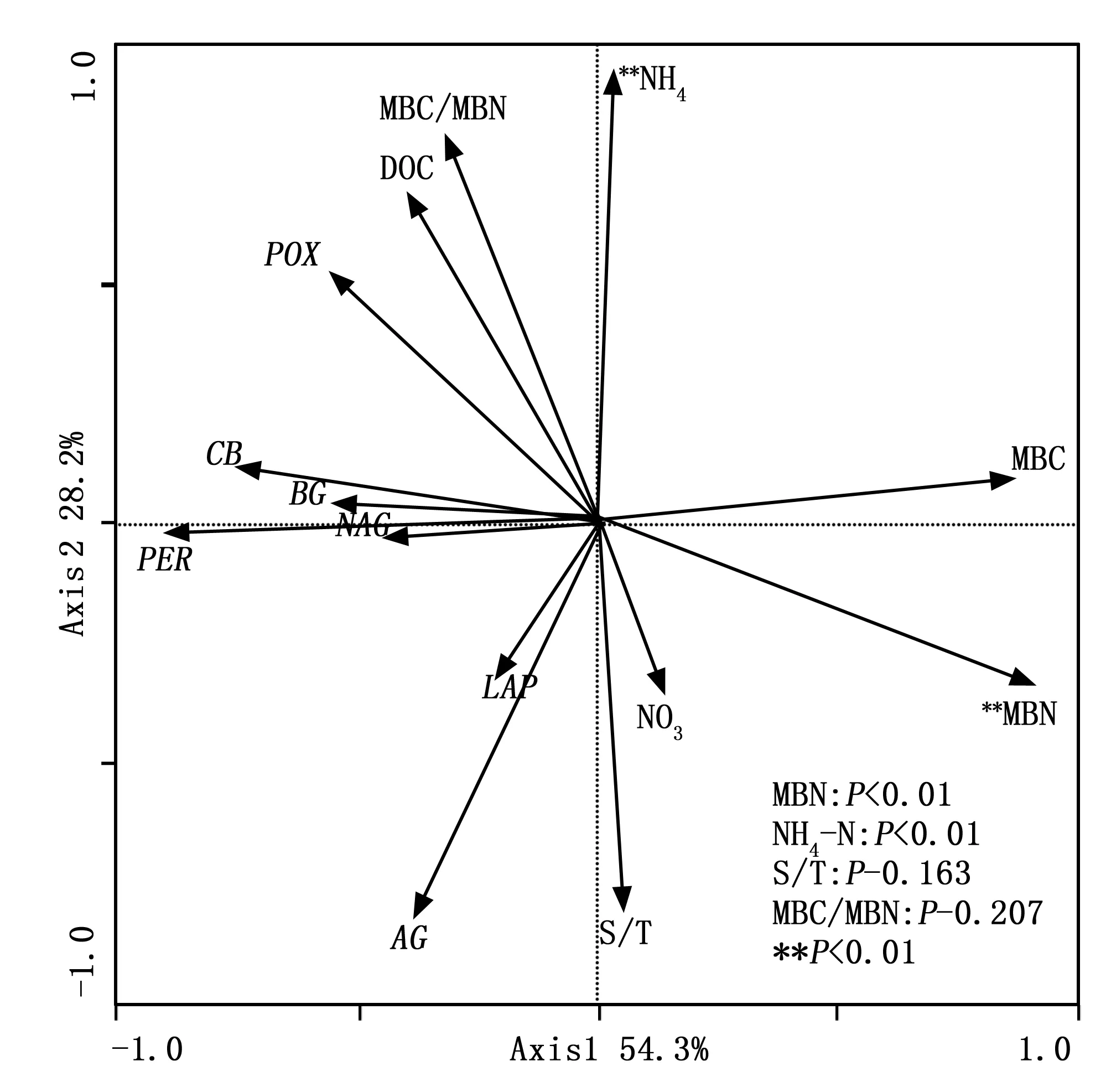
圖2 環境因子與土壤專一酶活性RDA分析Fig.2 Redundancy analysis of soil specific enzyme activity and environmental factors
4 討論
4.1 增溫處理對土壤碳庫和氮庫的影響

作為土壤碳庫和氮庫中重要組成部分,活性碳庫和氮庫(微生物量碳、微生物量氮、溶解性有機碳和溶解性有機氮)雖然所占比例不高,卻在調節土壤碳氮循環中發揮著重要的作用。研究表明:生長季增溫處理顯著提高了土壤中微生物量碳氮,但非生長季增溫處理對微生物量碳氮的影響并不顯著,說明微生物量碳氮對增溫處理的響應受季節變化影響。Xu等人[32]開展增溫試驗也發現土壤活性碳庫和氮庫對增溫處理的響應受季節變化影響顯著。溶解性有機碳作為土壤微生物有機體可直接利用碳源,增溫處理并未顯著增加溶解性有機碳含量。Luo等人[33]研究表明,溫度和濕度并不是影響土壤溶解性有機碳的主要因子,地下生物量等生物因子是調控土壤溶解性有機碳的重要因子。故增溫處理雖顯著增加土壤溫度,但并不能增加土壤中溶解性有機碳的含量。微生物量碳氮比在粗略水平上可以看作微生物中細菌和真菌的相對豐度比[34]。生長季中增溫處理顯著降低了土壤微生物碳氮比,說明與對照樣地相比增溫樣地的細菌群落占優勢。已有整合分析研究表明[35]:增溫處理會顯著增加土壤凈氮礦化作用和凈硝化作用。本研究觀察到增溫處理雖導致土壤硝態氮和銨態氮(生長季除外)含量增加,但并未達到顯著水平。這可能是因為增溫處理導致細根生物量和土壤微生物量的增加促進了二者對土壤中無機氮的吸收和利用。
4.2 增溫處理對土壤專一酶活性的影響
土壤酶作為土壤微生物活性和土壤理化性質的指示因子[11],在調控土壤碳氮循環中發揮著重要的作用。由于土壤酶活性與土壤性質、微生物特性等密切相關,所以增溫處理下土壤酶活性可能出現季節性變化。在考察土壤酶活性的研究中,專一酶活性可以把微生物和土壤酶活性建立較好的聯系。圖1表明:生長季中除NAG外,增溫處理不同程度降低其他4種水解酶專一酶活性,但均未達到顯著水平。說明氣候變暖情況下,酶催化反應變得更有效,單位微生物產生的酶量降低。黃雪蔓[36]研究發現:土壤微生物群落受土壤底物的數量(有機碳含量)和質量(碳氮比)影響。作為土壤微生物兩大主要類群,通常認為細菌與水解酶活性相關,主要利用土壤中活性底物;真菌與氧化酶活性相關,主要利用土壤中惰性底物[37-38]。微生物量碳氮比作為粗略反映微生物群落中細菌和真菌相對豐度的指標,且真菌比細菌具有更高的碳氮比,所以微生物量碳氮比升高反映真菌相對豐富度更高。生長季中對照樣地微生物量碳氮比(7.53)顯著高于增溫樣地微生物碳氮比(6.58),說明對照樣地中真菌相對豐富度比增溫樣地的高,真菌通常分泌氧化酶以分解大分子化合物,故生長季對照樣地內過氧化物酶活性顯著高于增溫樣地的。
環境因子變化可影響土壤底物擴散作用[39]和底物利用有效性[40]。非生長季中土壤溫度因子成為限制性因子時,底物擴散作用和有效性受到限制,微生物利用底物效率和微生物活性也隨之降低。增溫處理顯著提高了非生長季土壤溫度,故非生長季增溫樣地微生物活性增強,微生物為滿足自身生長需要,單位微生物量會產生更多的酶以提高其對土壤養分的利用,所以增溫處理在非生長季對土壤專一酶活性多表現出促進作用。
4.3 環境因子變異對專一土壤酶活性的影響
除溫度因子外,土壤濕度也影響土壤底物的擴散作用[39],作者引入水熱比(S/T),考察溫濕度因子共同作用對土壤專一酶活性的影響。圖2可知:LAP和AG與S/T和NO3-N顯著正相關,而溫度因子對氮循環酶LAP的作用不明顯[41],說明LAP活性受土壤濕度影響,該結論與Brzostek通過整合分析發現LAP酶活性受土壤濕度限制的結論一致[3];表5可知:增溫樣地和對照樣地非生長季土壤NO3-N與生長季土壤NO3-N差異并不顯著,但非生長季S/T顯著高于生長季,故非生長季LAP和AG活性與生長季相比均表現出增加趨勢(圖1,表5)。RDA排序圖表明NAG、BG和CB則與DOC和MBC/MBN呈正相關關系。表5可知:非生長季與生長季相比,對照樣地MBC/MBN顯著降低是引起非生長季對照樣地酶(NAG、BG和CB)活性低于生長季的主要原因,說明微生物群落結構的變化可能是影響土壤專一酶活性季節變化的主要原因。You[42]在該區域研究也發現微生物群落結構與土壤酶活性之間具有很強的相關性,氧化酶活性與真菌相關而細菌與水解酶活性相關。這與我們得到的結論較為一致。圖2可知,POX與NO3-N呈負相關關系;PER與NO3-N和NH4-N也呈負相關,與Sinsabaugh等人[37]研究結果一致,認為氧化酶活性與土壤無機氮可利用性呈負相關關系。我們把MBC作為分子將總土壤酶活性專一化,故RDA分析中土壤專一酶活性與MBC和MBN呈負相關關系。
5 結論
(1)增溫處理顯著提高了土壤溫度,但并未顯著降低土壤濕度。
(2)生長季增溫處理引起土壤溫度增加改變了酶催化反應效率進而改變了土壤專一酶活性;除PER外,增溫處理導致土壤專一酶活性的降低并未達到顯著水平。非生長季增溫處理普遍增加了土壤專一酶活性,說明土壤專一酶活性對增溫處理的季節性響應不同。
(3)除微生物量氮和銨態氮外,其他環境因子,諸如:土壤水熱比、微生物量碳、微生物量碳氮比、溶解性有機碳和硝態氮等是影響土壤專一酶活性在不同處理間和季節間變異的主要原因。
[1] IPCC. Climate Change 2013: The Physical Science Basis[M]. Cambridge University Press, Cambridge, UK., 2013.
[2] Groffman P M, Driscoll C T, Fahey T J,etal. Effects of mild winter freezing on soil nitrogen and carbon dynamics in a northern hardwood forest.[J]. Biogeochemistry, 2001, 56(2): 191-213.
[3] Brzostek E R, Blair J M, Dukes J S,etal. The effect of experimental warming and precipitation change on proteolytic enzyme activity: positive feedbacks to nitrogen availability are not universal[J]. Global Change Biology, 2012, 18(8): 2617-2625.
[4] Baldrian P,najdr J, Merhautová V,etal. Responses of the extracellular enzyme activities in hardwood forest to soil temperature and seasonality and the potential effects of climate change[J]. Soil Biology and Biochemistry, 2013, 56: 60-68.
[5] Weedon J T, George A Kowalchuk, Bodegom P M. No effects of experimental warming but contrasting seasonal patterns for soil peptidase and glycosidase enzymes in a sub-arctic peat bog[J]. Biogeochemistry, 2014, 117(1):55-66.
[6] Bastida F, Barberá G G, García C,etal. Influence of orientation, vegetation and season on soil microbial and biochemical characteristics under semiarid conditions[J]. Applied Soil Ecology, 2008, 38(1): 62-70.
[7] Wittmann C, K?hk?nen M A, Llvesniemi H,etal. Areal activities and stratification of hydrolytic enzymes involved in the biochemical cycles of carbon, nitrogen, sulphur and phosphorus in podsolized boreal forest soils[J]. Soil Biology and Biochemistry, 2004, 36(3): 425-433.
[8] Burns R. Enzyme activity in soil: location and a possible role in microbial ecology[J]. Soil Biology and Biochemistry, 1982, 14(5): 423-427.
[9] Sowerby A, Emmett B, Beier C,etal. Microbial community changes in heathland soil communities along a geographical gradient: interaction with climate change manipulations[J]. Soil Biology and Biochemistry, 2005, 37(10): 1805-1813.
[10] Zogg G P, Zak D R, Ringelberg D B,etal. Compositional and functional shifts in microbial communities due to soil warming[J]. Soil Science Society of America Journal, 1997, 61(2): 475-481.
[11] Weedon J, Aerts R., George A. Kowalchuk,etal. Enzymology under global change: organic nitrogen turnover in alpine and sub-Arctic soils[J]. Biochemical Society Transactions, 2011, 39(1): 309.
[12] Wang X, Dong S, Gao Q,etal. Effects of short-term and long-term warming on soil nutrients,microbial biomass and enzyme activities in an alpine meadow on the Qinghai-Tibet Plateau of China[J]. Soil Biology and Biochemistry, 2014, 76:140-142.
[13] Zhou X, Chen C, Wang Y,etal. Warming and increased precipitation have differential effects on soil extracellular enzyme activities in a temperate grassland[J]. Science of the Total Environment, 2013, 444 (1):552-558.
[14] Steinweg J M, Dukes J S, Paul E A,etal. Microbial responses to mutli-factor climate change: effects on soil enzymes[J]. Frontiers in Microbiology, 2013,4(146):1-11.
[15] McDaniel M D, Kaye J P, Kaye M W. Increased temperature and precipitation had limited effects on soil extracellular enzyme activities in a post-harvest forest[J]. Soil Biology and Biochemistry, 2013, 56:90-98.
[16] Bengtson P, Bengtsson G. Rapid turnover of DOC in temperate forests accounts for increased CO2production at elevated temperatures[J]. Ecology Letters, 2007, 10(9): 783-790.
[17] Luan J, Liu S, Wang J,etal. Rhizospheric and heterotrophic respiration of a warm-temperate oak chronosequence in China[J]. Soil Biology and Biochemistry, 2011, 43(3): 503-512.

[19] 史作民, 程瑞梅, 劉世榮, 等. 河南寶天曼化香林特征及物種多樣性[J].山地學報, 2005, 23(3): 374-380.
[20] 劉彥春, 暖溫帶銳齒櫟林土壤呼吸及微生物群落結構對土壤增溫和降雨減少的響應[D].北京: 中國林業科學研究院. 2013.
[21] Saiya-Cork K R, Sinsabaugh R L. The effects of long term nitrogen deposition on extracellular enzyme activity in anAcersaccharumforest soil[J]. Soil Biology and Biochemistry, 2002, 34(9): 1309-1315.
[22] German D P, Weintraub M N, Grandy A S,etal. Optimization of hydrolytic and oxidative enzyme methods for ecosystem studies[J]. Soil Biology and Biochemistry, 2011, 43(7): 1387-1397.
[23] Nelson D W, Sommers L E, Sparks D L,etal. Total Carbon, Organic Carbon, and Organic Matter[M]//Methods of Soil Analysis.Part 2. Chemical and Microbiological Properties, 1982: 539-579.
[24] Bremner J M, Mulvaney C, Nitrogen-Total[M]//Methods of Soil Analysis. Part 2. Chemical and Microbiological Properties, 1982: 595-624.
[25] Magill A H, Aber J D. Variation in soil net mineralization rates with dissolved organic carbon additions[J]. Soil Biology and Biochemistry, 2000, 32(5): 597-601.
[26] LY/T1228-999. 森林土壤 pH 值的測定[S]. 1999.
[27] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707.
[28] Stone M M, DeForest J L, Plante A F. Changes in extracellular enzyme activity and microbial community structure with soil depth at the Luquillo Critical Zone Observatory[J]. Soil Biology and Biochemistry, 2014,75: 237-247.
[29] Post W M, Emanuel W R, Zinke P J,etal. Soil carbon pools and world life zones[J]. Nature,1982, 298:156-159.
[30] Shaver G R, Billings W D, Chapin F S,etal. Global change and the carbon balance of arctic ecosystems[J]. BioScience, 1992,42(6): 433-441.
[31] Rui Y, Wang S, Xu Z,etal. Warming and grazing affect soil labile carbon and nitrogen pools differently in an alpine meadow of the Qinghai-Tibet Plateau in China[J]. Journal of Soils and Sediments, 2011, 11(6): 903-914.
[32] Xu Z, Hu R, Xiong P,etal. Initial soil responses to experimental warming in two contrasting forest ecosystems, Eastern Tibetan Plateau, China: nutrient availabilities, microbial properties and enzyme activities[J]. Applied Soil Ecology, 2010, 46(2): 291-299.
[33] Luo C, Xu G, Wang Y,etal. Effects of grazing and experimental warming on DOC concentrations in the soil solution on the Qinghai-Tibet plateau[J]. Soil Biology and Biochemistry, 2009, 41(12): 2493-2500.
[34] Yao H, Bowman D, Shi W. Seasonal variations of soil microbial biomass and activity in warm-and cool-season turfgrass systems[J]. Soil Biology and Biochemistry, 2011,43(7): 1536-1543.
[35] Bai E, Li S, Xu W,etal. A meta-analysis of experimental warming effects on terrestrial nitrogen pools and dynamics[J]. New Phytologist, 2013, 199(2): 441-451.
[36] 黃雪蔓, 劉世榮, 尤業明. 固氮樹種對第二代桉樹人工林土壤微生物生物量和結構的影響[J].林業科學研究,2014,27(5):612-620.
[37] Sinsabaugh R L, Gallo M E, Lauber C,etal. Extracellular enzyme activities and soil organic matter dynamics for northern hardwood forests receiving simulated nitrogen deposition[J]. Biogeochemistry, 2005, 75(2): 201-215.
[38] Talbot J M, Bruns T D, Smith D P,etal. Independent roles of ectomycorrhizal and saprotrophic communities in soil organic matter decomposition[J]. Soil Biology and Biochemistry, 2013, 57: 282-291.
[39] Koch A L. Diffusion the crucial process in many aspects of the biology of bacteria, in Advances in microbial ecology[M]. 1990.Springer. 37-70.
[40] Koch O, Tscherko D, Kandeler E. Temperature sensitivity of microbial respiration, nitrogen mineralization, and potential soil enzyme activities in organic alpine soils[J]. Global Biogeochemical Cycles, 2007, 21(4): 497-507.
[41] Wallenstein M D, Mcmahon S K, Schimel J P. Seasonal variation in enzyme activities and temperature sensitivities in Arctic tundra soils[J]. Global Change Biology, 2009, 15(7): 1631-1639.
[42] You Y, Wang J, Huang X,etal. Relating microbial community structure to functioning in forest soil organic carbon transformation and turnover[J]. Ecology and Evolution, 2014, 4(5): 633-647.
(責任編輯:彭南軒)
Response of Soil Enzyme Activities to Soil Warming and Explanation of Environmental Factors in Warm-temperate Oak Forest
WANGYi,LIUYan-chun,LIUShi-rong
(Research Institute of Forest Ecology, Environment and Protection, Chinese Academy of Forestry, Key Laboratory of Forest Ecology and Environment, State Forestry Administration, Beijing 100091, China)
[Objective]To study the seasonal variation of soil enzyme activities and its response to environmental factors and to understand the effect of microbial factor in the regulation of soil carbon cycle in the context of climate change. [Method]The infrared radiation heater and the 96 micro-plate method were used to assay the activity of the hydrolytic and oxidative enzymes of the soil, and determine the role of environmental factors in addressing the seasonal variation in the activity of soil enzymes. [Result]During growing season, the warming treatment significantly increased the soil temperature by 1.91℃, leading to a 12.15% decrease of organic carbon content and significant increase of 40.30% and 61.29% of microbial biomass carbon (MBC) and nitrogen (MBN). During non-growing season, however, although the warming treatment increased the soil temperature by 2.24℃, no significant effect was found on MBC or MBN. The effects of warming treatment on specific enzyme varied in different seasons. During growing season, the activities of specific enzyme in warming treatment were lower than those in control except for NAG, while they were higher during non-growing season except for BG and LAP. [Conclusion]The environmental factors accounted for 82.5% of the total variations of soil enzyme activities, while the activities of specific enzyme were significantly affected by NH4-N and MBN. The other environmental factors (soil moisture, MBC, DOC, MBC/MBN and NO3-N) were the main reasons for the variations of specific enzyme activities in different treatments and seasons.
warm-temperate zone;Quercusalienavar.acuteserrata; soil enzyme activity; warming; explanation of environmental factors
10.13275/j.cnki.lykxyj.2017.01.016
2015-04-30
2016-02-20
國家自然科學基金重大項目“植物對森林生態系統碳-氮-水耦合循環的作用機制”(項目編號:31290223);中國林業科學研究院基本科研業務費專項資金項目“海內外杰出學者講習計劃”(項目編號:CAFYBB2011007)。
王 一(1986—),在讀博士,主要研究方向為模擬氣候變化背景下森林生態系統土壤碳氮循環。E-mail:wylx0830@126.com
* 通訊作者:E-mail: liusr9311@163.com
S714
A
1001-1498(2017)01-0117-08

