小麥LEAsm基因及其啟動子的克隆與功能研究
李孟軍,李亞青,張士昌,張 楠,史占良
(石家莊市農林科學研究院,河北石家莊 050041)
小麥LEAsm基因及其啟動子的克隆與功能研究
李孟軍,李亞青,張士昌,張 楠,史占良
(石家莊市農林科學研究院,河北石家莊 050041)
胚胎發育晚期豐富蛋白(LEA)是一個小的高親水性的蛋白家族,該蛋白家族在逆境脅迫下大量積累,保護植物免受逆境脅迫。LEA蛋白可分為7組,其中重復的11-氨基酸基序是第3組 LEA蛋白的特征。為深入分析第3組LEA蛋白在小麥響應逆境脅迫中的作用機制,利用芯片技術從小麥表達譜中篩選出一個滲透脅迫誘導表達的第3組LEA蛋白基因TaLEAsm,然后根據該基因序列設計引物篩選石麥15的BAC文庫,獲得1個含有該基因的BAC單克隆,以該BAC單克隆質粒為模板,通過BAC延伸測序克隆了TaLEAsm基因及其啟動子序列,并對TaLEAsm序列特征、表達模式和啟動子功能進行了初步分析。結果表明,TaLEAsm基因序列僅含有1個105 bp的內含子,其開放讀碼框長675 bp,編碼224個氨基酸。TaLEAsm含有10個11-氨基酸重復序列,屬于第3組 LEA蛋白。低溫、高鹽和滲透脅迫均誘導TaLEAsm基因上調表達,但在根和葉中表達模式不同。在TaLEAsm基因起始密碼子上游1 500 bp序列中,預測含有14個逆境響應順式元件。在擬南芥中,TaLEAsm基因啟動子能夠啟動GUS基因表達,滲透脅迫誘導GUS基因明顯上調表達。以上結果表明,TaLEAsm為小麥脫水響應基因,其啟動子為滲透脅迫誘導啟動子。
小麥;TaLEAsm;啟動子;克隆;功能研究
胚胎發育晚期豐富蛋白(LEA)是生物體內與滲透調節有關的蛋白家族,在植物胚胎發育晚期大量積累,響應多種非生物逆境脅迫,如干旱、鹽害和低溫等[1]。Dure等[2]首次在棉花子葉中發現LEA蛋白。根據氨基酸序列保守結構域和親水性,植物LEA蛋白可分為7組,除第5組LEA蛋白具有疏水特征外,其余6組均為親水蛋白[3]。第3組LEA蛋白通常含有多拷貝的由11個氨基酸組成的基序 (TAQAAKEKAGE),其分子量差異通常是由于11個氨基酸基序的拷貝數造成的[4]。研究表明,主要農作物第3組LEA蛋白的11-氨基酸基序以多拷貝串聯形式存在,其長度占蛋白序列長度的40%~60%,帶電荷/極性氨基酸和疏水氨基酸數目分別占重復序列氨基酸總數的71%和29%[5]。
植物第3組LEA蛋白的積累與多種非生物逆境之間(低溫、干旱、鹽害等)存在很高的相關性。小麥第3組LEA-L2蛋白的組成型表達能夠顯著提高擬南芥的抗凍害能力[6]。轉大麥 HVA1的桑樹(Morusindica)和水稻對干旱和高鹽的耐受性明顯提高[7-8]。干旱和高鹽誘導水稻幼苗中 OsLEA19a上調表達,其編碼蛋白可能參與水稻對干旱和高鹽的抗性反應[9]。干旱、低溫脅迫、鹽脅迫和外源ABA處理能夠提高小麥 TaLEAL3的表達量,表明其可能參與了小麥逆境脅迫響應[10]。外源ABA、干旱、低溫、高鹽和高溫等均誘導臘梅 CpLEA的上調表達[11]。在煙草中過量表達 ZmLEA3能夠提高煙草的抗滲透脅迫和氧化脅迫的能力[12]。在玉米莖中 ZmLEA3的表達受到低溫、滲透脅迫、外源ABA和H2O2誘導后顯著提高[13]。
逆境脅迫誘導表達啟動子使抗逆基因在特定時間和空間表達,提高植物抗逆性的同時,可減少抗逆基因組成型表達給植物帶來的負面效應[14]。與CaMV35S啟動子相比較,誘導性啟動子RD29A啟動 TaEXPB23在煙草中表達,轉基因煙草對水分脅迫耐受性提高,同時降低了 TaEXPB23對煙草的負面影響[14]。擬南芥 CBF4上游序列CBF4P在干旱脅迫條件下轉錄活性高于CaMV35S啟動子[15]。水楊酸和低溫處理可誘導葡萄(Vitispseudoreticulata)VpSTS啟動子驅動GUS基因表達,起始密碼子上游162 bp對于該啟動子的組成型表達和誘導表達模式必不可少[16]。干旱脅迫誘導水稻 Oshox24的啟動子強烈上調表達,同時該啟動子還受到脫落酸的誘導[17]。 OsDhn1啟動子受到干旱誘導,但不受傷害、冷害、鹽害和外源ABA處理等誘導[18]。高鹽脅迫使擬南芥 AtPUB18啟動子驅動的GUS基因表達量顯著升高[19]。逆境脅迫誘導基因 ZmRXO1上游1 576 bp啟動子序列可驅動GUS基因在煙草中高水平表達,其中582 bp(-582 to -1)的序列能夠在激素(MeJA、GA、ABA)、干旱、低溫誘導下驅動GUS基因表達[20]。
LEA 蛋白基因在非生物逆境中的作用已在多種作物中得到證實[6-13],小麥第3組LEA蛋白基因,特別是其啟動子的克隆及其功能分析,不僅有利于對其作用機制的深入探討,而且也為利用第3組LEA 蛋白基因提高作物抗逆性奠定基礎。本研究利用Affymetrix小麥表達譜芯片分析石麥15滲透脅迫的誘導表達譜,發現1個第3組LEA蛋白基因TaLEAsm受滲透脅迫誘導高豐度表達。通過PCR篩選石麥15基因組BAC文庫,結合BAC克隆測序了TaLEAsm基因及其啟動子,并對TaLEAsm序列特征、表達模式和啟動子功能等進行了初步分析,以期為深入研究和利用TaLEAsm進行小麥抗逆遺傳改良奠定基礎。
1 材料與方法
1.1 材 料
供試材料為冬小麥品種石麥15,由石家莊市農林科學研究院小麥研究所提供。挑選大小基本一致的飽滿種子在光照培養箱中用自來水培養至二葉一心期,改用1/2 Hoagland培養液繼續培養7 d,培養溫度為22±1 ℃,每天光照14 h。選取生長發育一致的幼苗20~25株置培養皿中,分別進行16% PEG6000(1/2 Hoagland配制)、200 mmol·L-1NaCl(1/2 Hoagland配制)和4 ℃(春化箱)處理,并于各處理的0、1、3、6、9、12、24和48 h取根和葉片,取樣期間保持全天光照,所取樣品液氮速凍后于-70 ℃冰箱保存。試驗設置3個重復。
石麥15基因組BAC文庫由1 000 000個以上克隆組成,保存在1 020個混合池中,克隆插入片段平均長度為85 kb,空載率為2.5%,保存于石家莊市農林科學研究院生物技術實驗室。
1.2 石麥15的BAC文庫篩選
根據小麥TaLEAsmcDNA序列(GenBank:AY148490)設計TaLEAsmF1/TaLEAsmR1(TaLEAsmF1:5′-GGTCGTGTTCCAAGAAA CC-3′;TaLEAsmR1:5′-AGCAAAGTAAATTA AGCGCC-3′)和TaLEAsmF2/TaLEAsmR2(TaLEAsmF2:5′-GTTCCAAGAAACCAAAA TGG-3′;TaLEAsmR2:5′-ACATGCGTCTAGT GATTCCTG-3′)兩對嵌套引物對石麥15 BAC文庫進行篩選。 PCR 擴增程序:94 ℃ 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,30個循環。TaqDNA聚合酶為2×TaqPCR StarMix(GenStar)。
1.3TaLEAsm基因gDNA、cDNA及啟動子序列的獲得
以含有TaLEAsmBAC單克隆質粒為模板,根據BAC單克隆質粒上已知TaLEAsm序列設計測序引物,用BigDye○RTerminator v3.1 Cycle Sequencing Kit(ABI)進行測序PCR反應,用ABI 3730 XL DNA Analyzer進行測序。采用primer walking方法進行步移,直至獲得基因完整序列及其啟動子序列。用RNAiso Plus(TaKaRa) 提取根和葉片總RNA。用polyATract○RmRNA isolation system III (Promega) 分離mRNA。用PrimerScriptTM1st Strand cDNA Synthesis Kit (TaKaRa)合成第一鏈cDNA。PCR擴增引物為TaLEAsmF1/TaLEAsmR1。PCR產物克隆使用DNA A-Tailing Kit和pMD18-T vector (TaKaRa)。
1.4TaLEAsm基因的表達模式分析
實時定量PCR反應采用SYBR○RPremix ExTaqTMII(TaKaRa)。上游引物:5′-CACCAG GAATCACTAGACGCAC-3′;下游引物:5′-CAAATGAGCTGAAATCACGAAAG-3′。PCR擴增程序:95 ℃ 2 min;95 ℃ 30 s,59 ℃ 30 s,72 ℃ 30 s,40個循環。以小麥β-actin基因為內參,反應在ABI Prism7500熒光定量PCR儀上運行,3次重復。采用2-ΔΔCt法進行定量分析。
1.5TaLEAsm基因啟動子表達載體的構建與擬南芥的轉化
根據序列比對結果確定TaLEAsm基因啟動子序列,在此基礎上設計引物TaLEAsm-proF/TaLEAsm-proR(TaLEAsm-proF:5′-CGGG ATCCGTGCGTGTCGGAAGAACTC-3′,下劃線部分為BamHI酶切位點;TaLEAsm-proR:5′-CCAAGCTTTGGAACACGACCTGGAATC-3′,下劃線部分為HindIII酶切位點),擴增區域為起始密碼子ATG上游從11 bp到1 647 bp。TaLEAsm基因啟動子表達載體構建使用pCAMBIA1831Z載體。20 μL PCR反應體系包含2×Pfu PCR MasterMix 10 μL(TIANGEN)、上下游引物(10 μmol·L-1)各1 μL、模板質粒DNA (20 ng·L-1)2 μL及ddH2O 6 μL。PCR 擴增程序:94 ℃預變性5 min;94 ℃變性30 s,55 ℃退火30 s,72 ℃延伸4 min,30個循環;72 ℃延伸8 min。酶切片段連接使用T4 DNA ligase(NEB)。轉化菌株分別使用大腸桿菌DH5α和農桿菌GV3101。通過BamHⅠ和HindⅢ酶切和測序對構建的啟動子表達載體進行驗證。以擬南芥生態型Columbia-0為受體,采用花序浸染法進行轉化[21]。轉基因擬南芥鑒定采用PCR和GUS染色的方法,經過連續培養,啟動子功能驗證采用T3代純合體進行。
1.6 GUS組織化學染色
轉基因擬南芥苗(T3代)在抗性平板上生長10 d后,選取生長一致的幼苗,分別于1/2MS培養基、16% PEG8000(1/2MS培養基配制)、400 mmol·L-1Mannitol(1/2MS培養基配制)在培養室中處理12 h(22 ℃,16 h光照;16 ℃,8 h黑暗)。用不含X-Gluc的GUS染色液洗滌轉基因擬南芥植株后,轉移到Eppendorf管中,加入適量GUS染色液浸沒全部植株,37 ℃保溫8 h,然后去除染色液,用95%乙醇37 ℃脫色2~3 h,組織染色完畢后保存于75%乙醇中,4 ℃保存。使用變倍體視顯微鏡(Nikon SMZ1000)觀察,并用數碼相機(Nikon DXM1200F)拍照記錄。
2 結果與分析
2.1TaLEAsm引物特異性分析
Affymetrix小麥表達譜芯片分析表明,小麥cDNA序列(GenBank No. AY148490)滲透脅迫后上調表達,其中葉片表達量在滲透脅迫后3 h、9 h和27 h分別為對照的138.3倍、71.3倍和45.6倍,根系分別為對照的42.4倍、28.5倍和45.8倍。NCBI Blastx比對顯示,該基因為第3組LEA蛋白編碼基因,命名為TaLEAsm。根據TaLEAsmcDNA序列設計嵌套引物,分別以石麥15基因組DNA和cDNA為模板,使用高保真酶進行PCR和RT-PCR擴增,分別隨機挑取6個克隆測序。測序結果表明,PCR產物僅含有TaLEAsm,嵌套引物均為TaLEAsm特異性引物(圖1)。
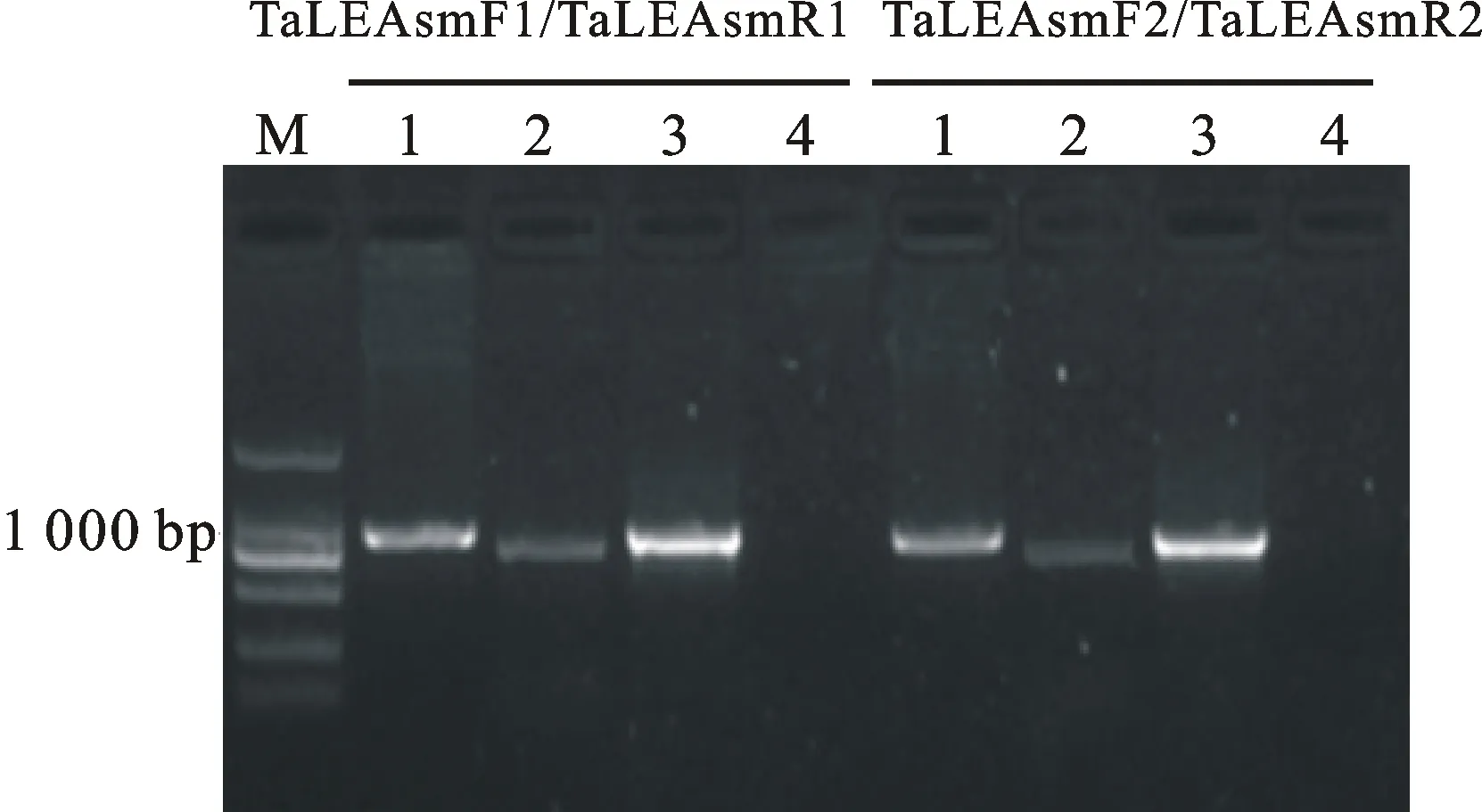
M:DL2000;1:石麥15的DNA;2:石麥15的cDNA;3:BAC質粒;4:ddH2O。
M:DL2000; 1:DNA from Shimai 15; 2:cDNA from Shimai 15; 3:BAC plasmid; 4:ddH2O.
圖1TaLEAsm基因PCR引物特異性檢測
Fig.1 Specific detection of PCR primers forTaLEAsmgene
2.2TaLEAsm基因gDNA和cDNA序列擴增結果
以石麥15基因組BAC文庫混合池質粒為模板,采用引物TaLEAsmF1/TaLEAsmR1,利用PCR技術對文庫進行篩選,獲得陽性混合池4個(pool 269、pool 479、pool 588和pool 721)。PCR產物測序表明,4個混合池中TaLEAsm基因序列一致。通過對混合池pool 269進一步篩選,分離出含有TaLEAsm的BAC單克隆。脈沖場凝膠電泳顯示,該克隆插入片段75 kb左右。
根據TaLEAsmcDNA序列設計測序引物,以含有該序列的BAC單克隆質粒為模板,通過5次測序反應,經序列組裝,獲得1條長為3 846 bp 的DNA序列。NCBI blastx分析表明,該序列中含有完整的TaLEAsm。TaLEAsm基因cDNA序列和gDNA序列分別長為843 bp和948 bp,該基因僅含有1個105 bp的內含子(圖2)。TaLEAsm讀碼框長為675 bp,編碼一個含有224個氨基酸的蛋白,分子量為23.2 kD。TaLEAsm具有10個重復的11-氨基酸基序(TAQAAKEKAGE),這些重復的基序以串聯重復形式分3組分布在TaLEAsm序列中,長度占蛋白質全序列的54%[4](圖3)。序列比對表明,單子葉植物第3組LEA基因在11-氨基酸基序重復區域保守性低,11-氨基酸基序數目的不同導致該區域序列長度的變化(圖4)。

圖2 TaLEAsm基因結構
2.3TaLEAsm基因的表達模式分析
分析TaLEAsm基因在低溫、高鹽、PEG脅迫處理下的小麥幼苗根和葉中的表達,發現其受這些脅迫誘導表達,但表達模式有所不同(圖5)。在高鹽條件下,根中TaLEAsm基因表達量明顯高于葉中,二者相差3倍以上;而在PEG滲透脅迫條件下,葉中TaLEAsm基因表達量高于根中,二者相差也在3倍以上。低溫、高鹽、PEG脅迫處理下,葉中TaLEAsm基因在24 h時表達量達到峰值;而根中TaLEAsm基因在12 h時表達量達到峰值。說明TaLEAsm基因為低溫、高鹽和PEG誘導表達基因;在高鹽和PEG脅迫下,TaLEAsm基因在根和葉中可能存在不同的調控機制。
2.4TaLEAsm基因啟動子的克隆與序列分析
TaLEAsm基因轉錄起始點為A,位于起始密碼子上游23 bp處,符合轉錄起始點的一般特點。通過延伸測序獲得TaLEAsm基因起始密碼子ATG上游5′側翼序列2 290 bp。采用PlantCARE在線預測TaLEAsm基因ATG上游1 500 bp序列的順式作用元件,該啟動子序列中含有14個與逆境響應相關的順式作用元件,包括ABRE(5)、CE3(2個)、CGTCA-motif(2個)、HSE(2個)、TGACG-motif(2個)和motif IIb(1個)(表1),說明TaLEAsm基因可能與小麥逆境脅迫反應有關。

11-氨基酸基序用細線標出。 The motif of eleven amino acids is marked by thin line.

圖4 單子葉植物第3組LEA蛋白的序列比對

圖5 TaLEAsm基因在不同脅迫處理下的表達模式

順式作用元件名稱Nameofcis-actingelement物種Species位置Location/bpDNA鏈Strand序列Sequence功能FunctionABRE大麥464+GCAACGTGTC脫落酸響應順式作用元件Hordeumvulgare1146-GCAACGTGTCCis-actingelementinvolvedintheabscisicacidresponsiveness1340+GCAACGTGTC1114+CGTACGTGCA1310+CCTACGTGGCCE3水稻Oryzasativa945-GACGCGTGTC脫落酸和休眠基因Viviparous-1響應順式作用元件1297+GACGCGTGTCCis-actingelementinvolvedinABAandVP1responsivenessCGTCA-motif大麥Hordeumvulgare951+CGTCA茉莉酸甲酯響應順式作用元件Cis-actingregulatoryelementinvolvedinthe1156+CGTCAMeJA-responsivenessHSE油菜Brassicaoleracea247-AAAAAATTTC熱脅迫響應順式作用元件Cis-actingelementinvolvedinheatstressresponsiveness825-AAAAAATTTCTGACG-motif大麥Hordeumvulgare951-TGACG茉莉酸甲酯響應順式作用元件Cis-actingregulatoryelementinvolvedinthe1156-TGACGMeJA-responsivenessMotifIIb水稻Oryzasativa1333+CCGCCGCGCT脫落酸反應元件Abscisicacidresponsiveelement
2.5TaLEAsm基因啟動子的功能分析
以含有TaLEAsm基因的BAC質粒為模板,經PCR擴增獲得了TaLEAsm起始密碼子ATG上游5′側翼序列1 637 bp,構建了啟動子表達載體(TaLEAsmPro::GUS)。采用花序轉化法轉化擬南芥,選取T3代純合體進行GUS表達分析。1/2MS培養基、16% PEG6000和400 mmol·L-1Mannitol處理的擬南芥幼苗在子葉中均能觀察到顯示GUS活性的藍色。與在1/2MS培養基生長的擬南芥幼苗相比,16% PEG6000和400 mmol·L-1Mannitol處理均導致擬南芥幼苗子葉的藍色明顯加深(圖6)。GUS染色結果表明,TaLEAsm基因啟動子存在組成型表達,滲透脅迫處理能夠明顯提高其表達水平,因此,TaLAEsm啟動子為滲透脅迫誘導型啟動子。

圖6 TaLEAsmPro::GUS轉基因擬南芥GUS染色
3 討 論
植物在生長發育過程中,面臨著多種非生物逆境脅迫,在長期進化過程中,植物形成了一系列的抵御機制,從而減輕或消除各種逆境脅迫對其生長發育的影響。已有研究表明,逆境脅迫誘導植物第3組LEA蛋白基因上調表達,轉第3組LEA蛋白基因能夠提高植物的抗逆性[6-13,22]。低溫、高鹽和干旱等非生物逆境脅迫均誘導小麥第3組LEA蛋白基因 TaLEAL3、 TaDRLea3-2和 TaLEAsm的上調表達,但其誘導表達譜呈現不同特征[10,23],這些結果表明,第3組LEA蛋白基因可能通過不同機制參與小麥逆境脅迫響應。
第3組LEA蛋白的11-氨基酸基序可形成兼性α-螺旋,其親水表面與過量的離子“螯合”,從而減輕胞質中高濃度離子對細胞的毒害。其疏水面可結合膜結構或蛋白,從而維持膜結構穩定和阻止蛋白聚集變性[4]。作物第3組LEA蛋白的11-氨基酸基序的拷貝數相差較大,少則5個(棉花D-7),多則27個(胡蘿卜DC8)[5]。小麥TaLEAsm屬于典型的第3組LEA蛋白基因,編碼蛋白含有10個11-氨基酸基序,這些基序以串聯重復形式分3組分布在TaLEAsm序列中,占蛋白長度的一半以上。第3組LEA蛋白11-氨基酸基序與植物抗逆性有關,但其拷貝數與植物抗逆性強弱之間是否相關缺乏試驗證據,尚待深入研究。
TaLEAsm和 TaLEAL3啟動子含有的逆境響應相關的順式作用元件不同,前者為ABRE、CE3等,而后者為ABRE、DRE、DRE/CRT 和DPBF 等,這表明TaLEAsm和 TaLEAL3可能通過依賴ABA的信號轉導途徑參與小麥逆境脅迫響應,同時也為二者對不同逆境的響應差異提供了佐證。
第3組LEA蛋白參與植物多種非生物逆境脅迫響應,隨著對其研究的不斷深入,第3組LEA蛋白有望在作物抗逆分子育種中發揮更為重要的作用。TaLEAsm及其啟動子的克隆為小麥抗逆轉基因育種提供了新的選擇[15-20,24]。TaLEAsm對低溫、鹽害和干旱脅迫響應強烈,其啟動子為干旱強誘導型啟動子,暗示該基因能夠提高小麥的非生物逆境抗性,但其逆境響應機制尚需深入探討。
[1] 楊 杞,尹佳佳,王 穎,等.檸條錦雞兒 CkLEA1基因克隆及表達分析[J].中國生物工程雜志,2013,33(5):93.
YANG Q,YIN J J,WANG Y,etal.Cloning and expression analysis of CkLEA1 gene inCaraganakorshinskiiKom [J].ChinaBiotechnology,2013,33(5):93.
[2]DURE L,CHLAN C.Developmental biochemistry of cottonseed embryogenesis and germination:XII.Purification and properties of principal storage proteins [J].PlantPhysiology,1981,68(1):180.
[3]XIONG L,ZHU J K.Molecular and genetic aspects of plant responses to osmotic stress [J].Plant,Cell&Environment,2002,25(2):131.
[4]DURE L.A repeating 11-mer amino acid motif and plant desiccation [J].PlantJournal,1993,3:363.
[5] 孫海丹,蘭 英,劉 昀,等.LEA蛋白質11-氨基酸基序與植物抗旱性[J] .東北師范大學學報(自然科學版),2004,36(3):85.
SUN H D,LAN Y,LIU Y,etal.11-amino acid motif in late embryogenesis abundant protein (LEA) and plant desiccation tolerance [J].JournalofNortheastNormalUniversity(NaturalScienceEdition),2004,36(3):85.
[6]NDONG C,DANYLUK J,WILSON K E,etal.Cold-regulated cereal chloroplast late embryogenesis abundant-like proteins:molecular characterization and functional analyses [J].PlantPhysiology,2002,129:1368.
[7]LAL S,GULYANI V,KHURANA P.Overexpression of HVA1 gene from barley generates tolerance to salinity and water stress in transgenic mulberry (Morusindica) [J].TransgenicResearch,2008,17:651.
[8]XU D,DUAN X,WANG B,etal.Expression of a late embryogenesis abundant protein gene, HVA1,from barley confers tolerance to water deficit and salt stress in transgenic rice [J].Plantphysiology,1996,110:249.
[9] 胡廷章,吳應梅,陳再剛,等.水稻 OsLEA19a基因的克隆、表達及生物信息學分析[J].華北農學報,2011,26(6):73.
HU T Z,WU Y M,CHEN Z G,etal.Molecular cloning,expression character and bioinformatics analysis of OsLEA19a from rice [J].ActaAgriculturaeBoreali-Sinica,2011,26(6):73.
[10] 閔東紅,趙 月,陳 陽,等.小麥脅迫相關基因 TaLEAL3的克隆及分子特性分析[J].作物學報,2012,38(10):1847.
MIN D H,ZHAO Y,CHEN Y,etal.Isolation and molecular characterization of stress-related TaLEAL3 gene in wheat [J].ActaAgronomicaSinica,2012,38(10):1847.
[11] 馬 婧,孫文婷,王 晶,等.蠟梅胚胎晚期豐富蛋白基因CpLEA的克隆及表達分析[J].園藝學報,2014,41(8):1663.
MA J,SUN W T,WANG J,etal.Cloning and expression analysis of a late embryogenesis abundant protein geneCpLEAfromChimonanthuspraecox[J].ActaHorticulturaeSinica,2014,41(8):1663.
[12]LIU Y,WANG L,XING X,etal. ZmLEA3,a multifunctional group 3 LEA protein from maize (ZeamaysL.),is involved in biotic and abiotic stresses [J].PlantandCellPhysiology,2013,54:944.
[13]LIU Y,LIANG J,SUN L,etal.Group 3 LEA protein, ZmLEA3,is involved in protection from low temperature stress [J].FrontiersinPlantScience,2016,7:1011.
[14]LI F,HAN Y Y,FENG Y,etal.Expression of wheat expansin driven by the RD29 promoter in tobacco confers water-stress tolerance without impacting growth and development [J].JournalofBiotechnology,2013,163(3):281.
[15] 霍秀文,米福貴,云錦鳳,等.轉錄因子CBF4誘導型啟動子的克隆及功能分析[J].分子植物育種,2005,3(3):363.
HUO X W,MI F G,YUN J F,etal.Cloning and functional analysis of an induced promoter of transcriptional factor CBF4 fromArabidopsis[J].MolecularPlantBreeding,2005,3(3):363.
[16]XU W,YU Y,DING J,etal.Characterization of a novel stilbene synthase promoter involved in pathogen- and stress-inducible expression from Chinese wildVitispseudoreticulata[J].Planta,2010,231(2):475.
[17] 楊 梅,熊立仲.水稻干旱誘導型啟動子Oshox24P的分離與鑒定[J].華中農業大學學報,2011,30(5):525.
YANG M,XIONG L Z.Isolation and characterization of a drought-inducible promoter Oshox24P in rice [J].JournalofHuazhongAgriculturalUniversity,2011,30(5):525.
[18]LEE S C,KIM S H,KIM S R.Drought inducible OsDhn1 promoter is activated by OsDREB1A and OsDREB1D [J].JournalofPlantBiology,2013,56(2):115.
[19] 張新宇,趙蘭杰,李艷軍,等.鹽脅迫對擬南芥 AtPUB18基因的誘導表達及其啟動子分析[J].西北植物學報,2014,34(1):54.
ZHANG X Y,ZHAO L J,LI Y J,etal.Expression of AtPUB18 after salt stress treatment and analysis of its promoter fromArabidopsisthaliana[J].ActaBotanicaBoreali-OccidentaliaSinica,2014,34(1):54.
[20]TAO Y,WANG F T,JIA D M,etal.Cloning and functional analysis of the promoter of a stress-inducible gene( ZmRXO1) in maize [J].PlantMolecularBiologyReporter,2014,33(2):1.
[21]CLOUGH S I,STEVEN I,BENT A F.Floral dip:a simplified method forAgrobacterium-mediated transformation ofArabidopsisthaliana[J].PlantJournal,1998,16(6):735.
[22]VASEVA I I,GRIGOROVA B S,SIMOVA-STOILOVA L P,etal.Abscisic acid and late embryogenesis abundant protein profile changes in winter wheat under progressive drought stress [J].PlantBiology,2010,12:698.
[23] 梁雅珺,于正陽,強智全,等.小麥 TaDRLea3-2基因的克隆及脅迫誘導表達分析[J].西北植物學報,2016,36(6):1091.
LIANG Y J,YU Z Y,QIANG Z Q,etal.Cloning of a new gene TaDRLea3-2 from wheat and its expression under different stresses treatments [J].ActaBotanyBoreal-OccidentSinica,2016,36(6):1091.
[24] 李孟軍,李亞青,張 楠,等.小麥 TaDHN2基因及其啟動子的克隆與功能研究[J].麥類作物學報,2015,35(8):1031.
LI M J,LI Y Q,ZHANG N,etal.Cloning and functional analysis of coding and promoter regions of TaDHN2 gene in wheat [J].JournalofTriticeaeCrops,2015,35(8):1031.
Isolation and Functional Analysis of Coding and Promoter Regions ofLEAsmGene in Wheat
LI Mengjun,LI Yaqing,ZHANG Shichang,ZHANG Nan,SHI Zhanliang
(Shijiazhuang Academy of Agriculture and Forestry Sciences,Shijiazhuang,Hebei 050041,China)
Late embryogenesis abundant (LEA) proteins are a family of small highly hydrophilic proteins that accumulate markedly in plants under stress conditions and protect plants from the damage caused by stress. LEA proteins can be classified into seven groups,in which group 3 LEA proteins are characterized as a repeating motif of eleven amino acids. In order to analyze the mechanism of group 3 LEA proteins in response to stress conditions deeply,an osmotic-stress induced gene,TaLEAsm,was screened in DNA microarrays for wheat expression profiles. One BAC clone was isolated from Shimai 15 BAC library using primers designed based onTaLEAsmcDNA sequence.TaLEAsmand its promoter sequence were cloned by sequencing walking using BAC clone plasmid as template. Only an 105 bp intron was identified inTaLEAsm. The open reading frame ofTaLEAsmis 675 bp long,encoding 224 amino acids.TaLEAsm belonged to group 3 LEA protein containing ten repeating motifs of eleven amino acids.TaLEAsmwas strongly up-regulated induced by low temperature,high salt and osmotic stress,showing different expression patterns in root and leaf of wheat. Fourteen stress-responsecis-elements were predicted in 1 500 bp sequence upstream ofTaLEAsmstart codon.TaLEAsmpromoter could lead to the expression ofGUSgene,which was induced by osmotic stress inArabidopsis.The results above indicatedTaLEAsmmay be a dehydration-response gene and its promoter was an inducible promoter.
Triticumaestivum;TaLEAsm; Promoter; Cloning; Functional analysis
時間:2017-01-16
2016-09-27
2016-11-18
國家重點研發計劃項目(2016YFD0101802);國家公益性行業(農業)科研專項(201203012);河北省科技支撐計劃項目(16226320D)
E-mail:lmj199612@aliyun.com
史占良(E-mail:shizhanl@163.com)
S512.1;S330
A
1009-1041(2017)02-0145-08
網絡出版地址:http://www.cnki.net/kcms/detail/61.1359.S.20170116.1833.002.html

