利用正交試驗設計優化桂花的SSR-PCR體系
王 萍, 母洪娜, 耿興敏, 楊秀蓮, 王良桂
(南京林業大學風景園林學院,江蘇南京 210037)
利用正交試驗設計優化桂花的SSR-PCR體系
王 萍, 母洪娜, 耿興敏, 楊秀蓮, 王良桂
(南京林業大學風景園林學院,江蘇南京 210037)
以潢川金桂DNA為SSR-PCR擴增模板,采用L16(45)正交設計對Taq酶用量、Mg2+濃度、模板DNA用量、dNTPs濃度以及引物濃度在4個水平上進行了優化,建立了桂花SSR-PCR反應的最佳體系,即在10 μL反應體系中,不同成分的最佳含量為Taq酶0.2 U、Mg2+3.0 mmol/L、模板DNA 40 ng、dNTPs 0.60 mmol/L、引物0.8 μmol/L。應用最佳體系對引物OfP50進行退火溫度的優化,得到最適退火溫度范圍為60~62 ℃。
桂花;SSR-PCR;體系優化;正交設計
簡單重復序列(simple sequence repeat,SSR)是一類由 1~6個堿基組成的基序串聯重復而成的DNA序列[1],其長度在100 bp以內,廣泛分布于各類真核生物基因組中。SSR標記由于具有高度的重復性、豐富的多態性、共顯性等優點,成為構建遺傳圖譜[2-3],研究遺傳多樣性,分析親緣關系[4-5],種質鑒定[6-8],進行分子輔助標記[9-10]、基因定位與克隆[11-12]等的理想工具。
桂花(OsmanthusfragransLour.)為木犀科木犀屬常綠小喬木或灌木,是城市優良的綠化樹種,也是我國十大傳統名花之一。近年來,對桂花分子方面的研究主要是利用SRAP[13-14]、RAPD[15]、ISSR[16-18]、AFLP[19-20]這幾種分子標記技術,以SSR分子標記對桂花開展的相關研究較少。本試驗采用正交試驗設計的方法對桂花SSR-PCR反應體系進行優化,以期建立一個穩定可靠的反應體系,為今后利用SSR標記技術對桂花開展進一步研究奠定基礎。
1 材料與方法
1.1 材料
試驗桂花采自南京林業大學校園內的潢川金桂,提取其DNA作為SSR-PCR反應的模板DNA。快捷型植物基因組DNA提取試劑盒(非離心柱型)購自天根生化科技(北京)有限公司;dNTPs、Mg2+、10×Buffer(Mg2+Free)、TaqDNA聚合酶、SSR引物、Marker(DL50)均購自上海捷瑞生物工程有限公司。根據筆者前期試驗,引物OfP50(5′-TTACCACCAAGATGACAGCGG-3′、5′-CCGCCCCCTTTCTCTCTCTA-3′)對于桂花具有良好的條帶可讀性與多態性,故選其為此次正交試驗及退火溫度的固定引物。
1.2 基因組DNA的提取
取生長良好的潢川金桂嫩葉,采用試劑盒的方法提取DNA。DNA的純度和濃度測定使用NanoDrop2000超微量分光光度計,選用D260 nm/D280 nm在1.7~1.9且濃度大于 20 ng/μL 的DNA進行PCR擴增,擴增前將DNA稀釋至 20 ng/μL。
1.3 PCR反應體系正交設計
選用L16(45)正交設計表,對PCR反應中5個因素(Taq酶含量、dNTPs含量、Mg2+含量、模板DNA含量、引物含量)在4個水平上進行試驗,因素水平的選取參考徐沂春等的方法[21-22]并加以綜合。PCR反應因素水平見表1,L16(45)設計方案見表2,本試驗采用 10 μL 體系,不足體積用ddH2O補齊,試驗設2次重復。
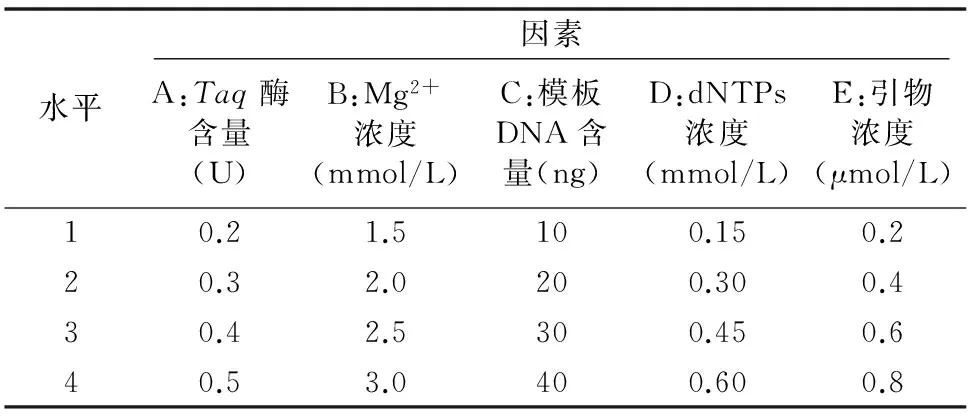
表1 優化桂花PCR反應體系的因素水平
1.4 SSR-PCR擴增
PCR擴增反應在Biometrac TPfofessional Standard PCR儀上進行。PCR反應程序:首先94 ℃預變性3 min;94 ℃變性45 s,58 ℃退火30 s,72 ℃延伸30 s,30個循環;最后72 ℃延伸5 min,4 ℃保存。
1.5 反應產物的電泳與檢測
在PCR產物中加入5 μL 0.25%溴酚藍,然后加樣,樣孔中每樣品點樣1 μL,D50Marker為對照,用12%聚丙烯酰胺凝膠于恒壓240 V電壓下電泳1 h左右,再進行銀染和顯影,凝膠在燈光下用數碼相機照相以供分析。
1.6 退火溫度的篩選
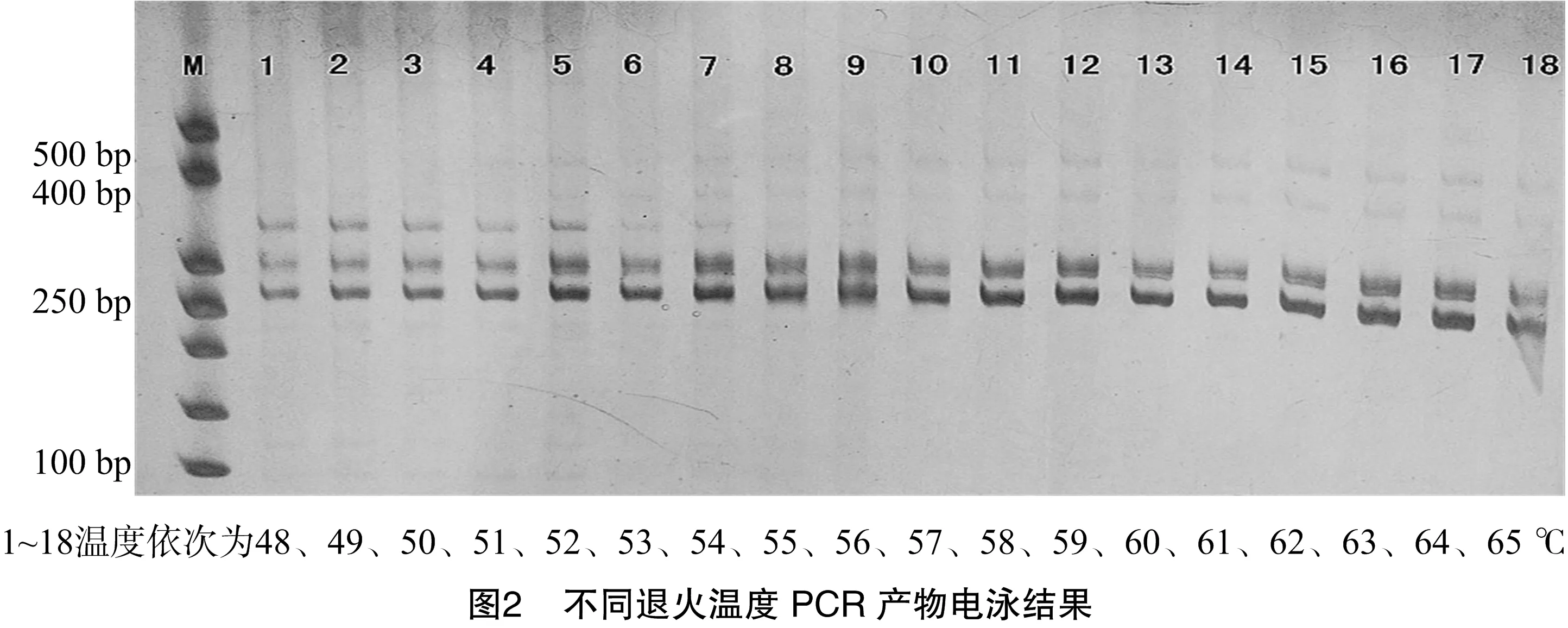
采用試驗確定的最佳反應體系對本次試驗所用引物OfP50 的退火溫度進行篩選。利用 ABI Veriti梯度PCR儀進行PCR反應程序中退火溫度梯度試驗。設置退火溫度為 48~65 ℃,共18個梯度,對所得PCR產物進行電泳檢測。

表2 優化桂花SSR-PCR反應體系L16(45)正交試驗設計
1.7 最佳反應體系的檢測
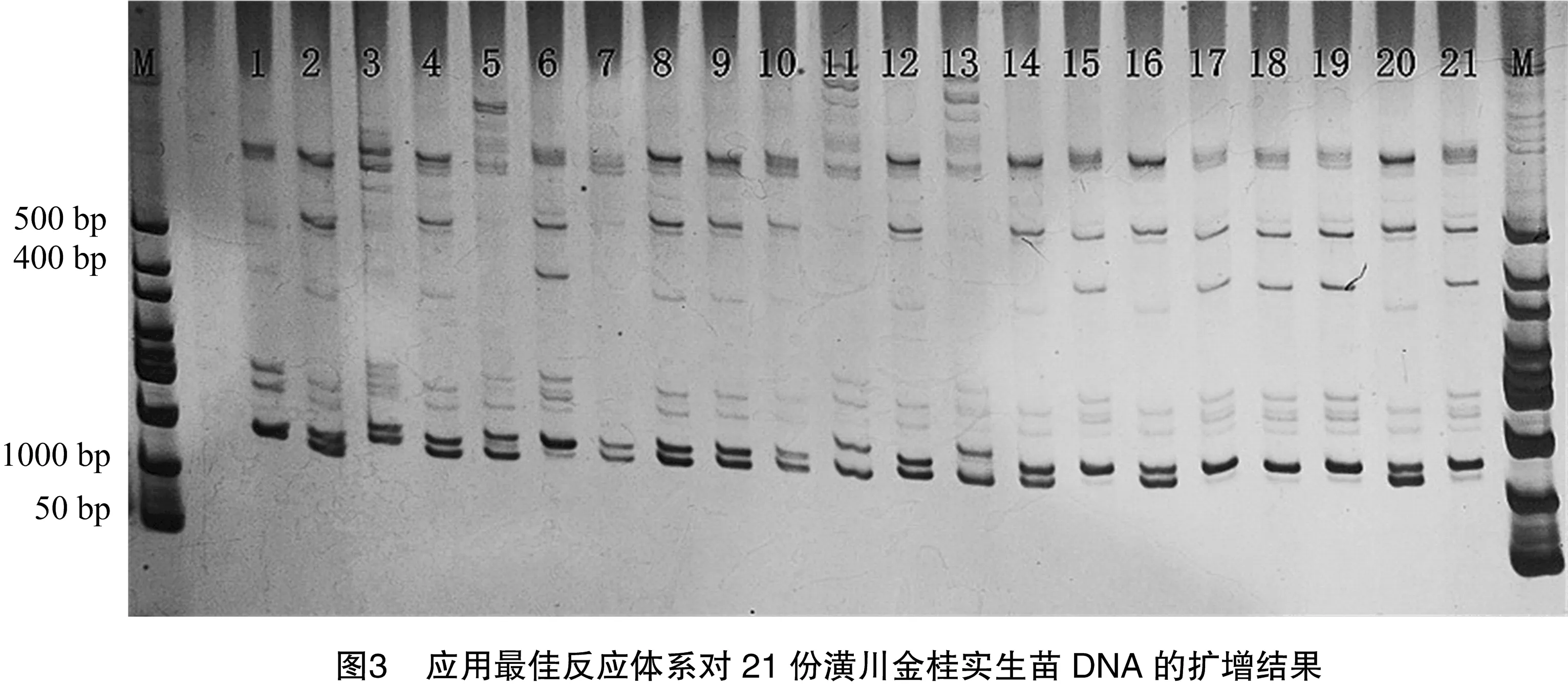
隨機選擇引物OfP16(5′-TGCATTTCTGACGCCTGGAT-3′、5′-ACCGTTGTCAAGCCCCTTTT-3′)對21份采集于南京林業大學校園同一植株的潢川金桂實生苗DNA進行SSR擴增,對優化確定的桂花SSR-PCR體系的穩定性進行檢測。
2 結果與分析
2.1 正交試驗
從圖1可以看出,5個因素的濃度組合不同,擴增出來的效果存在明顯差異。處理1、處理5、處理9沒有條帶;處理7、處理11、處理12、處理14、處理15、處理16擴增出了分子量小于50 bp的引物二聚體,處理15、處理16存在不同程度的雜帶;處理2、處理6、處理8、處理10條帶比較模糊;處理3、處理4、處理13擴增出了比較好的條帶。綜合考慮經濟因素以及清晰度,選擇處理4為最佳體系,即在10 μL反應體系中,Taq酶含量為0.2 U,Mg2+濃度為3.0 mmol/L,模板DNA含量為40 ng、dNTPs濃度為0.60 mmol/L、引物濃度為 0.8 μmol/L。

2.2 退火溫度篩選
退火溫度對擴增結果有較大的影響,引物在最適宜的退火溫度下擴增出來的條帶清晰,反之條帶會模糊、拖尾。試驗對引物OfP50設置了18個不同的退火溫度進行PCR擴增,不同溫度條件下產物的電泳結果見圖2,退火溫度過低,非特異性條帶增多,結果不可靠;退火溫度過高時,引物與模板結合差,清晰度下降。綜合考慮條帶數與清晰度,引物OfP50適宜的退火溫度范圍為60~62 ℃。
2.3 最佳反應體系穩定性檢測
應用該最佳反應體系,隨機選擇引物OfP16對21份取自同植株的潢川金桂實生苗DNA進行擴增,從圖3可以看出,21份DNA模板都擴增出了清晰目的條帶,說明該體系較穩定,適用于桂花SSR-PCR反應。
3 討論
PCR的體積對擴增效果有一定影響,體積過小,容易出現操作上的誤差,體積過大,增加試驗成本。本試驗采用 10 μL 反應體系,得到了清晰的條帶,相較王靜對桂花采用的20 μL反應體系[22],節省了試驗材料,并節約了成本。
引物的退火溫度對擴增效果有較大的影響,因此,采用不同的引物進行擴增反應時,須對引物進行退火溫度篩選,以確定最適宜的退火溫度。
正交設計的優越性就在于能均衡各個試驗因素并考慮到各因素間的交互效應,在減少試驗次數的同時又不使信息損失過多,可以在最短的時間內找到最優的組合[23]。很多學者在優化體系時也經常使用多次單因素設計[24-26],這種方法雖然簡便易行,但忽略了試驗因素間的交互效應,因此不能完全保證各個因素的最佳濃度組合到一起就是最佳反應體系,但是結果可以作為正交設計結果的參考。
桂花SSR-PCR優化體系的建立,可為今后桂花及其他木犀科植物的群體遺傳及基因型鑒定提供參考。
[1]周延清. DNA分子標記技術在植物研究中的應用[M]. 北京:化學工業出版社,2005.
[2]Gulsen O,Uzun A,Canan I,et al. A new citrus linkage map based on SRAP,SSR,ISSR,POGP,RGA and RAPD markers[J]. Euphytica,2010,173(2):265-277.
[3]陳慶全,張玉山. 秈型水稻SSR標記遺傳連鎖圖譜的構建及偏分離分析[J]. 分子植物育種,2009,7(4):685-689.
[4]孫希平,楊慶文. 中國與東南亞三國(越、老、柬)普通野生稻遺傳多樣性的比較研究[J]. 作物學報,2009,35(4):679-684.
[5]王利鋒,李會勇,唐保軍,等. 利用表型和SSR標記分析河南省玉米地方品種的遺傳多樣性[J]. 中國農業科學,2009,42(4):1136-1144.
[6]張紅蓮,李火根,胥 猛,等. 鵝掌楸屬種及雜種的SSR分子鑒定[J]. 林業科學,2010,46(1):36-39.
[7]張 杰,劉曉杰,孫君靈,等. 棉花種間雜交漸滲系SSR及農藝性狀分析[J]. 植物遺傳資源學報,2009,10(1):60-67.
[8]劉 峰,馮雪梅,鐘 文,等. 適合棉花品種鑒定的SSR核心引物的篩選[J]. 分子植物育種,2009,7(6):1160-1168.
[9]Zhang G L,Chen L Y,Xiao G Y,et al. Bulked segregant analysis to detect QTL related to heat tolerance in rice (OryzasativaL.) using SSR markers[J]. Agricultural Sciences in China,2009,8(4):482-487.
[10]滕衛麗,李文濱,韓英鵬,等. 大豆種質對SMV抗性鑒定的SSR輔助選擇[J]. 中國油料作物學報,2008,30(2):224-228.
[11]Liu C,Wang J,Huang T,et al. A missense mutation in the VHYNP motif of a DELLA protein causes a semi-dwarf mutant phenotype inBrassicanapus[J]. Theoretical and Applied Genetics,2010,121(2):249-258.
[12]陳立君,郭 強,劉迎雪,等. 大豆灰斑病1號生理小種抗性基因的SSR標記[J]. 中國農學通報,2009,25(9):43-46.
[13]胡春芳,袁錄霞,張 凡,等. 咸寧部分桂花品種親緣關系的 SRAP 分析[J]. 湖北農業科學,2012,51(9):1907-1911.
[14]李 梅,侯喜林,郝日明. 基于SRAP分子標記的桂花品種親緣關系研究[J]. 園藝學報,2009,36(11):1667-1675.
[15]趙小蘭,姚崇懷. 桂花部分品種的RAPD分析[J]. 華中農業大學學報,1999,18(5):484-487.
[16]范付華,夏 輝,王振啟,等. 咸寧地區部分桂花品種的ISSR分析[J]. 湖北大學學報(自然科學版),2014,36(3):272-276.
[17]段一凡,王賢榮,梁麗麗,等. 古桂遺傳多樣性與親緣關系的 ISSR 分析[J]. 福建林學院學報,2011,31(4):335-339.
[18]李 梅,侯喜林,單曉政,等. 部分桂花品種親緣關系及特有標記的ISSR分析[J]. 西北植物學報,2009,29(4):674-682.
[19]徐沂春,胡紹慶,趙宏波. 基于AFLP分子標記的不同類型野生桂花種群遺傳結構分析[J]. 浙江農林大學學報,2014,31(2):217-223.
[20]韓遠記,董美芳,袁王俊,等. 部分桂花栽培品種的AFLP分析[J]. 園藝學報,2008,35(1):137-142.
[21]徐沂春. 桂花遺傳多樣性及不同性別花的花芽特性[D]. 杭州:浙江農林大學,2013.
[22]王 靜. 桂花野生居群遺傳多樣性分析[D]. 南昌:江西農業大學,2011.
[23]續九如,黃智慧. 林業試驗設計[M]. 北京:中國林業出版社,1995.
[24]胡鳳榮,王 斐,王志強,等. 風信子ISSR-PCR體系的優化及引物篩選[J]. 分子植物育種,2013,12(1):139-144.
[25]謝文剛,張新全,彭 燕,等. 鴨茅SSR-PCR反應體系優化及引物篩選[J]. 分子植物育種,2008,6(2):381-386.
[26]高志紅,章 鎮,韓振海,等. 果梅SSR反應體系的優化[J]. 南京農業大學學報,2002,25(4):19-22.
10.15889/j.issn.1002-1302.2017.02.011
2016-01-12
國家科技支撐計劃(編號:2013BA001B06);江蘇省高校優勢學科建設工程(編號:PAPD)。
王 萍(1989—),女,江蘇常熟人,碩士,研究方向為園林植物育種。E-mail:alvawang@yeah.net。
王良桂,男,教授,博士生導師,研究方向為園林植物應用。E-mail:wlg@nifu.com.cn。
S685.130.1
A
1002-1302(2017)02-0044-03
王 萍,母洪娜,耿興敏,等. 利用正交試驗設計優化桂花的SSR-PCR體系[J]. 江蘇農業科學,2017,45(2):44-46.

