心臟淋巴管新生及其與心血管疾病預后的關系
張海鋒 譚玉珍(綜述) 王海杰(審校)
(復旦大學上海醫學院人體解剖與組織胚胎學系 上海 200032)
心臟淋巴管新生及其與心血管疾病預后的關系
張海鋒 譚玉珍(綜述) 王海杰△(審校)
(復旦大學上海醫學院人體解剖與組織胚胎學系 上海 200032)
心臟淋巴管的生理病理作用一直未引起人們的重視。但近年來,隨著血管內皮生長因子受體-3(vascular endothelial growth factor receptor 3,VEGFR-3)、淋巴管內皮細胞透明質酸受體(lymphatic vessel endothelial hyaluronan receptor 1,LYVE-1)、果蠅同源基因轉錄因子(prospero homeobox protein 1,Prox-1)、腎小球足細胞膜黏蛋白(podoplanin)等淋巴管內皮細胞標志物的發現,心臟淋巴管的研究迅速發展。心臟淋巴管引流淋巴液,其功能異常可引起心肌水腫、動脈硬化、心律失常、間質纖維化等。深入認識心臟淋巴管的生理病理作用,對于治療心肌梗死、改善心血管功能、預防心臟手術后并發癥等有著重要意義。本文綜述了心臟淋巴管的發生、分布以及與心血管疾病預后的關系。
淋巴管; 心臟; 淋巴管新生; 心肌梗死
Rudbeck等最早在研究犬心時發現心外膜下存在淋巴管。此后,有學者采用染料注射、過氧化氫注入等方法證實心內膜下和心肌間存在淋巴管[1]。Miller于1982年詳細描述了人心臟淋巴引流入局部淋巴結的途徑[2]。由于研究方法和技術的限制,對于心臟淋巴管功能的研究遠遠落后于心臟血管的研究,而且在心臟疾病研究中淋巴管的重要性也受到了忽視[3]。直到近幾年,隨著血管內皮生長因子受體-3(vascular endothelial growth factor receptor 3,VEGFR-3)[4]、淋巴管內皮細胞透明質酸受體(lymphatic vessel endothelial hyaluronan receptor 1, LYVE-1)[5]、果蠅同源基因轉錄因子(prospero homeobox protein 1,Prox-1)[6]、腎小球足細胞膜黏蛋白(podoplanin)[7]等淋巴管內皮細胞特異性標志物的發現,淋巴管的研究得到迅速發展。研究發現心臟淋巴管的主要功能是引流淋巴液,其異常時與心肌水腫、動脈硬化、心律失常、間質纖維化等發生密切相關[8]。因此,研究心臟淋巴管的結構、功能和新生等,對于減輕心肌梗死的病理變化、深入認識動脈硬化的發生發展、預防心臟手術后并發癥發生等有著重要意義。然而,關于心臟淋巴管與心血管疾病之間關系的研究剛剛起步。為此,本文綜合近年來心臟淋巴管相關的研究,對其發生、分布以及與疾病的關系等作一概述。
心臟淋巴管的發生 關于淋巴管的起源一直存在爭議[9-13]。1902年,Sabin等通過豬胚實驗提出淋巴管以出芽的方式起源于靜脈,稱為“離心模式”。1910年,Huntingdon等通過對貓胚切片的研究,提出淋巴管并非起自于靜脈,而是來源于間質內的不同細胞,稱為“向心模式”[8]。
采用墨汁注射并利用特異性標記Prox-1、LYVE-1或VEGFR-3免疫染色等顯示淋巴管的技術方法,在研究大鼠[14]、小鼠[15-18]、鳥類[16,19]心臟淋巴管發育時,發現淋巴管最初出現于心臟膈面的冠狀溝附近,然后沿血管從心底向心尖長出。然而,對于心臟發生過程中淋巴管內皮細胞的來源也一直沒有定論。2014年,Ratajska等[14]用免疫染色方法標記小鼠胚胎心臟,發現LYVE-1+細胞和管狀結構首先發生于冠狀溝背側,隨后構成這些結構的內皮細胞表達Prox-1。在小鼠胚胎發育晚期,這些管狀結構呈CD31+和LYVE-1+,這表明心臟淋巴管內皮細胞可能來源于早期的心臟靜脈。然而,尚未有確切證據表明所有的心臟淋巴管內皮細胞均以出芽方式來自于靜脈。2015年,Klotz等[20]用Whole-mount法檢測小鼠胚胎心臟的VEGFR-3、LYVE-1、Prox-1、podoplanin等標記物,發現在心臟淋巴管發育過程中新生的淋巴管內皮細胞至少部分來自于內皮祖細胞。Dashkevich等[21]將晚期心力衰竭心臟與正常心臟比較,提出心力衰竭后淋巴管的新生是在已有淋巴管基礎上由Prox-1+內皮細胞增殖形成,而并非由多分化潛能的干細胞分化而來或者由靜脈以出芽方式形成。然而,對于這些增殖的Prox-1+細胞是否來源于內皮祖細胞,目前尚不清楚。上述實驗結果表明,心臟淋巴管的新生可能有不同的細胞來源。關于心血管疾病時淋巴管內皮細胞的來源,還有待于進一步研究。
心臟淋巴管的分布和淋巴引流方向 心臟淋巴管的分布見圖1A。按分布位置心臟的淋巴管可分為心內膜下淋巴管、心肌層淋巴管和心外膜下淋巴管等[1]。毛細淋巴管匯合為淋巴管,后者再匯合成為左、右心淋巴干[14,22]。心臟內的淋巴引流途徑見圖1B。
心臟的毛細淋巴管 1924年,Aagaard等通過將染料注入活體犬的心肌,觀察到心內膜下、心肌層和心外膜下均有毛細淋巴管,三處之間形成連續性的毛細淋巴管網。1939年,Patek等采用印度墨水注射法證實了此發現,并提出心臟的淋巴引流起自心內膜下區,繼而穿過心肌層,匯入心外膜下淋巴管,再經心淋巴干注入淋巴結。此后,有學者采用注射過氧化氫,可使心外膜下淋巴管擴張,以更容易與心外膜組織相區分,從而研究了人、豬、犬等不同物種的心臟,進一步證實了這些發現[1,14]。
心內膜下的毛細淋巴管位于內皮下層的結締組織內,常有多個膨大,彼此交織形成網狀。心內膜下的毛細淋巴管穿入心肌層,與心肌層淋巴管匯合[23]。心肌層毛細淋巴管位于心肌纖維間的結締組織內,數目較少,缺乏連續性的基膜,內皮細胞連接的方式多樣,以適應不同的功能需要。間質內的淋巴管與毛細血管周圍的基膜緊密相連,形成“籃網狀”,沿微血管注入心外膜下淋巴管[1,23]。心外膜下的毛細淋巴管位于心外膜深面的結締組織內,形成疏松網狀,分為淺、深兩層,深層的毛細淋巴管比淺層的毛細淋巴管粗大,最后匯合成淋巴管[1]。
心臟的淋巴管 心臟的淋巴管形態多樣,由毛細淋巴管直接匯集成的淋巴管管壁較薄,內皮周圍有不規則和不連續的平滑肌層。沿著冠狀血管分支走行的淋巴管有較完整的平滑肌層,并有彈性纖維將其連于鄰近的結締組織。這些淋巴管在冠狀溝附近匯合成左、右心淋巴干[14,22]。與前室間支、左緣支和后室間支等伴行的淋巴管匯聚成左心淋巴干,在左心耳后方上行,經肺動脈干后面注入平主動脈弓高度的氣管前淋巴結。由該淋巴結發出的輸出淋巴管向上至主動脈的右后方,注入上腔靜脈和頭臂干之間的心淋巴結。在注入心淋巴結前,該輸出淋巴管通常分為兩個或多個分支,其中一支在變異時可向上經右淋巴導管注入右靜脈角。右心淋巴干引流右半心的淋巴,沿主動脈前面上行,注入左側氣管旁淋巴結,最后經胸導管注入左靜脈角[14,22,24]。

圖1 心臟淋巴管的分布(A)和淋巴引流方向(B)示意圖
Cui等[25]認為心臟淋巴的引流是由心肌舒縮等引起的被動性泵吸效應。當心肌舒張時,心室內血壓驅使淋巴從心內膜下進入心肌層。當心肌收縮時,心肌收縮的擠壓力又驅使淋巴從心肌層進入心外膜下淋巴管,隨后通過心淋巴干注入局部淋巴結。但目前尚無確切的實驗來證明這一觀點。
心臟淋巴管損傷對心血管疾病的影響 正常情況下,水和電解質等經毛細血管濾入心肌間隙,形成組織液,組織液中的水、脂肪和蛋白質等物質經心臟淋巴管收集,再引流入血管,以保持組織液代謝的動態平衡[2,26]。腫瘤、炎癥、外傷和缺血性心臟病等均可引起淋巴管閉塞[1],淋巴回流受阻,心肌間隙內組織液積聚,從而導致心肌水腫、心包積液等[27],心肌水腫壓迫心的傳導系可誘發心律失常[23],導致心臟功能障礙,而心肌收縮能力的下降又會加重心肌水腫[1]。近年來研究發現心臟淋巴管除了可以維持心肌間壓力和防止組織水腫以外,也與動脈硬化、間質纖維化等多種心血管疾病的病理變化及發展有關[2]。心臟淋巴管損傷,代謝產物堆積,易于引起成纖維細胞增殖,導致心肌梗死后纖維化的發生[14];冠狀血管內膜代謝物積聚引起動脈硬化[2],粥樣斑塊的脫落導致心肌缺血,進一步形成心肌梗死和纖維化,從而影響心臟功能(圖2)。
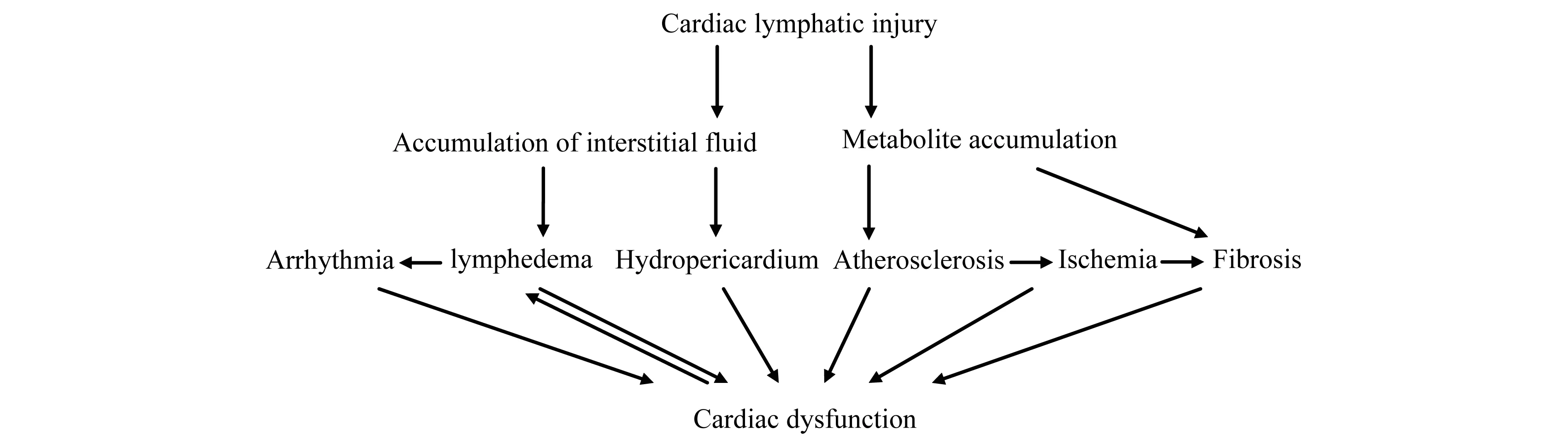
圖2 心臟淋巴管損傷對心血管疾病的影響
心臟淋巴管新生與心血管疾病的預后
心臟淋巴管與心肌梗死 心肌梗死后的心肌重建過程依次經過心肌壞死、肉芽形成和纖維化等階段。2007年,Ishikawa等[28]報道在心肌梗死后早期未發現淋巴管新生,其新生時間晚于血管新生。在肉芽形成早期,淋巴管在梗死邊緣從已存在的淋巴管以出芽方式開始新生,但對于這些新生淋巴管的內皮細胞來源尚不清楚。在纖維化和疤痕形成期,由于血管減少,主要依賴新生的淋巴管引流組織液和蛋白質。冠狀血管阻塞引起心肌梗死后,淋巴回流受阻,可加重心肌組織損傷。由于透明質酸和硫酸軟骨素等黏性物質的積聚,易于引起成纖維細胞增殖,導致心肌梗死后纖維化的發生[14]。2010年,Cui等[25]提出心肌梗死后淋巴回流得到改善可減輕間質水腫,有效排出缺氧后的組織代謝產物,從而改善心臟功能。促進淋巴管新生可能成為治療心肌梗死的一項理想措施[29]。
2011年,Park等[30]在急性心肌梗死后移植骨髓源性內皮祖細胞,并未發現這些細胞參與梗死邊緣區淋巴管的新生,但水腫減輕,纖維化減弱,心肌收縮功能得到改善。令人感興趣的研究發現,內皮祖細胞能夠分化為淋巴管內皮細胞[12-13,31]。Park等[30]未發現內皮祖細胞參與淋巴管新生,可能是因為心肌層淋巴管數目過少,而移植的細胞數目也較少所造成的。2015年,Klotz等[20]提出小鼠心肌梗死后給予血管內皮生長因子-C(vascular endothelial growth factor C,VEGF-C)可顯著地增強淋巴管新生,心臟功能得到明顯改善。2016年,Henri等[32]觀察到在大鼠心肌梗死后心肌注射納米材料結合的VEGF-C可以顯著地促進淋巴管新生,減輕心肌水腫,緩解炎癥和纖維化程度,改善心臟功能。這些研究證明淋巴管新生有利于心肌梗死后心臟功能的恢復。然而,細胞移植是否參與淋巴管新生,以及采用何種方式能更有效地促進心臟淋巴管新生有待進一步研究。
心臟淋巴管與動脈硬化 心臟淋巴管可能與冠狀動脈粥樣硬化的預后有關,但其作用機制尚不明確。Nakano等[33]報道冠狀動脈粥樣硬化時淋巴管新生較少,血管壁內組織液積聚,影響氧氣供應和微循環,可能導致粥樣斑塊的破裂和脫落。促進淋巴管新生是否可以延緩動脈硬化發展,目前尚不清楚。Xu等[34]認為動脈硬化引起血管損傷時,釋放多種因子促進血管新生和淋巴管新生。新生的淋巴管輸送炎性細胞和細胞因子至淋巴結,炎性細胞在淋巴結內因致敏而被激活,隨后經淋巴管回流至血液循環。這些被激活的炎性細胞又可通過血液循環被再輸送至損傷部位。這樣,血管和淋巴管因炎癥而組成了一個免疫應答環路。炎性細胞和細胞因子的功能被逐漸放大,導致粥樣硬化、持續性內膜增生和血管重構等。這些研究表明淋巴管新生參與了動脈硬化的病理發展過程,然而關于心臟淋巴管在動脈硬化發生發展過程中的具體作用機制,目前尚未見有確切的實驗依據證實。
心臟淋巴管與心臟手術后并發癥 心臟手術后淋巴管損傷所引起的心律失常很少引起人們的注意。Lupinski等[23]發現淋巴管損傷后心臟淋巴淤滯,組織水腫,間質壓力升高。心電圖出現類似心肌缺血樣的Q波、ST段改變和T波異常,進而發生心律失常。這些改變可能與淋巴水腫引起的缺血有關。由于主動脈根部脂肪墊內有引流竇房結附近淋巴的右心淋巴干通過,該淋巴干損傷可引起心房顫動和心臟功能障礙等并發癥[35]。因此,心臟手術時應注意保護好主動脈根部脂肪墊內的淋巴管,以減少術后心律失常等并發癥的發生[23]。心肌收縮是心肌層淋巴回流的決定因素[25],對心臟淋巴管的新生也有影響[36],淋巴管受損后引起心肌收縮能力的降低,從而加重了心臟手術后心肌水腫,可進一步導致心室功能障礙[1]。心外膜淋巴液的滲出可能產生心包腔積液[2]。心臟移植手術后,淋巴管受損引起心肌損傷和冠狀血管病變,是導致心臟移植手術失敗的重要原因之一[37]。然而,淋巴管過度新生可引起心臟移植后的免疫排斥反應[38]。因此,心臟手術時淋巴管的損傷對于手術預后產生影響。關于淋巴管新生對于不同并發癥的作用及其機制有待于進一步研究。
以上研究表明,心臟淋巴回流受阻是引起組織水腫、炎癥發生、纖維化、心律失常等病理變化的重要因素。心臟淋巴管新生和功能恢復可促進心血管功能的改善,有利于心臟疾病的轉歸。然而,有關心臟淋巴管新生的細胞分子生物學機制,譬如淋巴管新生時的細胞來源、淋巴管新生對動脈硬化和心臟移植的影響、細胞移植是否參與心肌梗死后的淋巴管新生等,目前尚未明確。至今為止,對心臟淋巴管新生的認識仍然有限,有待于深入研究。
[1] LOUKAS M,ABEL N,TUBBS RS,etal.The cardiac lymphatic system[J].ClinAnat,2011,24(6):684-691.
[2] MILLER AJ.The grossly invisible and generally ignored lymphatics of the mammalian heart[J].MedHypotheses,2011,76(4):604-606.
[3] CHOI I,LEE S,HONG YK.The new era of the lymphatic system:no longer secondary to the blood vascular system[J].ColdSpringHarbPerspectMed,2012,2(4):a006445.
[4] JOUKOV V,PAJUSOLA K,KAIPAINEN A,etal.A novel vascular endothelial growth factor,VEGF-C,is a ligand for the Flt4 (VEGFR-3) and KDR (VEGFR-2) receptor tyrosine kinases[J].EMBOJ,1996,15(7):1751.
[5] BANERJI S,NI J,WANG SX,etal.LYVE-1,a new homologue of the CD44 glycoprotein,is a lymph-specific receptor for hyaluronan[J].JCellBiol,1999,144(4):789-801.
[6] WIGLE JT,OLIVER G.Prox1 function is required for the development of the murine lymphatic system[J].Cell,1999,98(6):769-778.
[7] BREITENEDER-GELEFF S,SOLEIMAN A,KOWALSKI H,etal.Angiosarcomas express mixed endothelial phenotypes of blood and lymphatic capillaries:podoplanin as a specific marker for lymphatic endothelium[J].AmJPathol,1999,154(2):385-394.
[8] NORMAN S,RILEY P.Anatomy and development of the cardiac lymphatic vasculature:its role in injury and disease[J].ClinAnat,2016,29(3):305-315.
[9] BAUTCH VL,CARON KM.Blood and lymphatic vessel formation[J].ColdSpringHarbPerspectBiol,2015,7(3):a008268.
[10] NICENBOIM J,MALKINSON G,LUPO T,etal.Lymphatic vessels arise from specialized angioblasts within a venous niche[J].Nature,2015,522(7554):56-61.
[11] HOGAN BM,BLACK BL.Developmental biology:diversity in the lymphatic vasculature[J].Nature,2015,522(7554):37-38.
[12] STANCZUK L,MARTINEZ-CORRAL I,ULVMAR MH,etal.cKit lineage hemogenic endothelium-derived cells contribute to mesenteric lymphatic vessels[J].CellRep,2015,10(10):1708-1721.
[13] MARTINEZ-CORRAL I,ULVMAR MH,STANCZUK L,etal.Nonvenous origin of dermal lymphatic vasculature[J].CircRes,2015,116(10):1649-1654.
[14] RATAJSKA A,GULA G,FLAHT-ZABOST A,etal.Comparative and developmental anatomy of cardiac lymphatics[J].SciWorldJ,2014,2014:183170.
[15] JUSZYNSKI M,CISZEK B,STACHURSKA E,etal. Development of lymphatic vessels in mouse embryonic and early postnatal hearts[J].DevDyn,2008,237(10):2973-2986.
[16] KARUNAMUNI G,YANG K,DOUGHMAN YQ,etal. Expression of lymphatic markers during avian and mouse cardiogenesis[J].AnatRec(Hoboken), 2010,293(2):259-270.
[17] FLAHT A,JANKOWSKA-STEIFER E,RADOMSKA DM,etal.Cellular phenotypes and spatio-temporal patterns of lymphatic vessel development in embryonic mouse hearts[J].DevDyn,2012,241(9):1473-1486.
[18] YANG Y,GARCIA-VERDUGO JM,SORIANO-NAVARRO M,etal.Lymphatic endothelial progenitors bud from the cardinal vein and intersomitic vessels in mammalian embryos[J].Blood,2012,120(11):2340-2348.
[19] WILTING J,BUTTLER K,SCHULTE I,etal. The proepicardium delivers hemangioblasts but not lymphangioblasts to the developing heart[J].DevBiol,2007,305(2):451-459.
[20] KLOTZ L,NORMAN S,VIEIRA JM,etal.Cardiac lymphatics are heterogeneous in origin and respond to injury[J].Nature,2015,522(7554):62-67.
[21] DASHKEVICH A,BLOCH W,ANTONYAN A,etal. Morphological and quantitative changes of the initial myocardial lymphatics in terminal heart failure[J].LymphatResBiol,2009,7(1):21-27.
[22] 王海杰,譚玉珍.實用心臟解剖學[M].上海:復旦大學出版社,2007:134-136.
[23] LUPINSKI RW.Aortic fat pad and atrial fibrillation:cardiac lymphatics revisited[J].ANZJSurg,2009,79(1-2):70-74.
[24] FLAHT-ZABOST A,GULA G,CISZEK B,etal.Cardiac mouse lymphatics:developmental and anatomical update[J].AnatRec(Hoboken),2014,297(6):1115-1130.
[25] CUI Y.The role of lymphatic vessels in the heart[J].Pathophysiology,2010,17(4):307-314.
[26] ASPELUND A,ROBCIUC MR,KARAMAN S,etal.Lymphatic system in cardiovascular medicine[J].CircRes,2016,118(3):515-530.
[27] DAVIS KL,LAINE GA,GEISSLER HJ,etal.Effects of myocardial edema on the development of myocardial interstitial fibrosis[J].Microcirculation,2000,7(4):269-280.
[28] ISHIKAWA Y,AKISHIMA-FUKASAWA Y,ITO K,etal.Lymphangiogenesis in myocardial remodelling after infarction[J].Histopathology, 2007,51(3):345-353.
[29] ANGELI V,HARVEY N.Lymphatic vessels at the heart of the matter[J].CellMetab,2015,22(1):56-58.
[30] PARK JH,YOON JY,KO SM,etal.Endothelial progenitor cell transplantation decreases lymphangiogenesis and adverse myocardial remodeling in a mouse model of acute myocardial infarction[J].ExpMolMed,2011,43(8):479-485.
[31] TAN Y,WANG H,ZHANG M,etal.CD34+VEGFR-3+progenitor cells have a potential to differentiate towards lymphatic endothelial cells[J].JCellMolMed,2014,18(3):422-433.
[32] HENRI O,POUEHE C,HOUSSARI M,etal.Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction[J].Circulation,2016,133(15):1484-1497.
[33] NAKANO T,NAKASHIMA Y,YONEMITSU Y,etal.Angiogenesis and lymphangiogenesis and expression of lymphangiogenic factors in the atherosclerotic intima of human coronary arteries[J].HumPathol,2005,36(4):330-340.
[34] XU X,LIN H,LV H,etal.Adventitial lymphatic vessels-an important role in atherosclerosis[J].MedHypotheses, 2007,69(6):1238-1241.
[35] DAVIS Z,JACOBS HK,BONILLA J,etal.Retaining the aortic fat pad during cardiac surgery decreases postoperative atrial fibrillation[J].HeartSurgForum,2000,3(2):108-112.
[36] GREIWE L,VINCK M,SUHR F.The muscle contraction mode determines lymphangiogenesis differentially in rat skeletal and cardiac muscles by modifying local lymphatic extracellular matrix microenvironments[J].ActaPhysiol,2016,217(1):61-79.
[37] KONG X,WANG L,KONG D.Cardiac lymphatic interruption is a major cause for allograft failure after cardiac transplantation[J].LymphatResBiol,2007,5(1):45-47.
[38] DASHKEVICH A,RAISSADATI A,SYRJALA S,etal.Ischemia-reperfusion injury enhances lymphatic endothelial VEGFR3 and rejection in cardiac allografts[J].AmJTransplant,2016,16(4):1160-1172.
Cardiac lymphangiogenesis and its relation to prognosis of cardiovascular diseases
ZHANG Hai-feng, TAN Yu-zhen, WANG Hai-jie△
(DepartmentofHumanAnatomyandHistoembryology,ShanghaiMedicalCollege,FudanUniversity,Shanghai200032,China)
Physiopathological effects of cardiac lymphatics have been neglected for many years.Recently research on cardiac lymphatics increases greatly following discovering of specific markers of lymphatic endothelial cells such as vascular endothelial growth factor receptor 3 (VEGFR-3),lymphatic vessel endothelial hyaluronan recepotor 1 (LYVE-1),prospero homeobox protein 1 (Prox-1) and podoplanin.Cardiac lymphatics drain lymph and balance the fluid metabolism.Dysfunction of the lymphatic vessels contributes to lymphedema,atherosclerosis,arrhythmia and fibrosis.It is significant to explore physiopathological effects of cardiac lymphatics for treatment of myocardial infarction,improvement of cardiovascular functions and prevention of complication after heart surgery.This review summarizes development and distribution of cardiac lymphatics and their relation to prognosis of cardiovascular diseases.
lymphatic vessels; heart; lymphangiogenesis; myocardial infarction
國家自然科學基金(81270200,81470385);高等學校博士學科點專項科研基金(20130071110080)
R322.2+6
B
10.3969/j.issn.1672-8467.2017.01.018
2016-05-06;編輯:王蔚)
△Corresponding author E-mail:hjwang@shmu.edu.cn
*This work was supported by the National Natural Science Foundation of China (81270200,81470385) and the Scientific Research Foundation of State Education Commission (20130071110080).

