Src家族蛋白酪氨酸激酶(SFKs)對血管內皮細胞通透性的調節作用
王平忠,王曉艷,姜 泓,杜 虹,申煥君,李 璟
(第四軍醫大學唐都醫院傳染科,陜西西安710038)
Src家族蛋白酪氨酸激酶(SFKs)對血管內皮細胞通透性的調節作用
王平忠,王曉艷,姜 泓,杜 虹,申煥君,李 璟
(第四軍醫大學唐都醫院傳染科,陜西西安710038)
血管內皮細胞是機體重要的屏障和半透膜.溶質滲出主要經細胞旁途徑和穿細胞途徑,分別與細胞屏障結構受損和質膜小凹(caveolae)或囊泡的形成與分離有關.Src家族蛋白酪氨酸激酶(SFKs)可使一些屏障結構蛋白(如VE-cadherin、連環蛋白、踝蛋白、紐蛋白)和質膜小凹形成與分離相關的蛋白(如小凹蛋白-1、發動蛋白-2)磷酸化,破壞屏障結構和增加質膜小凹的形成與分離.因此,SFKs對血管內皮細胞通透性具有重要的調節作用.本文就SFKs如何調節血管內皮細胞通透性做一詳細介紹.
Src家族蛋白酪氨酸激酶;內皮細胞通透性;細胞連接;磷酸化
0 引言
血管內皮細胞是機體重要的屏障,能夠維持血漿大分子、蛋白、溶質等處于動態平衡狀態.當機體受到刺激時,單層內皮細胞允許炎癥細胞進入血管運輸到全身發揮作用.這種通透性是由于內皮細胞間或細胞與胞外基質之間的連接結構發生重組,導致細胞間形成縫隙,致使細胞通透性升高.目前關于內皮細胞屏障功能調節已經有許多研究,如信號分子RhoA、Rac1和Cdc42通過調節細胞骨架來影響通透性.本研究主要介紹Src家族蛋白酪氨酸激酶(Src family protein tyrosine kinases,SFKs)對血管內皮細胞的調節作用.
1 內皮細胞間及細胞與基質間的連接結構
血管內皮包括單層內皮細胞和基膜,是血管腔面的一層半通透性屏障.內皮細胞之間以及細胞與胞外基質之間借助諸多連接蛋白的連接構成了堅實和完整的屏障結構.內皮細胞之間通過緊密連接(tight junctions,TJ)、黏附連接(adherens junctions,AJ)和縫隙連接(gap junctions,GJ)而互相連在一起(圖1),成為細胞屏障結構的主要部分.①緊密連接.主要由閉鎖蛋白(occludin)、閉合蛋白(claudins)和連接黏附分子(junctional adhesion molecules,JAM)構成.其中,閉鎖蛋白只定位于內皮細胞和上皮細胞的緊密連接中.在腦的內皮細胞高水平表達,而在非神經組織的內皮細胞表達量很低[1].閉合蛋白家族有24個成員,與閉鎖蛋白無序列相似性,展示復雜的組織特異性表達譜,如人角膜內皮普遍表達claudin-1,-2,-4,-7,-10,-11,-15,-22和-23[2-3].連接黏附分子(JAM-A)為糖蛋白,與其同源的還有JAM-B和JAM-C.閉鎖蛋白、閉合蛋白、連接黏附分子的胞外域各自互相連接,以維持細胞間結構的完整性,它們的胞內域借閉鎖小帶(zona occludens,ZO)與肌動蛋白(actin)骨架連接.②黏附連接.主要成分是血管內皮細胞鈣黏蛋白(vascular endothelial cadherin,VE-cad).VE-cad的胞外域互相連接,呈拉鏈樣結構.
胞內域直接與β-連環蛋白(catenins,cat)和p120-cat連接,并借α-cat和γ-cat與肌動蛋白骨架連接.③縫隙連接.由連接蛋白類(connexins,CX)形成.人類已鑒定了21種不同的CX,但在內皮細胞表達的有3種:CX37、CX40、CX43.其中CX37、CX40高表達于內皮細胞,而CX43的表達較低[4].
此外,整合素(integrins)通過基質蛋白(玻連蛋白、纖連蛋白)將內皮細胞與細胞外基質(extracellular matrix,ECM)連接(圖1).其中,整合素的胞內域通過踝蛋白(talin)和紐蛋白(vinculin)與肌動蛋白骨架聯系,共同構成了黏著斑連接(focal adhesions,FA),黏著斑提供了肌動蛋白骨架收縮的錨定點.
溶質分子滲出通常經細胞旁途徑(paracellular pathway)和穿細胞途徑(transcellular pathway).細胞旁途徑與細胞屏障結構的完整性有關,是溶質滲出的主要途徑.當發生感染、炎癥或腫瘤等刺激時,屏障功能受損,內皮細胞間隙形成,對溶質分子的選擇性喪失,導致通透性升高,組織水腫.穿細胞途徑與質膜小凹(caveolae)或囊泡的形成與分離有關,是血漿蛋白運輸的主要途徑.小凹蛋白-1(caveolin-1)是小凹的主要成分,參與小凹的形成,而GTP酶發動蛋白-2(dynamin-2)參與新形成小凹的分離.

圖1 內皮細胞間及細胞與基質間連接結構示意圖(參考Mehta D,et al[5])
2 SFKs的結構特征
SFKs是一種非受體的細胞質蛋白酪氨酸激酶,從N-端到C-端分別是十四烷基化位點(M)、Src同源域4(SH4)、獨特區(U)、Src同源域3(SH3)、Src同源域2(SH2)、連接子(L)、催化域(CD)(或稱SH1)和調節域(R)(圖2).十四烷基化位點和SH4與細胞膜的結合有關.獨特區是不同Src家族成員所特有,可能介導SFKs和其他蛋白的相互作用.SH3、SH2是蛋白相互作用域,SH3識別富含脯氨酸的區域,而SH2識別蛋白中磷酸化的酪氨酸殘基.SH1是蛋白酪氨酸激酶活性位點.Src有2個主要磷酸化位點,即位于SH1的Tyr416和位于調節域(R)的Tyr527.這兩個位點的磷酸化狀態在Src激酶活性調節中起關鍵作用.

圖2 SFKs結構示意圖(參考Okada M[6])
Src家族有9個成員:c-Src、Fyn、Yes、Yrk、Lyn、Lck、Hck、Fgr、Blk.其中c-Src、Fyn、Yes、Lyn、Yrk廣泛表達于不同類型細胞,而Lck、Hck、Fgr、Blk則主要表達于造血干細胞.在血管內皮細胞,從mRNA和蛋白水平均可檢測到c-Src、Yes、Fyn、Lyn的表達[7].
3 SFKs的活化及其對內皮細胞通透性的調節
Src定位于細胞的許多區域,如細胞膜、核膜、胞內體膜、細胞質和細胞間粘附連接等.正常細胞Src的基礎活性很低,當受外界因素(如細胞因子[8]、細菌[9-10]、病毒[11]等)刺激時,通過磷酸化狀態的控制或蛋白-蛋白相互作用,可從無活性狀態轉變為有活性狀態.首先,Src活性可通過Tyr416和Tyr527磷酸化狀態的動態平衡進行調節.Tyr416磷酸化或Tyr527去磷酸化使Src活化.相反,Tyr416去磷酸化或Tyr527磷酸化使Src活性降低[12-13].其次,Src活性也可通過SH2域磷酸酪氨酸和SH3域脯氨酸富集基序(motif)聯合介導的特異性蛋白相互作用進行調節.憑借協調Src激酶活化及其與靶蛋白相互作用的SH2或SH3域,分子間的結合可能取代抑制的分子內的相互作用.研究[14-15]發現,SH2和SH3序列基序(motif)在許多信號傳導分子如效應蛋白、接頭分子、核轉錄因子及細胞骨架蛋白中被廣泛發現.
SFKs具有多種功能,除了調節細胞生長與分化、粘附與運動、腫瘤發生、免疫細胞功能外,在細胞通透性研究中發現,SFKs對細胞旁途徑和穿細胞途徑的物質轉運均具有調節作用.Cao等[16]利用SFKs特異性的pp60c-SrcsiRNA轉染血管內皮細胞,發現這會導致血管內皮生長因子(vascular endothelial growth factor,VEGF)引起的通透性降低.細胞旁途徑源于內皮細胞間屏障結構的改變.SFKs的許多靶分子(底物)如血管內皮細胞鈣粘蛋白(VE-cad)、踝蛋白(talin)、紐蛋白(vinculin)、連環蛋白(catenins-α、β、γ、p120)等都是細胞間或細胞與基質間結構的重要成分,當這些蛋白被Src磷酸化后,屏障結構受損,通透性增加(圖3)[17-20].研究[21]表明,利用SFKs抑制劑處理細胞,不僅會抑制連接蛋白的磷酸化,同時還會使內皮細胞通透性降低.同時發現,VE-cad的Y658和Y685位點與細胞連接的破壞相關[22].值得一提的是[23],過表達p120會阻止pY416-Src和VE-cad的結合從而抑制中性粒細胞穿過內皮遷移.此外,VE-cad被Src激酶磷酸化后,還可引起內化(internalization),導致屏障完整性丟失[24].
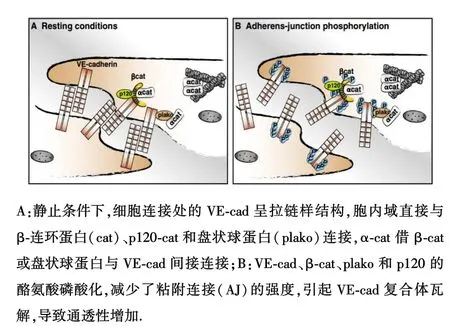
圖3 Src對VE-cad和連環蛋白的磷酸化及其對通透性的影響(Dejana E,et al[17])
穿細胞途徑依賴質膜小凹(caveolae)或囊泡的形成與釋放.小凹蛋白-1(caveolin-1)是小凹的主要成分.該蛋白的Tyr14是c-Src的主要磷酸化位點.該位點的Src磷酸化是小凹形成、融合和跨內皮細胞通透性調節的重要步驟[25].細胞膜新形成的小凹的分離則主要與GTP酶發動蛋白-2(dynamin-2)有關.該蛋白的Tyr231、Tyr597可被Src激酶磷酸化,誘導其自我組裝,增加GTP酶活性,刺激白蛋白的胞吞作用(endocytosis)[26-27].
另外,SFKs也可以通過調節黏著斑復合物(包含整合素、FAK激酶和多個接頭蛋白)來影響通透性的變化.研究[28]發現,VEGF能促進FAK的FERM區和VE-cad胞內域的結合,進而導致beta-catenin的Y142位點磷酸化,粘附連接VE-cad和beta-catenin復合物遭到破壞,致使內皮通透性升高.Src作為FAK的上游分子,在此過程中發揮了重要作用.皮質肌動蛋白結合蛋白(Cortactin)是一種微絲骨架結合蛋白,是Scr激酶直接磷酸化的底物,其磷酸化修飾定位于黏著斑位置,參與細胞和胞外基質的粘附調控.Ho等[29]通過體內外實驗發現下調Tbdn蛋白會激活c-Src/Cortactin通路,導致Cortactin的Y421磷酸化,致使血漿蛋白滲透率升高.
需要說明的是,SFKs能夠導致細胞通透性升高,但是也有例外[30].本研究使用脂多糖(lipopolysaccharide,LPS)和VEGF刺激血管內皮細胞,c-Src和Yes增加了細胞內容物的泄露,而Lyn則加強了內皮細胞的連接,維持細胞通透性.另有研究[31]表明,內皮細胞通透性的研究中,Src介導的酪氨酸磷酸化是必需的,但是卻是不足的,推測還有其他信號通路參與,其中一種可能是SFKs協同p38MAPK通路發揮作用.
4 結語
SFKs對內皮細胞通透性具有非常重要的調節作用.低活性的SFKs有利于維持內皮細胞屏障結構的完整性,減少穿細胞小凹的形成與分離,降低細胞通透性,而高活性的SFKs則能引起細胞通透性顯著增加.了解SFKs的活化和信號轉導機制及其在內皮細胞通透性變化中的作用,將有助于開辟治療血管通透性升高的相關疾病(如急性肺損傷、ARDS、腎綜合征出血熱等)的新途徑.
[1]Hirase T,Staddon JM,Saitou M,et al.Occludin as a possible determinant of tight junction permeability in endothelial cells[J].J Cell Sci,1997,110(Pt 14):1603-1613.
[2]Van Itallie CM,Anderson JM.Claudins and epithelial paracellular transport[J].Annu Rev Physiol,2006,68:403-429.
[3]Inagaki E,Hatou S,Yoshida S,et al.Expression and distribution of claudin subtypes in human corneal endothelium[J].Invest Ophthalmol Vis Sci,2013,54(12):7258-7265.
[4]Inai T,Shibata Y.Heterogeneous expression of endothelial connexin(Cx)37,Cx40,and Cx43 in rat large veins[J].Anat Sci Int,2009,84(3):237-245.
[5]Mehta D,Malik AB.Signaling mechanisms regulating endothelial permeability[J].Physiol Rev,2006,86(1):279-367.
[6]Okada M.Regulation of the SRC family kinases by Csk[J].Int J Biol Sci,2012,8(10):1385-1397.
[7]Gong P,Angelini DJ,Yang S,et al.TLR4 signaling is coupled to SRC family kinase activation,tyrosine phosphorylation of zonula adherens proteins,and opening of the paracellular pathway in human lung microvascular endothelia[J].J Biol Chem,2008,283(19): 13437-13449.
[8]Hardyman MA,Wilkinson E,Martin E,et al.TNF-α-mediated bronchial barrier disruption and regulation by src-family kinase activation[J].J Allergy Clin Immunol,2013,132(3):665-675.
[9]Liu A,Gong P,Hyun SW,et al.TRAF6 protein couples Toll-like receptor 4 signaling to Src family kinase activation and opening of paracellular pathway in human lung microvascular endothelia[J].J Biol Chem,2012,287(20):16132-16145.
[10]Johnson A,Neumann PH,Peng J,et al.The intracerebroventricular injection of rimonabant inhibits systemic lipopolysaccharide-induced lung inflammation[J].J Neuroimmunol,2015,286:16-24.
[11]Park GB,Kim D,Kim YS,et al.The Epstein-Barr virus causes epithelial-mesenchymal transition in human corneal epithelial cells via Syk/src and Akt/Erk signaling pathways[J].Invest Ophthalmol Vis Sci,2014,55(3):1770-1779.
[12]Shi S,Garcia JG,Roy S,et al.Involvement of c-Src in diperoxovanadate-induced endothelial cell barrier dysfunction[J].Am J Physiol Lung Cell Mol Physiol,2000,279(3):L441-L451.
[13]Schlessinger J.New roles for Src kinases in control of cell survival angiogenesis[J].Cell,2000,100(3):293-296.
[14]Horne WC,Sanjay A,Bruzzaniti A,et al.The role(s)of Src kinase and Cbl proteins in the regulation of osteoclast differentiation and function[J].Immunol Rev,2005,208:106-125.
[15]Gordon EJ,Fukuhara D,Westr?m S,et al.The endothelial adaptor molecule TSAd is required for VEGF-induced angiogenic sprouting through junctional c-Src activation[J].Sci Signal,2016,9(437):ra72.
[16]Cao HJ,Zheng LZ,Wang N,et al.Src blockage by siRNA inhibits VEGF-induced vascular hyperpemeability and osteoclast activity-an in vitro mechanism study for preventing destructive repair of osteonecrosis[J].Bone,2015,74:58-68.
[17]Dejana E,Orsenigo F,Lampugnani MG.The role of adherens junctions and VE-cadherin in the control of vascular permeability[J].J Cell Sci,2008,121(Pt 13):2115-2122.
[18]Digiacomo G,Tusa I,Bacci M,et al.Fibronectin induces macrophage migration through a SFK-FAK/CSF-1R pathway[J].Cell Adh Migr,2016,2:1-11.
[19]Qin B,Zhou J.Src Family Kinases(SFK)Mediate Angiotensin II-Induced Myosin Light Chain Phosphorylation and Hypertension[J].PLoS One,2015,10(5):e0127891.
[20]Birukova AA,Shah AS,Tian Y,et al.Selective Role of Vinculin in Contractile Mechanisms of Endothelial Permeability[J].Am J Respir Cell Mol Biol,2016,55(4):476-486.
[21]Adam AP,Sharenko AL,Pumiglia K,et al.Src-induced tyrosine phosphorylation of VE-cadherin is not sufficient to decrease barrier function of endothelial monolayers[J].J Biol Chem,2010,285(10): 7045-7055.
[22]Dejana E,Orsenigo F,Lampugnani MG,et al.The role of adherens junctions and VE-cadherin in the control of vascular permeability[J].J Cell Sci,2008,121(Pt 13):2115-2122.
[23]Alcaide P,Martinelli R,Newton G,et al.p120-Catenin prevents neutrophil transmigration independently of RhoA inhibition by impairing Src dependent VE-cadherin phosphorylation[J].Am J Physiol Cell Physiol,2012,303(4):C385-C395.
[24]Orsenigo F,Giampietro C,Ferrari A,et al.Phosphorylation of VE-cadherin is modulated by haemodynamic forces and contributes to the regulation of vascular permeability in vivo[J].Nat Commun,2012,3:1208.
[25]Hu G,Vogel SM,Schwartz DE,et al.Intercellular adhesion molecule-1-dependent neutrophil adhesion to endothelial cells induces caveolae-mediated pulmonary vascular hyperpermeability[J].Circ Res,2008,102(12):e120-e131.
[26]Shajahan AN,Timblin BK,Sandoval R,et al.Role of Src-induced dynamin-2 phosphorylation in caveolae-mediated endocytosis in endothelial cells[J].J Biol Chem,2004,279(19):20392-20400.
[27]Piazza TM,Lu JC,Carver KC,et al.SRC family kinases accelerate prolactin receptor internalization,modulating trafficking and signaling in breast cancer cells[J].Mol Endocrinol,2009,23(2): 202-212.
[28]Zhao X,Peng X,Sun S,et al.Role of kinase-independent and dependent functions of FAK in endothelial cell survival and barrier function during embryonic development[J].J Cell Biol,2010,189(6): 955-965.
[29]Ho N,Gendron RL,Grozinger K,et al.Tubedown regulation of retinal endothelial permeability signaling pathways[J].Biol Open,2015,4(8):970-979.
[30]Han J,Zhang G,Welch EJ,et al.A critical role for Lyn kinase in strengthening endothelial integrity and barrier function[J].Blood,2013,122(25):4140-4149.
[31]Adam AP,Lowery AM,Martino N,et al.Src Family Kinase Modulate the Loss of Endothelial Barrier Function in Response to TNF-α: Cross talk with p38 Signaling[J].PLoS One,2016,11(9): e0161975.
The role of Src family protein tyrosine kinases in regulating permeability of vascular endothelial cell
WANG Ping-Zhong,WANG Xiao-Yan,JIANG Hong,DU Hong,SHEN Huan-Jun,LI Jing
Department of Infectious Diseases,Tangdu Hospital,Fourth Military Medical University,Xi'an 710038,China
Vascular endothelial cells form a semi-permeable barrier between blood and tissue.The paracellular pathway and the transcellular pathway are main channels of solutes leakage.They are associated with disorganization of cellular barrier and formation and fission of caveolae or vesicles,respectively.Src family protein tyrosine kinases(SFKs)induce the phosphorylation of many important proteins in barrier(VE-cadherin,catenin,talin,vinculin)and caveolae structure(caveolin-1,dynamin-2),leading to damage of cellular barrier and increase of caveolae formation and fission.Therefore,SFKs plays an importmant role in regulating permeability of vascular endothelial cell.In this study,we make a detailed introduction that how SFKs regulates the permeability of vascular endothelial cell.
Src family protein tyrosine kinases;endothelial cell permeability;cell junction;phosphorylation
Q28
A
2095-6894(2017)01-07-04
2016-11-10;接受日期:2016-11-26
國家自然科學基金(81373118)
王平忠.教授,博士,博士生導師.Tel:029-83515039
E-mail:wangpz63@126.com

