三文魚過敏原小清蛋白分離純化及免疫結構鑒定
馬濤,王一俠,金振濤,谷瑞增,魯軍
(中國食品發酵工業研究院北京市蛋白功能肽工程技術研究中心,北京100027)
三文魚過敏原小清蛋白分離純化及免疫結構鑒定
馬濤,王一俠,金振濤,谷瑞增,魯軍*
(中國食品發酵工業研究院北京市蛋白功能肽工程技術研究中心,北京100027)
小清蛋白是魚類的主要過敏原,三文魚小清蛋白具有不同的亞型,分子量相近,序列基本相同,給分離純化帶來了不小的挑戰。本試驗采用硫酸銨鹽析、Qxl-Sepharose離子交換結合凝膠過濾等方法定向純化小清蛋白β1型,并應用免疫印跡法對純化的小清蛋白進行過敏原性鑒定,結合激光輔助解析/飛行時間質譜進行結構鑒定。結果顯示,硫酸銨鹽析、離子交換層析結合凝膠過濾純化方法可以得到純度達90%以上的小清蛋白β1型,且蛋白具有很強的免疫反應活性。針對該蛋白的研究不僅有利于過敏原檢測方法的建立,也可為低致敏性水產品的開發提供理論依據。
三文魚;原肌球蛋白;分離純化;免疫印跡
根據流行病學調查,全世界范圍內約有2%的成年人、8%的嬰幼兒對食物產生過敏反應,其中90%以上的食物過敏反應由蛋、奶、魚、甲殼類動物、花生、大豆、堅果和小麥等八大類食物引起[1]。魚是引起食物過敏的常見水產品之一,其主要過敏原是小清蛋白,一種水溶性鈣結合蛋白,分子量大約為12 ku,等電點(pI)為3.9~5.5,能夠引起人體由IgE介導的免疫反應[2-3]。相對而言,國內在水產品過敏原的研究起步較晚,目前的研究主要集中在蝦、蟹等甲殼類動物,對于魚類過敏的研究仍然很少[4-5]。
三文魚,學名鮭魚,是一種廣泛引起人們過敏的海水魚,可引發蕁麻疹、哮喘、嘔吐、腹瀉、過敏性休克等癥狀。隨著中國經濟的騰飛,人民的生活水平日益改善,三文魚以其豐富的營養含量及其獨特的口感贏得了中國消費者的青睞,目前中國已成為挪威三文魚在亞洲除日本之外最大的市場。國外研究表明,三文魚過敏原蛋白為Sals1蛋白,與人們深入研究的鱈魚Gad c 1蛋白僅有58%的氨基酸序列同源性。Sals1蛋白有2個亞型,均為109個氨基酸,序列基本相同,致敏活性完全不同[6-7]。但是,關于三文魚小清蛋白活性分離及結構特征國內卻乏人研究。本試驗以三文魚為研究對象,采用硫酸銨鹽析、QXL-Sepharose離子交換結合凝膠過濾等方法定向純化小清蛋白β1型,并應用免疫印跡法對純化的小清蛋白進行免疫原性鑒定,同時通過激光輔助解析/飛行時間質譜進行質譜鑒定,為建立魚類過敏原蛋白檢測及致敏活性控制技術奠定基礎。
1 材料與方法
1.1 材料與試劑
抗蛙小清蛋白單克隆抗體(PARV-19):Sigma公司;辣根過氧化酶標記的兔抗小鼠IgG:Abnova公司;0.45μm硝酸纖維素膜:Bio-Rad公司;其他試劑均為國產分析純。
1.2 儀器與設備
ChemiDoc MP凝膠成像儀:美國Bio-Rad公司;AKTApurifier 10蛋白質快速純化系統:瑞典GE Healthcare;Allegra X-15R高速冷凍離心機:美國Beckman公司;DYCZ-24DN電泳槽及電轉移裝置:北京市六一儀器廠;FE20K酸度計:瑞士梅特勒公司;恒溫水浴鍋等。
1.3 方法
1.3.1 肌漿蛋白的制備
三文魚過敏原小清蛋白主要存在于魚肉肌漿蛋白中。取三文魚紅肉60 g,切碎后置于4倍體積冰冷的緩沖液中(含有5mmol/LEDTA的20mmol/LTris-HCl pH7.5),用組織搗碎機搗碎。將懸浮液于8 000 r/min,4℃下離心30min,取上清即為肌漿蛋白[8]。
1.3.2 三文魚小清蛋白粗級純化
三文魚肌漿蛋白100℃水浴加熱30min,期間不斷攪拌,樣品冷卻至室溫,于12000 r/min,4℃離心10min,收集上清液。上清液進行60%(NH4)2SO4鹽析,繼續攪拌30min后于4℃靜置1 h,離心收集淀并用適量水將其溶解,溶解液即為粗純化的小清蛋白。
1.3.3 三文魚小清蛋白粗級純化
將粗純化的三文魚小清蛋白樣品于緩沖液(pH 7.5,10mmol/L Tris-HCl)中4℃透析過夜,12 000 r/min離心20min,將上清液上樣于緩沖液(20mmol/L Tris-HCl、pH7.5)平衡過的QxL-Sepharose預裝柱,流速為1mL/min,用緩沖液充分洗凈未吸附蛋白質。用0~ 0.5mol/LNaCl進行線性梯度洗脫,流速為1mL/min,收集各組分進行蛋白含量測定和SDS-PAGE電泳,確定目的蛋白所在組分并將其收集儲存。隨后上樣于用緩沖液(含有0.15mol/LNaCl的20mmol/LTris-HCl、pH7.5緩沖液)平衡過的Superdex 200凝膠柱,然后用相同緩沖液洗脫,流速為0.5mL/min,收集各組分并分別測定它們在280 nm下的吸光值,確定目的蛋白所在組分并將其收集儲存。
1.3.4 凝膠電泳(SDS-PAGE)
配制聚丙烯酰胺凝膠,加入SDS化的蛋白質樣品,電泳,考馬斯亮藍染色,凝膠成像系統拍照。
1.3.5 免疫印跡
將SDS-PAGE分離的蛋白質樣品轉移到膜上,5%牛血清白蛋白封閉1 h,TBST洗滌3次,加入一抗(按1∶50體積比稀釋的小鼠抗蛙小清蛋白單克隆抗體)孵育3 h,TBST洗滌,加入二抗(按1∶2000體積比稀釋的HRP標記的山羊抗鼠IgG)反應1 h,TBST洗滌3次,加入DAB顯色,觀察并拍照。
1.3.6 肽質量指紋圖譜分析
采用激光輔助解析/飛行時間質譜(MALDI-TOFMS)對三文魚小清蛋白進行分析,得到肽質量指紋圖譜(委托廣東駿輝生物科技有限公司)[9]。
2 結果與分析
2.1 三文魚小清蛋白的粗級純化
三文魚肌漿蛋白熱提取物的SDS-PAGE電泳結果,見圖1。
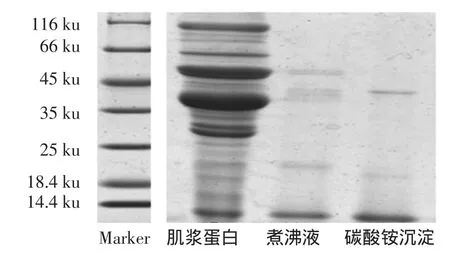
圖1 三文魚蛋白SDS-PAGE圖Fig.1 SDS-PAGE analysis of Salmon protein
魚肌肉蛋白根據其組成不同,可分為肌原纖維蛋白、肌漿蛋白、肌基質蛋白和異質組織蛋白4大部分。三文魚肌漿蛋白組成很復雜,至少含有十多種蛋白,其中116、36、48 ku左右蛋白含量較高。三文魚是引起食物過敏的常見水產品之一,其主要過敏原是小清蛋白,具有很高的熱穩定性。由于小清蛋白具有較高的熱穩定性,而大部分蛋白經過加熱后會發生變性沉淀[10],因此,本研究將魚類肌漿蛋白抽提后進行短暫的加熱處理,從而獲得含有較高純度小清蛋白的提取物,有效去除肌漿抽提物中其它蛋白、脂肪等物質對后續檢測的干擾。試驗通過Tris緩沖液提取、熱處理分離、硫酸銨鹽析進行小清蛋白初級純化。從電泳圖1可以看出,粗提樣品中含有至少十多種蛋白,成分復雜,經過煮沸和硫酸銨沉淀雜蛋白明顯減少,蛋白純度從13.8%提高到52.4%。
2.2 離子交換層析純化
三文魚粗蛋白通過硫酸銨鹽析,透析后上樣于QXL-Sepharose陰離子交換柱,用0~0.5mol/LNaCl進行線性梯度洗脫。小清蛋白離子交換層析圖,見圖2。
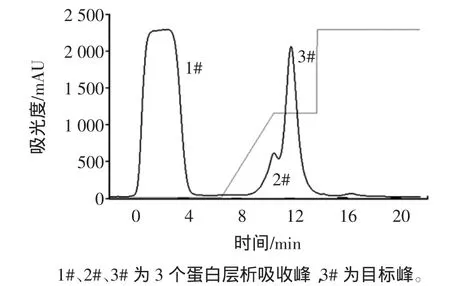
圖2 小清蛋白離子交換層析圖Fig.2 Iron-exchanged chromatogram of parvalbumin
從圖2可以看到經過QXL-Sepharose柱層析后,在加入NaCl開始洗脫到蛋白檢測值趨于平穩時,整個過程得到2個洗脫蛋白峰,其中第3#峰為目標峰,所含三文魚小清蛋白純度最高,通過光密度掃描檢測純度達到92%。從自動部分收集器中分別收集于錐形瓶中,經低溫條件下超濾管濃縮后,用于電泳分析,離子層析譜圖及電泳圖譜,見圖3。
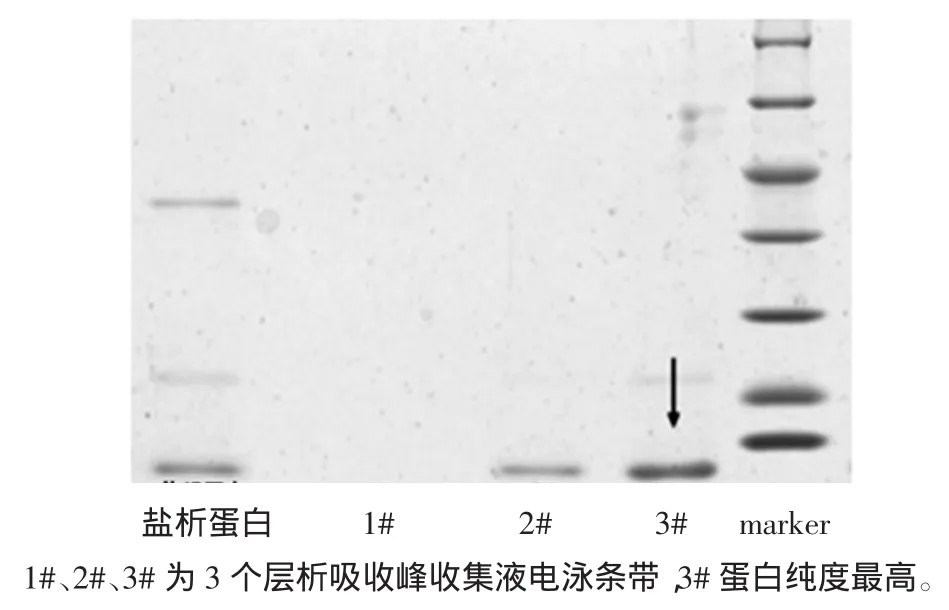
圖3 小清蛋白離子層析電泳圖Fig.3 SDS-PAGE analysis of parvalbumin through Ironexchanged chromatography
2.3 凝膠過濾層析純化
小清蛋白凝膠色譜層析譜圖見圖4,小清蛋白凝膠層析電泳圖見圖5。
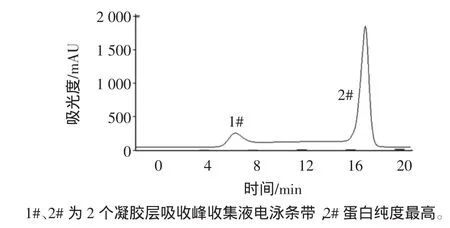
圖4 小清蛋白凝膠色譜層析譜圖Fig.4 Gel chromatogram of parvalbumin
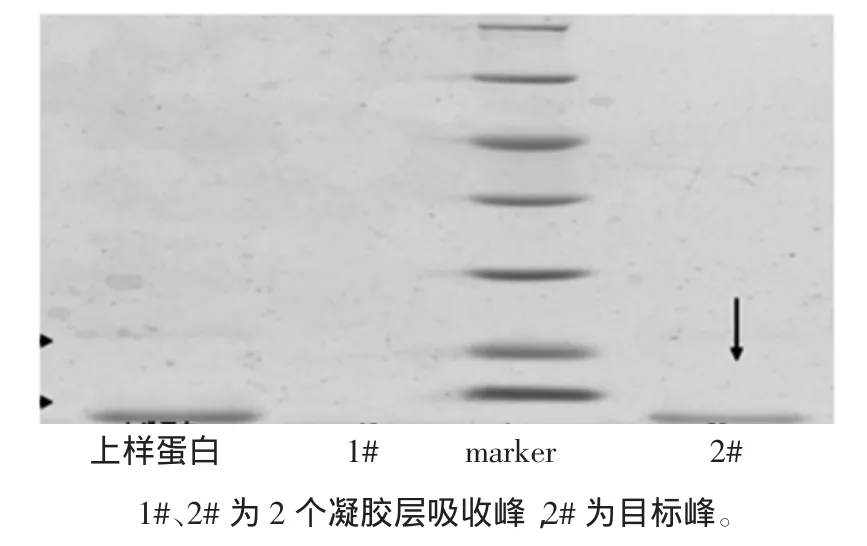
圖5 小清蛋白凝膠層析電泳圖Fig.5 SDS-PAGE analysis of parvalbum in through Gel chromatography
樣品經Superdex 200凝膠過濾柱,收集各組分并進行紫外檢測。在280 nm波長下,得到2個主要吸收峰,自動部分收集器中分別收集于錐形瓶中,經低溫條件下超濾管濃縮后,用于電泳分析,從圖5中可以看出,經過進一步的凝膠過濾純化,已基本去除了所有雜蛋白,蛋白達到較高的純度,灰度掃描顯示其純度大于99%。
2.4 電泳鑒定純度
小清蛋白分離純化電泳圖見圖6。
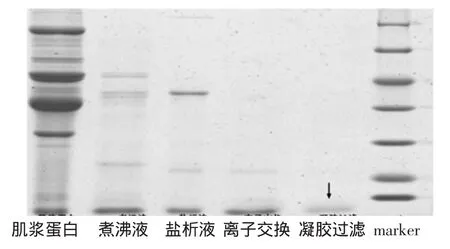
圖6 小清蛋白分離純化電泳圖Fig.6 SDS-PAGE analysis of parvalbumin through separation and purification process
將粗分離、鹽析、離子交換、凝膠過濾等得到的蛋白進行SDS-PAGE試驗,上樣分離膠經Quantity one軟件分析,圖6中可以看出,三文魚小清蛋白逐步得到純化,第5泳道只有一條條帶,分子量為12 ku左右,其相對含量大于99%。而據文獻報道,三文魚小清蛋白的分子量為12 ku,結果符合文獻報道。
2.5 免疫活性鑒定
分別取水溶性總蛋白及純化小清蛋白進行SDSPAGE,以小鼠抗蛙小清蛋白單克隆抗體為一抗進行Western blotting確認分析,結果見圖7。

圖7 小清蛋白免疫印跡鑒定Fig.7 Western-blotting analysis of parvalbumin
由圖7可見,三文魚水溶性總蛋白及純化小清蛋白在分子量約為12 ku處均與該單克隆抗體出現明顯的特異雜交顯色條帶,據此進一步判定純化的蛋白樣品即為小清蛋白,且具有較強的免疫反應活性。Davis等[11]報道,在對小清蛋白熱處理過程中,70℃~80℃時二硫鍵將斷裂,80℃~90℃時會形成分子內或分子間相互作用、二硫鍵重新排列,90℃~100℃時會形成新的聚合物。汪寧等[4]在研究鰱骨骼肌過敏原小清蛋白熱穩定活性時發現,鰱小清蛋白對高溫具有較強的抗性,加熱會促進該蛋白多聚物的形成。但隨著加熱時間的延長,,則蛋白免疫活性會降低,不能與抗蛙小清蛋白單克隆抗體有效結合。在本試驗過程中,熱變性時間控制在30min以內,純化的三文魚小清蛋白保持了較強的免疫活性。
2.6 質譜結構鑒定
小清蛋白質譜結構鑒定見圖8。
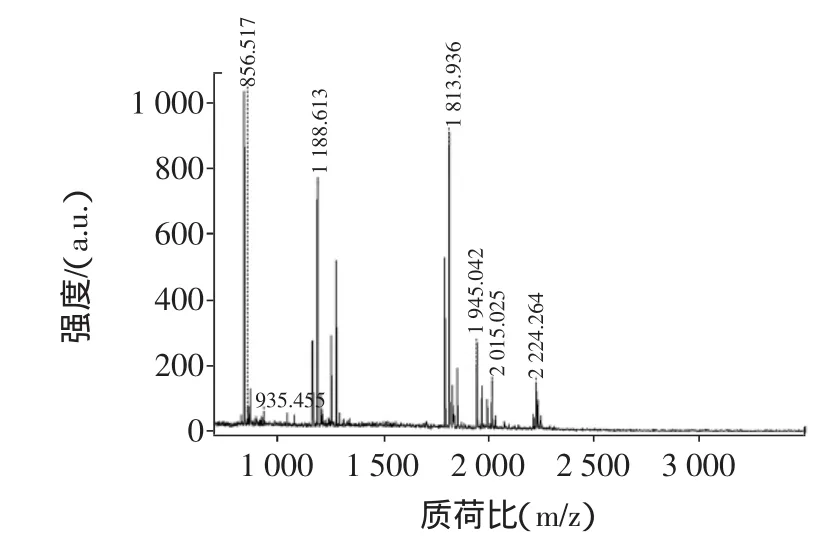
圖8 小清蛋白質譜結構鑒定Fig.8 MALDI-TOF-MS spectrogram of by Parvalbumin
為了進一步確證蛋白質的種類,對蛋白質進行了質譜鑒定。待鑒定的三文魚主要過敏原蛋白經胰蛋白酶酶切后,得到的肽段混合物經過基質輔助激光解吸電離/飛行時間質譜分析[12]。圖8得到的是三文魚過敏原蛋白12 ku主要過敏原蛋白的肽質量指紋圖譜,圖中每個譜峰代表1種肽段。應用MALDI-TOF-MS測定蛋白質或多肽混合物,不僅操作簡單、靈敏度高、分析速度快,而且從圖中可以看出它的譜峰簡單,可直接分析。利用Mascot搜索引擎,根據蛋白匹配分值與匹配次數關系進行鑒定。結果顯示,搜索匹配的蛋白質均為三文魚原肌球蛋白,且匹配得分值之間差異不大,所以該蛋白得到確定鑒定。鑒定結果顯示,該蛋白質確系三文魚過敏原小清蛋白Parvalbumin beta 1 [Salmo salar]。
3 結論
魚類是最容易引起過敏的食物之一,小清蛋白是其主要的過敏原蛋白組分。根據蛋白質一級結構的序列分析,小清蛋白可進一步分為α型和β型。α-小清蛋白的等電點大于或等于5.0,而β-小清蛋白由于含有更多的酸性氨基酸,其等電點在4.5以下[9]。三文魚引發人體的過敏原蛋白主要為Parvalbuminβ1,其中Parvalbuminβ2型蛋白序列相差不大但致敏活性卻截然不同。Marina Perez-Gordo采用肽段免疫芯片的技術針對parvalbuminβ1進行了篩選,發現MACAHLCKEADIKTALEA、KTFFHTIGFASKSADDVK、VEELKLFLQNFCPKARELTDA 3個重要的過敏原抗體結合表位肽段。本試驗以海洋三文魚作為研究對象,采用加熱及硫酸銨分級鹽析、離子交換結合凝膠過濾對小清蛋白進行純化,免疫印跡及質譜檢測結果顯示該蛋白為三文魚過敏原蛋白parvalbumin beta 1,且三文魚小清蛋白耐熱性強,采用100℃加熱處理30min仍能穩定存在且保持較強的免疫反應活性,小清蛋白是魚類的主要過敏原,對該蛋白的研究不僅有利于過敏原檢測方法的建立,也可為低致敏性水產品的開發提供理論依據。
[1]Sampson H A.Food allergy.Immunopathogenesis and clinical disorders[J].Allergy Clin Immunol,1999,103(5):717-728
[2]KOBAYASHIA,TaANAKA H,HAMADA Y,et al.Comparison of allergenicity and allergens between fish white and dark muscles[J]. Allergy,2006,61(3):357-363
[3]VAN DT,HORDVIKD I,ENDRESENB C,et al.Characterization of parvalbumin,the major allergen in Alaska pollack,and comparison withcodfish allergen M[J].Mol Immunol,2005,42(3):345-353
[4]汪寧,蔡秋鳳,劉光明,等.鰱骨骼肌過敏原小清蛋白的分離純化及多克隆抗體制備與應用[J].水產學報,2010,34(1):41-45
[5]練玉銀,劉志剛,溫岸玲.鯉魚主要過敏原的分離、鑒定與純化[J].中國公共衛生,2006,22(8):947-949
[6]Lindstrom CD,Van Do T,Hordvik I,et al.Cloning of two distinct cDNAs encoding parvalbumin,the major allergen of Atlantic salmon (Salmo salar)[J].Scand J Immunol,1996,44(4):335-344
[7]Marina PG,Jing L,Ludmilla B,et al.Epitope Mapping of Atlantic Salmon Major Allergen by Peptide Microarray Immunoassay[J].Allergy Immunol,2012,157(1):31-40
[8]杜雪莉,周利亙,王錫昌,等.黃鰭鯛骨骼肌伴肌動蛋白的純化及其抗體制備[J].水產學報,2008,32(3):465-469
[9]Pastor C,Cuesta-Herranz J,Cases B,et al.Identification of major allergens in watermelon[J].Int Arch Allergy Immunol,2009,149(4): 291-298
[10]Chen L,Hefle S L,Taylor SL,et al.Detecting fish parvalbum in with commercial mouse monoclonal ant-i frog parvalbum in IgG[J].J A-gric Food Chem,2006,54(15):5577-5582
[11]Davis P J,Williams S C.Protein modification by thermal processing [J].Allergy,1998,53(46):102-105
[12]Liang Y L,Cao M J,Su W J,et al.Identification and characterisation of the major allergen of Chinese mitten crab(Eriocheir sinensis)[J]. Food Chemistry,2008,111(4):998-1003
Purification and Allergenicity Identification of Salmon Parvalbumin
MA Tao,WANG Yi-xia,JIN Zhen-tao,GU Rui-zeng,LU Jun*
(Beijing Engineering Research Center of Protein and Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing100027,China)
Parvalbumin is the major allergen of fish species.The different subtypes of salmon parvalbumin with close molecular weight and sequence bring great challenges to protein separation and purification.Parvalbuminβ1 was purified by heat treatment,(NH4)2SO4salting out method and Qxl-Sepharose chromatography combined by gel filtration.Western blotting was used to identify the allergenicity of purified Parvalbumin.MALDITOF/MS was used to further identify the characteristic of parvalbumin structure.The results revealed that the purity of the parvalbumin β1 was more than 90 percent and it had immunological reactive activity.Investigation into this protein is beneficial not only to detecting allergen,but also to producing aquatic products with low allergenicity.
salmon;parvalbumin;separation and purification;immunoblotting
10.3969/j.issn.1005-6521.2017.04.001
2016-06-12
國家高技術研究發展計劃(863計劃)項目(2013AA102205-02);國家十二五科技支撐項目(2012BAD33B04-02);北京市科委科技創新基地培育與發展工程項目(Z121106002812040);科技北京百名領軍人才培養工程項目(Z131110000513026)
馬濤(1987—),男(漢),研究生,研究方向:食物過敏原。
*通信作者

