大鼠腦組織高爾基染色三種制備方法的比較
王 蕾,張 芳,湯仁仙,張冠群,牛海晨
大鼠腦組織高爾基染色三種制備方法的比較
王 蕾1,張 芳1,湯仁仙1,張冠群2,牛海晨3
腦組織;高爾基染色法;冷凍切片;振動切片;石蠟切片
1873年意大利著名的神經解剖學家卡米洛·高爾基發明硝酸銀染色法,從此可以定性定量地觀察神經元的形態[1]。隨后 Cox等[2-4]對高爾基染色法的固定液和染色液進行改良,提高結果的可視性,但初學者選擇合適的染色方法仍較為困難。本實驗采用相同的固定、染色和顯色液,采用不同的制作方法(冷凍切片、石蠟切片、振動切片)進行大鼠腦組織高爾基染色,比較三種制作方法各自的優缺點,為科研實驗和制作典型的教學示教切片提供可選方法。
1 材料與方法
1.1 動物SD大鼠 3只,體重220~240 g,實驗操作經徐州醫科大學動物倫理審查委員會批準。
1.2 取材首先SD大鼠經10%水合氯醛(國藥30037516)腹腔注射進行常規麻醉;然后用生理鹽水灌注,去除血液直至澄清;再立刻斷頭,小心取出3個腦組織,將腦組織根據所需部位,冠狀切面修成0.5 cm厚的組織塊。
1.3 固定本實驗所采用的固定液、染色液和顯色液均來自 Genmed的高爾基快速染色試劑盒。將修好的組織塊立刻放入裝有10 m L固定液 A和10 m L固定液 B的混合液離心管中,室溫下避光浸泡、孵育2周。
1.4 制作方法(1)石蠟切片:將固定好的腦組織取出,用去離子水漂洗2次,放入裝有 70%乙醇溶液的離心管中,依次梯度乙醇脫水,70%乙醇 24 h,80%乙醇溶液8 h,95%乙醇溶液Ⅰ6 h,95%乙醇溶液Ⅱ5 h,無水乙醇Ⅰ、Ⅱ、Ⅲ各2 h,用二甲苯Ⅰ、Ⅱ各 15 min透明[5]。用蜂蠟和石蠟以 1∶9比例的混合蠟浸蠟、包埋后用普通石蠟切片機冠狀切片,切片厚度分別為20、40、60μm,漂片、攤片和烤片后,置于二甲苯脫蠟,梯度乙醇補水至去離子水,用濾紙吸干多余水分后,等待染色。(2)冷凍切片:2周后將組織塊取出,用去離子水漂洗2次,放入裝有30%的蔗糖溶液的離心管中,在4℃冰箱里浸泡孵育,直至組織塊沉到離心管底,將組織取出。用去離子水稍加沖洗后,滴加包埋劑OTC適量于腦組織周圍,待稍冷凍后進行冠狀切片,切片厚度分別為60、80、100μm,將切好的腦片小心貼在事先掛好膠的明膠玻片上。將貼好的玻片用去離子水漂洗3次,每次5 min。用濾紙吸干多余水分后,等待染色。(3)振蕩切片:將腦組織從固定液中取出,用去離子水漂洗2次后振蕩切片,切片厚200μm,將切好的腦片收集在裝有70%乙醇溶液的離心管中,用毛筆將所需部位的腦片撈出,小心貼在事先掛好膠的明膠玻片上,用濾紙吸干多余的70%乙醇溶液后,將貼好的玻片用去離子水漂洗3次,每次5 min。用濾紙吸干多余水分,等待染色。
1.5染色和封片在50 mL棕色滴瓶加入 10 mL去離子水,然后加入5 mL顯色液 A和顯色液 B,混勻,標記為顯色工作液(有效期限 10天),然后進行以下操作,整個染色過程應避免光照:每塊腦片小心滴加500μL顯色工作液,鋪滿整個切片樣本表面,室溫下孵育30 min,小心用濾紙吸去切片上的染色液,將切片置入去離子水中孵育1 min,用濾紙吸去切片上的去離子水,每塊腦片滴加500μL顯色工作液,鋪滿整個切片樣本表面,室溫下孵育10~30 min,期間可在顯微鏡下觀察,直至組織呈現黑色,即刻中止,避免光照。用濾紙吸去切片上的顯色工作液,將切片置入去離子水中孵育1 min,常規乙醇梯度脫水,二甲苯透明,中性樹膠封固。
2 結果
在光學顯微鏡下觀察三種制片方法各自的染色結果并拍照。(1)石蠟切片:厚度分別為20、40、60μm,神經元數量依次增加,背景干凈呈淡黃色,神經細胞的胞體及樹突、軸突皆呈黑色或黑紅色。大鼠大腦皮質6層結構層次顯示不夠清晰,錐體細胞主樹突顯示逐漸完整,樹突數量逐漸增多,軸突逐漸顯現,可見星形膠質細胞(圖1)。(2)冷凍切片:厚度分別為60、80、100μm,神經元數量依次增加,背景干凈呈淺黃色,神經細胞的胞體及樹突、軸突皆呈黑色或黑紅色。大鼠大腦皮質6層結構逐漸清晰明顯,錐體細胞主樹突、樹突和軸突逐漸顯示完整,星形膠質細胞也漸漸顯示完整(圖2)。(3)振蕩切片:厚度分別為200、1 000μm,神經元數量豐富,背景干凈呈黃色,神經細胞的胞體及樹突、軸突皆呈黑色或黑紅色。大鼠大腦皮質6層結構清晰明顯,錐體細胞主樹突、樹突和軸突顯示完整,樹突棘豐富,星形膠質細胞顯示完整(圖3)。
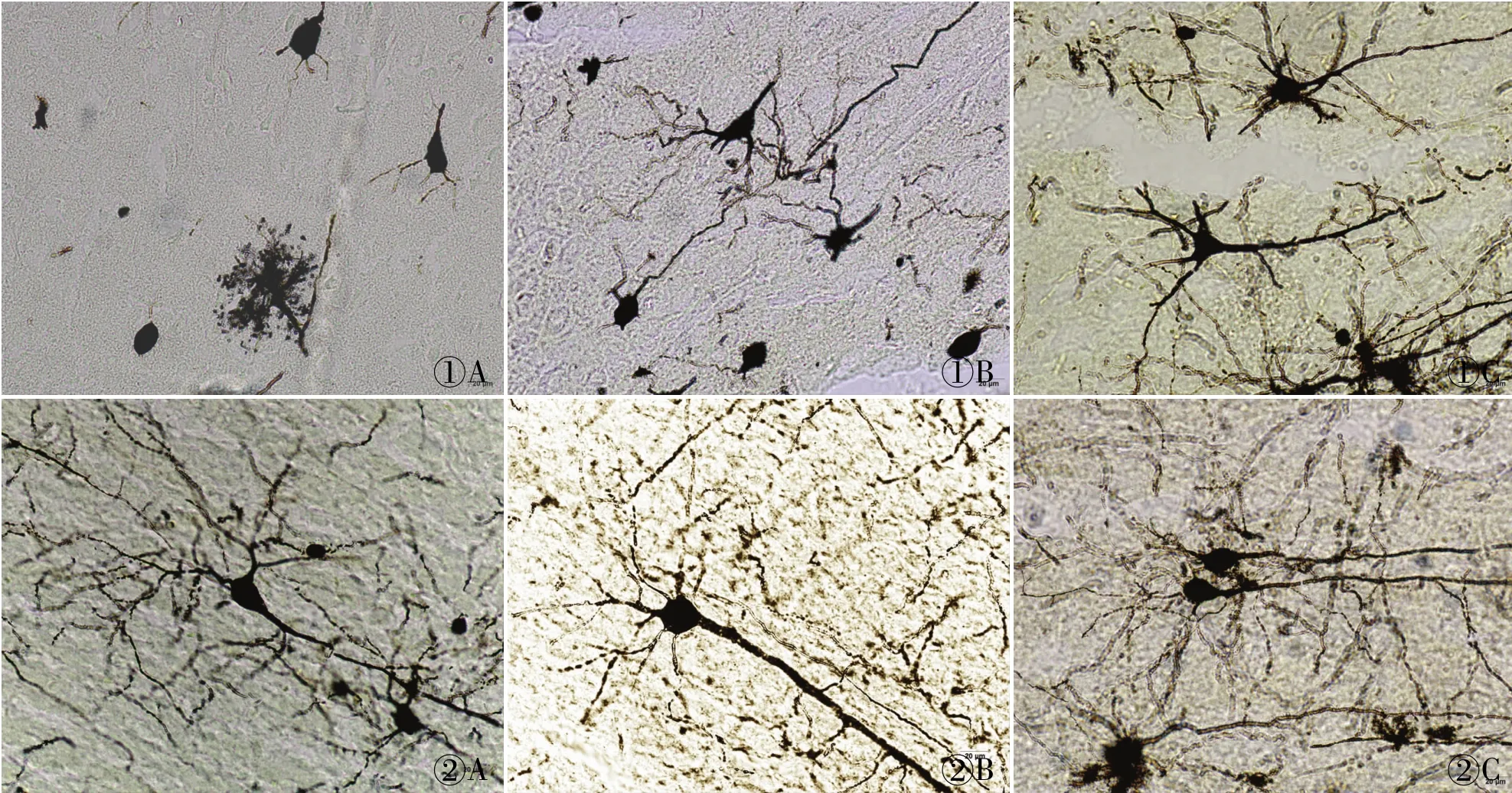
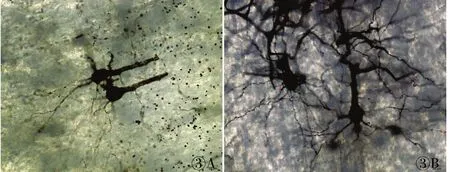
圖1 石蠟切片不同厚度的放大效果:A.20 μm;B.40μm;C.60μm
圖2 冷凍切片不同厚度的放大效果:A.20 μm;B.40μm;C.60μm
圖3 振蕩切片不同厚度的放大效果:A. 200μm;B.1 000μm
3 討論
神經組織由神經細胞和神經膠質細胞組成,神經細胞也稱為神經元[6]。大腦皮質的神經元都是多極神經元,根據細胞的形態可分為錐體細胞、顆粒細胞和梭形細胞三大類。(1)錐體細胞:數量較多,可分為大、中、小三型。胞體形似錐形,尖端發出一條較粗的頂樹突,伸向皮質表面,沿途發出許多小分支,胞體還向四周發出一些水平走向的樹突,軸突自胞體底部發出,長短不一,短的不超出所在的皮質,長的離開皮質進入白質,組成投射纖維和聯合纖維。(2)梭形細胞:數量較少,大小不一,胞體為梭形,樹突自胞體的上下兩端發出,上端樹突多伸達皮質表面。軸突從下端樹突的主干發出,其終末分支可與錐體細胞形成突觸。(3)顆粒細胞:數量最多,胞體較小,成顆粒狀。它們的軸突通常較短,終止于附近的錐體細胞或梭形細胞[7]。
大腦皮質的神經元分布,除個別區域外,一般從表面至深層依次可分為6層。(1)分子層:神經元小而少,主要由水平細胞和星形細胞構成,還有許多與皮質表面平行的神經纖維;(2)外顆粒層:主要由許多星形細胞和少量小型錐體細胞構成;(3)外錐體細胞層:較厚,由許多中、小型錐體細胞和星形細胞組成;(4)內顆粒層:細胞排列緊密、多數是星形細胞;(5)內錐體細胞層:主要由中型和大型錐體細胞組成;(6)多形細胞層:以梭形細胞為主,還有錐體細胞和顆粒細胞[7]。
無論是進行科研試驗還是制作典型的教學示教切片,觀察大腦皮質的神經細胞及其突起、大腦皮質神經元的分層,我們最常用到高爾基染色法。近年來,高爾基染色法最常用的制作方法主要有石蠟[5,8]、冷凍[9]和振蕩[10-11]。筆者對這三種方法進行比較,得出以下幾點體會:(1)用振蕩方法制作的切片,顯示大鼠大腦皮質神經元的分層效果最好,層次清晰,神經元數量多,錐體細胞主樹突、樹突和軸突顯示完整,樹突棘豐富,星形膠質細胞顯示完整,且1 000μm的切片比200μm的切片層次更清晰。(2)用石蠟方法制作的切片,背景最干凈,但是受普通輪轉切片機最大切片厚度60μm的限制,大鼠大腦皮質 6層結構層次不能清晰顯示,錐體細胞的主樹突、軸突及樹突顯示不完整,樹突棘很難顯示。星形膠質細胞顯示不完整。(3)用冷凍方法制作的切片,與石蠟切片一樣,受冷凍切片機最大切片厚度100μm的限制,大鼠大腦皮質6層結構層次清晰度介于石蠟切片和振蕩切片之間,錐體細胞的主樹突、軸突及樹突顯示較完整,樹突棘稀疏;星形膠質細胞顯示較完整。(4)石蠟切片和冷凍切片要經過脫水等過程,耗時較長,程序相對振蕩,切片復雜,且不易切出完整的切片。(5)石蠟切片厚度經常出現裂片,本實驗采用熔點在52~54℃的石蠟和熔點在54℃的蜂蠟以 9∶1的比例混合,浸蠟、包埋,以增加切片的潤滑和粘滯性,切片刀和組織塊的角度保持在10°以內,可減輕裂片的程度。大于10μm的石蠟切片切后易打卷,我們先把打卷的切片放在60℃溫水上,切片會很快展開,接著撈出放入38℃溫水上,待蠟片伸展平整后,用事先掛好膠的明膠玻片撈出,解決切片打卷后漂不開,浪費所需部位組織的問題。(6)冷凍切片也會經常出現裂片問題,把凍臺溫度控制在-17℃,箱內溫度控制在 -20℃,且腦組織涂上包埋劑 OTC后,稍凍結后開始切片,能明顯改善裂片的問題。(7)振蕩切片由于組織較厚,為了背景更加清晰,高爾基染色后可以延長低濃度乙醇溶液的脫水時間,減少高濃度乙醇溶液的脫水時間,封片時由于切片較厚,需增加中性樹膠的量才能將腦組織封固,并且能減少蓋蓋玻片時腦組織開裂。筆者認為振蕩切片制作方法觀察大鼠大腦皮質層次清晰,錐體細胞主樹突、樹突和軸突顯示完整,樹突棘豐富,星形膠質細胞顯示完整,且操作簡便,穩定性好,組織裂片率低,振動切片機屬于特殊的切片機,價格貴,有些實驗室不一定有振動切片機。
總而言之,高爾基染色法作為一種準確、可靠的神經組織染色,我們可以根據實驗室現有條件,根據科研或者教學的需要選擇不同的腦組織厚度,選擇合適的切片制作方法。
[1] Golgi C.Sulla struttura della sostanza grigia dell cervello[J].Gazz Med Lombardia,1873,6:244-246.
[2] Cox W.Impragnation des centralen nervensystemsmit quecksilbersalzen[J].Arch Mikr Anat,1891,37:16-21.
[3] Kopsch F.Erfahrungenüber die verwendung des formaldehyds bei der chromsilber-impr?gnation[J].Anat Anz,1896,11:727.
[4] Colonnier M.The tangential organization of the visual cortex[J].J Anat,1964,98:327.
[5] 康亞妮,王世忠,劉 皓,等.石蠟切片浸銀染色顯示大腦皮質神經元的Golgi改良法[J].天津醫科大學學報,2006,12(2):294-295.
[6] 丁文龍,王祖承,陸欽池,等.神經、精神系統及感覺器官[M].上海:上海交通大學出版社,2010:16.
[7] 高英茂.組織學與胚胎學[M].北京:高等教育出版社,2010:77.
[8] 李 方,張新江,蘇 明,等.改良Golgi-Cox染色法在大鼠腦缺血研究中的應用[J].西北國防醫學雜志,2002,2:85-86.
[9] Koyama Y,Tohyama M.A modified and highly sensitive golgi-cox method to enable complete and stable impregnation of embryonic neurons[J].JNeurosci Methods,2012,209(1):58-61.
[10]張富興,董加強,張卓超,等.一種快速簡單顯示神經元樹突棘的Golgi-Cox法[J].神經解剖學雜志,2009,5:497-500.
[11]Levine ND,Rademacher D J,Collier T J,etal.Advances in thin tissue Golgi-Cox impregnation:fast,reliablemethods formulti-assay analyses in rodentand non-human primate brain[J].JNeurosciMethods,2013,213(2):214-227.
R 44
:B
1001-7399(2017)01-0113-03
10.13315/j.cnki.cjcep.2017.01.032
接受日期:2016-10-31
徐州醫學院2015年度院科研課題立項(2015Kj05)
1徐州醫科大學基礎醫學院形態學實驗教學中心、3遺傳學教研室,徐州 221004
2東南大學醫學院附屬徐州中心醫院神經內科,徐州221009
王 蕾,女,碩士,實驗師。E-mail:wawa831214@sina. com

