硫化氫對水稻幼苗葉片中蛋白質表達譜的影響
陳露+徐慧芳+孟丹

摘要:硫化氫(H2S)作為重要的信號分子,調控著植物的生長發育。應用雙向電泳技術(2-DE)分析了水稻幼苗葉片經不同濃度的H2S處理后蛋白質表達譜的變化,并獲得29個表達豐度差異2倍以上的蛋白質。鑒定的差異蛋白質主要涉及到光合作用 (43%),能量代謝 (9%),氧化還原平衡 (13%),蛋白質合成、折疊、加工與降解 (19%),信號轉導 (3%)等。gene ontology(GO)分析發現,受硫化氫調控的差異,蛋白主要參與光合作用、防御和非生物脅迫應答等過程。表明不同濃度的硫化氫在調控水稻幼苗的形態變化方面主要涉及到光合過程和脅迫應答。
關鍵詞:水稻,H2S,蛋白質組,雙向電泳
中圖分類號: S511.01 文獻標志碼: A
文章編號:1002-1302(2016)11-0081-04
硫化氫(H2S)是近10年來繼一氧化氮(NO)和一氧化碳(CO)后在生物體內新發現的第3種內源性氣體信號分子[1],在植物體內主要是通過半胱氨酸脫巰基酶(CDes)催化半胱氨酸(Cys)降解生成。相關研究表明,H2S廣泛參與調節植物各種生理過程,如植物細胞的信號轉導、促進種子萌發、調節光合作用和根系發育、參與氣孔運動、緩解逆境脅迫等[2-7]。H2S供體能顯著提高小麥種子內β-淀粉酶、酯酶的活性,提供可溶性糖、可溶性蛋白和游離氨基酸,為小麥種子的萌發提供良好的環境從而促進其發芽[8],Wang等研究表明,0.01~0.13 mmol/L NaHS均能不同程度地緩解NaCl對小麥種子萌發率的抑制作用[7]。在干旱脅迫下,王蘭香等發現H2O2能夠誘導擬南芥L/D-CD基因的表達以提高葉片H2S含量來關閉氣孔,防止水分蒸發[9]。方慧慧等研究證明,在植物體內H2S和Ca2+信號存在復雜的關系,H2S能激活Ca2+信號下游相關基因的表達,同時Ca2+能增強H2S的產生,并且它們可以通過調節重金屬離子轉運蛋白增強谷子對Cr6+的耐受性[10]。在緩解銅脅迫造成的傷害中,Shan等研究表明,外源H2S能調節植物非酶類抗氧化劑維生素C和還原型谷胱甘肽(GSH)循環,增加葉片維生素C、GSH 含量,提高GSH、維生素C清除活性氧速率[11]。
相關研究中我們發現,不同濃度的H2S對水稻幼苗形態和生理生化有不同的效應,低濃度H2S能顯著促進幼苗生長,而高濃度的H2S對水稻幼苗生長有明顯的抑制作用[12]。為了了解硫化氫影響水稻幼苗生長發育的分子基礎,本研究通過蛋白質組技術分析了施加不同濃度硫化氫的水稻幼苗葉片蛋白質表達譜的變化及其參與的生物學過程。
1 材料與方法
1.1 材料及處理
試驗材料為圣稻16(Oryza sativa Shengdao 16)。挑選顆粒飽滿種子,用0.1% HgCl2消毒10 min,去離子水沖洗數次,25 ℃恒溫箱黑暗中浸種催芽48 h。萌發后選取露白一致的種子用鑷子整齊擺放在墊有濾紙的培養皿(直徑12 cm)中,加入適量清水,水量以不浸沒種子為標準,保持皿中水量充足。當苗長至1葉1心時,選擇長勢一致的幼苗用海綿松松地包裹,嵌入有孔泡沫板(厚度1.5 cm)中,放在盛有1/2 Hoagland營養液(2 L)塑料箱內,置于HP1000GS型智能人工氣候箱中水培。晝、夜溫度分別為28、25 ℃,相對濕度為60%~70%,白天給予光照12 h[1 000 μmol/(m2·s)]。培養箱適應生長1 d后,用含有NaHS(H2S的供體)的Hoagland營養液,濃度分別為:0(CK)、0.1、0.2、0.4、0.8、1.6、3.2 mmol/L培養,每2 d換1次,共處理3次。每個處理135株苗(3箱),3個重復,每個重復45株苗(1箱)。于開始處理后7 d,液氮取樣保存,進行各項蛋白質組學指標的測定。
1.2 蛋白質樣品的制備
采用TCA/丙酮沉淀方法[13]提取水稻葉片總蛋白。首先稱取1 g左右鮮質量材料于預冷研缽中,液氮研磨并加入10%樣品質量的聚乙烯吡咯烷酮(PVP),將研磨好的粉末轉移至離心管中,1個樣加20 mL-20 ℃預冷的10%TCA-丙酮,之后渦旋至少1.5 h,-20 ℃靜置沉淀,后12 000 r/min離心30 min去上清液。然后加20 mL丙酮和0.02 g 0.1% DTT 到離心管中,將沉淀搗碎,重復3次,-20 ℃存放。之后再離心,蓋上濾紙,真空干燥后進行第1次裂解,約2 h,用玻璃棒不定時攪動。樣品溶解在蛋白質裂解液中,理論上加入 20 μL/mg 裂解液,其配方為每10 mL裂解液中含4.204 2 g 7 moL/L 尿素,1.522 4 g 2 moL/L硫脲,0.4 g 4% CHAPS,60 μL 0.3%CA,100 μL 100 mmoL/L PMSF,0.0215 6 g 14 mmoL/L DTT。第1次裂解后12 000 r/min離心30 min,取上清液到新的10 mL離心管中,加5倍體積的常溫丙酮,混勻后常溫靜置沉淀,再離心30 min,去除上清液,真空干燥。之后進行第2次裂解2 h,再離心30 min,取上清液50 μL/管分裝,存于-80 ℃。以牛血清白蛋白(BSA)為對照,采用Bradford法[14]測定提取的水稻葉片蛋白提取液的蛋白濃度。
1.3 蛋白質的雙向電泳
首先是固相pH值梯度選擇,根據前期試驗中蛋白分布情況的摸索,使用pH值為4~7的非線性(NL)膠條,水稻根蛋白點可均勻分布在整塊膠上。其次為固相化pH值梯度(IPG)膠條的水化,將IPG膠條膠面朝下置于預先加好 460 μL 水化液和蛋白樣品液的混合液的聚焦槽中,中間注意不要有氣泡,2 mL礦物油覆蓋后于20 ℃水化13 h,然后進行第一向等電聚焦,設置等電聚焦時的溫度為20 ℃,每根膠條的極限電流為50 A。等電聚焦結束后進行IPG膠條的平衡,之后進行第二向SDS-PAGE電泳,電泳時使用低恒功率(2 W),待樣品在完全跑出IPG膠條、溴酚藍指示劑濃縮成一條線后,再加大功率(25 W),待溴酚藍指示劑達到底部邊緣2~3 cm時即可停止電泳。電泳結束后用考馬斯亮藍進行凝膠染色,后將脫色好的凝膠放置在掃描板上,調整圖像大小后,對凝膠進行圖像掃描,保存圖像。使用PDQuest 軟件分析圖像。在蛋白質表達差異分析方面,對每個處理的3塊重復膠的蛋白點相對表達量(體積分數,%) 進行比較,根據單向方差分析(ANOVA)方法驗證差異顯著性。
1.4 蛋白質的膠內酶解
用剪掉的槍頭將蛋白點從膠上人工切取,放置在1 mL離心管中,通過胰蛋白酶進行膠內酶解。酶解后的肽段用MALDI-TOF/TOF MS/MS質譜儀進行分析,并通過MASCOT軟件檢索水稻蛋白質數據庫[15]。
1.5 生物信息學分析
用蛋白質功能數據庫Pfam對差異表達的蛋白質進行功能分類[16],用PIR數據庫進行GO(gene ontology )分析[17]。
2 結果與分析
2.1 不同濃度硫化氫影響水稻幼苗葉片蛋白質表達譜的差異分析
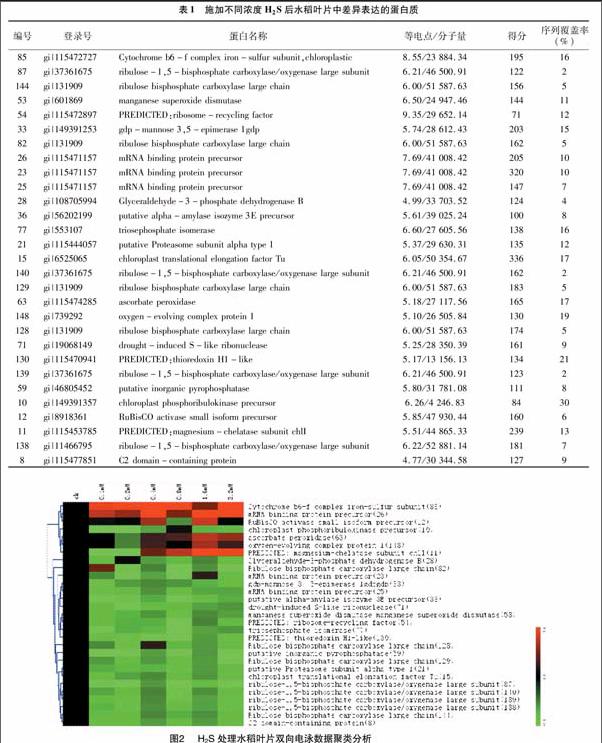
通過對水稻葉片蛋白質表達譜的分析,每塊二維凝膠圖譜上大約檢測到320個蛋白點。不同濃度的硫化氫供體硫氫化鈉(NaHS)[0(CK)、0.1、0.2、0.4、0.8、1.6、3.2 mmol/L]對水稻幼苗葉片的蛋白質表達的影響見圖1。定量分析發現在至少1個處理梯度上表達豐度上差異2倍以上的蛋白點29個。利用 MALDI-TOF/MS質譜分析結合水稻蛋白質數據庫檢索,獲得了29個蛋白點的身份(表1)。水稻葉片中在硫化氫影響下共有11個蛋白質在至少1個濃度處理下表達增強,有24個蛋白質在至少1個濃度處理下表達豐度下調(圖2)。
2.2 差異表達蛋白的功能分析和GO分析
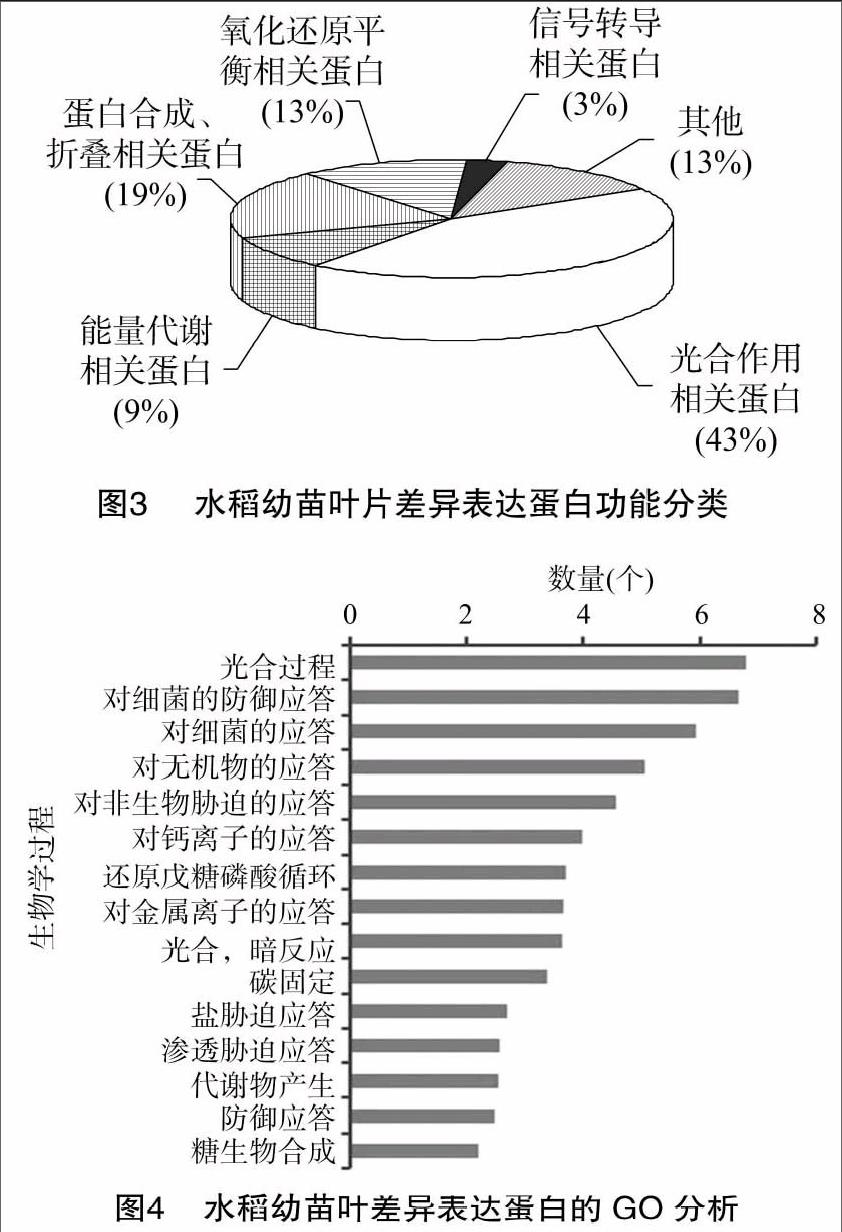
功能分析發現這些差異表達的蛋白質主要涉及到光合作用(43%)、能量代謝 (9%)、氧化還原平衡 (13%)、蛋白質合成、折疊、加工與降解 (19%),信號轉導(3%)(圖3)。GO分析發現這些蛋白質主要涉及到光合過程、防御和非生物脅迫應答等生物學過程(圖4)。
2.3 H2S調控的差異蛋白的功能相關性分析
不同濃度的H2S對水稻幼苗葉片的效應主要是影響葉片的光合作用,還影響蛋白質的合成、折疊,以及植物體內氧自由基的產生和清除系統;H2S還影響能量的合成代謝[18]。
與光合作用相關的蛋白包括1,5-二磷酸核酮糖羧化酶/加氧酶大亞基、二磷酸核酮糖羧化酶大鏈、細胞色素b6-f復合體鐵硫亞基、葉綠體磷酸核酮糖激酶、放氧復合體等。其中細胞色素b6-f是電子傳遞鏈中的重要電子傳遞體,而1, 5-二磷酸核酮糖羧化酶/加氧酶大亞基是羧化酶的活性亞基,3-磷酸甘油醛脫氫酶是CO2還原階段的重要酶,這2個蛋白在植物光合過程中參與CO2的固定和光呼吸的調節,并且在凈光合作用的過程中起關鍵作用,表明信號分子H2S影響了光合作用的電子傳遞及碳同化2個主要過程。同時我們亦發現部分與光合作用相關的蛋白表達量在低濃度時上調,在1.6、3.2 mmoL/L時表達量則下調,說明低濃度H2S能促進光合作用,而高濃度時則抑制[12]。
3 結論
通過對硫化氫影響水稻幼苗葉片的差異蛋白質表達譜分析,我們發現硫化氫調控了光合作用、能量代謝、氧化還原平衡、蛋白質合成、折疊、加工與降解、信號轉導等生物學過程,這些生物學過程主要參與植物的光合作用、防御,及對非生物脅迫的應答等作用。特別是光合作用過程,其正常的運轉是植物生長發育的重要保證,這些蛋白質直接影響與光合作用有關酶的活化、CO2的固定、光系統單位和電子傳遞鏈相關構成來調節光合作用,從而影響水稻幼苗的正常代謝而造成的。蛋白質是基因表達的產物,對其了解越多,越能客觀準確地揭示相關的生命現象,本試驗采用蛋白質組學方面的技術來研究H2S處理下水稻幼苗葉片中的相關蛋白,從而有助于了解硫化氫對水稻幼苗生長發育的影響。
參考文獻:
[1]Szabo C. Hydrogen sulphide and its therapeutic potential[J]. Nature Reviews Drug Discovery,2007,6(11):917-935.
[2]Garía-Mata C,Lorenzo L. Hydrogen sulphide,a novel gasotransmitter involved in guard cell signalling[J]. New Phytologist,2010,188:977-984.
[3]Li Z G,Gong M,Liu P. Hydrogen sulfide is a mediator in H2O2-induced seed germination in Jatropha curcas[J]. Acta Physiologiae Plantarum,2012,34(6):2207-2213.
[4]Chen J,Wu F H,Wang W H,et al. Hydrogen sulphide enhances photosynthesis through promoting chloroplast biogenesis,photosynthetic enzyme expression,and thiol redox modification in Spinacia oleracea seedlings[J]. Journal of Experimental Botany,2011,62(13):4481-4493.
[5]李東波,肖朝霞,劉靈霞,等. 外源硫化氫對豌豆根尖及其邊緣細胞的影響[J]. 植物學報,2010,45(3):354-362.
[6]Lisjak M,Srivastava N,Teklic T,et al. A novel hydrogen sulfide donor causes stomatal opening and reduces nitric oxide accumulation[J]. Plant Physiology and Biochemistry,2010,48(12):931-935.
[7]Wang Y Q,Li L,Cui W T,et al. Hydrogen sulfide enhances alfalfa (Medicago sativa) tolerance against salinity during seed germination by nitric oxide pathway[J]. Plant and Soil,2012,351(1/2):107-119.
[8]Zhang H,Dou W,Jiang C X,et al. Hydrogen sulfide stimulates β-amylase activity during early stages of wheat grain germination[J]. Plant Signaling & Behavior,2010,5(8):1031-1033.
[9]王蘭香,侯智慧,侯麗霞,等. H2O2介導的H2S產生參與干旱誘導的擬南芥氣孔關閉[J]. 植物學報,2012,47(3):217-225.
[10]方慧慧,裴雁曦,田保華,等. H2S與Ca2+協同增強谷子對Cr6+脅迫的耐受[J]. 中國細胞生物學學報,2014,36(6):758-765.
[11]Shan C,Dai H,Sun Y. Hydrogen sulfide protects wheat seedlings against copper stress by regulating the ascorbate and glutathione metabolism in leaves[J]. Australian Journal of Crop Science,2012,6(2):248-254.
[12]徐慧芳,陳楨雨,劉 輝,等. H2S對水稻幼苗形態及生理生化的影響[J]. 中國農學通報,2013,29(36):52-58.
[13]Damerval C,de Vienne D,Zivy M,et al. Technical improvments in two-dimensional electrophoresis increase the level of genetic variation detected in wheat-seedling proteins[J]. Electrophoresis,1986,7:52-54.
[14]Bradford M. A rap id and sensitive method for the quantitation of microgram quantities of protein using the principle of protein dye binding[J]. Analytical Biochemistry,1976,72:248-254.
[15]Wan X Y,Liu J Y. Comparative proteomics analysis reveals an intimate protein network provoked by hydrogen peroxide stress in rice seedling leaves[J]. Molecular & Cellular Proteomics,2008,7(8):1469-1488.
[16]Apweiler R,Attwood T K,Bairoch A,et al. The InterPro database,an integrated documentation resource for protein families,domains and functional sites[J]. Nucleic Acids Research,2001,29(1):37-40.
[17]Wu C H,Yeh L S,Huang H,et al. The protein information resource[J]. Nucleic Acids Research,2003,31:345-347.
[18]孟 丹,劉 玲,陳 露,等. 外源硫化氫對鋁脅迫下水稻幼苗生長及生理生化的影響[J]. 江蘇農業科學,2014,42(6):63-66.

