多粘類芽孢桿菌纖維素酶基因bglA,bglB和EG在乳酸菌中的分泌表達(dá)
劉原子,王 艷,萬學(xué)瑞,王 川,吳 潤(rùn),劉 崗,吳自祥
(甘肅農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院,甘肅 蘭州 730070)
多粘類芽孢桿菌纖維素酶基因bglA,bglB和EG在乳酸菌中的分泌表達(dá)
劉原子,王 艷,萬學(xué)瑞,王 川,吳 潤(rùn),劉 崗,吳自祥
(甘肅農(nóng)業(yè)大學(xué)動(dòng)物醫(yī)學(xué)院,甘肅 蘭州 730070)
通過PCR擴(kuò)增獲得乳酸菌(LactobacteriumlactisMG1363)的usp45基因,將其克隆到乳酸菌(L.lactis)食品級(jí)表達(dá)載體pNZ8048中獲得分泌型表達(dá)載體pNZ-X;然后將多粘類芽孢桿菌(Bacilluspolymyxa)β-葡萄糖苷酶基因bglA、bglB及內(nèi)切β-葡聚糖酶基因EG分別連接載體pNZ-X,獲得重組質(zhì)粒pNZ-X::bglA,pNZ-X::bglB和pNZ-X::EG,將3個(gè)質(zhì)粒電轉(zhuǎn)導(dǎo)入L.lactisNZ9000,得到重組乳酸菌L.lactisNZ9000/pNZ-X::bglA、L.lactisNZ9000/pNZ-X::bglB和L.lactisNZ9000/pNZ-X::EG,并測(cè)定分泌性表達(dá)的BglA,BglB和EG的酶活性。結(jié)果顯示:3個(gè)酶大小均在50 kU;DNS法測(cè)定酶活力表明重組菌株的酶活力顯著低于多粘類芽孢桿菌的酶活力(P<0.05),但具有一定的活性;剛果紅染色結(jié)果也表明重組乳酸菌分泌產(chǎn)生的酶可產(chǎn)生明顯的水解圈。試驗(yàn)為重組纖維素酶在食品級(jí)菌株中重組表達(dá)提供了一種可行的方案,為秸稈的降解研究奠定了基礎(chǔ)。
乳酸菌;纖維素酶;多粘類芽孢桿菌;分泌型表達(dá);酶活測(cè)定
纖維素作為環(huán)境友好的可再生能源,因其特殊的結(jié)構(gòu)并未得到很好的開發(fā)與利用,在我國(guó)農(nóng)村秸稈主要被焚燒,浪費(fèi)資源且污染環(huán)境,只有很少的一部分被作為飼料利用。目前,纖維素的降解包括物理法、化學(xué)法和生物降解法,其中,生物降解法是將纖維素徹底分解而又無污染的有效途徑[1]。纖維素酶在秸稈青貯中的應(yīng)用主要是將纖維素酶食品級(jí)菌株添加到飼料中進(jìn)行青貯,不僅為飼料工業(yè)節(jié)省大量的人力財(cái)力[2],而且可補(bǔ)充草食動(dòng)物內(nèi)源酶的不足,有消除抗?fàn)I養(yǎng)因子,提高畜禽生產(chǎn)性能,降低致病微生物的黏附和定植等功能。因此,纖維素酶作為飼料添加劑已成為人們研究的熱點(diǎn)。目前,產(chǎn)纖維素酶的微生物有細(xì)菌、真菌、放線菌等,細(xì)菌主要有芽孢桿菌等,真菌有木霉屬(Trichoderma)、曲霉屬(Aspergillus)等,放線菌主要有玫瑰色放線菌(Actinomycesroseodiastaticus)和纖維放線菌(Actinomycescellulose)等[3]。
常見的纖維素酶的表達(dá)系統(tǒng)有大腸桿菌[4]、乳酸發(fā)酵短桿菌[5]和釀酒酵母等[6-7]。乳酸菌(LAB)作為安全的食品級(jí)微生物,是一類可發(fā)酵糖產(chǎn)生乳酸的革蘭氏陽性菌的總稱,在過去20年里,乳酸菌在基因工程的發(fā)展與分子生物學(xué)研究方面已經(jīng)取得了顯著的進(jìn)步[8],其nisin誘導(dǎo)基因表達(dá)系統(tǒng)因其誘導(dǎo)劑、篩選物和宿主菌株均為食品級(jí),符合FDA安全標(biāo)準(zhǔn),因此,乳酸菌是應(yīng)用最廣的異源蛋白表達(dá)系統(tǒng)[9-11],而且這些食品級(jí)的細(xì)菌不產(chǎn)生脂多糖或其他毒素,不形成包涵體,重組產(chǎn)物也不需要純化[8,12]。
有研究報(bào)道多粘類芽孢桿菌產(chǎn)生的β-葡萄糖苷酶對(duì)木質(zhì)纖維素來源的纖維二糖的水解有較高專一性[13]。選擇實(shí)驗(yàn)室分離的來源于西北特殊地理環(huán)境的一株多粘類芽孢桿菌作為研究材料,以便實(shí)現(xiàn)纖維素酶基因在乳酸菌中的分泌型重組表達(dá),為提高飼料轉(zhuǎn)化率,補(bǔ)充草食動(dòng)物內(nèi)源酶和提高畜禽生產(chǎn)性能奠定研究基礎(chǔ)。
1 材料和方法
1.1 材料
1.1.1 菌株與質(zhì)粒 大腸桿菌DH5α、質(zhì)粒pBluescript ⅡKS(+)為實(shí)驗(yàn)室保存,多粘類芽孢桿菌(內(nèi)切β-葡聚糖酶的酶活力高達(dá)254.144 U/mL)為本實(shí)驗(yàn)室分離所得,質(zhì)粒pNZ8048、乳酸桿菌L.lactisNZ9000和L.lactisMG1363由中國(guó)科學(xué)院微生物研究所鐘瑾研究員饋贈(zèng)。
1.1.2 試劑 限制性內(nèi)切酶NotⅠ、XbaⅠ、Hind Ⅲ、EcoRⅤ和pMD18-T購(gòu)于TaKaRa公司;T4 DNA Ligase購(gòu)于Thermo fisher公司;nisin(乳酸鏈球菌素)購(gòu)于Sigma公司;氨芐青霉素、氯霉素、Easy Taq supermix、FastPfu fly DNA Polymerase購(gòu)于北京全式金生物技術(shù)有限公司;剛果紅、3,5-二硝基水楊酸、水楊苷、CMC-Na購(gòu)于國(guó)產(chǎn)分析純;CTAB、酵母提取物和蛋白胨購(gòu)于OXOID公司產(chǎn)品;質(zhì)粒DNA小提試劑盒、膠回收試劑盒購(gòu)于天根生化科技有限公司;BCA試劑盒購(gòu)于biomiga公司。
1.1.3 培養(yǎng)基 培養(yǎng)大腸桿菌DH5α及多粘類芽孢桿菌的培養(yǎng)基為L(zhǎng)B培養(yǎng)基[14],LB-微晶纖維素鈉培養(yǎng)基用于多粘類芽孢桿菌的誘導(dǎo),LB-CMC培養(yǎng)基用于剛果紅染色[15],GM17培養(yǎng)基用于L.lactisNZ9000及L.lactisMG1363的培養(yǎng)[16]。使用氨芐青霉素篩選質(zhì)粒的終濃度為100 μg/mL,氯霉素終濃度為10 μg/mL。
1.2 方法
1.2.1 基因組DNA的提取 多粘類芽孢桿菌在LB液體培養(yǎng)基中37℃震蕩培養(yǎng)過夜,將菌體收集后通過CTAB法提取基因組DNA[17];乳酸菌L.lactisMG1363在GM17液體培養(yǎng)基中30℃靜置培養(yǎng)過夜,將菌體收集后也通過CTAB法提取基因組DNA。
1.2.2 分泌型表達(dá)載體pNZ-X的構(gòu)建 以乳酸菌L.lactisMG1363基因組DNA為模板,根據(jù)GenBank公布的L.lactisMG1363的usp45基因序列設(shè)計(jì)P1/P2引物(表1)PCR擴(kuò)增usp45片段,使用北京全式金生物技術(shù)有限公司的EasyTaq supermix進(jìn)行擴(kuò)增。PCR反應(yīng)條件為:94℃預(yù)變性3 min;94℃ 30 s、56℃ 30 s、72℃ 1 min,共30個(gè)循環(huán);72℃延伸5 min。用膠回收試劑盒回收PCR產(chǎn)物后,與pMD18-T連接并轉(zhuǎn)化E.coliDH5α。經(jīng)菌液PCR擴(kuò)增及雙酶切驗(yàn)證后,將正確的質(zhì)粒和pNZ8048同時(shí)經(jīng)NcoⅠ和Hind Ⅲ雙酶切,將酶切產(chǎn)物分別膠回收后,通過T4 DNA Ligase連接,轉(zhuǎn)化E.coliDH5α,在含氯霉素抗性的LB平板上挑選陽性菌,經(jīng)菌液PCR和雙酶切驗(yàn)證正確后將得到的分泌型表達(dá)載體pNZ-X送往金唯智生物科技有限公司測(cè)序。
1.2.3 分泌型表達(dá)載體pNZ-X::bglA、pNZ-X::bglB和pNZ-X::EG的構(gòu)建 以多粘類芽孢桿菌基因組DNA為模板,使用北京全式金生物技術(shù)有限公司的FastPfu fly DNA Polymerase進(jìn)行擴(kuò)增,bglA-F/R為引物(表1)進(jìn)行PCR擴(kuò)增bglA片段,bglB-F/R為引物進(jìn)行PCR擴(kuò)增bglB片段,bglA和bglB的PCR反應(yīng)條件為:95℃預(yù)變性5 min;95℃ 30 s、58℃ 30 s、72℃ 1 min 40 s,共30個(gè)循環(huán);72℃延伸10 min;以多粘類芽孢桿菌基因組DNA為模板,內(nèi)5-F/R為引物(表1)進(jìn)行PCR擴(kuò)增EG片段,PCR反應(yīng)條件為:95℃預(yù)變性5 min;95℃ 30 s、56℃ 30 s、72℃ 1 min 40 s,共30個(gè)循環(huán);72℃延伸10 min。將純化后的PCR產(chǎn)物與經(jīng)過EcoRⅤ酶切的pBluescript ⅡKS(+)通過T4 DNA Ligase連接,將連接產(chǎn)物轉(zhuǎn)化E.coliDH5α,經(jīng)菌液PCR和雙酶切驗(yàn)證后得到重組質(zhì)粒pBluescript ⅡKS(+)::bglA、pBluescript ⅡKS(+)::bglB、pBluescript ⅡKS(+)::EG。
將重組質(zhì)粒pBluescript ⅡKS(+)::bglA、pBluescript ⅡKS(+)::bglB、pBluescript ⅡKS(+)::EG和載體pNZ-X同時(shí)經(jīng)XbaⅠ和Hind Ⅲ酶切,酶切產(chǎn)物分別膠回收后,通過T4 DNA Ligase將載體pNZ-X與片段bglA,bglB和EG分別連接,并將連接產(chǎn)物轉(zhuǎn)化E.coliDH5α,獲得重組質(zhì)粒pNZ-X::bglA、pNZ-X::bglB和pNZ-X::EG,經(jīng)菌液PCR擴(kuò)增和雙酶切鑒定后,將這三個(gè)重組質(zhì)粒送往金唯智生物科技有限公司測(cè)序。
1.2.4 質(zhì)粒電擊轉(zhuǎn)化乳酸菌L.lactisNZ9000及誘導(dǎo)表達(dá)L.lactisNZ9000感受態(tài)細(xì)胞的制備及電擊轉(zhuǎn)化參考文獻(xiàn)[18-19],用Bio-Rad 電轉(zhuǎn)儀(Gene Pulser Xcell 617BR1 06692)電擊,電擊條件為:1200 V,100 Ω,25 μF,電擊轉(zhuǎn)化后將復(fù)蘇菌涂在含氯霉素抗性的GM17培養(yǎng)基上篩選陽性菌落,30℃培養(yǎng)24 h后挑取單個(gè)菌落接種于新鮮含氯霉素的GM17培養(yǎng)基,30℃培養(yǎng)至D600 nm為0.6,加入nisin至終濃度為10 ng/mL誘導(dǎo)表達(dá),48 h后取上清液用鎳柱進(jìn)行純化,并通過SDS-PAGE檢測(cè)蛋白表達(dá)情況[20]。
1.2.5 重組纖維素酶的定量分析和酶活力的測(cè)定 通過BCA試劑盒繪制562 nm下的蛋白濃度標(biāo)準(zhǔn)曲線,并測(cè)定樣品的D562 nm值,通過標(biāo)準(zhǔn)曲線,計(jì)算樣品的總蛋白濃度。
通過DNS法測(cè)定BglA,BglB和EG酶活[21]。酶活定義為每分鐘內(nèi)分解底物生成1 μg葡萄糖所需酶量定義為1個(gè)酶活單位,以U/mL表示。平行試驗(yàn)重復(fù)3次,并使用SPSS軟件進(jìn)行顯著性差異分析。
將LB-CMC培養(yǎng)基進(jìn)行剛果紅染色,并根據(jù)水解圈的大小判斷水解活性。

表1 纖維素酶基因擴(kuò)增引物
2 結(jié)果與分析
2.1 分泌型表達(dá)載體pNZ-X、pNZ-X::bglA、pNZ-X::bglB及pNZ-X::EG的構(gòu)建
usp45基因經(jīng)PCR擴(kuò)增后檢測(cè),所得產(chǎn)物片段大小為80 bp,將其連接pMD18-T載體后經(jīng)雙酶切檢測(cè),分別在3 000 bp和80 bp出現(xiàn)條帶。將正確的克隆子以NcoⅠ、Hind Ⅲ酶切后,膠回收小片段,與同樣酶切的pNZ8048連接,轉(zhuǎn)化E.coliDH5α,獲得重組質(zhì)粒pNZ-X,經(jīng)雙酶切后,分別在3 500 bp和80 bp出現(xiàn)相應(yīng)條帶,測(cè)序結(jié)果與GenBank上公布的usp45序列(GenBank登錄號(hào)EU382094.1)完全一致,表明分泌型表達(dá)載體pNZ-X構(gòu)建成功。
將正確的質(zhì)粒pBluescript ⅡKS(+)::bglA、pBluescript ⅡKS(+)::bglB及pBluescript ⅡKS(+)::EG以XbaⅠ、Hind Ⅲ酶切后,與同樣酶切的pNZ-X質(zhì)粒連接,轉(zhuǎn)化E.coliDH5α。重組質(zhì)粒通過雙酶切驗(yàn)證分別在3 500 bp和1 500 bp位置有相應(yīng)的條帶,測(cè)序結(jié)果與GenBank上公布的序列(bglAGenBank登錄號(hào)M60210.1,bglBGenBank登錄號(hào)M60211.1,EGGenBank登錄號(hào)AB695293.1)完全一致,說明分泌型表達(dá)載體pNZ-X::bglA、 pNZ-X::bglB及pNZ-X::EG構(gòu)建成功。
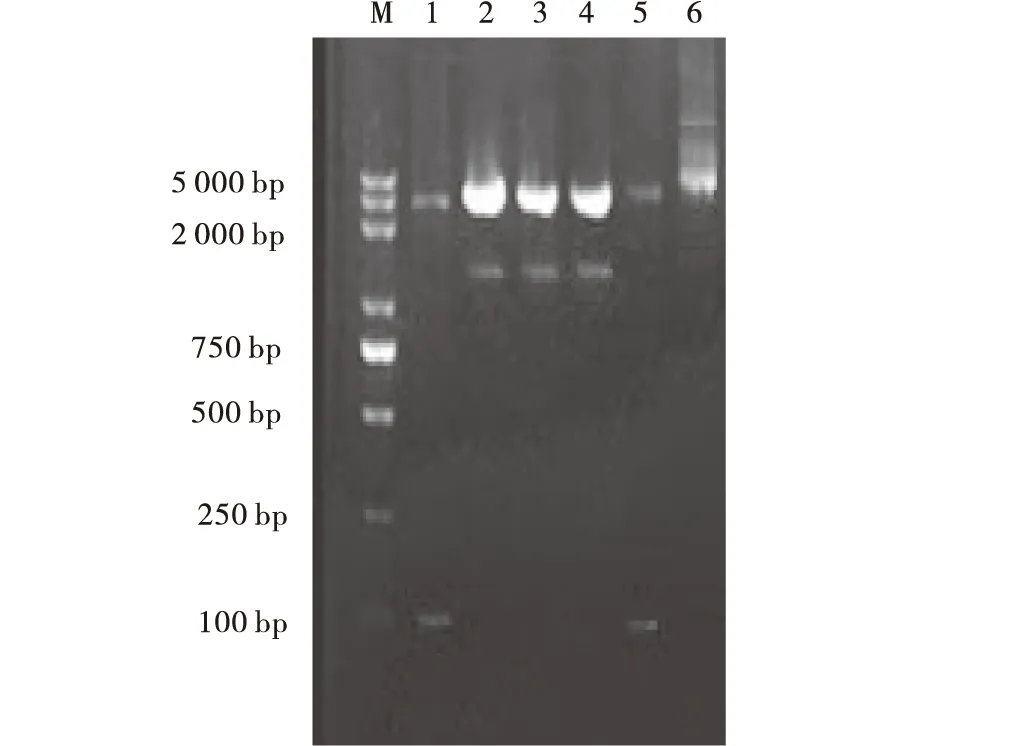
圖1 重組質(zhì)粒雙酶切驗(yàn)證Fig.1 Recombinant plasmid digested注:M.DNA marker;1.pMD18-T::usp45重組質(zhì)粒雙酶切;2.pNZ-X::bglA重組質(zhì)粒雙酶切;3.pNZ-X::bglB重組質(zhì)粒雙酶切;4.pNZ-X::EG重組質(zhì)粒雙酶切;5.pNZ::X重組質(zhì)粒雙酶切;6.pNZ8048質(zhì)粒.
2.2 質(zhì)粒pNZ-X::bglA、pNZ-X::bglB及pNZ-X::EG轉(zhuǎn)化乳酸菌
分別提取質(zhì)粒pNZ-X::bglA,pNZ-X::bglB和pNZ-X::EG,電轉(zhuǎn)化L.lactisNZ9000,涂在含氯霉素抗性的GM17平板上,得到多個(gè)克隆子。克隆子經(jīng)過PCR擴(kuò)增鑒定,分別含有質(zhì)粒pNZ-X::bglA、pNZ-X::bglB及pNZ-X::EG,表明乳酸菌分泌型表達(dá)系統(tǒng)構(gòu)建成功。
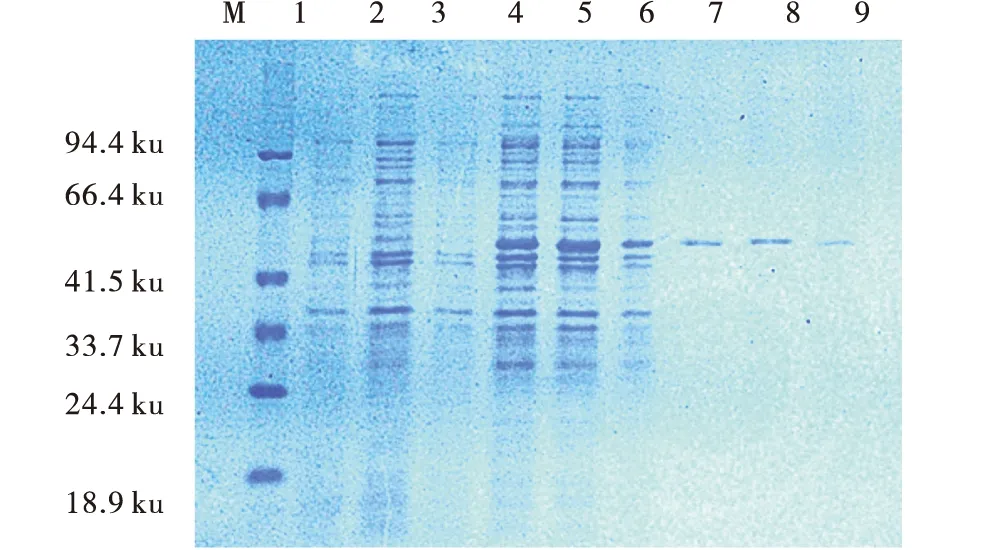
圖2 SDS-PAGE電泳Fig.2 SDS-PAGE electrophoresis注:M.蛋白;1.BglA誘導(dǎo)前;2.BglB誘導(dǎo)前;3.EG誘導(dǎo)前;4.BglA誘導(dǎo)后;5.BglB誘導(dǎo)后;6.EG誘導(dǎo)后;7.BglA純化后;8.BglB純化后;9.EG純化后
2.3 重組蛋白的表達(dá)及SDS-PAGE電泳
將測(cè)序正確的質(zhì)粒電轉(zhuǎn)乳酸菌NZ9000感受態(tài)細(xì)胞,用nisin誘導(dǎo)表達(dá)后,提取蛋白樣品進(jìn)行SDS-PAGE分析(圖2),結(jié)果表明,BglA,BglB和EG在誘導(dǎo)前沒有特異性的條帶,在誘導(dǎo)后出現(xiàn)了特異性條帶,純化后只有單一的條帶,誘導(dǎo)后的BglA,BglB和EG蛋白在50Ku處有明顯的蛋白表達(dá)帶,與文獻(xiàn)中報(bào)道的多粘類芽孢桿菌(Bacilluspolymy)所產(chǎn)β-葡萄糖苷酶分子量為50 Ku相符[22],EG與BglA,BglB的片段大小一致,因此在相同位置出現(xiàn)蛋白條帶。
2.4 DNS法測(cè)定重組菌株酶活力
用DNS法測(cè)定重組β-葡萄糖苷酶酶活力值(表2)。通過SPSS軟件分別比較多粘類芽孢桿菌與BglA、BglB、EG的酶活值。多粘類芽孢桿菌的酶活力為(4.134±0.216) U/mL,BglA的酶活力為(2.174±0.305)U/mL,BglB酶活力為(1.933±0.268)U/mL, EG的酶活力為(2.427±0.558)U/mL,BglA、BglB、EG與多粘類芽孢桿菌的酶活力值差異顯著(P<0.05),顯著低于多粘類芽孢桿菌的酶活值。
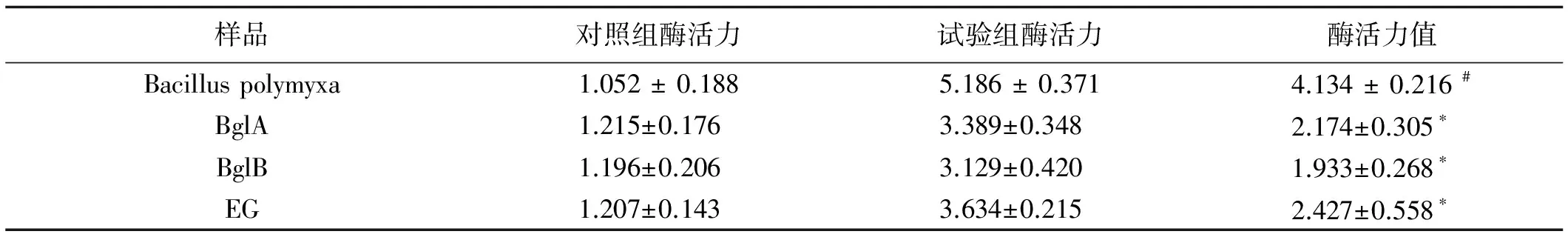
表2 DNS法測(cè)定酶活力值
注:*表示差異顯著(P<0.05),#表示差異不顯著(P>0.05)
2.5 剛果紅染色
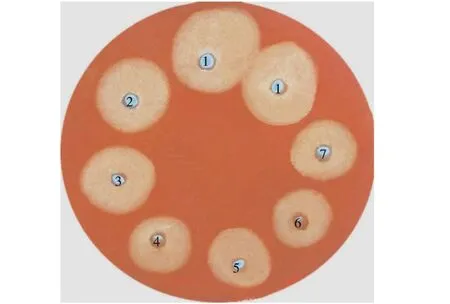
圖3 剛果紅染色水解圈Fig.3 Congo red stain hydrolysis circle注:1.多粘類芽孢桿菌;2.EG上清;3.BglA上清;4.BglB上清;5.BglA純化后;6.BglB純化后;7.EG純化后
將樣品按順序加入CMC-Na的LB平板孔中,37℃過夜培養(yǎng),經(jīng)剛果紅染色、NaCl溶液脫色后出現(xiàn)水解圈,根據(jù)水解圈直徑的大小即可判斷水解活性的強(qiáng)弱。多粘類芽孢桿菌的水解圈直徑最大,酶活最強(qiáng)。BglA,BglB和EG上清液加入剛果紅染色平板中出現(xiàn)水解圈,說明上清液中存在蛋白,分泌型表達(dá)載體構(gòu)建成功,并且上清液的水解圈大于純化后的水解圈,是由于純化后去除了雜蛋白。
3 討論
研究表明反芻動(dòng)物糞便中有20%~70%的纖維素可被檢出[23],在草食動(dòng)物體內(nèi)纖維素的轉(zhuǎn)化率并不高,大部分的纖維素都被動(dòng)物體直接排出,沒有被動(dòng)物利用,因此,通過青貯提高秸稈飼料營(yíng)養(yǎng)、提高反芻動(dòng)物對(duì)青貯飼料中的纖維素利用非常重要。目前,纖維素酶的表達(dá)主要是在大腸桿菌中,也有在酵母[1,4]、枯草芽孢桿菌[24]、絲狀真菌[1,3]中表達(dá)的。盧敏等[25]及我們以前構(gòu)建的纖維素酶表達(dá)工程菌多連接pET表達(dá)載體,并在大腸桿菌中誘導(dǎo)表達(dá),其表達(dá)量均不是很高。趙云等[26]將多粘類芽孢桿菌(bacilluspolymyxa)β-葡萄糖苷酶基因克隆到pET-28a上,并在E.coliBL21中表達(dá),粗酶液酶活為24.7 I U/mL;任大明等[27]將綠色木霉纖維素酶CBHⅠ基因克隆到 pET-28a上,并在E.coliBL21中表達(dá),重組酶活力為5.3 U/mg。
由于乳酸菌對(duì)人體安全,分泌型載體表達(dá)外源基因不利于形成二硫鍵,使表達(dá)產(chǎn)物能夠正確折疊,并且周質(zhì)空間的蛋白酶水解活性較低,分泌到此的蛋白更加穩(wěn)定[28]。乳酸菌表達(dá)系統(tǒng)L.lactisNZ9000是食品級(jí)安全表達(dá)系統(tǒng),可通過nisin的誘導(dǎo)作用,大幅度提高外源基因的表達(dá)效率,因此很多基因已在乳酸菌中進(jìn)行了表達(dá),Zhang等將干擾素α2b克隆到pNZ-LEISS, pSP和 pSP-LEISS上,并電轉(zhuǎn)L.lactisNZ9000,并使干擾素α2b產(chǎn)量提高了三倍[9];陳思維等[29]將人胰島素基因克隆至乳酸菌表達(dá)載體pVE5523,電擊轉(zhuǎn)化實(shí)現(xiàn)了帶信號(hào)肽 SPUsp45的人胰島素基因在乳酸乳球菌(Lactococcuslactis)MG1363和干酪乳桿菌(Lactobacilluscasei) ATCC27092中表達(dá),使與免疫耐受相關(guān)的細(xì)胞因子 IL-4水平顯著升高。因此,應(yīng)用食品級(jí)分泌型表達(dá)載體表達(dá)外源基因,獲得重組微生物菌株進(jìn)行生產(chǎn)纖維素酶前景廣闊。
本研究將乳酸菌MG1363中帶有的一段編碼信號(hào)肽的核苷酸序列,設(shè)計(jì)引物并進(jìn)行擴(kuò)增,將其連接質(zhì)粒pNZ8048,構(gòu)成分泌型表達(dá)載體pNZ-X,通過信號(hào)肽基因序列usp45的引導(dǎo)將表達(dá)的蛋白分泌到胞外,并在培養(yǎng)基上清中成功檢測(cè)到了纖維素酶活性,說明本研究構(gòu)建的pNZ-X可以作為分泌型表達(dá)載體,且實(shí)現(xiàn)了多粘類芽孢桿菌β-葡萄糖苷酶基因bglA、bglB及內(nèi)切β-葡聚糖酶基因EG的分泌型表達(dá)。本研究成功構(gòu)建了食品級(jí)纖維素酶菌株,為青貯及提高飼料轉(zhuǎn)化率,補(bǔ)充草食動(dòng)物內(nèi)源酶,提高畜禽生產(chǎn)性能奠定研究基礎(chǔ)。
4 結(jié)論
試驗(yàn)分別克隆了多粘類芽孢桿菌的β-葡萄糖苷酶基因bglA、bglB及內(nèi)切葡聚糖酶基因EG,并分別與連有信號(hào)肽序列的分泌型表達(dá)載體相連接,成功構(gòu)建了分泌型表達(dá)載體pNZ-X::bglA、pNZ-X::bglB及pNZ-X::EG。
[1] 謝占玲,吳潤(rùn).纖維素酶的研究進(jìn)展[J].草業(yè)科學(xué),2004,21(4):72-76.
[2] 山其木格,包慧芳,王煒,等.地衣芽孢桿菌WS-6β-葡聚糖酶基因的克隆及表達(dá)[J].生物技術(shù)通報(bào),2008(6):135-138.
[3] 劉潔麗,王靖.生物產(chǎn)纖維素酶研究進(jìn)展[J].化學(xué)與生物工程,2008(12):9-12.
[4] Shou Takashima,Hiroshi Iikura,Akira Nakamura,etal.Overproduction of recombinant Trichoderma reesei cellulases by Aspergillus oryzae and their enzymatic pro perties[J].Journal of Biotechnology,1998,65:163-171.
[5] 馬翠鸞,何玉財(cái),咸漠.分子生物學(xué)技術(shù)在纖維素酶改造中的應(yīng)用[J].化工科技,2008(5):52-57.
[6] Wang G L.In vitro expression of Penicillium janthinellumcellobiohydrolase I gene in a coupled transcription translation system[J].Journal of Biotechnology,2000,81:205.
[7] Wang G L.PCR-mediated analysis of transcription of CBH I and CBH II genes from Trichoderma pseudokoningiiand Penicillium janthinellum[J].Biotechnology Letters,1999,21:321
[8] King M S,Boes C,Kunji E R.Membrane protein expression in Lactococcus lactis[J].Methods in Enzymology,2015,556:77-97.
[9] Zhang Q X,Zhong J,Liang X B,etal.Improvement of human interferon alpha secretion byLactococcus lactis[J].Biotechnology,2010,32(9):1271-7.
[10] Hugenholtz J,Smid E J.Nutraceutical production with food-grademicroorganisms[J].Current Opinion in Biotechnology,2002,13(5):497-507.[11] Niel E W J V,Hahn-H?gerdal B.Nutrient requirements of lactococci in defined growth media[J].Applied Microbiology and Biotechnology,1999,52(5):617-627.
[12] Zhang Q,Jin Z,Huan L.Expression of hepatitis B virus surface antigen determinants in Lactococcus lactis,for oral vaccination[J].Microbiological Research,2011,166(2):111-20.
[13] 王遠(yuǎn),高秋強(qiáng),辛秀娟.β-葡萄糖苷酶基因和內(nèi)切葡聚糖酶基因在枯草芽孢桿菌中的表達(dá)[J].應(yīng)用與環(huán)境生物學(xué)報(bào),2013(6):990-996.
[14] Sambrook J,Fritsch E F,Maniatis T.Molecular Cloning:A laboratory manual[M].New York:cold spring harbor laboratory press,1989.
[15] 胡爽,王煒,詹發(fā)強(qiáng),等.一株產(chǎn)纖維素酶細(xì)菌的篩選鑒定[J].生物技術(shù),2008(5):36-38.
[16] Berthier F,Zagorec M,Champomier-Vergès M,etal.Efficient transformation of Lactobacillus sakeby electroporation[J].Microbiology,1996,142:12173-12179.
[17] Wilson K.Preparation of genomic DNA from bacteria[A]∥Ausubul F M,Bent R.Current protocols in molecular biology.New York:J Wiley & Sons,1987.
[18] O' sullivan D J,Klaenhammer T R.Rapid mini-prep isolation of high-quality plasmid DNA from LactococcusandLactobacillusspp[J].Applied and Environmental Microbiology,1993,59(8):2730-2733.
[19] Altare F,Durandy A,Lammas D,etal.Impairment of mycobacterial immunity in human interleu kin-12 receptor deficiency[J].Science,1998,280(5368):1432.
[20] Frederick M Ausubel,Roger Brent,Robert E King ston,etal.Current protocols in molecular biology[M].John Wiley & Sons Inc,1995.
[21] 丁軻,羅偉光,丁盼盼,等.雙纖維素酶基因在乳酸桿菌中的融合分泌表達(dá)[J].食品科學(xué),2014,15:127-131.
[22] Gonzalez candelas L,Aristoy M C,Polania J.Cloning and characterrization of two genes fromBacilluspolymyxaexpressingβ-glucosidaseactivity in Escherichia coli[J].Applied and Environmental Microbiology,1989,55(12):3173 -3177.
[23] Zhou H Z,Gao Y H,Gao G,etal.Oral Administration of Recombinant Lactococcus lactis,Expressing the Cellulase Gene Increases Digestibility of Fiber in Geese[J].Current Microbiology,2015,71(6):693-698.
[24] 趙沁,喬代蓉.纖維素酶及其研究進(jìn)展和應(yīng)用[C]∥中國(guó)微生物學(xué)會(huì)微生物資源專業(yè)委員會(huì).第四屆全國(guó)微生物資源學(xué)術(shù)暨國(guó)家微生物資源平臺(tái)運(yùn)行服務(wù)研討會(huì)論文集.中國(guó)微生物學(xué)會(huì)微生物資源專業(yè)委員會(huì),2012:5.
[25] 盧敏,王帥豪,狄元冉,等.纖維素酶基因克隆與表達(dá)[J].動(dòng)物營(yíng)養(yǎng)學(xué)報(bào),2012(6):1013-1018.[26] 趙云,劉偉豐,毛愛軍,等.多粘芽孢桿菌(bacillus polymyxa)β-葡萄糖苷酶基因在大腸桿菌中的表達(dá)、純化及酶學(xué)性質(zhì)分析[J].生物工程學(xué)報(bào),2004,20(5):741-744.
[27] 任大明,畢霏,陳紅漫,等.綠色木霉纖維素酶CBH I基因的克隆與原核表達(dá)[J].沈陽農(nóng)業(yè)大學(xué)學(xué)報(bào),2012(3):366-369.
[28] 袁濤,張雪梅,黃林,等.大腸桿菌分泌型載體表達(dá)重組人堿性成纖維細(xì)胞生長(zhǎng)因子[J].華西藥學(xué)雜志,1999(1):319-322.
[29] 陳思維,鐘瑾,還連棟.人胰島素基因在乳酸菌中的表達(dá)及其對(duì)非肥胖糖尿病(NOD)小鼠的作用[J].微生物學(xué)報(bào),2007(6):987-991.
Secretory expression ofBacilluspolymyxacellulase genebglA、bglBandEGin lactic acid bacteria
LIU Yuan-zi,WANG Yan,WAN Xue-rui,WANG Chuan,WU Run,LIU Gang,WU Zi-xiang
(CollegeofVeterinaryMedicine,GansuAgriculturalUniversity,Lanzhou730070,China)
Theusp45 gene ofL.lactisMG1363 was amplified by PCR,cloned into theL.lactisfood grade expression vector pNZ8048 by the score of secretion type expression vector pNZ-X.ThenBacilluspolymyxabeta glucosidase genebglA,bglBand endo beta glucanase geneEGwere cloned into the vector pNZ-X respectively,the recombinant plasmid pNZ-X::bglA,pNZ-X::bglBand pNZ-X::EG,the three plasmids were transfected intoL.lactisNZ9000 to obtain the recombinantL.lactisNZ9000/pNZ-X::bglA,L.lactisNZ9000/pNZ-X::bglBandL.lactisNZ9000/pNZ-X::EG,measured the enzyme activities ofBglA,BglBandEG.The results shown that the size of three enzymes were all in 50Ku.The enzyme activity shown that the enzyme activity ofBacilluspolymyxawas significantly higher than that of the recombinant strain of enzyme by DNS(P<0.05),but has a certain activity.Congo red staining results also shown that the secreted recombinantL.lactiscould produce the enzyme hydrolysis significantly.This study provided a feasible solution for the recombinant expression of cellulase in the food grade strain,and also a foundation for the research of degradation of straw.
lactic acid bacteria;cellulase;Bacilluspolymyxa;secretory expression;enzyme activity assay
2016-09-08;
2016-10-10
甘肅省科技支撐計(jì)劃項(xiàng)目(1204NKCA103);國(guó)家自然科學(xué)基金青年項(xiàng)目(31500067)資助
劉原子(1989-),男,甘肅省慶陽市人,在讀碩士研究生。 E-mail:793168333@qq.com 王川,吳潤(rùn)為通訊作者。
Q 939.99
A
1009-5500(2017)01-0008-06

